21 березня, 2023
Едоксабан у доказовій медицині та реальній клінічній практиці
 Фібриляція передсердь (ФП) – найпоширеніша аритмія, яка асоціюється з підвищенням ризику розвитку інсульту, хронічної серцевої недостатності (ХСН), призводить до збільшення звернень пацієнта по медичну допомогу, погіршує якість життя. Зокрема, ФП уражає 1‑2% загального населення та 10% населення віком понад 75 років і є причиною кожного четвертого інсульту.
Фібриляція передсердь (ФП) – найпоширеніша аритмія, яка асоціюється з підвищенням ризику розвитку інсульту, хронічної серцевої недостатності (ХСН), призводить до збільшення звернень пацієнта по медичну допомогу, погіршує якість життя. Зокрема, ФП уражає 1‑2% загального населення та 10% населення віком понад 75 років і є причиною кожного четвертого інсульту.
У Фрамінгемському дослідженні ФП асоціювалася з майже 5-разовим збільшенням ризику інсульту, який має тяжчий перебіг, частіше рецидивує і нерідко закінчується смертю. Клінічне значення ФП пов’язане, головним чином, із високим ризиком передсердного тромбоутворення і тромбоемболічних ускладнень [1]. Кардіоверсія є самостійним чинником ризику інсульту, оскільки відновлення систолічної функції передсердь може призвести до «вигнання» тромбу з вушка лівого передсердя (ВЛП) і потрапляння його до системного кровотоку. Упродовж багатьох років єдиною групою оральних антикоагулянтів, які використовували для профілактики тромбоемболічних ускладнень у пацієнтів із ФП, були антагоністи вітаміну К, переважно – варфарин. Як доступний і ефективний препарат, варфарин має істотний недолік – непередбачуваність антикоагулянтної дії, що потребує підбору дози і регулярного контролю міжнародного нормалізованого відношення (МНВ). Це, з одного боку, робить варфаринотерапію досить трудомісткою і не завжди можливою, а з другого – створює передумови для неадекватного лікування через вихід значень МНВ за межі терапевтичного діапазону, який має бути в інтервалі від 2 до 3 до 75% часу. Останнім часом розроблено і випробувано нові класи антикоагулянтних препаратів. Їх ефективність і безпечність проспективно оцінено в масштабних клінічних випробуваннях, зокрема зі спостереженнями з «реального життя». Так, у кількох великих рандомізованих контрольованих клінічних дослідженнях із залученням пацієнтів із ФП без значних уражень клапанів серця або механічних клапанів було виявлено, що нові оральні антикоагулянти (НОАК) є ефективним профілактичним засобом для зниження ризику інсульту. Загальний досвід застосування НОАК у разі ФП накопичений у понад 80 тис. пацієнтів, що приблизно вдесятеро більше, ніж у тих, у кого коли-небудь тестували ефективність антагоністів вітаміну К проти плацебо або аспірину.
Фармокінетика
Едоксабан – четвертий представник НОАК, зареєстрований у Європі та США 2015 р. для профілактики тромбоемболічних ускладнень у пацієнтів із неклапанною ФП. Власне, едоксабан – селективний та конкурентний інгібітор Xa фактора. Фармакокінетику едоксабану вивчали у багатьох дослідженнях на здорових добровольцях у добовій дозі 10-180 мг. Едоксабану притаманний лінійний передбачуваний профіль фармакокінетики. Після перорального застосування препарат досягає пікових значень концентрації у плазмі протягом 1‑2 год. Період його напіввиведення (Т1/2) становить приблизно 10‑14 год. Стійка концентрація досягається через 3 дні щоденного прийому. Біодоступність едоксабану за перорального введення становить 62%. У дослідженні з оцінювання впливу їжі з високим вмістом жирів на фармакокінетику одноразової дози едоксабану (60 мг) у японських та європеоїдних добровольців чоловічої статі виявлено клінічно незначне збільшення площі під фармакокінетичною кривою, що допомогло зробити висновок про можливість його застосування незалежно від вживання їжі. Едоксабан є субстратом P-глікопротеїну (P-gp) та має мінімальну інгібуючу дію на цитохром Р450 печінки. Тобто у клінічних концентраціях едоксабан чинить мінімальний вплив на фармакокінетику інших лікарських засобів, які є субстратами ізоферментів цитохрому Р450 печінки або залежать від білків-транспортерів. Виводиться едоксабан переважно у незміненому вигляді із сечею та через секрецію жовчовивідних шляхів із фекаліями. Відносна кількість метаболітів препарату збільшується зі збільшенням ступеня ниркової недостатності. Вплив функції печінки на фармакокінетику одноразової дози оцінювали у пацієнтів із легкою та помірною печінковою недостатністю та у здорових осіб із контрольної групи. Як зазначають дослідники, порушення функції печінки не мало впливу на пікову або загальну концентрацію едоксабану в крові у пацієнтів, що узгоджується з обмеженою роллю метаболізму в печінці в загальному кліренсі препарату. Застосування едоксабану може збільшувати протромбіновий час, МНВ, меншою мірою – активований частковий тромбопластиновий час, активований період згортання. Єдиним адекватним методом лабораторного контролю для едоксабану є визначення анти-Ха-факторної активності [2].
Доказова база ефективності та безпечності
Базовим дослідженням із вивчення ефективності та безпеки едоксабану стало багатоцентрове міжнародне рандомізоване подвійне сліпе дослідження ENGAGE AF-TIMI 48, у якому едоксабан у дозі 30 або 60 мг раз на добу порівнювали із застосуванням варфарину (МНВ 2‑3). На сьогодні це є наймасштабнішим дослідженням, що порівнює НОАК і варфарин у пацієнтів із ФП, як за кількістю залучених пацієнтів (n =21 105), так і за тривалістю спостереження (медіана тривалості спостереження 2,8 року). Дослідження охоплювало пацієнтів віком старше 21 року з підтвердженою неклапанною ФП і середнім / високим ризиком тромбоемболічних ускладнень (індекс CHADS2‑2 бали та більше). Учасників рандомізували у співвідношенні 1:1:1 до групи едоксабану (60 мг), едоксабану (30 мг) або варфарину (цільове МНВ 2‑3). Дозу едоксабану знижували вдвічі за наявності хоча б одного з таких критеріїв: кліренс креатиніну 30‑50 мл/хв, маса тіла ≤60 кг, супутнє приймання інгібіторів P-глікопротеїну (кетоконазолу, хінідину, дронедарону). У разі відміни цих препаратів дозу едоксабану збільшували до повної. Середній вік пацієнтів становив 72 роки, середнє значення індексу CHADS2‑2,8 бала. Первинною кінцевою точкою була оцінка частоти інсульту та системних тромбоемболічних ускладнень. Основною кінцевою точкою безпеки визначали частоту великих кровотеч. Частота інсульту та системної тромбоемболії за рік спостереження становила 1,50% у групі варфарину; 1,18% – у групі застосування високої дози едоксабану (відношення шансів (ВШ) 0,79; р<0,001 для гіпотези «едоксабан у високій дозі не гірший за варфарин) та 1,61% – у групі низької дози едоксабану (ВШ 1,07; р<0,005 для гіпотези «едоксабан у низькій дозі не гірше варфарину»).
Порівняно з варфарином було виявлено тенденцію до зниження частоти інсульту та системних тромбоемболій у групі застосування високої дози едоксабану (ВШ 0,87; р<0,08). Для низької дози едоксабану, навпаки, встановлено тенденцію до збільшення частоти первинної кінцевої точки (ВШ 1,13; р<0,10). Частота великих кровотеч за рік сягала 3,43% у групі варфарину; 2,75% – у групі високої дози едоксабану (ВШ 0,80; р<0,001) та 1,61% – у групі низької дози едоксабану (ВШ 0,47; р<0,001). Оскільки прийом низької дози едоксабану 30/15 мг асоціювався з тенденцією до збільшення частоти інсультів і системних емболій, а також із достовірно вищою, порівняно з варфарином, частотою ішемічних інсультів (ВШ 1,41; р<0,001), такий режим застосування едоксабану надалі не був схвалений для профілактики тромбоемболічних ускладнень у пацієнтів із ФП. Едоксабан (60/30 мг/добу) суттєво знижував ризик геморагічного інсульту порівняно з варфарином (ВШ 0,54; р<0,001). Ризик ішемічного інсульту був порівнянний між групами едоксабану (60/30 мг) і варфарину (ВШ 1,00; р=0,97). У дослідженні оцінювали частоту кінцевих точок, що характеризують сумарну клінічну ефективність порівнюваних препаратів і поєднують найбільш клінічно значущі ішемічні та геморагічні ускладнення. Застосування едоксабану у високій дозі асоціювалося з меншою (порівняно з варфарином) частотою таких комбінованих кінцевих точок, як інсульт, системна тромбоемболія, велика кровотеча та смерть від усіх причин (ВШ 0,89; р<0,003); інвалідизуючий інсульт, загрозлива для життя кровотеча та смерть від усіх причин (ВШ 0,88; р<0,008). Заздалегідь спланований субаналіз засвідчив, що зниження дози едоксабану із 60 до 30 мг (у пацієнтів із КлКр 30‑50 мл/хв, масою тіла <60 кг, а також супутнім застосуванням кетоконазолу, хінідину та дронедарону) не призводило до достовірного збільшення ризику всіх інсультів і системної емболії, а також ішемічного інсульту порівняно з варфарином, тоді як ступінь зниження частоти великих кровотеч на тлі приймання едоксабану в таких пацієнтів був навіть більшим, ніж у підгрупі застосування повної дози. Цікавим є проведений субаналіз окремих груп із тяжкою коморбідною патологією. Близько 28% учасників дослідження ENGAGE AF-TIMI 48 перенесли раніше інсульт або транзиторну ішемічну атаку. Попередньо спланований субаналіз підтвердив, що в таких пацієнтів очікувано був вищий ризик ішемічних ускладнень та кровотеч, ніж у всій когорті, але всі основні виявлені тенденції зберігалися: приймання едоксабану (60/30 мг/добу) асоціювалося з меншою частотою великих кровотеч та геморагічних інсультів, а також із тенденцією до зниження частоти інсульту та системних тромбоемболій порівняно з варфарином. За результатами цього аналізу, встановлено, що у пацієнтів за період приймання досліджуваних препаратів едоксабан (60/30 мг/добу) асоціювався зі зниженням сумарної частоти всіх інсультів порівняно з варфарином (ВШ 0,80; 95% ДІ 0,65‑0,98). Пацієнти із супутньою ІХС (n=4510) продемонстрували переваги едоксабану (60/30 мг) проти варфарину порівняно з учасниками без ішемічної хвороби серця. ВШ розвитку інсульту / системної тромбоемболії на тлі едоксабану порівняно з пацієнтами, що приймали варфарин, у підгрупі із супутньою ІХС становило 0,65; у підгрупі без ІХС – 0,94; p<0,062. Аналогічно ВШ розвитку інфаркту міокарда у тих, хто приймав едоксабан, порівнянні з варфарином, становило 0,69 у пацієнтів із ІХС та 1,24 – в осіб без ІХС; p<0,017. Переваги едоксабану щодо частоти великих кровотеч не залежали від супутньої ІХС. Також окремо виконали аналіз пацієнтів із кліренсом креатиніну 30‑50 мл/хв (n=4074). У пацієнтів із КлКр≤50 мл/хв ступінь зниження частоти великих кровотеч більший (ВШ 0,76; р<0,036), ніж в осіб із КлКр>50‑95 мл/хв (ВШ 0,89; р<0,15). Хоча прямих порівняльних досліджень ефективності та безпечності різних НОАК не проводили, результати метааналізу P. B. Nielsen et al. (2015)продемонстрували, що у пацієнтів із помірним зниженням ниркової функції едоксабан у дозі 60 мг виявився безпечнішим щодо розвитку великих кровотеч, ніж дабігатран (110 і 150 мг), ривароксабан (20 мг) та апіксабан (5 мг). При цьому частота інсультів / системних тромбоемболій не різнилася у пацієнтів, які приймали різні НОАК [3].
Отже, едоксабан у дозі 60/30 мг на добу є вдалим вибором для пацієнтів із ФП та помірним зниженням ниркової функції. До цього дослідження, як і в інші реєстраційні дослідження основних НОАК, не залучали пацієнтів із кліренсом креатиніну <30 мл/хв. Хоча і експертні спільноти, і регуляторні органи допускають застосування едоксабану в зниженій дозі у пацієнтів із кліренсом креатиніну15‑29 мл/хв.
Аналіз результатів дослідження ENGAGE AF-TIMI 48 засвідчив, що у пацієнтів зі збільшеним кліренсом креатиніну >95 мл/хв спостерігається недостовірна тенденція до збільшення кількості інсультів та епізодів системної тромбоемболії на тлі застосування едоксабану (60/30 мг) порівняно з варфарином. ВШ розвитку інсульту або системної тромбоемболії у групі едоксабану (60/30 мг) порівняно з варфарином становило 0,87 (95% ДІ 0,65‑1,18) у пацієнтів із КлКр<50 мл/хв; 0,78 (0,64‑0,96) в осіб із КлКр>50‑95 мл/хв та 1,36 (0,88‑2,10) в учасників із КлКр>95 мл/хв. Оскільки едоксабан виводиться нирками на 50%, посилення ниркової функції теоретично може призводити до підвищеної екскреції препарату. Управління із санітарного нагляду за якістю харчових продуктів та медикаментів США (FDA) вважає отримані результати підставою для того, щоб не рекомендувати приймання едоксабану пацієнтам із ФП та КлКр>95 мл/хв, тоді як експерти Європейського медичного агентства (ЕМА) та Європейського товариства кардіологів (ESC) не вважають отримані в додатковому аналізі результати підґрунтям для подібних обмежень.
У дослідженні ENGAGE AF-TIMI 48 продемонстровано, що спільне призначення едоксабану з інгібіторами P-gp, як-от верапаміл або дронедарон, збільшує концентрацію антикоагулянту в 1,5 раза, тоді як вплив аміодарону, аторвастатину або дигоксину був мінімальним. За одночасного застосування едоксабану із циклоспорином, дронедароном, еритроміцином або кетоконазолом рекомендовано знижувати його дозу до 30 мг. Інгібітори CYP3A4 мають мінімальний вплив на концентрацію едоксабану в плазмі [4].
Усунення фібриляції передсердь
Кардіоверсія, як і катетерна абляція, що робиться для усунення фібриляції передсердь, характеризується високим ризиком тромбоемболічних ускладнень. Зокрема, становлять практичний інтерес клінічні дослідження, які порівнювали едоксабан із варфарином у цих клінічних ситуаціях. ENSURE- AF – найбільше дослідження, де порівнювали НОАК (едоксабан у дозі 60/30 мг) та еноксапарин / варфарин у пацієнтів, яким виконували кардіоверсію. До рандомізованого відкритого дослідження було залучено 2199 осіб (середній вік 64 роки, середнє значення CHA2 DS2-VASc – 2,6 бала, середній час перебування МНВ у цільовому діапазоні у групі варфарину – 70,8%). Понад половині пацієнтів виконували кардіоверсії після черезстравохідної ехокардіографії (ЧСЕХОКГ). Зокрема, ЧСЕХОКГ та кардіоверсії виконували протягом трьох діб із рандомізації. У групі едоксабану пацієнт мав отримати препарат щонайменше за 2 год до кардіоверсії. Тактика в групі застосування варфарину / еноксапарину залежала від МНВ: якщо воно >2, ініціація еноксапарину не була потрібна, можна виконувати кардіоверсію, якщо <2 – одночасно з варфарином призначався еноксапарин, який скасовували після досягнення цільових значень МНВ. Після кардіоверсії пацієнти отримували антикоагулянтну терапію щонайменше 4 тиж. Час спостереження – 30 днів. Частота тромбоемболічних ускладнень була низькою в усіх групах: комбіновану кінцеву точку «інсульт / системна тромбоемболія / серцево-судинна смерть» зафіксовано у 5 пацієнтів групи едоксабану (<1%) та у 11 – групи еноксапарину / варфарину (1%). Частота великих і невеликих клінічно значущих кровотеч була зіставна в обох групах також і становила 1%. За результатами дослідження доведено, що застосування інгібітора Xa фактора едоксабану як антикоагулянта при проведенні електричної кардіоверсії у пацієнтів із ФП настільки ефективне і безпечне, як і більш звична схема з використанням варфарину і гепарину. Автори дослідження звернули увагу на те, що антикоагулянтна дія едоксабану настає дуже швидко і робить можливим виконання кардіоверсії вже через 2 год після застосування першої дози препарату. До того ж показники частоти великих кровотеч і тромбоемболії упродовж 2 міс. спостереження в дослідженні були низькими і статистично не різнилися в групах едоксабану або варфарину з тимчасовим призначенням еноксапарину. Ці результати також не залежали від наявності або відсутності контролю за допомогою ЧСЕХОКГ, який виконували приблизно в половини випадків в обох групах. На думку дослідників, едоксабан можливо використовувати практично у будь-яких пацієнтів, які потребують кардіоверсії, навіть в осіб зі зниженою функцією нирок або недостатньою масою тіла, оскільки препарат наявний у двох дозуваннях – 60 і 30 мг [5].
Катетерна абляція на тлі терапії едоксабаном
У межах дослідження ELIMINATE-AF оцінювали безпеку проведення катетерної абляції з приводу ФП без відміни едоксабану в дозуванні 60/30 мг (група порівняння – терапія варфарином). Абляцію виконували найбільше через 18 год після застосування останньої дози едоксабану, наступне приймання – не пізніше ніж через 6 год після завершення втручання. У групі варфарину абляція допускалася за значень МНВ від 1,5 до 3,5. Частота первинної кінцевої точки (серцево-судинна смерть, інсульт, велика кровотеча) за 3 міс. післяопераційного спостереження (до уваги брали кінцеві точки з моменту закінчення абляції) була дуже невисокою і становила 0,3% у групі застосування едоксабану та 2% – у групі варфарину (ВШ 0,16; 95% 0,02‑1,73) під час аналізу «за наміром лікуватися». Частота тих самих подій у вибірці пацієнтів, яким абляція була виконана, від моменту початку абляції становила 2,7% у групі едоксабану та 1,7% – у групі варфарину (ВШ 1,60; 95% ДІ 0,44‑5,78). Основна частка несприятливих подій – це геморагічні ускладнення, що сталися під час абляції та протягом 48 год після неї. Деяка тенденція до більшої частоти таких ускладнень у пацієнтів, які приймають едоксабан, автори пояснювали більшою дозою гепарину перед втручанням для досягнення цільових рівнів активованого часу згортання >300 сек. Отже, едоксабан є однією з можливих опцій антикоагулянтної підтримки пацієнтів, яким виконували катетерну абляцію з приводу ФП [6].
Застосування едоксабану в пацієнтів із неклапанною фібриляцією передсердь у клінічній практиці
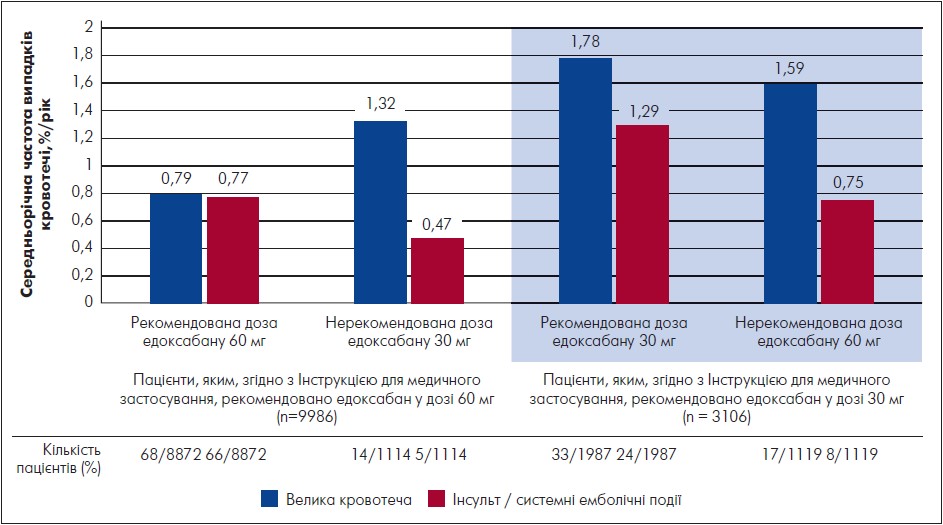
У серпні 2020 р. опубліковано результати річного спостереження за пацієнтами (n=13 092), які увійшли до Европейського регістру ETNA-AF-Europe. До цього дослідження залучили 852 центри у 10 країн Європи. Мета дослідження – оцінити ризики та користь застосування едоксабану в реальній клінічній практиці у пацієнтів із неклапанною ФП. Серед основних ускладнень, які вивчали на тлі приймання едоксабану: кровотечі, ускладнення з боку печінки, серцево-судинна смерть і смерть від усіх причин, інсульти (ішемічні та геморагічні), системні емболічні події, транзиторна ішемічна атака, великі серцево-судинні події, венозна тромбоемболія, гострий коронарний синдром у великій невідібраній когорті пацієнтів із ФП високого ризику, які регулярно лікуються едоксабаном. Cередній вік пацієнтів – 73,6±9,5 років. Уперше діагностована ФП була симптомною у 54% і безсимптомною у 34% пацієнтів, решту (12%) дослідники визначили як невідому. Найпоширенішими симптомами серед симптоматичних пацієнтів на початку дослідження були серцебиття (69%), задишка (60%) і втома (58%). Середній час між першим діагнозом ФП і долученням до дослідження становив 4,6 міс. (IQR: 0,4‑29,9). Серед частих супутніх захворювань були артеріальна гіпертензія (77%), діабет (22%), захворювання клапанів серця (18%), застійна серцева недостатність (6%) та інфаркт міокарда в анамнезі (4%). Середній бал CHA2DS2-VASc: 3,1±1,4. Едоксабан застосовували в терапевтичній дозі, схваленій для профілактики інсульту за неклапанної ФП, тобто 60 мг раз на добу зі зниженням дози до 30 мг раз на добу в пацієнтів з однією з таких характеристик: порушення функції нирок (КлКр 15‑50 мл/хв), або низька маса тіла (≤60 кг), або пацієнти, які отримують інгібітори глікопротеїну р-циклоспорин, дронедарон, еритроміцин або кетоконазол. Фіксували значні відмінності щодо характеристик пацієнтів, які отримували дозу 60 мг проти 30 мг. Середній початковий рівень КлКр становив 75,5 мл/хв і 50,8 мл/хв для груп едоксабану 60 і 30 мг відповідно. Хронічну хворобу нирок в анамнезі зафіксовано у 19,5 і 51,6% пацієнтів, які отримували едоксабан у дозах 60 і 30 мг відповідно. Більшість пацієнтів (77,8%), які отримували едоксабан 30 мг, проти 42,7%осіб, які приймали едоксабан 60 мг, були віком ≥75 років. Показники CHA2DS2-VASc ≥4 були частішими у пацієнтів, які отримували едоксабан 30 мг (58,2%) порівняно з едоксабаном у дозі 60 мг (31%). Зокрема, більша частка пацієнтів із серцево-судинними захворюваннями в анамнезі отримувала едоксабан у дозуванні 30 мг порівняно з едоксабаном у дозі 60 мг. Ішемічний інсульт був у 6,9% проти 5,6% у групі дозування едоксабану 30 мг проти 60 мг та інфаркт міокарда у 6,2% проти 3,7% відповідно. Так само в анамнезі будь-яку кровотечу документували частіше для едоксабану 30 мг порівняно з дозою едоксабану 60 мг (5,2 проти 2,5% відповідно) (рис. 1). В ETNA-AF-Europe середній бал CHA2DS2-VASc, як зазначають дослідники, був вищим за офіційно розрахований бал, тоді як середній бал HAS-BLED – нижчим за офіційно розрахований. У рутинній клінічній практиці зазвичай спостерігають, що НОАК часто призначають у менших дозуваннях, попри те, що вони не відповідають критеріям зниження дози, зазначеним у рекомендаціях. Порівняно з основними клінічними дослідженнями, використання знижених дозувань НОАК у щоденній клінічній практиці виявляється частіше. Так, за даними ретроспективного дослідження, знижену дозу НОАК застосовували у 56,8% пацієнтів без чітких показань і адекватну – у 43,2% пацієнтів за показаннями. Примітно, що розподіл дозування едоксабану 60 і 30 мг в ETNA-AF-Europe значною мірою відповідав розподілу у відповідних країнах за ENGAGE AF-TIMI 48; загалом 23,4% пацієнтів у ETNA-AF-Europe отримували знижену дозу едоксабану 30 мг, що було подібно до відсотка тих (21,8%), які мали право на зниження дози в європейській когорті дослідження ENGAGE AF-TIMI 48.
Рисунок 1. Велика кровотеча та інсульт / системні емболічні події у внесених до регістру ETNA-AF-Europe пацієнтів, які отримували дозування згідно з рекомендаціями
Адаптовано за J.R. de Groot et al., 2021.
Оскільки погана функція нирок пов’язана з віком та різними супутніми захворюваннями, відмінності у початкових характеристиках пацієнтів, які отримували едоксабан у дозах 30 і 60 мг, загалом відповідають очікуванням. Застійна серцева недостатність, інфаркт міокарда, стенокардія та захворювання клапанів серця в анамнезі частіше спостерігали в групі дозування 30 мг порівняно з тими, хто отримував 60 мг едоксабану. У дослідженні пацієнти високого ризику, попередньо визначені як ті, у кого в анамнезі був інсульт, велика кровотеча в анамнезі, внутрішньочерепна кровотеча в анамнезі або бал CHA2DS2-VASc≥4, становили 38,4%, і більша їх частка, що важко піддавалися лікуванню, отримувала дозу едоксабану 30 мг проти 60 мг. Те саме стосувалося пацієнтів, яких дослідники вважали слабкими. В ETNA-AF-Europe спостерігали високе дотримання 83,8% критеріїв вибору дози відповідно до показань призначення препарату. Однак не всі пацієнти отримували дозування відповідно до рекомендацій: близько 16% пацієнтів застосовували дозу, яка не відповідала показанням призначення препарату. При цьому 7,5% (n=1031) пацієнтів отримували едоксабан 30 мг замість рекомендованих 60 мг, а 8,6% (n=1175) пацієнтів приймали 60 мг замість рекомендованих 30 мг. Обґрунтування призначення дози 60 мг, попри наявність критерію її зниження, наразі незрозуміле та потребує подальшого аналізу. Майбутні аналізи конкретних характеристик цих пацієнтів, як-от дуже висока маса тіла або певні супутні захворювання, будуть необхідні. Крім того, вік пацієнта, кліренс креатиніну або маса тіла, близька до зазначеного порогу зниження дози, або побоювання ятрогенної кровотечі у слабких пацієнтів, які вже мали в анамнезі часті кровотечі, могли сприяти вибору нижчої дози едоксабану, що відхиляється від рекомендацій призначення препарату. Проте загалом частота несприятливих подій у пацієнтів, які приймали едоксабан, виявилася дуже невеликою: інсульт або системну емболію зафіксовано у 103 осіб (0,82% на рік), великі кровотечі – у 132 осіб (1,05% на рік). Частота внутрішньочерепних крововиливів становила 0,24% на рік, смертність – 3,50% на рік, частота смерті від серцево-судинних захворювань – 1,63% на рік. Отже, едоксабан підтвердив свою ефективність та безпеку щодо профілактики тромбоемболічних ускладнень у пацієнтів із неклапанною ФП в європейській популяції [7].
Тромбоз глибоких вен ніг / тромбемболії легеневої артерії
Ефективність НОАК у лікуванні тромбозу глибоких вен ніг (ТГВ) / тромбемболії легеневої артерії (ТЕЛА) аналізували в рандомізованому подвійному дослідженні Hokusai-VTE, мета якого – вивчення ефективності застосування гепарину / едоксабану порівняно з гепарином / варфарином у профілактиці рецидивуючих тромбозів у пацієнтів із гострим ТГВ / ТЕЛА. Усі пацієнти спочатку отримували гепарин (щонайменше 5 днів, потім – варфарин (цільове МНВ 2‑3) чи едоксабан 60 мг/добу.
Пацієнтам із масою тіла <60 кг, або із КлКр 30‑50 мл/хв, або при застосуванні інгібіторів Р-глікопротеїну, як-от еритроміцин, азитроміцин, кларитроміцин, кетоконазол чи ітраконазол, призначали едоксабан у дозуванні 30 мг/добу впродовж 3‑12 міс. Первинна кінцева точка ефективності (перша повторна ТГВ / ТЕЛА або смерть, пов’язана із цими станами) з’явилася в 3,2% пацієнтів у групах застосування едоксабану та 3,5% – у групі варфарину. Зокрема, первинну кінцеву точку (перша велика кровотеча чи невелика клінічно значуща кровотеча) виявили у 8,5% групи едоксабану та в 10,3% – групи варфарину. Терапевтичний діапазон МНВ спостерігали в 65% пацієнтів, а прихильність до терапії едоксабаном становила 80%. Приблизно 12% осіб у кожній групі отримували лікування протягом 3 міс., 26% – від 3 до 6 міс., 62% – >6 міс. і 40% – упродовж 12 міс. Едоксабан виявився не гіршим щодо первинної кінцевої точки – рецидивуючої венозної тромбоемболії (3,2 проти 3,5%; p<0,001). У пацієнтів із ТЕЛА та дисфункцією правого шлуночка ефективність едоксабану була вищою, ніж у варфарину (3,3% проти 6,2%, ВШ: 0,52). При застосуванні едоксабану рідше виникали клінічно значущі кровотечі (8,5% проти 10,3%; p=0,004). За призначення половини дози едоксабану (30 мг) у пацієнтів із високим ризиком кровотеч фіксували досягнення ефективності (3,0% проти 4,2%) та меншу кількість кровотеч (7,9% проти 12,8%) порівняно з варфарином відповідно [8].
Нині накопичено достатній досвід застосування едоксабану в рутинній клінічній практиці, що свідчить про його ефективність та безпеку за межами клінічних досліджень. Аналіз національної бази даних Південної Кореї за 2014‑2016 рр. дав змогу порівняти між собою результати пацієнтів із ФП, які отримували едоксабан (n=4200) та варфарин (n=31,565). Зокрема, у пацієнтів, які приймали едоксабан, достовірно нижчим виявився ризик таких ускладнень, як ішемічний інсульт (ВШ 0,693; 95% ДІ 0,487‑0,959), внутрішньочерепні крововиливи (ВШ 0,407; 95% ДІ 0,182‑0,785), госпіталізації через великі кровотечі (ВШ 0,532; 95% ДІ 0,352‑0,773), а також смерть від усіх причин (ВШ 0,716; 95% ДІ 0,54) Виявлені переваги едоксабану зберігалися в усіх основних підгрупах (стать, вік, індекс CHA2 DS2-VASc, доза едоксабану, ниркова функція) [9].
На наш погляд, едоксабан має низку переваг, завдяки яким він може бути препаратом вибору для лікування певних категорій пацієнтів. Продемонстровано оптимальний профіль безпеки едоксабану в пацієнтів із хронічною хворобою нирок помірного ступеня тяжкості. У пацієнтів із ІХС застосування едоксабану асоціювалося зі зниженням частоти інфарктів міокарда, а також інсультів та епізодів системної тромбоемболії порівняно з варфарином. Крім того, невелика кількість взаємодій едоксабану з іншими класами ліків робить призначення його привабливим для поліморбітних пацієнтів, які отримують велику кількість препаратів. Для цілої низки пацієнтів безперечною перевагою може виявитися застосування едоксабану раз на добу, що асоціюється з високою прихильністю до лікування у хворих на серцево-судинну патологію, зокрема ФП. Цікавим з погляду тактики лікування є клінічний випадок молодого пацієнта з поліморбідною патологією та персистуючою формою ФП.
Клінічний випадок
Хворий Б., 1976 р.н., упродовж останніх п’яти років спостерігався у сімейного лікаря через скарги на головний біль, запаморочення, що переважно виникали на тлі підвищення артеріального тиску (максимальний 176/100 мм рт. ст). Відтоді приймав антигіпертензивну терапію (еналаприл, амлодипін). За останні 3 міс. (приблизно з квітня 2022 р.) його стан погіршився, з’явилась тахіаритмія, задишка за незначного фізичного навантаження, набряки нижніх кінцівок. На ЕКГ виявлено фібриляцію передсердь із частотою серцевих скорочень 130‑150 на хвилину. Ознаки гіпертрофії лівого шлуночка (ЛШ). Сімейний лікар поставив діагноз: Гіпертонічна хвороба серця ІІІ ст. 2 ст. Гіпертрофія ЛШ. Ризик високий. Персистуюча форма фібриляції передсердь, тахісистолічний варіант. СН ІІА ст.
Лікування. Призначено: загальний аналіз крові, біохімічний аналіз крові, гормони щитоподібної залози, ЕХО КГ. Терапія: бісопролол 2,5 мг; ацетилсаліцилова кислота 100 мг; еналаприл 30 мг; індапамід 2,5 мг. Попри постійне приймання призначеної терапії, стан пацієнта прогресивно погіршувався: тахіаритмія почала турбувати практично щодня, задишка почала з’являтись під час підйому на один поверх, сухий кашель, збільшились набряки нижніх кінцівок, що змусило хворого 01.06.2022 звернутися по допомогу до аритмолога в ДУ «ННЦ Інститут кардіології, клінічної та регенеративної медицини імені академіка М. Д. Стражеска» НАМН України (м. Київ).
Анамнез життя. Алергічний анамнез не обтяжливий. Пацієнт палить 20 років. Обтяжена спадковість: у батька була гіпертонічна хвороба, переніс транзиторну ішемічну атаку.
Об’єктивний статус. Стан задовільний. Нормостенік. Індекс маси тіла 27,1 кг/м2. Задишки в стані спокою немає. АТ 160/98 мм рт. ст. Розміри серця збільшені вліво. Тони приглушені, аритмічні із ЧСС 120‑140 уд./хв. Частота дихальних рухів 18 на хвилину. У легенях дихання везикулярне. Поодинокі сухі хрипи з обох боків у нижніх відділах легень. Живіт округлої форми, м’який, під час пальпації безболісний. Печінка на 2 см виступає з-під реберної дуги. Набряки гомілок з обох боків.
Пацієнт надав результати інструментально-біохімічного дослідження, які було виконано за тиждень до консультації, 23.05.2022. Структурно-функціональний стан щитоподібної залози (ЩЗ) у нормі: УЗД ЩЗ – патології не виявлено, ТТГ 3,4 мОд/л; вільний Т4 11,4 пкмоль/л; вільний Т3 3,1 пкмоль/л.
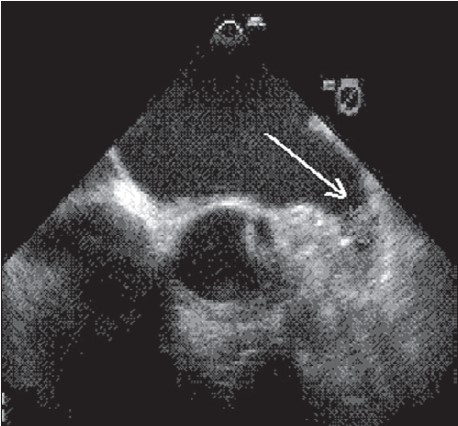
Результати біохімічного аналізу крові: АЛТ 34 од/л; АСТ 27 од/л; КФК 170 од/л; глюкоза 5,5 ммоль/л; креатинин 142 мкмоль/л. Швидкість клубочкової фільтрації 66 мл/хв за формулою Кокрофта–Голта. Ліпідограма в нормі. Пацієнту на поліклінічному етапі виконано такі інструментальні дослідження: ЕКГ, трансторакальна ЕХО КГ (ТТЕХОКГ), черезстравохідне ЕХО КГ (ЧСЕХОКГ). ЕКГ: фібриляція передсердь із частотою серцевих скорочень 132‑146 уд./хв. Гіпертрофії лівого шлуночка (ЛШ). ТТЕХОКГ: Ao 3,7 см; ЛП 4,6 см; ПШ 3,7 см; ТМШП 1,3 см; КДО 180 мл; КСО 100 мл; ТЗСЛШ 1,2 см; фракція викиду (ФВ) ЛШ 44%; ІММЛШ 224 г/м2; СТЛА 35 мм рт. ст. ЧСЕХОКГ: діаметр лівого передсердя 4,7 см; ФВ лівого шлуночка 43%; площа вушка лівого передсердя (ВЛП) 5,1 см2; швидкість вигнання крові з ВЛП 23,1 см/с; ФВ ВЛП 31%. У ВЛП візуалізовано тромб розміром 0,8 см (рис. 2). На підставі скарг пацієнта, даних анамнезу, клініко-інструментального обстеження встановлено клінічний діагноз: ГХ ІІІ стадії, 2-го ступеня. Гіпертензивне серце. Персистуюча форма ФП, тахісистолічний варіант. CHA2DS2VASc 2 бали. Тромбоз ВЛП. Ризик високий. СН Б ст., зі зниженою ФВ ЛШ. ФК ІІІ за NYHA. Через виявлення ознак тромбоутворення у ВЛП кардіоверсію пацієнту не виконували. Призначено терапію: едоксабан 60 мг раз на день, аміодарон 200 мг тричі на добу під контролем ЧСС, бісопролол 5 мг раз на день, раміприл 10 мг раз на день, торасемід 10 мг вранці раз на день, еплеренон 50 мг раз на день, дапигліфлозин 10 мг на добу.
Рисунок 2. Тромб вушка лівого передсердя
Слід звернути увагу, що за наявності ФП, призначення ацетилсаліцилової кислоти не рекомендовано для проведення профілактики кардіоемболічних ускладнень, що були до консультації кардіолога в ДУ «ННЦ Інститут кардіології, клінічної та регенеративної медицини імені академіка М. Д. Стражеска» НАМН України. За сучасними Європейськими та Українськими рекомендаціями, у нативних пацієнтів із ФП антикоагулянтна терапія має починатись не з ацетилсаліцилової кислоти або варфарину, а з призначення НОАК (клас рекомендацій І, рівень доказовості А). Аналогічні рекомендації (про перевагу НОАК) стосуються різних особливих ситуацій: хворі після ішемічного інсульту, після внутрішньочерепного крововиливу (якщо буде призначена антикоагулянтна терапія), у межах підготовки до кардіоверсії або абляції ФП, а також із ФП і гострим або хронічним коронарним синдромом, яким виконують черезшкірне коронарне втручання [10].
Рекомендовано: 1. Обмежити вживання солі, контроль діурезу, відмова від паління. 2. Повторна консультація через 4 тиж. призначеної терапії з повторним виконанням ТТ та ЧСЕХОКГ і за відсутності тромбозу ВЛП застосування кардіоверсії для відновлення синусового ритму.
Повторне звернення. Через місяць, 01.07.2022, пацієнт повторно звернувся до ДУ «ННЦ Інститут кардіології, клінічної та регенеративної медицини імені академіка М. Д. Стражеска» НАМН України. Стан хворого дещо покращився, зменшилась слабкість, зникли набряки, але залишилась неритмічна діяльність серця із ЧСС 100‑116 уд./хв., задишка під час фізичного навантаження, підйому на 2-й поверх. За повторного проведення ЧСЕХОКГ: діаметр лівого передсердя 4,7 см; ФВ лівого шлуночка 43%; площа вушка лівого передсердя (ВЛП) 4,1 см2; швидкість вигнання крові з ВЛП 40,1 см/с; ФВ ВЛП 41%. Тромбоутворення в лівому передсерді та у ВЛП не виявлено. Отримані результати дали змогу відновити синусовий ритм за допомогою кардіоверсії, для чого пацієнта госпіталізували до відділення клінічної аритмології та електрофізіології, де успішно виконали кардіоверсію з відновленням синусового ритму. За даними повторної ТТЕХОКГ, збільшилась ФВ ЛШ до 50%, зменшились ознаки дилатації лівих відділів серця: КДО 162 мл; КСО 80 мл; ЛП 4,3 см.
Пацієнта виписали зі стаціонару в задовільному стані з діагнозом: ГХ ІІІ стадії, 2-го ступеня. Гіпертензивне серце. Персистуюча форма ФП, синусовий ритм відновлений ЕІТ 25.07.2022. CHA2DS2VASc 2 бали. Ризик високий. СН А ст. ФК ІІ за NYHA.
Рекомендовано: 1. Продовжити призначену терапію. 2. Повторна консультація – через місяць. За місяць пацієнт повідомив про значне покращання самопочуття, відсутність тахіаритмії, задишки, набряків на нижніх кінцівках. На ЕКГ зберігався синусовий ритм із ЧСС 64 уд./хв. АТ 136/80 мм рт. ст. Призначену терапію приймає в повному обсязі. Рекомендовано повторну консультацію через 6 міс.
Висновки
Цей приклад демонструє, що проведення ЧСЕХОКГ є доцільною, коли термін антикоагуляційної терапії становить 4 тиж. та обов’язковою за умови скорочення періоду гіпокоагуляціїї для відновлення синусового ритму. Але не завжди застосування НОАК протягом 4 тиж. створює умови для безпечного відновлення синусового ритму, тому що є декілька чинників, які можуть сприяти тромбоутворенню.
У нашій клінічній практиці були випадки, коли на тлі 4 тиж. гіпокоагуляції не мали тромболітичного ефекту, але це не стало приводом для відмови від відновлення синусового ритму. Продовження приймання НОАК протягом наступних 3 міс. супроводжувалось відсутністю ознак тромбоутворення у ВЛП та уможливило безпечно відновити синусовий ритм.
Виявлення та ефективне лікування одного з найпоширеніших ускладнень за ФП – тромбоутворення в лівому передсерді, а саме ВЛП, у якому діагностують до 90% усіх тромбів. За ФП пікова швидкість кровотоку у ВЛП (порівняно із синусовим ритмом) знижується практично вдвічі. ФП призводить до розширення порожнини ЛП, порушення його скоротливої функції. У разі ФП бракує повноцінної систоли передсердь, власне, спорожнення ВЛП відбувається пасивно, завдяки скороченню прилеглої стінки лівого шлуночка. Це призводить до сповільнення кровотоку у ВЛП, а порушення скоротливої здатності ЛШ перетворює ВЛП на статичний мішок, заповнений кров’ю, що сприяє тромбоутворенню. За сучасними міжнародними протоколами діагностування та лікування хворих із ФП, зокрема із серцевою недостатністю, ТТЕХОКГ рекомендовано у пацієнтів із підозрою на тромбоз ЛП або ВЛП для оцінювання розмірів ЛП та розмірів і функції ЛШ, а також для встановлення можливої етіології ФП та визначення додаткових чинників ризику інсульту. З іншого боку, ЧСЕХОКГ має переваги перед ТТЕХОКГ в оцінюванні анатомії та функції ВЛП щодо варіабельності клінічних контекстів, зокрема перед кардіоверсією, абляцією передсердних аритмій і перкутанного закриття ВЛП. ЧСЕХОКГ залишається золотим стандартом і методом вибору діагностування оцінювання анатомії та функції ВЛП, тромбозу лівого передсердя і його вушка, чутливість і специфічність якої становлять відповідно 92 і 98%.
Одним із важливих результатів нашого спостереження став приклад застосування сучасного представника НОАК, а саме едоксабану в рекомендованій дозі, що дало змогу підтримати високий комплаєнс його застосування, значно покращити результати лікування, оптимізувати прогноз на тлі доброї переносимості препарату та відсутності побічних реакцій з його боку. Саме тому в останніх Європейських та Американських рекомендаціях із лікування ФП ідеться про необхідність широкого та своєчасного впровадження НОАК як засобу зручної та ефективної терапії (AHA/ASA, 2019; ESC/ESVS, 2020; EHRA, 2021). Наявна доказова база свідчить про те, що едоксабан – ефективна і безпечна опція у профілактиці тромбоемболічних ускладнень у пацієнтів із неклапанною фібриляцією передсердь. Для едоксабану розроблено адекватний підхід до зниження його дозування у пацієнтів з імовірним підвищенням концентрації препарату в плазмі, зумовленим порушенням ниркової функції, малою масою тіла або взаємодією з іншими лікарськими засобами.
На фармацевтичному ринку України перший едоксабан представлено з 2021 року препаратом Едоксакорд 60 і 30 мг виробництва Київського вітамінного заводу, біоеквівалентність його інноваційному препарату Ліксіана, виробництва «Даічі Санкіо Юроуп ГмбХ» (Німеччина), доведено в клінічному випробуванні в умовах одноразового перорального застосування здоровими добровольцями.
Література
- NICE guideline Atrial fibrillation: diagnosis and management. Published: 27 April 2021 Last updated: 30 June 2021. URL: www.nice.org.uk/guidance/ng196.
- Ogata K., Mendell-Harary J., Tachibana M. et al. Clinical safety, tolerability, pharmacokinetics, and pharmacodynamics of the novel factor Xa inhibitor edoxaban in healthy volunteers. The Journal of Clinical Pharmacology. 2010. Vol. 50, № 7. Р. 743‑53. DOI: 10.1177/0091270009351883.
- Nielsen P. B., Lane D. A., Rasmussen L. H. et al. Renal function and non-vitamin K oral anticoagulants in comparison with warfarin on safety and efficacy outcomes in atrial fibrillation patients: a systemic review and meta-regression analysis. Clin Res Cardiol. 2015.Vol. 104, № 5. Р. 418‑429. DOI: 10.1007/s00392‑014‑0797‑9.
- Giugliano R.P., Ruff C.T., Braunwald E. ENGAGE AF-TIMI 48 Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. The New England Journal of Medicine. 2013.Vol. 369, № 22. Р. 2093104. DOI: 10.1056/NEJMoa1310907.
- Goette A., Merino J. L., Ezekowitz M. D. et al. Edoxaban versus enoxaparinwarfarin in patients undergoing cardioversion of atrial fibrillation (ENSURE-AF): a randomised, open-label, phase 3b trial. Lancet. 2016. Vol. 388, № 10055. Р. 1995‑2003. DOI: 10.1016/S0140‑6736(16)31474-X.
- Hohnloser S. H., Camm J., Cappato R. et al. Uninterrupted edoxaban vs. vitamin K antagonists for ablation of atrial fibrillation: the ELIMINATE-AF trial. Eur Heart J. 2019. Vol. 40, № 36. Р. 3013‑3021. DOI: 10.1093/eurheartj/ ehz190/
- European Heart Journal – Cardiovascular Pharmacotherapy. April 2021. Vol. 7, № FI1. P. f30–f39. URL: https://doi.org/10.1093/ehjcvp/pvaa079.
- Karim Said. Hokusai-VTE: Edoxaban for the treatment of venous thromboembolism Glob Cardiol Sci Pract. 2013. Vol. 4. Р. 416‑420.Published online 2013 Dec 30. DOI: 10.5339/gcsp.2013.50
- Eue-Keun Choi Clinical Events with Edoxaban in South Korean and Taiwanese Atrial Fibrillation Patients in Routine Clinical PracticeJ Clin Med. 2021 Nov 16.Vol. 10, № 22. Р. 5337. DOI: 10.3390/jcm10225337.
- Hindricks G., Potpara T., Dagres N. et al. ESC guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). European Heart Journal. 2020: ehaa612.