11 лютого, 2015
Лечение системной красной волчанки: достижения, проблемы

 А.И. Дядык, д.м.н., профессор, А.Э. Багрий, д.м.н., профессор, С.Р. Зборовский, Донецкий национальный медицинский университет им. М. ГорькогоСистемная красная волчанка (СКВ) – прототип системного аутоиммунного заболевания, характеризуемого поликлональным аутоантительным ответом. Аутоантитела обусловливают поражение различных органов и систем организма как за счет непосредственного воздействия на мишени (антиэритроцитарные, антитромбоцитарные, антилимфоцитарные и другие аутоантитела), так и опосредованно через формирование иммунных комплексов в циркуляции и депозицию их и/или формирование in situ в различные структуры с активацией каскадных систем, индукцией воспалительного ответа и развитием клинической картины, характеризующейся широким спектром и разнообразными клиническими проявлениями, неоднозначным течением и прогнозом, а также ответом на проводимую терапию.ЭпидемиологияСКВ является одним из наиболее тяжелых и распространенных заболеваний соединительной ткани. Данные о распространенности этой патологии в различных регионах мира довольно широко варьируют: от 12,5 случаев на 100 тыс. населения в Великобритании до 39 и 40 случаев на 100 тыс. населения в Швеции и США соответственно. Представлены убедительные данные о существенном повышении уровня распространенности СКВ за последние десятилетия.ПатогенезПрименительно к задачам настоящей работы мы приведем здесь лишь краткое перечисление классических составляющих патогенеза СКВ, которые важны для последующего рассмотрения основных вопросов лечебной тактики.В развитии СКВ важное место отводится следующим факторам:• генетической предрасположенности (более высокая частота заболеваемости у родственников первой степени родства, у лиц негроидной расы в сравнении с европеоидной, у обладателей некоторых гаплотипов системы главного комплекса гистосовместимости – HLA);• половым гормонам (превалирование заболевания у женщин репродуктивного возраста);• многообразным иммунным механизмам, среди которых следует выделить:– нарушения систем цитокинов, хемокинов и иных сигнальных молекул, определяющих как клеточно-опосредованные, так и гуморальные иммунные реакции;– комплекс изменений количества и функции Т-лимфоцитов, а также их субпопуляций (например, дефицит супрессорной функции, способствующий повышению синтеза антител и продукции аутоантител);– разноплановые В-клеточные нарушения, обусловливающие генерализованную гиперактивность В-лимфоцитов (увеличение количества созревающих В-клеток, а также повышение скорости пролиферации и активации В-клеток и скорости секреции ими иммуноглобулинов);– нарушения процессов, обеспечивающих толерантность к аутоантигенам, что благоприятствует формированию гетерогенного поликлонального аутоантительного ответа (среди аутоантител наиболее специфичными для СКВ являются антинуклеарные антитела, а также антитела, направленные против различных ядерных компонентов, включая ДНК, РНК, гистоны и нуклеопротеиновые комплексы).Прогноз и летальность при СКВВ последние десятилетия отмечено существенное повышение выживаемости больных данной патологией. В 1940-1960-х гг. СКВ рассматривалaсь как фатальное заболевание, которое часто заканчивалось летальным исходом в течение нескольких месяцев или лет. В то время 5-летняя выживаемость пациентов с СКВ не превышала 50%. По данным эпидемиологических исследований, опубликованных за последние 15 лет, 5-летняя, 10-летняя и 20-летняя выживаемость больных СКВ, соответственно, составила 96; 89 и 80%.Повышение выживаемости больных СКВ связывают с рядом факторов: улучшением качества диагностики заболевания (прежде всего ранней); широким применением в клинической практике глюкокортикоидов (ГК) и препаратов цитотоксического действия (ПЦТД); дифференцированным подходом к проведению патогенетической терапии и выбору ее особенностей, которые базируются на комплексной оценке клинических, лабораторных и морфологических (если это необходимо и возможно) параметров; внедрением в клиническую практику при тяжелых поражениях почек и других органов, кроветворной и центральной нервной системы (ЦНС) агрессивных режимов, включающих пульс-терапию метилпреднизолоном (МП) и циклофосфаном (в части случаев в комбинации с плазмаферезом); повышением эффективности гемодиализа, перитонеального диализа и трансплантации почек при развитии терминальной стадии почечной недостаточности; своевременной имплантацией усовершенствованных механических и биологических клапанов при выраженной дисфункции клапанного аппарата сердца, обусловленного эндокардитом Либмана-Сакса. Необходимо подчеркнуть, что важное место в снижении летальности больных СКВ отводят строго обоснованному назначению ГК и ПЦТД (особенно высоких дозировок), подбору их минимальных дозировок, обеспечивающих оптимальный лечебный эффект при низком уровне побочных эффектов. Кроме того, в последние десятилетия у больных СКВ по показаниям используются новые антибактериальные, антигипертензивные, антиангинальные, диуретические и гиполипидемические средства.Уровень летальности больных СКВ значимо зависит от социально-экономического статуса. Низкий социально-экономический уровень населения существенно затрудняет своевременную диагностику заболевания, проведение оптимальной патогенетической и симптоматической терапии, а также не позволяет осуществлять адекватные лечебные мероприятия при тяжелых поражениях жизненно важных органов (например, гемодиализ, перитонеальный диализ, трансплантацию почек, имплантацию клапанов, коронарную ангиопластику и др.).Уяснение факторов риска летальных исходов служит важным фактором в дальнейшем повышении выживаемости больных СКВ. К ведущим причинам летальных исходов при СКВ относятся волчаночный гломерулонефрит, волчаночные поражения ЦНС, неконтролируемая активность СКВ, интеркуррентные инфекции и сердечно-сосудистые заболевания. Кроме того, остается высоким риск, обусловленный побочными эффектами (в том числе опасными для жизни) лекарственных средств, прежде всего глюкокортикоидов и препаратов цитостатического действия. Серьезную угрозу для жизни больных СКВ представляет внезапная отмена патогенетической терапии.Лечебная тактика при СКВТерапия СКВ является сложнейшей задачей. Подобная ситуация объясняется рядом факторов. Остается неизвестной этиология заболевания, требуют уточнения отдельные звенья патогенеза. СКВ характеризуется неоднородностью генетических и иммунологических нарушений, разнообразием клинических, морфологических и лабораторных проявлений. Естественное течение заболевания отличается непредсказуемостью. Для СКВ характерно, что клинико-лабораторные, морфологические проявления и ответ на проводимое лечение, а также способность к спонтанным эволюциям у каждого больного индивидуальны. В связи с этим представляется достаточно затруднительным прогнозирование течения и исхода СКВ, а также эффективности патогенетической терапии у конкретного больного.Вышеизложенное объясняет отсутствие унифицированного метода лечения СКВ. Однако, несмотря на существующие проблемы, следует отметить значимые успехи в ее терапии за последние десятилетия, позволившие существенно изменить прогноз заболевания и снизить летальность. Своевременная диагностика СКВ, применение адекватных лечебных подходов, участие в диагностике и лечении заболевания наряду с ревматологами дерматологов, нефрологов, кардиологов, неврологов, пульмонологов, гастроэнтерологов, окулистов, гематологов, иммунологов позволяют достаточно успешно контролировать заболевание у подавляющего большинства пациентов. Результаты многочисленных контролируемых исследований, посвященных оценке эффективности различных методов лечения СКВ, послужили основанием для выработки стратегических подходов к ведению таких больных.Несмотря на существенные успехи, многие вопросы терапии СКВ далеки от желаемого разрешения. Так, на сегодня не существует какого-либо лекарственного средства, которое способствовало бы полному излечению от заболевания. Обострения СКВ (часто непредсказуемые) могут развиваться после продолжительных (в течение месяцев и даже лет) ремиссий. При этом существенно могут отличаться клинические проявления как по вовлеченным в патологический процесс органам и системам, так и по тяжести их поражения. Кроме того, остается серьезной проблема побочных эффектов (в том числе и жизнеопасных), часто возникающих при применении различных лечебных режимов.Перед началом терапии и выбором оптимальной лечебной программы необходимо провести тщательное обследование пациента с целью подтверждения диагноза СКВ и определения особенностей заболевания по следующему алгоритму.1. Ответить на вопросы:а) имеются ли у больного симптомы, присущие СКВ в соответствии с критериями Американской коллегии ревматологов (АКР)?б) если указанные симптомы отсутствуют, имеются ли у больного гистологические критерии дискоидной волчанки или подострой кожной волчанки? Если нет, то уверен ли врач в наличии у больного СКВ при отсутствии 4 критериев АКР?в) исключены ли у больного такие заболевания, как склеродермия, дерматомиозит, смешанные заболевания соединительной ткани?2. Если диагноз СКВ подтвержден, то следует установить наличие поражения жизненно-важных органов (т.е. вовлечение в патологический процесс почек; сердца; легких; печени; ЦНС; сосудов – васкулиты; системы кроветворения – тромбоцитопения, гемолитическая анемия, лейкоцитопения) или отсутствие таковых.3. Установить наличие особых клинических и серологических проявлений СКВ (т.е. антифосфолипидного синдрома, положительных Ro(SS-А) антител, синдрома Шегрена, судорожных припадков, неадекватного поведения, сопутствующей фибромиалгии и др.), требующих специальных лечебных подходов.Целью лечения СКВ является: • достижение полной или частичной клинической ремиссии (индукционная терапия);• профилактика обострений (поддерживающая терапия);• своевременная и адекватная терапия обострений;• снижение тяжести поражения жизненно важных органов;• достижение этих целей при высоком терапевтическом индексе (определяется как отношение терапевтической эффективности к количеству побочных действий).Нам представляется важной с практической точки зрения классификация СКВ по тяжести клинических проявлений, которая предложена американскими ревматологами (табл.).
А.И. Дядык, д.м.н., профессор, А.Э. Багрий, д.м.н., профессор, С.Р. Зборовский, Донецкий национальный медицинский университет им. М. ГорькогоСистемная красная волчанка (СКВ) – прототип системного аутоиммунного заболевания, характеризуемого поликлональным аутоантительным ответом. Аутоантитела обусловливают поражение различных органов и систем организма как за счет непосредственного воздействия на мишени (антиэритроцитарные, антитромбоцитарные, антилимфоцитарные и другие аутоантитела), так и опосредованно через формирование иммунных комплексов в циркуляции и депозицию их и/или формирование in situ в различные структуры с активацией каскадных систем, индукцией воспалительного ответа и развитием клинической картины, характеризующейся широким спектром и разнообразными клиническими проявлениями, неоднозначным течением и прогнозом, а также ответом на проводимую терапию.ЭпидемиологияСКВ является одним из наиболее тяжелых и распространенных заболеваний соединительной ткани. Данные о распространенности этой патологии в различных регионах мира довольно широко варьируют: от 12,5 случаев на 100 тыс. населения в Великобритании до 39 и 40 случаев на 100 тыс. населения в Швеции и США соответственно. Представлены убедительные данные о существенном повышении уровня распространенности СКВ за последние десятилетия.ПатогенезПрименительно к задачам настоящей работы мы приведем здесь лишь краткое перечисление классических составляющих патогенеза СКВ, которые важны для последующего рассмотрения основных вопросов лечебной тактики.В развитии СКВ важное место отводится следующим факторам:• генетической предрасположенности (более высокая частота заболеваемости у родственников первой степени родства, у лиц негроидной расы в сравнении с европеоидной, у обладателей некоторых гаплотипов системы главного комплекса гистосовместимости – HLA);• половым гормонам (превалирование заболевания у женщин репродуктивного возраста);• многообразным иммунным механизмам, среди которых следует выделить:– нарушения систем цитокинов, хемокинов и иных сигнальных молекул, определяющих как клеточно-опосредованные, так и гуморальные иммунные реакции;– комплекс изменений количества и функции Т-лимфоцитов, а также их субпопуляций (например, дефицит супрессорной функции, способствующий повышению синтеза антител и продукции аутоантител);– разноплановые В-клеточные нарушения, обусловливающие генерализованную гиперактивность В-лимфоцитов (увеличение количества созревающих В-клеток, а также повышение скорости пролиферации и активации В-клеток и скорости секреции ими иммуноглобулинов);– нарушения процессов, обеспечивающих толерантность к аутоантигенам, что благоприятствует формированию гетерогенного поликлонального аутоантительного ответа (среди аутоантител наиболее специфичными для СКВ являются антинуклеарные антитела, а также антитела, направленные против различных ядерных компонентов, включая ДНК, РНК, гистоны и нуклеопротеиновые комплексы).Прогноз и летальность при СКВВ последние десятилетия отмечено существенное повышение выживаемости больных данной патологией. В 1940-1960-х гг. СКВ рассматривалaсь как фатальное заболевание, которое часто заканчивалось летальным исходом в течение нескольких месяцев или лет. В то время 5-летняя выживаемость пациентов с СКВ не превышала 50%. По данным эпидемиологических исследований, опубликованных за последние 15 лет, 5-летняя, 10-летняя и 20-летняя выживаемость больных СКВ, соответственно, составила 96; 89 и 80%.Повышение выживаемости больных СКВ связывают с рядом факторов: улучшением качества диагностики заболевания (прежде всего ранней); широким применением в клинической практике глюкокортикоидов (ГК) и препаратов цитотоксического действия (ПЦТД); дифференцированным подходом к проведению патогенетической терапии и выбору ее особенностей, которые базируются на комплексной оценке клинических, лабораторных и морфологических (если это необходимо и возможно) параметров; внедрением в клиническую практику при тяжелых поражениях почек и других органов, кроветворной и центральной нервной системы (ЦНС) агрессивных режимов, включающих пульс-терапию метилпреднизолоном (МП) и циклофосфаном (в части случаев в комбинации с плазмаферезом); повышением эффективности гемодиализа, перитонеального диализа и трансплантации почек при развитии терминальной стадии почечной недостаточности; своевременной имплантацией усовершенствованных механических и биологических клапанов при выраженной дисфункции клапанного аппарата сердца, обусловленного эндокардитом Либмана-Сакса. Необходимо подчеркнуть, что важное место в снижении летальности больных СКВ отводят строго обоснованному назначению ГК и ПЦТД (особенно высоких дозировок), подбору их минимальных дозировок, обеспечивающих оптимальный лечебный эффект при низком уровне побочных эффектов. Кроме того, в последние десятилетия у больных СКВ по показаниям используются новые антибактериальные, антигипертензивные, антиангинальные, диуретические и гиполипидемические средства.Уровень летальности больных СКВ значимо зависит от социально-экономического статуса. Низкий социально-экономический уровень населения существенно затрудняет своевременную диагностику заболевания, проведение оптимальной патогенетической и симптоматической терапии, а также не позволяет осуществлять адекватные лечебные мероприятия при тяжелых поражениях жизненно важных органов (например, гемодиализ, перитонеальный диализ, трансплантацию почек, имплантацию клапанов, коронарную ангиопластику и др.).Уяснение факторов риска летальных исходов служит важным фактором в дальнейшем повышении выживаемости больных СКВ. К ведущим причинам летальных исходов при СКВ относятся волчаночный гломерулонефрит, волчаночные поражения ЦНС, неконтролируемая активность СКВ, интеркуррентные инфекции и сердечно-сосудистые заболевания. Кроме того, остается высоким риск, обусловленный побочными эффектами (в том числе опасными для жизни) лекарственных средств, прежде всего глюкокортикоидов и препаратов цитостатического действия. Серьезную угрозу для жизни больных СКВ представляет внезапная отмена патогенетической терапии.Лечебная тактика при СКВТерапия СКВ является сложнейшей задачей. Подобная ситуация объясняется рядом факторов. Остается неизвестной этиология заболевания, требуют уточнения отдельные звенья патогенеза. СКВ характеризуется неоднородностью генетических и иммунологических нарушений, разнообразием клинических, морфологических и лабораторных проявлений. Естественное течение заболевания отличается непредсказуемостью. Для СКВ характерно, что клинико-лабораторные, морфологические проявления и ответ на проводимое лечение, а также способность к спонтанным эволюциям у каждого больного индивидуальны. В связи с этим представляется достаточно затруднительным прогнозирование течения и исхода СКВ, а также эффективности патогенетической терапии у конкретного больного.Вышеизложенное объясняет отсутствие унифицированного метода лечения СКВ. Однако, несмотря на существующие проблемы, следует отметить значимые успехи в ее терапии за последние десятилетия, позволившие существенно изменить прогноз заболевания и снизить летальность. Своевременная диагностика СКВ, применение адекватных лечебных подходов, участие в диагностике и лечении заболевания наряду с ревматологами дерматологов, нефрологов, кардиологов, неврологов, пульмонологов, гастроэнтерологов, окулистов, гематологов, иммунологов позволяют достаточно успешно контролировать заболевание у подавляющего большинства пациентов. Результаты многочисленных контролируемых исследований, посвященных оценке эффективности различных методов лечения СКВ, послужили основанием для выработки стратегических подходов к ведению таких больных.Несмотря на существенные успехи, многие вопросы терапии СКВ далеки от желаемого разрешения. Так, на сегодня не существует какого-либо лекарственного средства, которое способствовало бы полному излечению от заболевания. Обострения СКВ (часто непредсказуемые) могут развиваться после продолжительных (в течение месяцев и даже лет) ремиссий. При этом существенно могут отличаться клинические проявления как по вовлеченным в патологический процесс органам и системам, так и по тяжести их поражения. Кроме того, остается серьезной проблема побочных эффектов (в том числе и жизнеопасных), часто возникающих при применении различных лечебных режимов.Перед началом терапии и выбором оптимальной лечебной программы необходимо провести тщательное обследование пациента с целью подтверждения диагноза СКВ и определения особенностей заболевания по следующему алгоритму.1. Ответить на вопросы:а) имеются ли у больного симптомы, присущие СКВ в соответствии с критериями Американской коллегии ревматологов (АКР)?б) если указанные симптомы отсутствуют, имеются ли у больного гистологические критерии дискоидной волчанки или подострой кожной волчанки? Если нет, то уверен ли врач в наличии у больного СКВ при отсутствии 4 критериев АКР?в) исключены ли у больного такие заболевания, как склеродермия, дерматомиозит, смешанные заболевания соединительной ткани?2. Если диагноз СКВ подтвержден, то следует установить наличие поражения жизненно-важных органов (т.е. вовлечение в патологический процесс почек; сердца; легких; печени; ЦНС; сосудов – васкулиты; системы кроветворения – тромбоцитопения, гемолитическая анемия, лейкоцитопения) или отсутствие таковых.3. Установить наличие особых клинических и серологических проявлений СКВ (т.е. антифосфолипидного синдрома, положительных Ro(SS-А) антител, синдрома Шегрена, судорожных припадков, неадекватного поведения, сопутствующей фибромиалгии и др.), требующих специальных лечебных подходов.Целью лечения СКВ является: • достижение полной или частичной клинической ремиссии (индукционная терапия);• профилактика обострений (поддерживающая терапия);• своевременная и адекватная терапия обострений;• снижение тяжести поражения жизненно важных органов;• достижение этих целей при высоком терапевтическом индексе (определяется как отношение терапевтической эффективности к количеству побочных действий).Нам представляется важной с практической точки зрения классификация СКВ по тяжести клинических проявлений, которая предложена американскими ревматологами (табл.).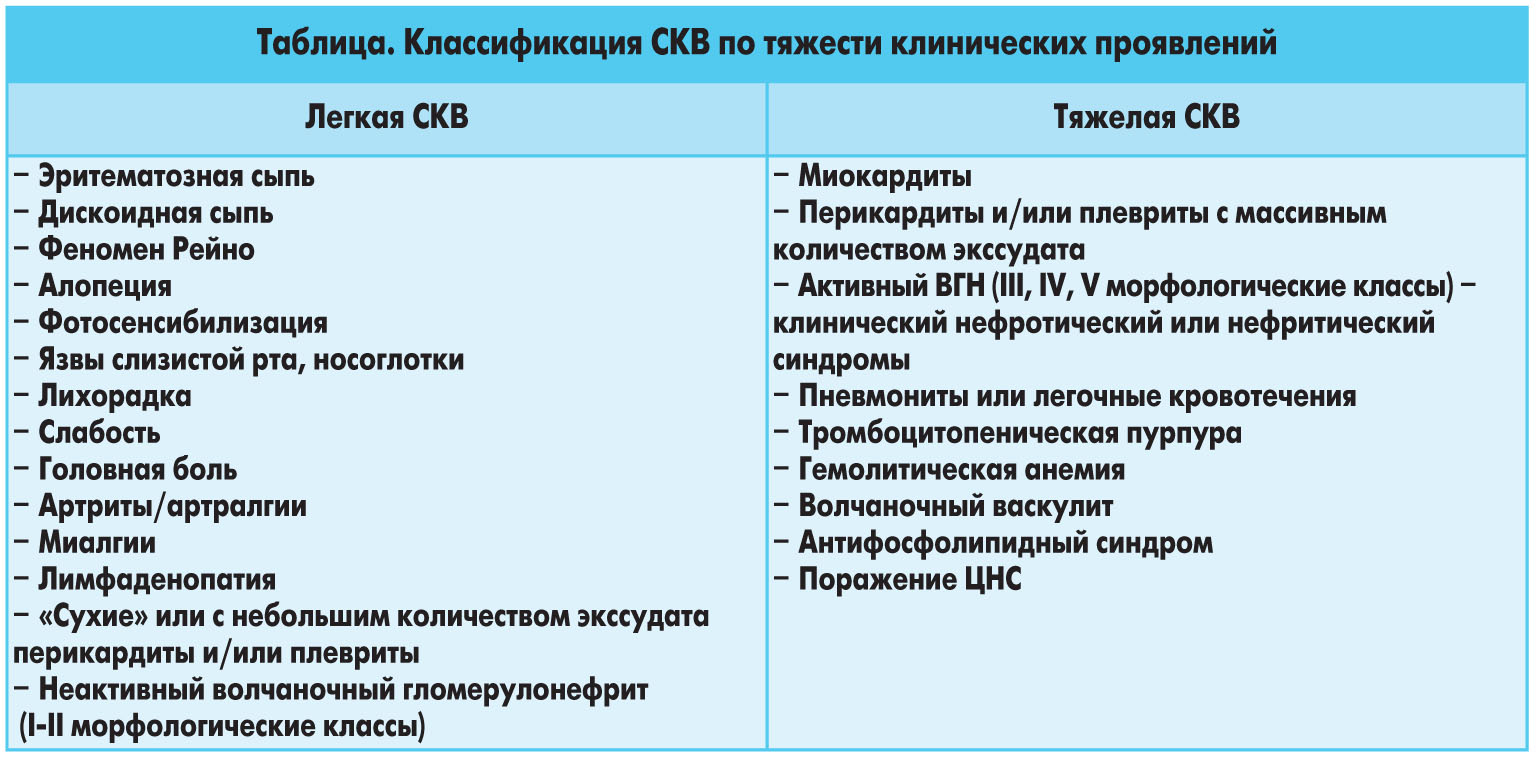 Важное место в лечении СКВ должно быть отведено проблеме взаимоотношений врача с больным и его родственниками.Все пациенты с впервые установленным диагнозом СКВ и их родственники обязательно нуждаются в обсуждении следующих вопросов.• Что собой представляет СКВ, с чем ассоциируется ее развитие?• Существование многих клинических вариантов СКВ, требующих различных лечебных подходов и имеющих неоднозначный прогноз.• Общие вопросы лечебной тактики, включающие диетический режим, дозированные физические нагрузки, тепловые режимы (противопоказаны перегревание, посещение бани), солнцезащитные мероприятия, отказ от курения.• Вопросы профилактики остеопороза, интеркуррентных инфекций, применения контрацептивов и проведения иммунизации.• Влияние на такие симптомы, как слабость, утомляемость, психоэмоциональная лабильность, болевой синдром.• Работа и семья, генетическая предрасположенность, беременность при СКВ.Следует также обеспечить пациента специальной литературой, касающейся различных вопросов СКВ, самоконтроля, физических нагрузок, а также возможностью круглосуточной связи со специалистом для получения консультативной помощи.Слабость, утомляемость. Данные симптомы наблюдаются на различных этапах течения СКВ у 50-90% больных, часто определяют общее состояние, качество жизни и трудоспособность пациента. При выборе тактики лечения следует прежде всего установить наличие или отсутствие таких потенциальных причин слабости, как анемия, лихорадка, инфекция, гипотиреоз, гипо- или гипергликемия и осложнения лекарственной терапии, требующие соответствующих лечебных подходов.Выбор адекватных дозированных физических нагрузок представляется одним из кардинальных подходов в устранении или снижении слабости. Следует избегать полного покоя или постельного режима, что может усугубить слабость, способствовать развитию остеопороза, мышечной дистрофии, атрофии и контрактур. В то же время чрезмерные физические нагрузки и попытки перебороть слабость неприемлемы. Представляется важным активное участие больного в выборе характера физической активности.Курение. Наряду с другими неблагоприятными последствиями курение приводит к ухудшению оксигенации, способствует повышению артериального давления, повышает риск развития ишемической болезни сердца, ухудшает функцию почек, усугубляет синдром Рейно, а также может ассоциироваться с формированием аутоантител.Солнечные лучи и защита от них. У больных СКВ довольно часто (около 45-70% случаев) наблюдается фоточувствительность. Фотосенсибилизация обусловлена прежде всего воздействием ультрафиолетовых лучей (УФЛ), роль которых в патогенезе фотоиндуцируемых системных процессов признается ведущей. Фотоиндуцируемые кожные изменения, развивающиеся на открытых участках тела, представлены макулярными, папулезными и буллезными повреждениями, а также классической эритемой. При инсоляции чаще наблюдается усугубление уже имеющихся повреждений кожи, хотя могут развиваться и новые. Фотоиндуцируемое системное обострение характеризуется появлением (или усугублением) слабости, недомогания, лихорадки, артритов, артралгий.Солнцезащитные мероприятия включают использование различных химических агентов в виде кремов, масел, гелей, абсорбирующих УФЛ. Способность этих веществ блокировать УФЛ отличается, что необходимо учитывать. Вещества, защищающие кожу от УФЛ, могут вызывать ее раздражение и развитие дерматитов, в связи с чем необходим индивидуальный подбор солнцезащитных средств.Солнцезащитные вещества следует наносить на участки пораженной кожи, а также на участки кожи, доступные попаданию солнечных лучей (щеки, нос, губы, руки) за полчаса до предполагаемой экспозиции. УФЛ могут проникать через обычные стекла, отражаться от поверхности песка, воды, цемента или снега.Уменьшение экспозиции солнечных лучей на 30-50% достигается механическими защитными мероприятиями (при помощи широкополых шляп, зонтов, рубашек с длинными рукавами).По-видимому, здесь уместно отметить, что противомалярийные препараты существенно повышают толерантность больных СКВ к солнечным лучам, причем даже у тех, кто был очень чувствителен к УФЛ до применения данных средств.В то же время использование ряда антибиотиков, включающих тетрациклины, сульфаниламиды и фторхинолоны, ассоциируется с развитием фотосенсибилизации или ее усугублением.Солнцезащитные мероприятия являются одной из причин развития дефицита витамина D у больных СКВ, что может способствовать возникновению остеопороза и спонтанных переломов, метаболического синдрома и кардиоваскулярных заболеваний. Коррекция дефицита витамина D устраняет или снижает тяжесть этих рисков.Альтернативные подходы в ведении больных СКВИспользование комплементарной и альтернативной медицины (релаксационная техника, массаж, фитотерапия, различные диетические режимы, мегавитаминная терапия, гомеопатические средства, биодобавки, акупунктура, гипноз и др.) имеет место примерно у 30% пациентов с СКВ. Так, американские, британские и канадские ревматологи в исследовании, в котором принимали участие 725 больных СКВ, использовали различные альтернативные подходы на разных этапах течения СКВ наряду с традиционным лечением, однако не получили реальных доказательств их клинической эффективности. Вместе с тем применение некоторых из этих подходов сопряжено с неблагоприятными эффектами. Так, фитопродукты часто содержат несколько активных компонентов, часть из которых может быть небезопасна. Среди больных СКВ и их родственников бытует мнение, что различные варианты комплементарной и альтернативной медицины являются натуральными, а следовательно, безопасными, однако некоторые из них могут оказывать негативное влияние на течение СКВ. Например, некоторые компоненты фитопродуктов могут потенциально взаимодействовать с варфарином, увеличивая при этом риск кровотечений. Некоторые из так называемых дезинтоксикационных методов (например, ирригация толстого кишечника) сопряжены с серьезными осложнениями, в частности с повреждением слизистой кишечника.Стратегические подходы к лечению больных СКВ, предлагаемые экспертами Европейской лиги против ревматизма (European League Against Rheumatism – EULAR), показаны на рисунках 1 и 2.
Важное место в лечении СКВ должно быть отведено проблеме взаимоотношений врача с больным и его родственниками.Все пациенты с впервые установленным диагнозом СКВ и их родственники обязательно нуждаются в обсуждении следующих вопросов.• Что собой представляет СКВ, с чем ассоциируется ее развитие?• Существование многих клинических вариантов СКВ, требующих различных лечебных подходов и имеющих неоднозначный прогноз.• Общие вопросы лечебной тактики, включающие диетический режим, дозированные физические нагрузки, тепловые режимы (противопоказаны перегревание, посещение бани), солнцезащитные мероприятия, отказ от курения.• Вопросы профилактики остеопороза, интеркуррентных инфекций, применения контрацептивов и проведения иммунизации.• Влияние на такие симптомы, как слабость, утомляемость, психоэмоциональная лабильность, болевой синдром.• Работа и семья, генетическая предрасположенность, беременность при СКВ.Следует также обеспечить пациента специальной литературой, касающейся различных вопросов СКВ, самоконтроля, физических нагрузок, а также возможностью круглосуточной связи со специалистом для получения консультативной помощи.Слабость, утомляемость. Данные симптомы наблюдаются на различных этапах течения СКВ у 50-90% больных, часто определяют общее состояние, качество жизни и трудоспособность пациента. При выборе тактики лечения следует прежде всего установить наличие или отсутствие таких потенциальных причин слабости, как анемия, лихорадка, инфекция, гипотиреоз, гипо- или гипергликемия и осложнения лекарственной терапии, требующие соответствующих лечебных подходов.Выбор адекватных дозированных физических нагрузок представляется одним из кардинальных подходов в устранении или снижении слабости. Следует избегать полного покоя или постельного режима, что может усугубить слабость, способствовать развитию остеопороза, мышечной дистрофии, атрофии и контрактур. В то же время чрезмерные физические нагрузки и попытки перебороть слабость неприемлемы. Представляется важным активное участие больного в выборе характера физической активности.Курение. Наряду с другими неблагоприятными последствиями курение приводит к ухудшению оксигенации, способствует повышению артериального давления, повышает риск развития ишемической болезни сердца, ухудшает функцию почек, усугубляет синдром Рейно, а также может ассоциироваться с формированием аутоантител.Солнечные лучи и защита от них. У больных СКВ довольно часто (около 45-70% случаев) наблюдается фоточувствительность. Фотосенсибилизация обусловлена прежде всего воздействием ультрафиолетовых лучей (УФЛ), роль которых в патогенезе фотоиндуцируемых системных процессов признается ведущей. Фотоиндуцируемые кожные изменения, развивающиеся на открытых участках тела, представлены макулярными, папулезными и буллезными повреждениями, а также классической эритемой. При инсоляции чаще наблюдается усугубление уже имеющихся повреждений кожи, хотя могут развиваться и новые. Фотоиндуцируемое системное обострение характеризуется появлением (или усугублением) слабости, недомогания, лихорадки, артритов, артралгий.Солнцезащитные мероприятия включают использование различных химических агентов в виде кремов, масел, гелей, абсорбирующих УФЛ. Способность этих веществ блокировать УФЛ отличается, что необходимо учитывать. Вещества, защищающие кожу от УФЛ, могут вызывать ее раздражение и развитие дерматитов, в связи с чем необходим индивидуальный подбор солнцезащитных средств.Солнцезащитные вещества следует наносить на участки пораженной кожи, а также на участки кожи, доступные попаданию солнечных лучей (щеки, нос, губы, руки) за полчаса до предполагаемой экспозиции. УФЛ могут проникать через обычные стекла, отражаться от поверхности песка, воды, цемента или снега.Уменьшение экспозиции солнечных лучей на 30-50% достигается механическими защитными мероприятиями (при помощи широкополых шляп, зонтов, рубашек с длинными рукавами).По-видимому, здесь уместно отметить, что противомалярийные препараты существенно повышают толерантность больных СКВ к солнечным лучам, причем даже у тех, кто был очень чувствителен к УФЛ до применения данных средств.В то же время использование ряда антибиотиков, включающих тетрациклины, сульфаниламиды и фторхинолоны, ассоциируется с развитием фотосенсибилизации или ее усугублением.Солнцезащитные мероприятия являются одной из причин развития дефицита витамина D у больных СКВ, что может способствовать возникновению остеопороза и спонтанных переломов, метаболического синдрома и кардиоваскулярных заболеваний. Коррекция дефицита витамина D устраняет или снижает тяжесть этих рисков.Альтернативные подходы в ведении больных СКВИспользование комплементарной и альтернативной медицины (релаксационная техника, массаж, фитотерапия, различные диетические режимы, мегавитаминная терапия, гомеопатические средства, биодобавки, акупунктура, гипноз и др.) имеет место примерно у 30% пациентов с СКВ. Так, американские, британские и канадские ревматологи в исследовании, в котором принимали участие 725 больных СКВ, использовали различные альтернативные подходы на разных этапах течения СКВ наряду с традиционным лечением, однако не получили реальных доказательств их клинической эффективности. Вместе с тем применение некоторых из этих подходов сопряжено с неблагоприятными эффектами. Так, фитопродукты часто содержат несколько активных компонентов, часть из которых может быть небезопасна. Среди больных СКВ и их родственников бытует мнение, что различные варианты комплементарной и альтернативной медицины являются натуральными, а следовательно, безопасными, однако некоторые из них могут оказывать негативное влияние на течение СКВ. Например, некоторые компоненты фитопродуктов могут потенциально взаимодействовать с варфарином, увеличивая при этом риск кровотечений. Некоторые из так называемых дезинтоксикационных методов (например, ирригация толстого кишечника) сопряжены с серьезными осложнениями, в частности с повреждением слизистой кишечника.Стратегические подходы к лечению больных СКВ, предлагаемые экспертами Европейской лиги против ревматизма (European League Against Rheumatism – EULAR), показаны на рисунках 1 и 2.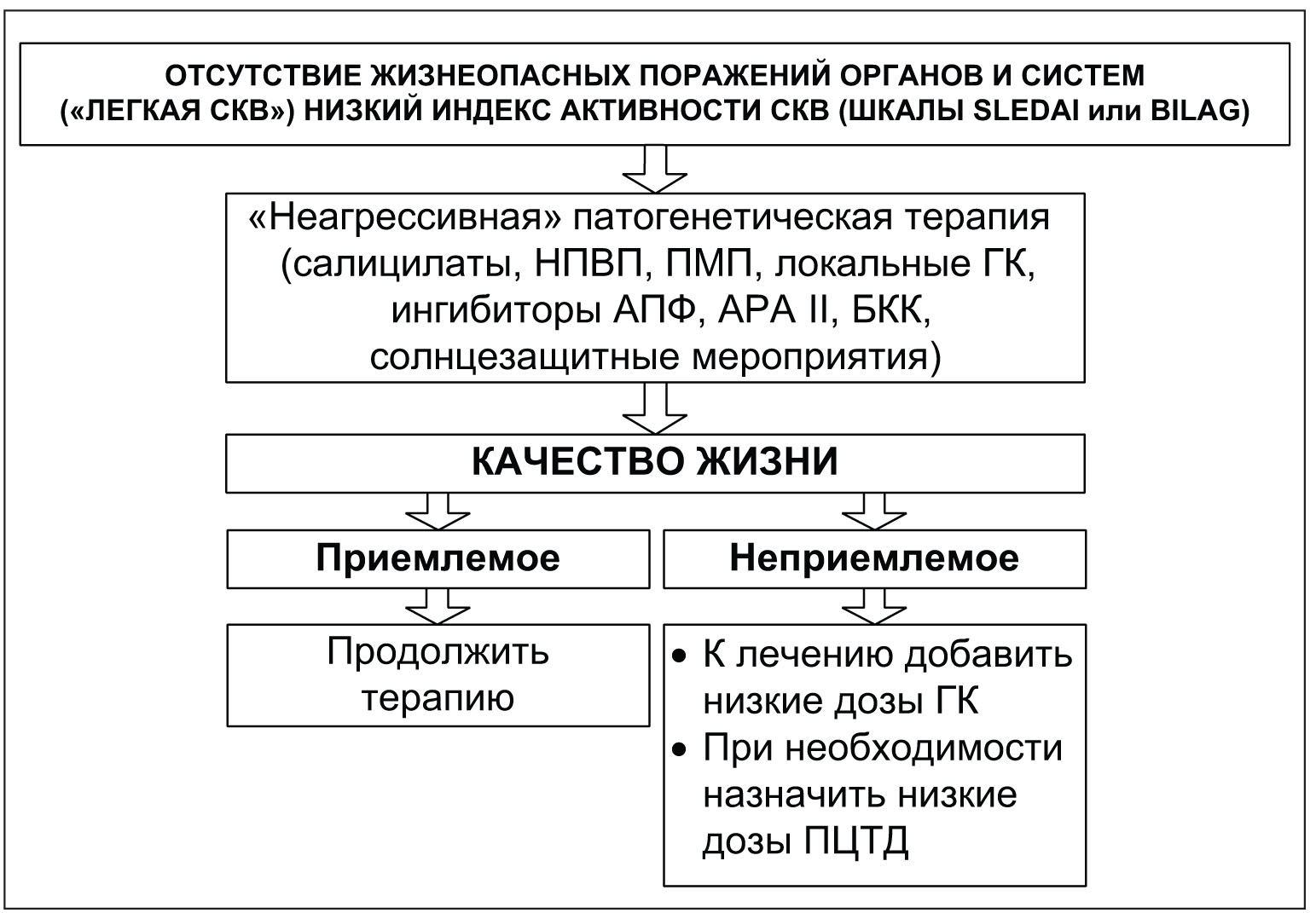 Рис. 1. Стратегические подходы к ведению больных СКВ Примечание: АРА II – антагонисты рецепторов ангиотензина II; БКК – блокаторы кальциевых каналов; ПЦТД – препараты цитостатического действия.
Рис. 1. Стратегические подходы к ведению больных СКВ Примечание: АРА II – антагонисты рецепторов ангиотензина II; БКК – блокаторы кальциевых каналов; ПЦТД – препараты цитостатического действия.
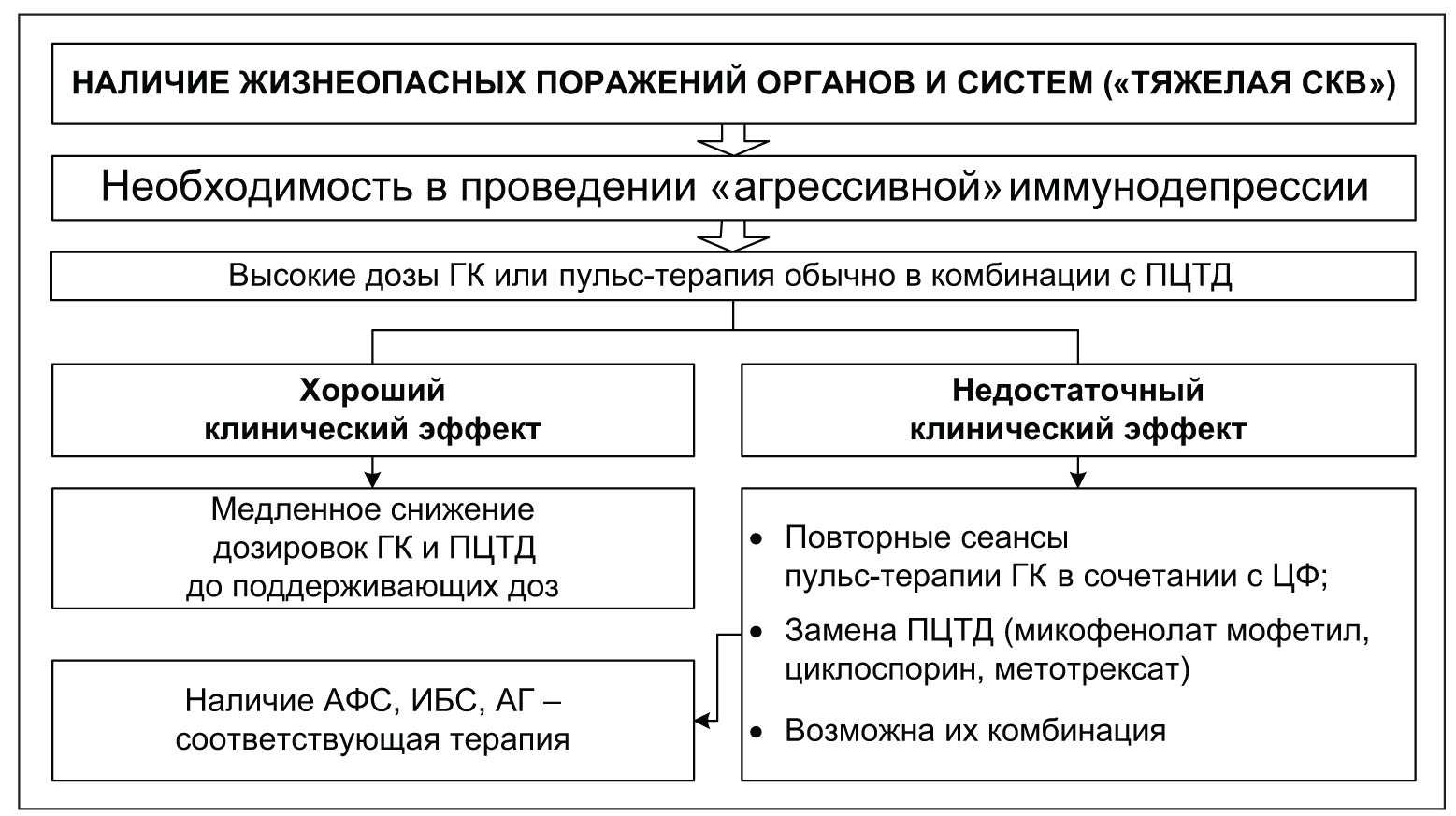 Рис. 2. Стратегические подходы к ведению больных СКВ Примечание: АФС – антифосфолипидный синдром; ЦФ – циклофосфан (циклофосфамид); ИБС – ишемическая болезнь сердца; АГ – артериальная гипертензия
Рис. 2. Стратегические подходы к ведению больных СКВ Примечание: АФС – антифосфолипидный синдром; ЦФ – циклофосфан (циклофосфамид); ИБС – ишемическая болезнь сердца; АГ – артериальная гипертензия ГлюкокортикоидыСегодня ГК, несмотря на высокий риск развития побочных эффектов (в том числе серьезных), остаются краеугольным камнем в лечении подавляющего большинства больных СКВ. Их широкое применение объясняется мощным противовоспалительным, иммуносупрессивным и противоаллергическим действием. В настоящее время принято разграничивать два механизма действия ГК – геномный и негеномный. Геномный механизм реализуется посредством связывания специфических цитоплазматических рецепторов. В отличие от геномных, негеномные эффекты являются результатом прямого физико-химического взаимодействия с биологическими мембранами и/или стероидселективными мембранными рецепторами. В таблице 1 показаны основные противовоспалительные и иммуносупрессивные эффекты ГК.В клинической практике сегодня применяются исключительно синтетические ГК, обладающие выраженной противовоспалительной и иммуносупрессивной активностью при слабых и даже нулевых минералокортикоидных эффектах. В таблице 2 представлены эквивалентные дозы ГК и их минералокортикоидная активность.
В таблице 1 показаны основные противовоспалительные и иммуносупрессивные эффекты ГК.В клинической практике сегодня применяются исключительно синтетические ГК, обладающие выраженной противовоспалительной и иммуносупрессивной активностью при слабых и даже нулевых минералокортикоидных эффектах. В таблице 2 представлены эквивалентные дозы ГК и их минералокортикоидная активность. Номенклатура дозировок и режим приема ГКВ соответствии с рекомендациями Европейского консенсуса по номенклатуре доз и режимов применения ГК их суточные дозировки ≤7,5 мг обозначаются как низкие; >7,5≤30 мг – как средние; ≥30≤100 мг – как высокие и >100 мг – как очень высокие; пульс-терапия ≥250 мг/сут внутривенно. Дозировки ГК даны в преднизолоновом эквиваленте.За последние 30 лет значительно изменились подходы к тактике глюкокортикоидной терапии (ГКТ) у больных СКВ.При отсутствии высокой иммунной активности волчаночного поражения жизненно важных органов и систем или прогностически неблагоприятных проявлений заболевания, т.е. когда у больного имеют место субфебрильная температура и/или артрит/артралгии, и/или миозит/миалгии, и/или лимфаденопатия, и/или перикардит (без или с небольшим количеством жидкости в полости перикарда), и/или плеврит (без или с небольшим количеством жидкости в плевральной полости), и/или эритема, и/или дискоидная сыпь, и/или язвы слизистой рта или носоглотки, и/или слабость и утомляемость, и/или головная боль (т.е. «легкая» волчанка), в качестве терапии первого шага приемлемо применение ПМП (часто в комбинации с НПВП) под строгим контролем динамики клинических проявлений и лабораторных параметров. Если в течение нескольких недель не достигается полная клинико-лабораторная ремиссия, то обосновано назначение ГК. Причем следует начинать с низкой дозы преднизолона 2,5-5,0 мг/сут или эквивалентных доз других ГК. При необходимости каждую 1-2 нед следует увеличивать первоначальную дозу на 20-25%. Для достижения полной ремиссии и необходимости дальнейшего повышения дозы ГК возможно назначение низких дозировок неалкилирующих препаратов цитостатического действия (ПЦТД).Другая тактика ГКТ используется у больных СКВ с вовлечением в патологический процесс жизненно важных органов и систем. Наличие высокой активности заболевания, лихорадки; развитие перикардита и/или плеврита с массивным накоплением жидкости в полостях, и/или миокардита, и/или поражения центральной нервной системы (ЦНС), и/или легочных пневмонитов или геморрагий, и/или гемолитической анемии, и/или тромбоцитопенической пурпуры, и/или васкулитов, и/или активного волчаночного гломерулонефрита (ВГН) (т.е. «тяжелой» волчанки) являются основанием для применения высоких дозировок ГК или глюкокортикоидной пульс-терапии. Первоначальная доза преднизолона должна составлять 0,5-1,5 мг/кг/сут (или эквивалентная доза других ГК), а при отсутствии желаемого клинического ответа или в очень тяжелых клинических ситуациях – до 2 мг/кг/сут. Продолжительность применения первоначальной дозы обычно составляет 4-6 нед, а при необходимости препарат назначают на более длительный срок. В тяжелых случаях (например, при тромбоцитопенической пурпуре, гемолитической анемии, поражении ЦНС, миокардите и др.), когда требуется получить быстрый эффект, приемлемо проведение глюкокортикоидной пульс-терапии.При проведении пероральной терапии средними и высокими дозами ГК используются различные варианты их приема: непрерывный (ежедневный) и прерывистые (альтернативный и интермиттирующий). При непрерывном варианте прием суточной дозы может осуществляться однократно в утренние часы или в несколько приемов. Последний показан при активной СКВ, протекающей с лихорадкой и тяжелыми поражениями жизненно важных органов и систем.Пероральная терапия адекватными дозами ГК приводит к уменьшению выраженности или исчезновению многих проявлений СКВ, положительной динамике или нормализации различных лабораторных параметров.Оценка эффективности адекватной ГКТ при различных вариантах СКВ показана в таблице 3.
Номенклатура дозировок и режим приема ГКВ соответствии с рекомендациями Европейского консенсуса по номенклатуре доз и режимов применения ГК их суточные дозировки ≤7,5 мг обозначаются как низкие; >7,5≤30 мг – как средние; ≥30≤100 мг – как высокие и >100 мг – как очень высокие; пульс-терапия ≥250 мг/сут внутривенно. Дозировки ГК даны в преднизолоновом эквиваленте.За последние 30 лет значительно изменились подходы к тактике глюкокортикоидной терапии (ГКТ) у больных СКВ.При отсутствии высокой иммунной активности волчаночного поражения жизненно важных органов и систем или прогностически неблагоприятных проявлений заболевания, т.е. когда у больного имеют место субфебрильная температура и/или артрит/артралгии, и/или миозит/миалгии, и/или лимфаденопатия, и/или перикардит (без или с небольшим количеством жидкости в полости перикарда), и/или плеврит (без или с небольшим количеством жидкости в плевральной полости), и/или эритема, и/или дискоидная сыпь, и/или язвы слизистой рта или носоглотки, и/или слабость и утомляемость, и/или головная боль (т.е. «легкая» волчанка), в качестве терапии первого шага приемлемо применение ПМП (часто в комбинации с НПВП) под строгим контролем динамики клинических проявлений и лабораторных параметров. Если в течение нескольких недель не достигается полная клинико-лабораторная ремиссия, то обосновано назначение ГК. Причем следует начинать с низкой дозы преднизолона 2,5-5,0 мг/сут или эквивалентных доз других ГК. При необходимости каждую 1-2 нед следует увеличивать первоначальную дозу на 20-25%. Для достижения полной ремиссии и необходимости дальнейшего повышения дозы ГК возможно назначение низких дозировок неалкилирующих препаратов цитостатического действия (ПЦТД).Другая тактика ГКТ используется у больных СКВ с вовлечением в патологический процесс жизненно важных органов и систем. Наличие высокой активности заболевания, лихорадки; развитие перикардита и/или плеврита с массивным накоплением жидкости в полостях, и/или миокардита, и/или поражения центральной нервной системы (ЦНС), и/или легочных пневмонитов или геморрагий, и/или гемолитической анемии, и/или тромбоцитопенической пурпуры, и/или васкулитов, и/или активного волчаночного гломерулонефрита (ВГН) (т.е. «тяжелой» волчанки) являются основанием для применения высоких дозировок ГК или глюкокортикоидной пульс-терапии. Первоначальная доза преднизолона должна составлять 0,5-1,5 мг/кг/сут (или эквивалентная доза других ГК), а при отсутствии желаемого клинического ответа или в очень тяжелых клинических ситуациях – до 2 мг/кг/сут. Продолжительность применения первоначальной дозы обычно составляет 4-6 нед, а при необходимости препарат назначают на более длительный срок. В тяжелых случаях (например, при тромбоцитопенической пурпуре, гемолитической анемии, поражении ЦНС, миокардите и др.), когда требуется получить быстрый эффект, приемлемо проведение глюкокортикоидной пульс-терапии.При проведении пероральной терапии средними и высокими дозами ГК используются различные варианты их приема: непрерывный (ежедневный) и прерывистые (альтернативный и интермиттирующий). При непрерывном варианте прием суточной дозы может осуществляться однократно в утренние часы или в несколько приемов. Последний показан при активной СКВ, протекающей с лихорадкой и тяжелыми поражениями жизненно важных органов и систем.Пероральная терапия адекватными дозами ГК приводит к уменьшению выраженности или исчезновению многих проявлений СКВ, положительной динамике или нормализации различных лабораторных параметров.Оценка эффективности адекватной ГКТ при различных вариантах СКВ показана в таблице 3.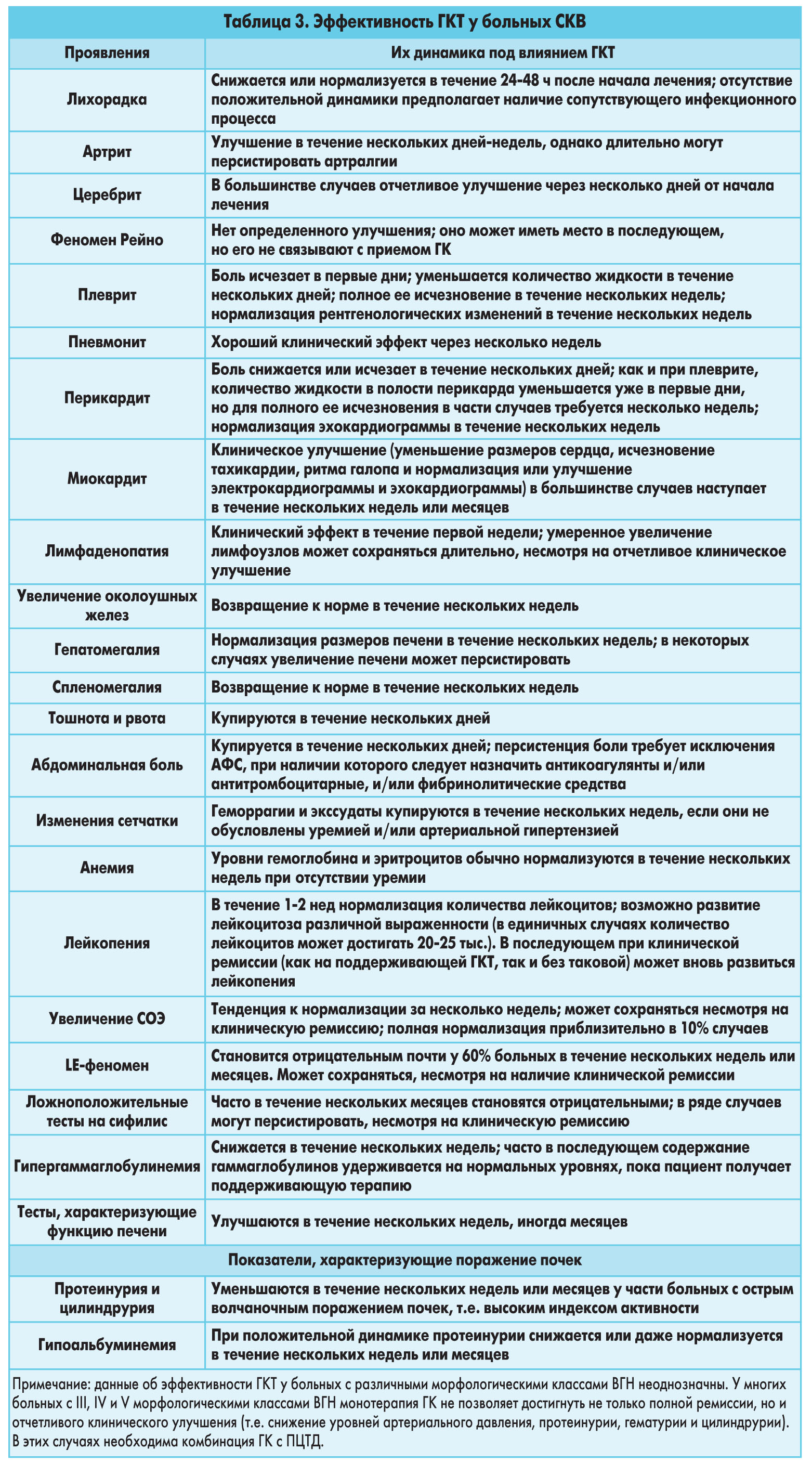 Пульс-терапия метилпреднизолоном подразумевает внутривенное введение 250-1000 мг препарата внутривенно (примерно 5-30 мг на 1 кг массы тела) в сутки в течение 2-3 дней. Такие курсы проводятся 1 раз в месяц и, в зависимости от особенностей клинической картины, могут продолжаться в течение 6 мес и более.Однако если на первых этапах пульс-терапия метилпреднизолоном считалась весьма перспективной, то в последующем выяснилось, что в большинстве случаев ее благоприятный эффект кратковременный и нередко не превышает таковой при пероральной ГКТ. Кроме того, получены сообщения о тяжелых осложнениях, возникающих в результате пульс-терапии (инсульты, аритмии, летальные исходы вследствие остановки сердца, интеркуррентные инфекции). Очевидно, решение о проведении пульс-терапии должно быть строго регламентировано и осуществляться под строгим контролем.Осложнения ГКТПрименение ГК сопряжено с вероятностью развития различных осложнений, риск возникновения которых и особенно тяжесть ассоциируются с высокими дозировками ГК и длительностью применения. Классификация наиболее частых осложнений ГКТ представлена в таблице 4.
Пульс-терапия метилпреднизолоном подразумевает внутривенное введение 250-1000 мг препарата внутривенно (примерно 5-30 мг на 1 кг массы тела) в сутки в течение 2-3 дней. Такие курсы проводятся 1 раз в месяц и, в зависимости от особенностей клинической картины, могут продолжаться в течение 6 мес и более.Однако если на первых этапах пульс-терапия метилпреднизолоном считалась весьма перспективной, то в последующем выяснилось, что в большинстве случаев ее благоприятный эффект кратковременный и нередко не превышает таковой при пероральной ГКТ. Кроме того, получены сообщения о тяжелых осложнениях, возникающих в результате пульс-терапии (инсульты, аритмии, летальные исходы вследствие остановки сердца, интеркуррентные инфекции). Очевидно, решение о проведении пульс-терапии должно быть строго регламентировано и осуществляться под строгим контролем.Осложнения ГКТПрименение ГК сопряжено с вероятностью развития различных осложнений, риск возникновения которых и особенно тяжесть ассоциируются с высокими дозировками ГК и длительностью применения. Классификация наиболее частых осложнений ГКТ представлена в таблице 4. Отмена ГКТПосле достижения контроля волчаночного процесса под влиянием ГКТ возникает необходимость в снижении первоначальной дозы ГК, что важно для обеспечения эффективности лечения. Скорость и величина уменьшения дозы определяются такими факторами, как величина первоначальной дозы ГК, продолжительность и режим их применения.При снижении дозы ГК или полной их отмене не рекомендуется назначать адренокортикотропный гормон, так как не получено доказательств того, что он способен предотвращать или уменьшать проявления синдрома отмены и, в частности, способствовать восстановлению гипоталамо-гипофизарно-надпочечниковой функции.Снижение дозировок ГК должно осуществляться под строгим контролем клинико-лабораторных параметров. Один из предлагаемых вариантов отмены (уменьшения дозы) ГКТ предполагает следующую тактику. У больных, получающих высокие дозы ГК (30 мг/сут и более преднизолона или других ГК в эквивалентных дозировках) в течение нескольких недель, 10% этой дозы можно уменьшать с интервалом в 4 дня. Если ГКТ в высоких дозировках проводилась в течение нескольких месяцев, то 10% снижение первоначальной дозы следует проводить с интервалами в несколько недель. У больных, получающих умеренные (средние) дозы ГК (7,5-30 мг/сут преднизолона), 10% снижение может осуществляться каждые 2 нед. Пациентам, длительно получающим высокие или средние дозы ГК, после достижения суточной дозы преднизолона в 7,5 мг в последующем ее следует снижать на 1 мг в месяц, так как время, необходимое для восстановления гипофизарно-надпочечниковой функции, варьирует у различных больных и может достигать одного года.Неадекватное уменьшение дозы ГК может быть причиной как обострения волчаночного процесса, так и развития синдрома отмены, что нередко сложно дифференцировать.Различают четыре типа синдрома отмены у больных, длительно получающих ГК:• при первом типе клинические и лабораторные признаки нарушения гипофизарно-надпочечниковой функции исчезают после применения кортизола;• при втором типе (наиболее часто встречается у больных СКВ) наблюдаются артралгия, миалгия, слабость, утомляемость, депрессия, лихорадка и др.; если эта клиническая картина правильно оценена как проявление синдрома отмены, то в течение нескольких недель описанные симптомы проходят без увеличения дозы ГК;• третий тип характеризуется развитием глюкокортикоидной зависимости; для контроля клинической симптоматики, описанной выше для второго типа, приемлемо назначение супрафизиологических доз ГК – более 5 мг/сут;• при четвертом типе у больных отсутствуют какие-либо клинические проявления, но имеют место лабораторные доказательства наличия депрессии гипоталамо-гипофизарно-надпочечниковой функции.Противомалярийные препаратыПо мнению авторитетных специалистов, ПМП не занимают сегодня достойного места в лечении системных заболеваний соединительной ткани (в том числе СКВ), что объясняется как малым количеством контролируемых рандомизированных исследований, посвященных оценке эффективности этих препаратов, так и недостаточной информированностью врачей об особенностях механизма действия, показаниях к применению, клинической эффективности, частоте и тяжести побочных действий (прежде всего ретинопатий).К ПМП относятся гидроксихлорохин (ГХЛ) и хлорохин (ХЛ). Оба препарата абсорбируются в кишечнике и выводятся с мочой (примерно 50%), калом и через поры кожи.Механизм действия ПМП характеризуется многогранностью и включает следующие эффекты:• иммунные:– ингибирование формирования антигенов и их презентацию;– снижение уровней провоспалительных цитокинов в сыворотке крови и коже (ИЛ-1β, ИЛ-6, ИЛ-18 и ФНО);• антитромботические:– ингибирование агрегации и адгезии тромбоцитов;– замедление формирования антифосфолипидных антител;• кардиоваскулярные:– повышение уровней холестерина липопротеинов высокой плотности (ЛПВП);– снижение уровней холестерина липопротеинов низкой плотности (ЛПНП);– увеличение эластичности крупных артерий;– снижение сосудистой резистентности;– уменьшение риска развития сахарного диабета;• противомикробные;• антипролиферативные.Широкий спектр благоприятных механизмов действия ПМП и результаты многочисленных исследований, посвященных оценке их эффективности у больных СКВ, позволяют сегодня говорить о положительном влиянии данных лекарственных средств на такие клинические проявления, как недомогание, лихорадка, кожные поражения, язвенные поражения слизистой рта и носоглотки, артриты и артралгии, миозиты и миалгии, плевриты и перикардиты. ПМП также можно применять в качестве протектора развития обострений волчаночного процесса и средства, позволяющего снижать дозировки ГК и препаратов цитотоксического действия, сохраняя при этом достигнутый клинический эффект. ПМП способны замедлять прогрессирование атеросклероза, а также снижать риск развития антифосфолипидного синдрома и/или тяжесть его клинических проявлений. Важно отметить, что применение ПМП в комбинации с ГК и ПЦТД позволяет уменьшать тяжесть поражения жизненно важных органов и систем, что обусловливает повышение выживаемости больных СКВ.У пациентов с СКВ при нормальной функции почек дозировки ГХЛ обычно составляют 200-400 мг/сут (не более 6,5 мг на 1 кг массы тела); а ХЛ – 100-200 мг/сут (не более 3 мг на 1 кг массы тела); время плазменного полувыведения составляет соответственно 40-50 дней и 3,5-12 дней. Клинический эффект при лечении ГХЛ наблюдается на 8-12-й неделе, а его максимум достигается к 6-12-му месяцу; клинический эффект при применении ХЛ достигается к 4-6-й неделе.Существуют доказательства, что табакокурение снижает эффективность ПМП вследствие уменьшения их абсорбции, увеличения метаболического клиренса и блокирования их поступления в лизосомы.Мы считаем заслуживающими внимания данные о частоте и видах побочных действий ПМП, наблюдаемых у 938 пациентов с различными ревматическими заболеваниями (в том числе у 178 пациентов с СКВ), что показано в таблице 5.
Отмена ГКТПосле достижения контроля волчаночного процесса под влиянием ГКТ возникает необходимость в снижении первоначальной дозы ГК, что важно для обеспечения эффективности лечения. Скорость и величина уменьшения дозы определяются такими факторами, как величина первоначальной дозы ГК, продолжительность и режим их применения.При снижении дозы ГК или полной их отмене не рекомендуется назначать адренокортикотропный гормон, так как не получено доказательств того, что он способен предотвращать или уменьшать проявления синдрома отмены и, в частности, способствовать восстановлению гипоталамо-гипофизарно-надпочечниковой функции.Снижение дозировок ГК должно осуществляться под строгим контролем клинико-лабораторных параметров. Один из предлагаемых вариантов отмены (уменьшения дозы) ГКТ предполагает следующую тактику. У больных, получающих высокие дозы ГК (30 мг/сут и более преднизолона или других ГК в эквивалентных дозировках) в течение нескольких недель, 10% этой дозы можно уменьшать с интервалом в 4 дня. Если ГКТ в высоких дозировках проводилась в течение нескольких месяцев, то 10% снижение первоначальной дозы следует проводить с интервалами в несколько недель. У больных, получающих умеренные (средние) дозы ГК (7,5-30 мг/сут преднизолона), 10% снижение может осуществляться каждые 2 нед. Пациентам, длительно получающим высокие или средние дозы ГК, после достижения суточной дозы преднизолона в 7,5 мг в последующем ее следует снижать на 1 мг в месяц, так как время, необходимое для восстановления гипофизарно-надпочечниковой функции, варьирует у различных больных и может достигать одного года.Неадекватное уменьшение дозы ГК может быть причиной как обострения волчаночного процесса, так и развития синдрома отмены, что нередко сложно дифференцировать.Различают четыре типа синдрома отмены у больных, длительно получающих ГК:• при первом типе клинические и лабораторные признаки нарушения гипофизарно-надпочечниковой функции исчезают после применения кортизола;• при втором типе (наиболее часто встречается у больных СКВ) наблюдаются артралгия, миалгия, слабость, утомляемость, депрессия, лихорадка и др.; если эта клиническая картина правильно оценена как проявление синдрома отмены, то в течение нескольких недель описанные симптомы проходят без увеличения дозы ГК;• третий тип характеризуется развитием глюкокортикоидной зависимости; для контроля клинической симптоматики, описанной выше для второго типа, приемлемо назначение супрафизиологических доз ГК – более 5 мг/сут;• при четвертом типе у больных отсутствуют какие-либо клинические проявления, но имеют место лабораторные доказательства наличия депрессии гипоталамо-гипофизарно-надпочечниковой функции.Противомалярийные препаратыПо мнению авторитетных специалистов, ПМП не занимают сегодня достойного места в лечении системных заболеваний соединительной ткани (в том числе СКВ), что объясняется как малым количеством контролируемых рандомизированных исследований, посвященных оценке эффективности этих препаратов, так и недостаточной информированностью врачей об особенностях механизма действия, показаниях к применению, клинической эффективности, частоте и тяжести побочных действий (прежде всего ретинопатий).К ПМП относятся гидроксихлорохин (ГХЛ) и хлорохин (ХЛ). Оба препарата абсорбируются в кишечнике и выводятся с мочой (примерно 50%), калом и через поры кожи.Механизм действия ПМП характеризуется многогранностью и включает следующие эффекты:• иммунные:– ингибирование формирования антигенов и их презентацию;– снижение уровней провоспалительных цитокинов в сыворотке крови и коже (ИЛ-1β, ИЛ-6, ИЛ-18 и ФНО);• антитромботические:– ингибирование агрегации и адгезии тромбоцитов;– замедление формирования антифосфолипидных антител;• кардиоваскулярные:– повышение уровней холестерина липопротеинов высокой плотности (ЛПВП);– снижение уровней холестерина липопротеинов низкой плотности (ЛПНП);– увеличение эластичности крупных артерий;– снижение сосудистой резистентности;– уменьшение риска развития сахарного диабета;• противомикробные;• антипролиферативные.Широкий спектр благоприятных механизмов действия ПМП и результаты многочисленных исследований, посвященных оценке их эффективности у больных СКВ, позволяют сегодня говорить о положительном влиянии данных лекарственных средств на такие клинические проявления, как недомогание, лихорадка, кожные поражения, язвенные поражения слизистой рта и носоглотки, артриты и артралгии, миозиты и миалгии, плевриты и перикардиты. ПМП также можно применять в качестве протектора развития обострений волчаночного процесса и средства, позволяющего снижать дозировки ГК и препаратов цитотоксического действия, сохраняя при этом достигнутый клинический эффект. ПМП способны замедлять прогрессирование атеросклероза, а также снижать риск развития антифосфолипидного синдрома и/или тяжесть его клинических проявлений. Важно отметить, что применение ПМП в комбинации с ГК и ПЦТД позволяет уменьшать тяжесть поражения жизненно важных органов и систем, что обусловливает повышение выживаемости больных СКВ.У пациентов с СКВ при нормальной функции почек дозировки ГХЛ обычно составляют 200-400 мг/сут (не более 6,5 мг на 1 кг массы тела); а ХЛ – 100-200 мг/сут (не более 3 мг на 1 кг массы тела); время плазменного полувыведения составляет соответственно 40-50 дней и 3,5-12 дней. Клинический эффект при лечении ГХЛ наблюдается на 8-12-й неделе, а его максимум достигается к 6-12-му месяцу; клинический эффект при применении ХЛ достигается к 4-6-й неделе.Существуют доказательства, что табакокурение снижает эффективность ПМП вследствие уменьшения их абсорбции, увеличения метаболического клиренса и блокирования их поступления в лизосомы.Мы считаем заслуживающими внимания данные о частоте и видах побочных действий ПМП, наблюдаемых у 938 пациентов с различными ревматическими заболеваниями (в том числе у 178 пациентов с СКВ), что показано в таблице 5.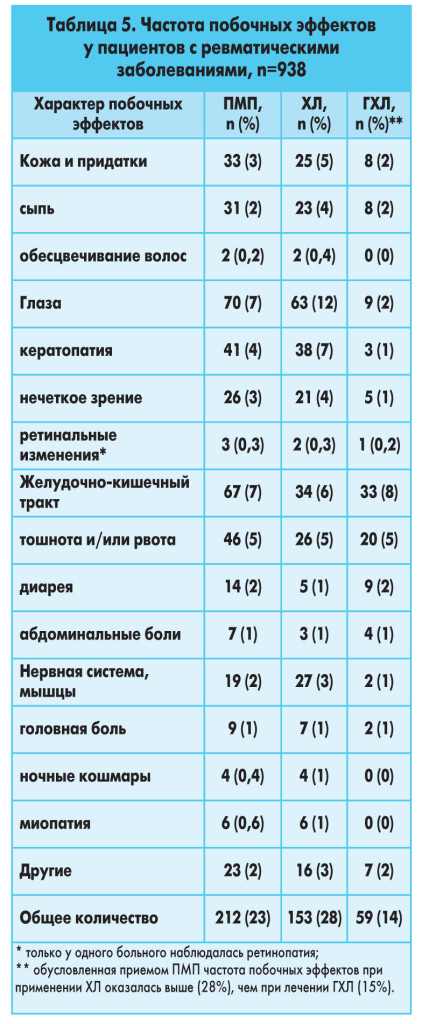 Приведенные данные позволяют рассматривать ПМП в качестве лекарственных средств первой линии при СКВ, учитывая их эффективность, безопасность и низкую стоимость.Нестероидные противовоспалительные препаратыНПВП благодаря их уникальной противовоспалительной, аналгетической и жаропонижающей активности широко применяются как при ревматических, так и неревматических заболеваниях. Эти эффекты обусловлены главным образом способностью НПВП ингибировать синтез простагландинов, а также агрегацию нейтрофилов.У подавляющего большинства пациентов с СКВ (в 80-90% случаев) на различных этапах заболевания применяются НПВП, оказывающие благоприятный эффект при таких клинических проявлениях, как лихорадка, артриты, артралгии, миалгии, умеренные серозиты (плеврит, перикардит, асцит), головная боль, слабость, недомогание. Способность некоторых НПВП, прежде всего ацетилсалициловой кислоты, оказывать антитромбоцитарное действие обусловила их применение у пациентов с СКВ и наличием АФС.Важно отметить, что сегодня мы не располагаем убедительными доказательствами (т.е. отсутствуют данные хорошо спланированных, с репрезентативным количеством больных, контролируемых рандомизированных исследований) положительной эффективности НПВП у больных СКВ при наличии поражений внутренних органов и жизненно важных систем, а также увеличения их выживаемости.Основываясь на собственном многолетнем опыте и результатах большого количества сообщений, американские ревматологи пришли к следующим выводам в отношении применения НПВП у пациентов с СКВ:• подавляющее большинство больных на разных стадиях заболевания принимают НПВП по поводу лихорадки, головной боли, миалгий, артралгий или артритов и/или серозитов;• при мышечно-скелетных проявлениях аспирин более эффективен по сравнению с ибупрофеном, целекоксиб более эффективен и безопасен, чем другие представители НПВП;• риск развития таких побочных эффектов, как повышение фоточувствительности, задержка жидкости, развитие артериальной гипертензии, гастроинтестинальной ульцерации и асептического менингита при применении НПВП, выше по сравнению с таковым у здоровых лиц;• частота развития побочных эффектов при применении НПВП ниже таковой при учете факторов риска и данных динамических осмотров больных;• следует оценить соотношение «риск-польза»;• предпочтительнее применять аспирин, напроксен или целекоксиб; с целью снижения частоты и тяжести побочных действий следует использовать минимально эффективные дозировки НПВП, ограничивая длительность их применения.Иммуносупрессивные средства (препараты цитотоксического действия)Иммуносупрессивные препараты (ИСП) сегодня широко и эффективно используются в комбинации с глюкокортикоидами (ГК) в лечении больных СКВ при вовлечении в патологический процесс жизненно важных органов и систем. Одни лекарственные средства (циклофосфамид и мофетила микофенолат) обычно применяются в качестве индукционной (первоначальной) терапии, направленной на достижение полной или частичной ремиссии; другие (азатиоприн, метотрексат) – с целью профилактики обострений. Комбинация ИСП и ГК ассоциируется с повышением эффективности лечения СКВ и нередко позволяет снижать дозировки последних. В то же время прием ИСП сопровождается развитием ряда побочных эффектов (в том числе жизнеопасных). В последние два десятилетия опубликованы результаты ряда контролируемых рандомизированных исследований (КРИ), направленных на оценку индукционной и поддерживающей терапии различными препаратами иммуносупрессивного действия. В большинстве КРИ оценивались возможности этих лекарственных средств в терапии III, IV и реже V морфологических классов активного волчаночного гломерулонефрита (ВГН). Механизмы действия, эффективность и побочные явления ИСП, применяемых у больных СКВ, обсуждаются ниже.Циклофосфамид. Несмотря на серьезные токсические эффекты (прежде всего гонадальные), циклофосфамид сегодня остается одним из наиболее часто применяемых ИСП у пациентов с СКВ в качестве индукционной терапии.Данный препарат метаболизируется в печени митохондриальными энзимами цитохрома Р-450 на ряд активных метаболитов, проявляющих лечебные эффекты.Многочисленные иммунные механизмы циклофосфамида включают прямое действие на ДНК, что ведет к гибели клеток на любой стадии их цикла; иммуномодулирующие эффекты, ответственные за относительно быстрое начало терапевтических процессов (в течение 2-4 дней); влияние на изменение функции макрофагов, увеличение продукции простагландина Е2, изменение транскрипции генов и прямое функциональное воздействие на лимфоциты. Циклофосфамид приводит к развитию дозозависимой лимфопении, уменьшает популяцию кластерной дифференцировки CD4, CD8 и В-клеток с более существенным снижением CD4 и В-лимфоцитов.Важно отметить, что, несмотря на существенное уменьшение продукции патогенных аутоантител под влиянием циклофосфамида, в целом уровни иммуноглобулинов G, А и М мало изменяются, что предполагает специфическую супрессию продукции аутоантител, а следовательно, объясняет его отчетливый лечебный эффект у больных СКВ.Данное лекарственное средство легко абсорбируется в кишечнике, а пероральные и внутривенные дозировки эквивалентны. Терапевтические дозы циклофосфамида составляют 2-4 мг на 1 кг массы тела. Их следует уменьшать примерно на 30% у больных со скоростью клубочковой фильтрации (СКФ) <30 мл/мин.Терапевтическая характеристика циклофосфамида:• не представлено доказательств, что его внутривенное применение более эффективно, чем пероральное, но бесспорно менее токсично;• преднизолон в комбинации с пероральным или внутривенным циклофосфамидом применялся во всех исследованиях, демонстрируя хороший лечебный эффект;• комбинация пульс-терапии (болюса) метилпреднизолона с пульс-терапией (болюсом) циклофосфамидом 1-2 раза в месяц (в зависимости от дозировок) при лечении ВГН характеризуется хорошим клиническим эффектом;• кумулятивная доза циклофосфамида определяет риск гонадального поражения и малигнизации;• поддерживающая терапия циклофосфамидом более токсична, чем мофетила микофенолатом и азатиоприном;• протеинурия и другие проявления ВГН обычно уменьшаются или исчезают постепенно в течение 6-12 мес. Прогноз ВГН хуже у больных, у которых протеинурия не снижается до <1,0 г/сут, чем у лиц, у которых достигается полная ремиссия;• отмечены благоприятные эффекты циклофосфамида и у пациентов с экстраренальными проявлениями СКВ, включающими дискоидную волчанку, волчаночное поражение центральной нервной системы (ЦНС), тромбоцитопению, пульмониты и легочные геморрагии, гемолитическую анемию, аутоиммунную нейтропению, некротизирующий васкулит, антифосфолипидный синдром с васкулопатией.Хлорамбуцил – алкилирующий агент, иммуносупрессивные свойства которого подобны таковым циклофосфамида, но имеющий более высокий риск малигнизации. Следует отметить, что хлорамбуцил в отличие от циклофосфамида не метаболизируется в акролеин, а значит, не ассоциируется с риском развития геморрагического цистита и может применяться у больных СКВ с нейрогенным мочевым пузырем или перенесших ранее геморрагический цистит. В связи с высоким риском развития токсических эффектов длительное применение хлорамбуцила при СКВ ограничено.Азатиоприн на протяжении десятилетий широко применяется при СКВ благодаря его иммуносупрессивной активности, ассоциируемой с предотвращением обострений заболевания после достигнутой ремиссии, а также благодаря сохранению лечебного эффекта при снижении дозировок ГК.Неактивный азатиоприн метаболизируется внутриклеточно в активные антагонисты пурина – 6-меркаптопурин и 6-тионозиловую кислоту. Препарат снижает количество Т-клеток, В-клеток и киллерных клеток, тем самым ингибируя клеточные и гуморальные иммунные процессы.В большинстве ревматологических и нефрологических клиник азатиоприн не используется в качестве индукционной терапии при поражении жизненно важных органов в отличие от циклофосфамида и мофетила микофенолата.Азатиоприн применяется перорально, так как его внутривенное введение сопряжено с выраженным раздражающим действием, в дозировках 1-3 мг/кг массы тела в сутки.Мофетил микофенолат обладает уникальным механизмом действия, позволяющим контролировать активность СКВ и ее различные проявления. Он ингибирует формирование антител, предотвращает миграцию лейкоцитов за счет уменьшения экспрессии эндотелиальных молекул адгезии, подавляет пролиферацию Т- и В-лимфоцитов in vitro в ответ на митогенную стимуляцию, снижает оксидативное повреждение.В многочисленных исследованиях продемонстрирована способность данного препарата индуцировать ремиссию у больных СКВ и предотвращать обострения. Причем способность мофетила микофенолата индуцировать ремиссию сопоставима с таковой у циклофосфамида (в том числе при ВГН). В то же время мофетила микофенолат менее токсичен, чем алкилирующие агенты, в связи с чем является препаратом выбора у больных СКВ репродуктивного возраста ввиду отсутствия гонадальной токсичности. Возможность мофетила микофенолата предотвращать обострения СКВ превышает таковой показатель азатиоприна.Мофетил микофенолат применяется перорально в дозировках 2,0-3,0 г/сут. После достижения ремиссии с целью профилактики обострений приемлемы дозировки 0,5-1,0 г/сут.Циклоспорин и такролимус. Ингибиторы кальциневрина циклоспорин и такролимус обладают комплексом иммунологических эффектов, включающих ингибицию активацииТ-клеточных генов и транскрипции генов, а также уменьшение образования интерлейкина (Ил)-2, фактора некроза опухоли альфа (ФНО), ИЛ-3, ИЛ-4 и других цитокинов. Кроме того, эти препараты ингибируют поступление антигенпрезентирующих клеток и антигенов, а также ИЛ-17 и Т-клеточнозависимую продукцию антител В-клетками. Циклоспорин и такролимус применяются перорально или внутривенно.В ряде исследований продемонстрирована эффективность данных ингибиторов кальциневрина как у больных с волчаночным поражением почек, так и при наличии различных экстраренальных проявлений.Дозировки циклоспорина составляют 2,0-5,0 мг/кг массы тела, такролимуса – 4,0 мг/кг массы тела.Эффективность ингибиторов кальциневрина изучалась в основном у больных с ВГН. Результаты немногочисленных исследований свидетельствуют, что циклоспорин и такролимус способны снижать уровни протеинурии, но уступают таковой циклофосфамида. Применение циклоспорина и такролимуса считается приемлемым у мужчин и женщин репродуктивного возраста, в том числе при беременности в связи с отсутствием токсического влияния на гонады и кроветворение.Лефлуномид. Препарат является ингибитором de novo пиримидинового синтеза, хорошо изучен у больных ревматоидным артритом (РА) и занял достойное место в лечении этого заболевания наряду с метотрексатом. Лефлуномид – цитотоксический изоксазола дериват, отличающийся структурно от других иммуномодуляторов. Он быстро конвертируется в активный метаболит малононитриламид, предотвращающий активацию лимфоцитов и снижающий активность ЦОГ-2 и адгезию лейкоцитов.Лефлуномид применяется перорально в дозировке 10-20 мг/сут при РА и до 30 мг/сут при СКВ. Препарат быстро абсорбируется при приеме внутрь и подвергается интенсивной энтеропеченочной рециркуляции.Использование лефлуномида у больных СКВ может быть рассмотрено в тех случаях, если проведение стандартной иммуномодулирующей терапии невозможно или если она неэффективна. Опыт применения лефлуномида при СКВ незначителен. В единичных исследованиях показана способность препарата снижать активность заболевания и улучшать клиническую картину. В связи с этим считается возможным его использование в случаях, резистентных к традиционным лечебным подходам.Метотрексат – фолатный антагонист, ингибирующий дигидрофолатредуктазу в дозировках, используемых при ревматических заболеваниях. Отсутствуют убедительные данные об изменениях в субпопуляциях лимфоцитов, поверхностных маркеров, лимфоцитарной функции и уровней аутоантител у больных с ревматическими заболеваниями, у которых был показан терапевтический эффект при лечении метотрексатом. Препарат обладает множеством противовоспалительных эффектов, которые обусловлены его способностью стимулировать освобождение аденозина, подавляющего воспалительные функции нейтрофилов, макрофагов и лимфоцитов.Метотрексат применяется перорально и подкожно в дозировках 5-30 мг/нед в комбинации с фолиевой кислотой (5-10 мг/нед) кроме дней приема метотрексата. Дозы более 20 мг обычно используются при подкожном введении, которое ассоциируется с более высокой эффективностью и менее выраженными побочными эффектами, чем пероральное.Несмотря на небольшое количество клинических исследований, многие клиницисты считают приемлемым применение метотрексата при СКВ, протекающей с преимущественным поражением кожи, суставов, мышц и плевры. При этом отмечен стероидснижающий эффект препарата.Побочные эффекты ИСП. Применение ИСП сопряжено с риском развития серьезных осложнений. Одни из них присущи всем иммуносупрессивным средствам независимо от групповой принадлежности, другие – обусловлены их специфическими особенностями.Использование ИСП ведет к депрессии гемопоэтических клеток, нарастающей при кумуляции препаратов, риск которой повышается при снижении функции почек. В связи с этим необходимо изучение почечной функции до и в ходе лечения. Обычно первым проявлением токсического влияния ИСП на гемопоэз является лейкопения; в последующем возможно развитие тромбоцитопении и анемии. Агранулоцитоз наблюдается редко.При приеме ИСП могут развиваться тошнота и рвота, частота и тяжесть которых нарастают по мере увеличения дозировок и при длительном их применении.Использование ИСП ассоциируется с риском развития интеркуррентных бактериальных, вирусных и грибковых инфекций.Лечение ИСП может осложняться развитием лихорадки, алопеции, кожными высыпаниями, депрессией клеток слизистых оболочек с возможными кровотечениями в желудочно-кишечном тракте, а также нарушением функции печени и почек.Интенсивно изучается проблема риска онкогенных и тератогенных побочных эффектов ИСП. В ряде исследований отмечено развитие опухолевых процессов в коже, мочевом пузыре и гематологической системе при лечении данными препаратами. Одни авторы считают, что онкогенный риск обусловлен побочными эффектами ИСП, другие связывают развитие опухолей у больных СКВ с генетической предрасположенностью, а не с неблагоприятным воздействием лекарственных средств.Представлены доказательства мутагенной активности ИСП. Их кластогенный (хромосомный поломочный) эффект определяется видом препарата, его дозировкой и продолжительностью применения, а также особенностями индивидуального ответа организма. Количественные и структурные хромосомные нарушения связывают с прямым воздействием ИСП на молекулы ДНК, в результате чего изменяется последовательность нуклеотидов – происходит перекрещивание молекул ДНК как с частями такой же молекулы, так и с другими молекулами ДНК.Тератогенный эффект ИСП (в первую очередь алкилирующих) служит противопоказанием для планирования беременности при их приеме. При назначении этих препаратов необходимо убедиться в отсутствии беременности.Тяжесть токсических эффектов различных ИСП неоднозначна. Так, у азатиоприна менее выражены токсические влияния, чем у циклофосфамида. Однако его иммуносупрессивный потенциал и клиническая эффективность уступают циклофосфамиду.Тяжесть и частота токсического действия метотрексата оцениваются неоднозначно, но превалирует точка зрения, что осложнения при проведении им лечения менее выражены, чем при терапии циклофосфамидом.Применение циклофосфамида сопряжено с существенным токсическим влиянием на половые железы, результатом чего являются развитие аменореи и азооспермии, риск которых увеличивается при длительном применении и высоких дозировках.Лечение циклофосфамидом может осложняться развитием геморрагического цистита, что связано с непосредственным влиянием на эпителиальные клетки мочевого пузыря альдегидного метаболита препарата акролеина. Для уменьшения его концентрации (особенно при пероральном применении) необходимо поддерживать адекватную гидратацию.Нефротоксичность, ассоциирующаяся со снижением СКФ, повышением уровней креатинина крови и развитием артериальной гипертензии (АГ), является ведущим побочным эффектом ингибиторов кальциневрина – циклоспорина и такролимуса. При этом в почках выявляются облитерирующая артериопатия, гломерулосклероз, тубулярная атрофия и интерстициальный фиброз. В отличие от алкилирующих агентов циклоспорину и такролимусу не присуща депрессия костного мозга. При лечении циклоспорином и такролимусом возможно развитие гирсутизма и гингивальной гиперплазии.Применение метотрексата сопряжено с гепатотоксичностью и развитием легочных инфильтратов, проявляющихся кашлем и одышкой, с неблагоприятным прогнозом.Фотосенсибилизирующие эффекты возможны при применении метотрексата.Суммируя изложенное выше об эффективности и побочных действиях ИСП, следует отметить, что они сегодня составляют важный компонент в лечении больных СКВ. Однако высокий риск тяжелых осложнений, обусловленных проведением цитостатической терапии, требует строгого подхода к отбору пациентов. В когорту больных СКВ, требующих применения ИСП, должны входить пациенты с тяжелыми поражениями жизненно важных органов, у которых лечение ГК недостаточно эффективно и/или развивается стероидная зависимость, и/или необходимо снижение дозировок ГК. Кроме того, комбинированное применение ИСП с ГК позволяет существенно уменьшить дозировки последних, сохраняя адекватный лечебный эффект. Также возможно использование ИСП у больных СКВ, которые проинформированы о риске развития побочных действий при применении этих лекарственных средств и у которых возможно проведение мониторирования клинических и лабораторных параметров в ходе лечения с целью своевременного выявления токсических эффектов.Новые биологические препараты в лечении СКВЗначительный прогресс, достигнутый за последние два десятилетия в иммунологии, обусловил разработку и внедрение в клиническую практику ряда новых лечебных подходов. В отличие от обсуждаемых выше лекарственных средств, механизм действия которых на иммунопатологические процессы не является избирательным, но обеспечивает неспецифическую иммуносупрессию, новые препараты способны селективно воздействовать на отдельные компоненты иммунной системы (например, строго специфично связываться с определенным видом рецепторов антигенов или цитокинов), что открывает возможности для целенаправленной супрессии специфической популяции/субпопуляции иммунокомпетентных клеток.Существенные успехи в изучении патогенеза СКВ, создающие базу для разработки новых селективных биологических препаратов, включают: 1) выявление и идентификацию многочисленных цитокинов, хемокинов и иных медиаторов; 2) установление особенностей процесса апоптоза и его регуляции; 3) определение новых клеточных субпопуляций, участвующих в патогенезе СКВ; 4) установление разнообразных путей передачи сигналов в процессе межклеточной кооперации в ходе иммунного ответа; 5) описание и выявление последовательностей генов, обеспечивающих восприимчивость к СКВ.Представленные нами выше лечебные подходы, базирующиеся на применении нестероидных противовоспалительных препаратов, противомалярийных агентов, ГК, ИСП, включающих циклофосфамид, азатиоприн, мофетил микофенолат, метотрексат, ингибиторы кальциневрина, лефлуномида, позволяют добиться благоприятного эффекта у значительного количества больных СКВ. Вместе с тем высокий риск развития побочных эффектов при их применении, а также недостаточный у ряда пациентов явились основанием для активного поиска новых лечебных подходов. В последние два десятилетия в эксперименте и многочисленных контролируемых рандомизированных исследованиях продолжают изучаться лечебные возможности, побочные эффекты различных биологических активных агентов, способных селективно воздействовать на отдельные компоненты иммунной системы. Характеристика, лечебные возможности, осложнения и роль биологических препаратов рассматриваются ниже.Белимумаб. На момент настоящей публикации это пока единственный одобренный Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA, США) и Европейским агентством по лекарственным средствам (ЕМА) биологический препарат для лечения больных СКВ; он зарегистрирован и присутствует на фармацевтическом рынке Украины. Белимумаб представляет собой моноклональное антитело к растворимым молекулам одного из важнейших факторов роста В-лимфоцитов (обозначается как BLyS – B-lymphocyte stimulator – «В-лимфоцитарный стимулятор»; также именуется как BAFF – B-cell activating factor – «фактор, активирующий В-клетки»).Связывание белимумаба с растворимыми молекулами BLyS ингибирует взаимодействие последних с BAFF-рецепторами на поверхности покоящихся и активированных В-лимфоцитов, а также плазматических клеток, что приводит к истощению их пула и тем самым к уменьшению присущей СКВ генерализованной В-клеточной гиперактивности и снижению выработки аутоантител. Применение белимумаба не ассоциировано с воздействием на В-клетки памяти, поскольку они лишены BAFF-рецепторов. С одной стороны, это может рассматриваться как определенное ограничение препарата (так как эти клетки могут инициировать формирование нового пула В-лимфоцитов, способных к секреции нежелательного репертуара аутоантител); с другой стороны, это свойство может являться и преимуществом (поскольку при использовании белимумаба не нарушается потенциальная способность В-клеток к продукции протективных антител против гриппа, пневмококка, столбняка и др.).Основанием для одобрения белимумаба в лечении СКВ послужили результаты двух рандомизированных плацебо-контролируемых исследований со схожими протоколами (BLISS-52 и BLISS-76, цифры соответствуют их продолжительности в неделях). В обоих исследованиях у больных имело место активное течение СКВ и они были серопозитивны (титр антинуклеарных аутоантител ≥1:80 или аутоантител к нативной ДНК ≥30 ед/мл). В добавление к стандартной терапии больных рандомизировали на прием белимумаба в дозах 1,0 и 10 мг/кг или плацебо; внутривенные инфузии осуществляли в дни 0, 14-й, 28-й, а затем каждые 28 дней. Первичной конечной точкой являлся один из международных индексов активности СКВ – SRI. В каждом из исследований отмечено существенное снижение уровня этого индекса к 52-й неделе лечения при использовании белимумаба в дозе 10 мг/кг в сравнении с приемом плацебо. Эта доза была одобрена FDA для лечения больных с активной формой СКВ.Лечение белимумабом считается приемлемым у серопозитивных пациентов с активной формой СКВ при отсутствии клинического улучшения при стандартных лечебных подходах. Назначение белимумаба также может быть оправдано у лиц с достаточно высоким уровнем активности СКВ при наличии у них плохой переносимости ГК.С учетом того, что противопоказания к применению белимумаба включают наличие различных острых и хронических инфекций, перед его назначением необходимо проведение скрининга для исключения ВИЧ-инфекции, гепатитов В и С, туберкулеза, а также цитомегаловирусной инфекции (для лиц, ранее получавших ИСП).К проблемам, связанным с терапией белимумабом, относятся следующие:1) отсутствие серьезных исследований, в которых его эффективность и безопасность сопоставлялись бы не с плацебо, а с другими препаратами, применяемыми при СКВ (например, мофетила микофенолатом, циклофосфамидом, азатиоприном и др.);2) отсутствие данных о возможных его комбинациях с указанными выше препаратами;3) относительно небольшая продолжительность проведенных исследований, посвященных эффективности белимумаба, что позволяет судить о ее сохранении при длительном (более полутора лет) применении;4) определенное неудобство для пациента (требуются ежемесячные внутривенные введения в условиях стационара);5) достаточно высокая цена (так, в США стоимость лечения в течение первого года достигает 28 тыс. долларов, в то время как для генериков преднизолона – 140 долларов, гидроксихлорохина – 132 долларов, азатиоприна – 468 долларов и мофетила микофенолата – 1224 долларов).Ритуксимаб представляет собой химерическое (созданное с помощью генной инженерии, сочетающее биологические компоненты человека и мыши) моноклональное антитело (иммуноглобулин класса IgG1 каппа) к антигену CD20, который располагается на поверхности ряда субпопуляций В-лимфоцитов (включая таковые при В-клеточных лимфомах). При его применении уменьшаются количество и функциональная активность В-лимфоцитов.Этот препарат не имеет формального одобрения FDA и ЕМА для лечения лиц с СКВ, однако в ряде ревматологических центров он применяется у таких больных в случаях невосприимчивости к другим лекарственным средствам. Основные сферы применения ритуксимаба в настоящее время – при терапии пациентов с неходжкинскими лимфомами, ревматоидным артритом; также возможно его использование при некоторых вариантах системных васкулитов (в частности, при микроскопическом полиангиите).У ритуксимаба пока отсутствует представительная доказательная база. В двух крупных плацебо-контролируемых рандомизированных исследованиях (EXPLORER и LUNAR) данный препарат не продемонстрировал значимого влияния на параметры активности как СКВ в целом, так и ВГН (III и IV классов) в частности. В настоящее время проводится еще одно исследование (RING) применения ритуксимаба у больных ВГН, результаты которого, вероятно, смогут более четко определить эффективность этого препарата при СКВ.Другие биологические препараты при СКВ. На разных стадиях изучения сейчас находятся еще несколько различных биологических препаратов, которые применяются при СКВ.• Лекарственные средства, селективно направленные на компоненты В-клеточного звена иммунной системы.– Атацицепт – рекомбинантный человеческий протеин, одновременно ингибирующий сразу 2 фактора роста В-лимфоцитов – BLyS и APRIL. К настоящему времени одно из исследований данного лекарственного средства (APRIL-LN) у пациентов с ВГН завершилось преждевременно из-за более высокой частоты побочных эффектов в группе Атацицепта. В 2014 г. были представлены результаты еще одного исследования этого препаратом (APRIL-SLE); показано, что применение Атацицепта ассоциировалось с уменьшением количества и степени выраженности обострений СКВ. Однако исследование было закончено досрочно из-за двух случаев фатальных легочных инфекций.– Абетимус – толерогенный олигомер ДНК, вызывающий развитие толерантности В-лимфоцитов, специфичных в отношении продукции антител к двуспиральной ДНК; при его применении происходит существенное снижение уровней этих аутоантител в циркуляции. Несколько исследований с этим препаратом пока закончились безрезультатно.– Окрелизумаб – моноклональное антитело к антигену CD20 на поверхности В-клеток (по механизму действия подобен ритуксимабу). Проводится исследование BELONG у лиц с СКВ.– Эпратузумаб – моноклональное антитело к антигену CD22 на поверхности В-клеток; при его приеме в меньшей степени, чем при использовании моноклональных антител к CD20, уменьшается количество циркулирующих В-клеток. Сейчас продолжается исследование EMBODY у больных с активной СКВ.• Лекарственные средства, селективно направленные на компоненты Т-клеточного звена иммунной системы.– Абатацепт – протеин, связывающийся с антигенами CD80/86 на поверхности антигенпредставляющих клеток и В-лимфоцитов; его использование приводит к блокированию стимуляции этими клетками Т-лимфоцитов. Проводится исследование ACCESS этого препарата у лиц с активной СКВ и ВГН.– Среди биологических препаратов, целенаправленно воздействующих на Т-клеточные компоненты иммунной системы, также изучаются рапамицин и N-ацетилцистеин (способны корректировать нарушения функции митохондрий Т-лимфоцитов); ингибиторы тирозинкиназы (syk); моноклональные антитела к антигену CD40 и др.• Лекарственные средства, селективно блокирующие провоспалительные цитокины (антицитокиновые препараты).– Пока на достаточно ранних стадиях изучения применения при СКВ находятся моноклональные антитела сифалимумаб и ронтализумаб (ингибиторы интерферона-альфа), а также тоцилизумаб (блокатор рецептора ИЛ-6).– Подходы, целенаправленно блокирующие ФНО (оказавшиеся эффективными у больных с ревматоидным артритом и серонегативными спондилоартропатиями), у пациентов с СКВ не смогли продемонстрировать убедительных преимуществ (несколько исследований с инфликсимабом и этанерцептом завершились преждевременно и безрезультатно).СКВ и беременностьРазвитие СКВ преимущественно у женщин репродуктивного возраста требует отдельного обсуждения.1. Течение СКВ во время беременности может сопровождаться возникновением обострений; их частота более высока у пациенток, имевших до зачатия высокую/умеренную активность заболевания, ВГН (особенно при наличии АГ и/или сниженной функции почек, у лиц с известной морфологической картиной (с III, IV и V классами гломерулонефрита), поражения центральной нервной системы, миокардит, легочную гипертензию. Обострения СКВ могут регистрироваться в любом триместре беременности, а также после родоразрешения. У пациенток с СКВ также повышена частота акушерских (преэклампсия, преждевременная отслойка плаценты, кровотечения) и плодовых осложнений (гипотрофия, недоношенность, перинатальная смерть).2. Важным является планирование гестации у женщин с СКВ. Вынашивание беременности не рекомендуется пациенткам, имевшим до зачатия указанные выше клинические особенности. В ходе гестации за состоянием матери и плода должен осуществляться тщательный клинико-лабораторный и инструментальный контроль при регулярном наблюдении ревматолога, нефролога, невролога, акушера-гинеколога. Наряду с измерением рутинных параметров (уровней артериального давления, показателей массы тела, электрокардиограммы, общеклинических и стандартных биохимических исследований, СКФ, анализов мочи) необходимы также исследования уровней антифосфолипидных антител, антител к двуспиральной ДНК, комплемента (С3 и С4 или СН50), антиSSA/Ro- и антиSSB/La-антител, а в последнем триместре – антенатальная оценка частоты сердечных сокращений плода и, возможно, эхокардиография плода.3. Принципы лечебной тактики у пациенток с СКВ в ходе гестации соответствуют рассмотренным выше для больных СКВ в целом. При отсутствии тяжелых клинических проявлений для контроля активности заболевания может быть достаточным прием противомалярийных средств (гидроксихлорохина), нестероидных противовоспалительных препаратов (ацетилсалициловой кислоты, ибупрофена), в части случаев – низких доз глюкокортикоидов (метилпреднизолона ≤8-12 мг/сут под прикрытием антацидных препаратов). При высокой активности СКВ, а также наличии тяжелых клинических проявлений оправдано применение средних/высоких доз ГК (например, метилпреднизолона >12 мг/сут в сочетании с адекватной гастропротекцией). Ряд авторов считают возможным для контроля активности СКВ в ходе гестации использовать азатиоприн. В ходе гестации противопоказано применение циклофосфамида, метотрексата, мофетила микофенолата, циклоспорина, ингибиторов ангиотензинпревращающего фермента и биологических препаратов.
Приведенные данные позволяют рассматривать ПМП в качестве лекарственных средств первой линии при СКВ, учитывая их эффективность, безопасность и низкую стоимость.Нестероидные противовоспалительные препаратыНПВП благодаря их уникальной противовоспалительной, аналгетической и жаропонижающей активности широко применяются как при ревматических, так и неревматических заболеваниях. Эти эффекты обусловлены главным образом способностью НПВП ингибировать синтез простагландинов, а также агрегацию нейтрофилов.У подавляющего большинства пациентов с СКВ (в 80-90% случаев) на различных этапах заболевания применяются НПВП, оказывающие благоприятный эффект при таких клинических проявлениях, как лихорадка, артриты, артралгии, миалгии, умеренные серозиты (плеврит, перикардит, асцит), головная боль, слабость, недомогание. Способность некоторых НПВП, прежде всего ацетилсалициловой кислоты, оказывать антитромбоцитарное действие обусловила их применение у пациентов с СКВ и наличием АФС.Важно отметить, что сегодня мы не располагаем убедительными доказательствами (т.е. отсутствуют данные хорошо спланированных, с репрезентативным количеством больных, контролируемых рандомизированных исследований) положительной эффективности НПВП у больных СКВ при наличии поражений внутренних органов и жизненно важных систем, а также увеличения их выживаемости.Основываясь на собственном многолетнем опыте и результатах большого количества сообщений, американские ревматологи пришли к следующим выводам в отношении применения НПВП у пациентов с СКВ:• подавляющее большинство больных на разных стадиях заболевания принимают НПВП по поводу лихорадки, головной боли, миалгий, артралгий или артритов и/или серозитов;• при мышечно-скелетных проявлениях аспирин более эффективен по сравнению с ибупрофеном, целекоксиб более эффективен и безопасен, чем другие представители НПВП;• риск развития таких побочных эффектов, как повышение фоточувствительности, задержка жидкости, развитие артериальной гипертензии, гастроинтестинальной ульцерации и асептического менингита при применении НПВП, выше по сравнению с таковым у здоровых лиц;• частота развития побочных эффектов при применении НПВП ниже таковой при учете факторов риска и данных динамических осмотров больных;• следует оценить соотношение «риск-польза»;• предпочтительнее применять аспирин, напроксен или целекоксиб; с целью снижения частоты и тяжести побочных действий следует использовать минимально эффективные дозировки НПВП, ограничивая длительность их применения.Иммуносупрессивные средства (препараты цитотоксического действия)Иммуносупрессивные препараты (ИСП) сегодня широко и эффективно используются в комбинации с глюкокортикоидами (ГК) в лечении больных СКВ при вовлечении в патологический процесс жизненно важных органов и систем. Одни лекарственные средства (циклофосфамид и мофетила микофенолат) обычно применяются в качестве индукционной (первоначальной) терапии, направленной на достижение полной или частичной ремиссии; другие (азатиоприн, метотрексат) – с целью профилактики обострений. Комбинация ИСП и ГК ассоциируется с повышением эффективности лечения СКВ и нередко позволяет снижать дозировки последних. В то же время прием ИСП сопровождается развитием ряда побочных эффектов (в том числе жизнеопасных). В последние два десятилетия опубликованы результаты ряда контролируемых рандомизированных исследований (КРИ), направленных на оценку индукционной и поддерживающей терапии различными препаратами иммуносупрессивного действия. В большинстве КРИ оценивались возможности этих лекарственных средств в терапии III, IV и реже V морфологических классов активного волчаночного гломерулонефрита (ВГН). Механизмы действия, эффективность и побочные явления ИСП, применяемых у больных СКВ, обсуждаются ниже.Циклофосфамид. Несмотря на серьезные токсические эффекты (прежде всего гонадальные), циклофосфамид сегодня остается одним из наиболее часто применяемых ИСП у пациентов с СКВ в качестве индукционной терапии.Данный препарат метаболизируется в печени митохондриальными энзимами цитохрома Р-450 на ряд активных метаболитов, проявляющих лечебные эффекты.Многочисленные иммунные механизмы циклофосфамида включают прямое действие на ДНК, что ведет к гибели клеток на любой стадии их цикла; иммуномодулирующие эффекты, ответственные за относительно быстрое начало терапевтических процессов (в течение 2-4 дней); влияние на изменение функции макрофагов, увеличение продукции простагландина Е2, изменение транскрипции генов и прямое функциональное воздействие на лимфоциты. Циклофосфамид приводит к развитию дозозависимой лимфопении, уменьшает популяцию кластерной дифференцировки CD4, CD8 и В-клеток с более существенным снижением CD4 и В-лимфоцитов.Важно отметить, что, несмотря на существенное уменьшение продукции патогенных аутоантител под влиянием циклофосфамида, в целом уровни иммуноглобулинов G, А и М мало изменяются, что предполагает специфическую супрессию продукции аутоантител, а следовательно, объясняет его отчетливый лечебный эффект у больных СКВ.Данное лекарственное средство легко абсорбируется в кишечнике, а пероральные и внутривенные дозировки эквивалентны. Терапевтические дозы циклофосфамида составляют 2-4 мг на 1 кг массы тела. Их следует уменьшать примерно на 30% у больных со скоростью клубочковой фильтрации (СКФ) <30 мл/мин.Терапевтическая характеристика циклофосфамида:• не представлено доказательств, что его внутривенное применение более эффективно, чем пероральное, но бесспорно менее токсично;• преднизолон в комбинации с пероральным или внутривенным циклофосфамидом применялся во всех исследованиях, демонстрируя хороший лечебный эффект;• комбинация пульс-терапии (болюса) метилпреднизолона с пульс-терапией (болюсом) циклофосфамидом 1-2 раза в месяц (в зависимости от дозировок) при лечении ВГН характеризуется хорошим клиническим эффектом;• кумулятивная доза циклофосфамида определяет риск гонадального поражения и малигнизации;• поддерживающая терапия циклофосфамидом более токсична, чем мофетила микофенолатом и азатиоприном;• протеинурия и другие проявления ВГН обычно уменьшаются или исчезают постепенно в течение 6-12 мес. Прогноз ВГН хуже у больных, у которых протеинурия не снижается до <1,0 г/сут, чем у лиц, у которых достигается полная ремиссия;• отмечены благоприятные эффекты циклофосфамида и у пациентов с экстраренальными проявлениями СКВ, включающими дискоидную волчанку, волчаночное поражение центральной нервной системы (ЦНС), тромбоцитопению, пульмониты и легочные геморрагии, гемолитическую анемию, аутоиммунную нейтропению, некротизирующий васкулит, антифосфолипидный синдром с васкулопатией.Хлорамбуцил – алкилирующий агент, иммуносупрессивные свойства которого подобны таковым циклофосфамида, но имеющий более высокий риск малигнизации. Следует отметить, что хлорамбуцил в отличие от циклофосфамида не метаболизируется в акролеин, а значит, не ассоциируется с риском развития геморрагического цистита и может применяться у больных СКВ с нейрогенным мочевым пузырем или перенесших ранее геморрагический цистит. В связи с высоким риском развития токсических эффектов длительное применение хлорамбуцила при СКВ ограничено.Азатиоприн на протяжении десятилетий широко применяется при СКВ благодаря его иммуносупрессивной активности, ассоциируемой с предотвращением обострений заболевания после достигнутой ремиссии, а также благодаря сохранению лечебного эффекта при снижении дозировок ГК.Неактивный азатиоприн метаболизируется внутриклеточно в активные антагонисты пурина – 6-меркаптопурин и 6-тионозиловую кислоту. Препарат снижает количество Т-клеток, В-клеток и киллерных клеток, тем самым ингибируя клеточные и гуморальные иммунные процессы.В большинстве ревматологических и нефрологических клиник азатиоприн не используется в качестве индукционной терапии при поражении жизненно важных органов в отличие от циклофосфамида и мофетила микофенолата.Азатиоприн применяется перорально, так как его внутривенное введение сопряжено с выраженным раздражающим действием, в дозировках 1-3 мг/кг массы тела в сутки.Мофетил микофенолат обладает уникальным механизмом действия, позволяющим контролировать активность СКВ и ее различные проявления. Он ингибирует формирование антител, предотвращает миграцию лейкоцитов за счет уменьшения экспрессии эндотелиальных молекул адгезии, подавляет пролиферацию Т- и В-лимфоцитов in vitro в ответ на митогенную стимуляцию, снижает оксидативное повреждение.В многочисленных исследованиях продемонстрирована способность данного препарата индуцировать ремиссию у больных СКВ и предотвращать обострения. Причем способность мофетила микофенолата индуцировать ремиссию сопоставима с таковой у циклофосфамида (в том числе при ВГН). В то же время мофетила микофенолат менее токсичен, чем алкилирующие агенты, в связи с чем является препаратом выбора у больных СКВ репродуктивного возраста ввиду отсутствия гонадальной токсичности. Возможность мофетила микофенолата предотвращать обострения СКВ превышает таковой показатель азатиоприна.Мофетил микофенолат применяется перорально в дозировках 2,0-3,0 г/сут. После достижения ремиссии с целью профилактики обострений приемлемы дозировки 0,5-1,0 г/сут.Циклоспорин и такролимус. Ингибиторы кальциневрина циклоспорин и такролимус обладают комплексом иммунологических эффектов, включающих ингибицию активацииТ-клеточных генов и транскрипции генов, а также уменьшение образования интерлейкина (Ил)-2, фактора некроза опухоли альфа (ФНО), ИЛ-3, ИЛ-4 и других цитокинов. Кроме того, эти препараты ингибируют поступление антигенпрезентирующих клеток и антигенов, а также ИЛ-17 и Т-клеточнозависимую продукцию антител В-клетками. Циклоспорин и такролимус применяются перорально или внутривенно.В ряде исследований продемонстрирована эффективность данных ингибиторов кальциневрина как у больных с волчаночным поражением почек, так и при наличии различных экстраренальных проявлений.Дозировки циклоспорина составляют 2,0-5,0 мг/кг массы тела, такролимуса – 4,0 мг/кг массы тела.Эффективность ингибиторов кальциневрина изучалась в основном у больных с ВГН. Результаты немногочисленных исследований свидетельствуют, что циклоспорин и такролимус способны снижать уровни протеинурии, но уступают таковой циклофосфамида. Применение циклоспорина и такролимуса считается приемлемым у мужчин и женщин репродуктивного возраста, в том числе при беременности в связи с отсутствием токсического влияния на гонады и кроветворение.Лефлуномид. Препарат является ингибитором de novo пиримидинового синтеза, хорошо изучен у больных ревматоидным артритом (РА) и занял достойное место в лечении этого заболевания наряду с метотрексатом. Лефлуномид – цитотоксический изоксазола дериват, отличающийся структурно от других иммуномодуляторов. Он быстро конвертируется в активный метаболит малононитриламид, предотвращающий активацию лимфоцитов и снижающий активность ЦОГ-2 и адгезию лейкоцитов.Лефлуномид применяется перорально в дозировке 10-20 мг/сут при РА и до 30 мг/сут при СКВ. Препарат быстро абсорбируется при приеме внутрь и подвергается интенсивной энтеропеченочной рециркуляции.Использование лефлуномида у больных СКВ может быть рассмотрено в тех случаях, если проведение стандартной иммуномодулирующей терапии невозможно или если она неэффективна. Опыт применения лефлуномида при СКВ незначителен. В единичных исследованиях показана способность препарата снижать активность заболевания и улучшать клиническую картину. В связи с этим считается возможным его использование в случаях, резистентных к традиционным лечебным подходам.Метотрексат – фолатный антагонист, ингибирующий дигидрофолатредуктазу в дозировках, используемых при ревматических заболеваниях. Отсутствуют убедительные данные об изменениях в субпопуляциях лимфоцитов, поверхностных маркеров, лимфоцитарной функции и уровней аутоантител у больных с ревматическими заболеваниями, у которых был показан терапевтический эффект при лечении метотрексатом. Препарат обладает множеством противовоспалительных эффектов, которые обусловлены его способностью стимулировать освобождение аденозина, подавляющего воспалительные функции нейтрофилов, макрофагов и лимфоцитов.Метотрексат применяется перорально и подкожно в дозировках 5-30 мг/нед в комбинации с фолиевой кислотой (5-10 мг/нед) кроме дней приема метотрексата. Дозы более 20 мг обычно используются при подкожном введении, которое ассоциируется с более высокой эффективностью и менее выраженными побочными эффектами, чем пероральное.Несмотря на небольшое количество клинических исследований, многие клиницисты считают приемлемым применение метотрексата при СКВ, протекающей с преимущественным поражением кожи, суставов, мышц и плевры. При этом отмечен стероидснижающий эффект препарата.Побочные эффекты ИСП. Применение ИСП сопряжено с риском развития серьезных осложнений. Одни из них присущи всем иммуносупрессивным средствам независимо от групповой принадлежности, другие – обусловлены их специфическими особенностями.Использование ИСП ведет к депрессии гемопоэтических клеток, нарастающей при кумуляции препаратов, риск которой повышается при снижении функции почек. В связи с этим необходимо изучение почечной функции до и в ходе лечения. Обычно первым проявлением токсического влияния ИСП на гемопоэз является лейкопения; в последующем возможно развитие тромбоцитопении и анемии. Агранулоцитоз наблюдается редко.При приеме ИСП могут развиваться тошнота и рвота, частота и тяжесть которых нарастают по мере увеличения дозировок и при длительном их применении.Использование ИСП ассоциируется с риском развития интеркуррентных бактериальных, вирусных и грибковых инфекций.Лечение ИСП может осложняться развитием лихорадки, алопеции, кожными высыпаниями, депрессией клеток слизистых оболочек с возможными кровотечениями в желудочно-кишечном тракте, а также нарушением функции печени и почек.Интенсивно изучается проблема риска онкогенных и тератогенных побочных эффектов ИСП. В ряде исследований отмечено развитие опухолевых процессов в коже, мочевом пузыре и гематологической системе при лечении данными препаратами. Одни авторы считают, что онкогенный риск обусловлен побочными эффектами ИСП, другие связывают развитие опухолей у больных СКВ с генетической предрасположенностью, а не с неблагоприятным воздействием лекарственных средств.Представлены доказательства мутагенной активности ИСП. Их кластогенный (хромосомный поломочный) эффект определяется видом препарата, его дозировкой и продолжительностью применения, а также особенностями индивидуального ответа организма. Количественные и структурные хромосомные нарушения связывают с прямым воздействием ИСП на молекулы ДНК, в результате чего изменяется последовательность нуклеотидов – происходит перекрещивание молекул ДНК как с частями такой же молекулы, так и с другими молекулами ДНК.Тератогенный эффект ИСП (в первую очередь алкилирующих) служит противопоказанием для планирования беременности при их приеме. При назначении этих препаратов необходимо убедиться в отсутствии беременности.Тяжесть токсических эффектов различных ИСП неоднозначна. Так, у азатиоприна менее выражены токсические влияния, чем у циклофосфамида. Однако его иммуносупрессивный потенциал и клиническая эффективность уступают циклофосфамиду.Тяжесть и частота токсического действия метотрексата оцениваются неоднозначно, но превалирует точка зрения, что осложнения при проведении им лечения менее выражены, чем при терапии циклофосфамидом.Применение циклофосфамида сопряжено с существенным токсическим влиянием на половые железы, результатом чего являются развитие аменореи и азооспермии, риск которых увеличивается при длительном применении и высоких дозировках.Лечение циклофосфамидом может осложняться развитием геморрагического цистита, что связано с непосредственным влиянием на эпителиальные клетки мочевого пузыря альдегидного метаболита препарата акролеина. Для уменьшения его концентрации (особенно при пероральном применении) необходимо поддерживать адекватную гидратацию.Нефротоксичность, ассоциирующаяся со снижением СКФ, повышением уровней креатинина крови и развитием артериальной гипертензии (АГ), является ведущим побочным эффектом ингибиторов кальциневрина – циклоспорина и такролимуса. При этом в почках выявляются облитерирующая артериопатия, гломерулосклероз, тубулярная атрофия и интерстициальный фиброз. В отличие от алкилирующих агентов циклоспорину и такролимусу не присуща депрессия костного мозга. При лечении циклоспорином и такролимусом возможно развитие гирсутизма и гингивальной гиперплазии.Применение метотрексата сопряжено с гепатотоксичностью и развитием легочных инфильтратов, проявляющихся кашлем и одышкой, с неблагоприятным прогнозом.Фотосенсибилизирующие эффекты возможны при применении метотрексата.Суммируя изложенное выше об эффективности и побочных действиях ИСП, следует отметить, что они сегодня составляют важный компонент в лечении больных СКВ. Однако высокий риск тяжелых осложнений, обусловленных проведением цитостатической терапии, требует строгого подхода к отбору пациентов. В когорту больных СКВ, требующих применения ИСП, должны входить пациенты с тяжелыми поражениями жизненно важных органов, у которых лечение ГК недостаточно эффективно и/или развивается стероидная зависимость, и/или необходимо снижение дозировок ГК. Кроме того, комбинированное применение ИСП с ГК позволяет существенно уменьшить дозировки последних, сохраняя адекватный лечебный эффект. Также возможно использование ИСП у больных СКВ, которые проинформированы о риске развития побочных действий при применении этих лекарственных средств и у которых возможно проведение мониторирования клинических и лабораторных параметров в ходе лечения с целью своевременного выявления токсических эффектов.Новые биологические препараты в лечении СКВЗначительный прогресс, достигнутый за последние два десятилетия в иммунологии, обусловил разработку и внедрение в клиническую практику ряда новых лечебных подходов. В отличие от обсуждаемых выше лекарственных средств, механизм действия которых на иммунопатологические процессы не является избирательным, но обеспечивает неспецифическую иммуносупрессию, новые препараты способны селективно воздействовать на отдельные компоненты иммунной системы (например, строго специфично связываться с определенным видом рецепторов антигенов или цитокинов), что открывает возможности для целенаправленной супрессии специфической популяции/субпопуляции иммунокомпетентных клеток.Существенные успехи в изучении патогенеза СКВ, создающие базу для разработки новых селективных биологических препаратов, включают: 1) выявление и идентификацию многочисленных цитокинов, хемокинов и иных медиаторов; 2) установление особенностей процесса апоптоза и его регуляции; 3) определение новых клеточных субпопуляций, участвующих в патогенезе СКВ; 4) установление разнообразных путей передачи сигналов в процессе межклеточной кооперации в ходе иммунного ответа; 5) описание и выявление последовательностей генов, обеспечивающих восприимчивость к СКВ.Представленные нами выше лечебные подходы, базирующиеся на применении нестероидных противовоспалительных препаратов, противомалярийных агентов, ГК, ИСП, включающих циклофосфамид, азатиоприн, мофетил микофенолат, метотрексат, ингибиторы кальциневрина, лефлуномида, позволяют добиться благоприятного эффекта у значительного количества больных СКВ. Вместе с тем высокий риск развития побочных эффектов при их применении, а также недостаточный у ряда пациентов явились основанием для активного поиска новых лечебных подходов. В последние два десятилетия в эксперименте и многочисленных контролируемых рандомизированных исследованиях продолжают изучаться лечебные возможности, побочные эффекты различных биологических активных агентов, способных селективно воздействовать на отдельные компоненты иммунной системы. Характеристика, лечебные возможности, осложнения и роль биологических препаратов рассматриваются ниже.Белимумаб. На момент настоящей публикации это пока единственный одобренный Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA, США) и Европейским агентством по лекарственным средствам (ЕМА) биологический препарат для лечения больных СКВ; он зарегистрирован и присутствует на фармацевтическом рынке Украины. Белимумаб представляет собой моноклональное антитело к растворимым молекулам одного из важнейших факторов роста В-лимфоцитов (обозначается как BLyS – B-lymphocyte stimulator – «В-лимфоцитарный стимулятор»; также именуется как BAFF – B-cell activating factor – «фактор, активирующий В-клетки»).Связывание белимумаба с растворимыми молекулами BLyS ингибирует взаимодействие последних с BAFF-рецепторами на поверхности покоящихся и активированных В-лимфоцитов, а также плазматических клеток, что приводит к истощению их пула и тем самым к уменьшению присущей СКВ генерализованной В-клеточной гиперактивности и снижению выработки аутоантител. Применение белимумаба не ассоциировано с воздействием на В-клетки памяти, поскольку они лишены BAFF-рецепторов. С одной стороны, это может рассматриваться как определенное ограничение препарата (так как эти клетки могут инициировать формирование нового пула В-лимфоцитов, способных к секреции нежелательного репертуара аутоантител); с другой стороны, это свойство может являться и преимуществом (поскольку при использовании белимумаба не нарушается потенциальная способность В-клеток к продукции протективных антител против гриппа, пневмококка, столбняка и др.).Основанием для одобрения белимумаба в лечении СКВ послужили результаты двух рандомизированных плацебо-контролируемых исследований со схожими протоколами (BLISS-52 и BLISS-76, цифры соответствуют их продолжительности в неделях). В обоих исследованиях у больных имело место активное течение СКВ и они были серопозитивны (титр антинуклеарных аутоантител ≥1:80 или аутоантител к нативной ДНК ≥30 ед/мл). В добавление к стандартной терапии больных рандомизировали на прием белимумаба в дозах 1,0 и 10 мг/кг или плацебо; внутривенные инфузии осуществляли в дни 0, 14-й, 28-й, а затем каждые 28 дней. Первичной конечной точкой являлся один из международных индексов активности СКВ – SRI. В каждом из исследований отмечено существенное снижение уровня этого индекса к 52-й неделе лечения при использовании белимумаба в дозе 10 мг/кг в сравнении с приемом плацебо. Эта доза была одобрена FDA для лечения больных с активной формой СКВ.Лечение белимумабом считается приемлемым у серопозитивных пациентов с активной формой СКВ при отсутствии клинического улучшения при стандартных лечебных подходах. Назначение белимумаба также может быть оправдано у лиц с достаточно высоким уровнем активности СКВ при наличии у них плохой переносимости ГК.С учетом того, что противопоказания к применению белимумаба включают наличие различных острых и хронических инфекций, перед его назначением необходимо проведение скрининга для исключения ВИЧ-инфекции, гепатитов В и С, туберкулеза, а также цитомегаловирусной инфекции (для лиц, ранее получавших ИСП).К проблемам, связанным с терапией белимумабом, относятся следующие:1) отсутствие серьезных исследований, в которых его эффективность и безопасность сопоставлялись бы не с плацебо, а с другими препаратами, применяемыми при СКВ (например, мофетила микофенолатом, циклофосфамидом, азатиоприном и др.);2) отсутствие данных о возможных его комбинациях с указанными выше препаратами;3) относительно небольшая продолжительность проведенных исследований, посвященных эффективности белимумаба, что позволяет судить о ее сохранении при длительном (более полутора лет) применении;4) определенное неудобство для пациента (требуются ежемесячные внутривенные введения в условиях стационара);5) достаточно высокая цена (так, в США стоимость лечения в течение первого года достигает 28 тыс. долларов, в то время как для генериков преднизолона – 140 долларов, гидроксихлорохина – 132 долларов, азатиоприна – 468 долларов и мофетила микофенолата – 1224 долларов).Ритуксимаб представляет собой химерическое (созданное с помощью генной инженерии, сочетающее биологические компоненты человека и мыши) моноклональное антитело (иммуноглобулин класса IgG1 каппа) к антигену CD20, который располагается на поверхности ряда субпопуляций В-лимфоцитов (включая таковые при В-клеточных лимфомах). При его применении уменьшаются количество и функциональная активность В-лимфоцитов.Этот препарат не имеет формального одобрения FDA и ЕМА для лечения лиц с СКВ, однако в ряде ревматологических центров он применяется у таких больных в случаях невосприимчивости к другим лекарственным средствам. Основные сферы применения ритуксимаба в настоящее время – при терапии пациентов с неходжкинскими лимфомами, ревматоидным артритом; также возможно его использование при некоторых вариантах системных васкулитов (в частности, при микроскопическом полиангиите).У ритуксимаба пока отсутствует представительная доказательная база. В двух крупных плацебо-контролируемых рандомизированных исследованиях (EXPLORER и LUNAR) данный препарат не продемонстрировал значимого влияния на параметры активности как СКВ в целом, так и ВГН (III и IV классов) в частности. В настоящее время проводится еще одно исследование (RING) применения ритуксимаба у больных ВГН, результаты которого, вероятно, смогут более четко определить эффективность этого препарата при СКВ.Другие биологические препараты при СКВ. На разных стадиях изучения сейчас находятся еще несколько различных биологических препаратов, которые применяются при СКВ.• Лекарственные средства, селективно направленные на компоненты В-клеточного звена иммунной системы.– Атацицепт – рекомбинантный человеческий протеин, одновременно ингибирующий сразу 2 фактора роста В-лимфоцитов – BLyS и APRIL. К настоящему времени одно из исследований данного лекарственного средства (APRIL-LN) у пациентов с ВГН завершилось преждевременно из-за более высокой частоты побочных эффектов в группе Атацицепта. В 2014 г. были представлены результаты еще одного исследования этого препаратом (APRIL-SLE); показано, что применение Атацицепта ассоциировалось с уменьшением количества и степени выраженности обострений СКВ. Однако исследование было закончено досрочно из-за двух случаев фатальных легочных инфекций.– Абетимус – толерогенный олигомер ДНК, вызывающий развитие толерантности В-лимфоцитов, специфичных в отношении продукции антител к двуспиральной ДНК; при его применении происходит существенное снижение уровней этих аутоантител в циркуляции. Несколько исследований с этим препаратом пока закончились безрезультатно.– Окрелизумаб – моноклональное антитело к антигену CD20 на поверхности В-клеток (по механизму действия подобен ритуксимабу). Проводится исследование BELONG у лиц с СКВ.– Эпратузумаб – моноклональное антитело к антигену CD22 на поверхности В-клеток; при его приеме в меньшей степени, чем при использовании моноклональных антител к CD20, уменьшается количество циркулирующих В-клеток. Сейчас продолжается исследование EMBODY у больных с активной СКВ.• Лекарственные средства, селективно направленные на компоненты Т-клеточного звена иммунной системы.– Абатацепт – протеин, связывающийся с антигенами CD80/86 на поверхности антигенпредставляющих клеток и В-лимфоцитов; его использование приводит к блокированию стимуляции этими клетками Т-лимфоцитов. Проводится исследование ACCESS этого препарата у лиц с активной СКВ и ВГН.– Среди биологических препаратов, целенаправленно воздействующих на Т-клеточные компоненты иммунной системы, также изучаются рапамицин и N-ацетилцистеин (способны корректировать нарушения функции митохондрий Т-лимфоцитов); ингибиторы тирозинкиназы (syk); моноклональные антитела к антигену CD40 и др.• Лекарственные средства, селективно блокирующие провоспалительные цитокины (антицитокиновые препараты).– Пока на достаточно ранних стадиях изучения применения при СКВ находятся моноклональные антитела сифалимумаб и ронтализумаб (ингибиторы интерферона-альфа), а также тоцилизумаб (блокатор рецептора ИЛ-6).– Подходы, целенаправленно блокирующие ФНО (оказавшиеся эффективными у больных с ревматоидным артритом и серонегативными спондилоартропатиями), у пациентов с СКВ не смогли продемонстрировать убедительных преимуществ (несколько исследований с инфликсимабом и этанерцептом завершились преждевременно и безрезультатно).СКВ и беременностьРазвитие СКВ преимущественно у женщин репродуктивного возраста требует отдельного обсуждения.1. Течение СКВ во время беременности может сопровождаться возникновением обострений; их частота более высока у пациенток, имевших до зачатия высокую/умеренную активность заболевания, ВГН (особенно при наличии АГ и/или сниженной функции почек, у лиц с известной морфологической картиной (с III, IV и V классами гломерулонефрита), поражения центральной нервной системы, миокардит, легочную гипертензию. Обострения СКВ могут регистрироваться в любом триместре беременности, а также после родоразрешения. У пациенток с СКВ также повышена частота акушерских (преэклампсия, преждевременная отслойка плаценты, кровотечения) и плодовых осложнений (гипотрофия, недоношенность, перинатальная смерть).2. Важным является планирование гестации у женщин с СКВ. Вынашивание беременности не рекомендуется пациенткам, имевшим до зачатия указанные выше клинические особенности. В ходе гестации за состоянием матери и плода должен осуществляться тщательный клинико-лабораторный и инструментальный контроль при регулярном наблюдении ревматолога, нефролога, невролога, акушера-гинеколога. Наряду с измерением рутинных параметров (уровней артериального давления, показателей массы тела, электрокардиограммы, общеклинических и стандартных биохимических исследований, СКФ, анализов мочи) необходимы также исследования уровней антифосфолипидных антител, антител к двуспиральной ДНК, комплемента (С3 и С4 или СН50), антиSSA/Ro- и антиSSB/La-антител, а в последнем триместре – антенатальная оценка частоты сердечных сокращений плода и, возможно, эхокардиография плода.3. Принципы лечебной тактики у пациенток с СКВ в ходе гестации соответствуют рассмотренным выше для больных СКВ в целом. При отсутствии тяжелых клинических проявлений для контроля активности заболевания может быть достаточным прием противомалярийных средств (гидроксихлорохина), нестероидных противовоспалительных препаратов (ацетилсалициловой кислоты, ибупрофена), в части случаев – низких доз глюкокортикоидов (метилпреднизолона ≤8-12 мг/сут под прикрытием антацидных препаратов). При высокой активности СКВ, а также наличии тяжелых клинических проявлений оправдано применение средних/высоких доз ГК (например, метилпреднизолона >12 мг/сут в сочетании с адекватной гастропротекцией). Ряд авторов считают возможным для контроля активности СКВ в ходе гестации использовать азатиоприн. В ходе гестации противопоказано применение циклофосфамида, метотрексата, мофетила микофенолата, циклоспорина, ингибиторов ангиотензинпревращающего фермента и биологических препаратов.


