11 червня, 2022
Клінічне значення дослідження вмісту імуноглобуліну G у лікарській практиці
 Імунологія сьогодні стрімко розвивається. Постійно з’являються нові дані та фактори, що змушують під іншим кутом дивитися на деякі питання імунології. Важливу роль в організмі людини відіграють імуноглобуліни (Ig), що синтезуються плазматичними клітинами та виконують в організмі функцію антитіл. Ig класу G (Ig G) сьогодні є одними з найбільш вивчених із 5 ізотипів. Вміст Ig G у сироватці крові людини становить 10-20% усіх білків плазми. За своєю будовою Ig G є глікопротеїном, що на 80-95% складається з білків і на 5-20% – з вуглеводів.
Імунологія сьогодні стрімко розвивається. Постійно з’являються нові дані та фактори, що змушують під іншим кутом дивитися на деякі питання імунології. Важливу роль в організмі людини відіграють імуноглобуліни (Ig), що синтезуються плазматичними клітинами та виконують в організмі функцію антитіл. Ig класу G (Ig G) сьогодні є одними з найбільш вивчених із 5 ізотипів. Вміст Ig G у сироватці крові людини становить 10-20% усіх білків плазми. За своєю будовою Ig G є глікопротеїном, що на 80-95% складається з білків і на 5-20% – з вуглеводів.
Ig G є важливою складовою гуморального імунітету, який бере участь у контролі над інфекціями. З’єднання Ig G із патогеном активує фагоцитоз. Ig G здатний до класичного шляху активації системи комплементу, що призводить до утворення білків, які також можуть розщеплювати патоген. Окремі підкласи Ig G беруть участь у реакціях гіперчутливості І, ІІ і ІІІ типів (G. Vidarsson et al., 2014). Однією з важливих особливостей Ig G є можливість запобігання анафілактичним реакціям, які опосередковані Ig E. Цей механізм реалізується у випадку, коли Ig G взаємодіють з антигенами раніше, ніж це зробить Ig E, і виступають антитілами, що блокують його (L.N. Pointner et al., 2022).
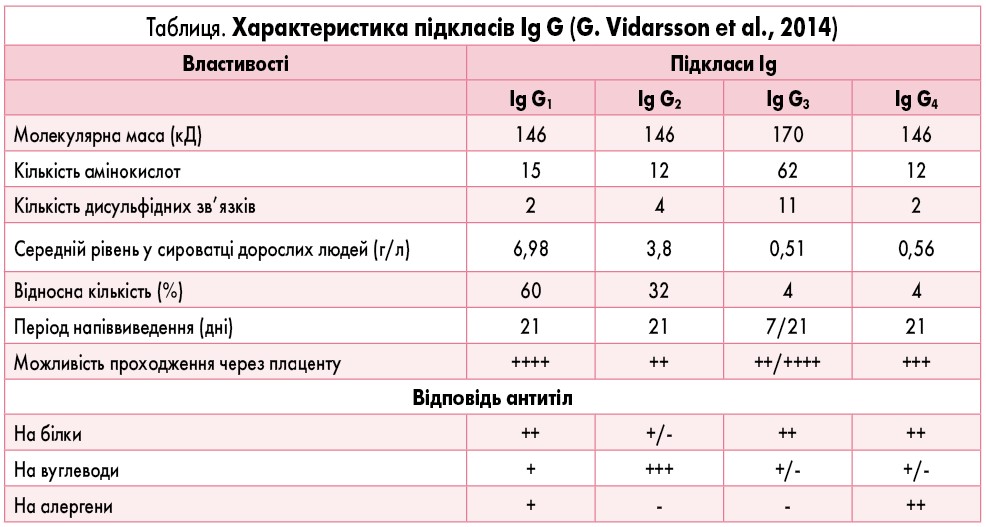
Клас Ig G складається з підкласів – Ig G1, Ig G2, Ig G3 та Ig G4, що мають певні відмінності у будові та виконують різні ефекторні функції (Л.В. Кузнецова та ін., 2013). Відмінності у структурі і функціях підкласів Ig G узагальнені в таблиці.
Залежно від виду патології (інфекції, алергічні стани, аутоімунні процеси) виробляються різні підкласи Ig G. При інфекційних захворюваннях продукуються переважно Ig G1 і Ig G3. Їх секреція індукується вірусами та бактеріями з білковою структурою і, як наслідок, активується класичний шлях системи комплементу. Антитіла Ig G2 слабко впливають на систему комплементу класичним шляхом, але здатні викликати опсонізацію та знищення деяких мікроорганізмів, що мають ліпополісахаридну оболонку. Ig G2 відіграє ключову роль у знешкодженні інкапсульованих бактерій, активуючи систему комплементу альтернативним шляхом. Те, що бактерії містять у своїй структурі різні антигенні детермінанти, часто призводить до вироблення антитіл Ig G усіх підкласів.
Ig G3 відіграють значну роль в ефекторних функціях імунної системи і є важливими протизапальними антитілами. Вони відповідають за стримування розвитку надмірного запального процесу внаслідок дії інших класів антитіл. У пацієнтів з аутоімунними захворюваннями специфічні антитіла частіше всього представлені Ig G1 та Ig G3, але окремі системні захворювання сполучної тканини, такі як системний червоний вовчак, стимулюють вироблення Ig G усіх підкласів.
При алергічних захворюваннях на ранніх етапах відмічається підвищення Ig G1 разом із Ig E. А Ig G4 зазвичай синтезуються під час тривалого впливу антигенів при важких атопічних дерматитах. Вони також пов’язані з розвитком толерантності до алергенів. У цьому випадку Ig G4 часто стають домінуючим підкласом серед решти Ig G. Прикладом стимуляції синтезу Ig G4 може слугувати проведення алергенспецифічної імунотерапії (G. Vidarsson et al., 2014).
Визначення Ig G використовується для діагностики алергічних захворювань імунокоплексного типу – третього типу алергічних реакцій за Джеллом і Кумбсом (M.C. Dispenza, 2019). До імунокомплексних захворювань належать: харчова непереносимість, сироваткова хвороба, екзогенні алергічні альвеоліти, медикаментозні алергії, аутоалергічні захворювання сполучної тканини, місцеві реакції за типом феномена Артюса. Реалізація цих захворювань відбувається за рахунок антитіл Ig G, які утворюють імунні комплекси з розчиненими антигенами, здатними накопичуватися при недостатній кількості лізуючого їх комплементу в стінках судин, кишечнику тощо.
Відомо, що харчова алергія – це стан підвищеної чутливості організму до харчових продуктів. У літературі харчовою алергією прийнято називати стани, опосередковані Ig E.
Деякі автори називають алергічні реакції на харчові продукти ІІІ типу, опосередковані Ig G, харчовою непереносимістю (L.N. Pointner et al., 2022; C. Kanagaratham et al., 2020). Вважається, що поширеність харчової непереносимості становить 5-20% у різних популяціях (M.C.E. Lomer, 2014). Однак через брак діагностичних засобів для проведення скринінгових досліджень справжня поширеність харчової непереносимості, зумовленої Ig G, залишається невідомою. Вважається, що непереносимість харчових продуктів, опосередкована Ig G, викликана підвищеною проникністю кишечнику. Це дозволяє окремим харчовим речовинам, оминаючи ентероцити, потрапляти до кровоносного русла та індукувати вироблення специфічних Ig G антитіл у значній кількості.
Наявність у крові незначної кількості Ig G до харчових продуктів є нормальною реакцією організму на харчові антигени. Після кожного прийому їжі в сироватці крові циркулюють як антитіла, так і зв’язані зі специфічними Ig G комплекси харчових антигенів. За нормальних умов та невеликої кількості ці комплекси швидко виводяться з організму, не викликаючи патологічних реакцій. У випадках надмірного проникнення харчового антигену або при значному виробленні специфічних антитіл Ig G відбувається відкладення імунних комплексів та розвиток патологічних змін у стінці кишечнику і кровоносних судинах. У таких випадках внаслідок надмірного вироблення специфічних імуноглобулінів Ig G на харчові продукти відбувається зниження вироблення протизапальних цитокінів, таких як інтерлейкін (IL)-10, що зумовлює довготривалі хронічні запальні процеси переважно в кишечнику та шкірі.
Існують певні проблеми в діагностиці харчової непереносимості. Слід враховувати, що синтез специфічних Ig G і досягнення ними значних рівнів відбувається протягом декількох місяців. Якщо при цьому обстеження обмежується визначенням лише специфічних Ig E, які частіше знаходяться в межах норми, то пацієнти можуть доволі довго залишатися без вірно встановленого діагнозу, продовжуючи страждати від різноманітних неспецифічних симптомів.
Непереносимість харчових продуктів, зумовлена Ig G, проявляється широким спектром симптомів, а також розвитком ряду захворювань.
В огляді J.F. Geiselman та співавт. (2019) описується зв’язок між харчовою непереносимістю, зумовленою Ig G, та головним болем при мігрені. N. Mitchell та співавт. (2011) встановили, що виключення з раціону харчових продуктів, до яких були виявлені специфічні Ig G, у пацієнтів із мігренозним головним болем впливає на клінічний перебіг захворювання. У пацієнтів, що дотримувалися елімінаційної дієти, кількість нападів головного болю зменшилася на 23% за 4 тижні.
Існує ряд досліджень, що показують зв’язок між рівнем специфічних Ig G і виразністю проявів синдрому подразненого кишшечнику (СПК; S. Zar et al., 2005; H. Guo et al., 2012). Було виявлено, що на розвиток і прогресування СПК впливають різні фактори, але спільним для більшості пацієнтів є покращення стану при зміні раціону харчування з урахуванням результатів обстеження на вміст специфічних Ig G. Зокрема, у роботі Hong Guo та співавт. наводяться дані про наявність специфічних Ig G до певних харчових продуктів у 50,7% пацієнтів із СПК (основна група), порівняно з 15,4% пацієнтів у групі контролю. Елімінаційна дієта, що була заснована на результатах виявлення специфічних Ig G, була призначена 35 пацієнтам із СПК протягом 12 тижнів. За результатами спостережень у пацієнтів основної групи виявили значне поліпшення клінічних симптомів СПК. На думку авторів, такий підхід мав значні терапевтичні й економічні переваги перед неконтрольованим прийомом симптоматичних препаратів і різноманітними необґрунтованими дієтами.
У досліджені Liu Jian та співавт. (2018) відмічено, що більшість пацієнтів із виразковим колітом (ВК) лікуються переважно лікарськими препаратами, проте важливим є і дотримання правильної дієти. У ході дослідження було встановлено переваги саме елімінаційної дієти на основі визначення рівнів Ig G, специфічних до харчових продуктів. У 71,3% пацієнтів, що дотримувалися вказаної дієти, зникли позакишкові прояви захворювання, зменшилася виразність кишкових проявів та покращилася якість життя.
Ran Tao та співавт. (2019) надають певну роль харчовій непереносимості у розвитку і перебігу депресивного синдрому у підлітків. Так, більше 80% пацієнтів із депресивними розладами скаржилися на тривалу харчову непереносимість, що лабораторно підтверджувалася підвищеним рівнем гістаміну та кількістю специфічних Ig G у сироватці крові.
Сьогодні є ряд робіт, що показують частоту харчової непереносимості багатьох продуктів (Q. Zeng et al., 2013). У дослідженні V. Priedite та співавт. (2014) у пацієнтів із кишковими розладами найчастіше відмічалися специфічні Ig G до яєць, пшениці, жита, молока та бананів. Рідше всього специфічні Ig G виявлялися до яблук, моркви, картоплі, томатів, а також до курятини, свинини та яловичини.
За даними Z. Shakoor та співавт. (2016), найчастіше Ig G-опосередкована харчова непереносимість виявлялася до горіхів, гороху, кукурудзи, пшениці, глютену, яєць та молока (рис. 1).
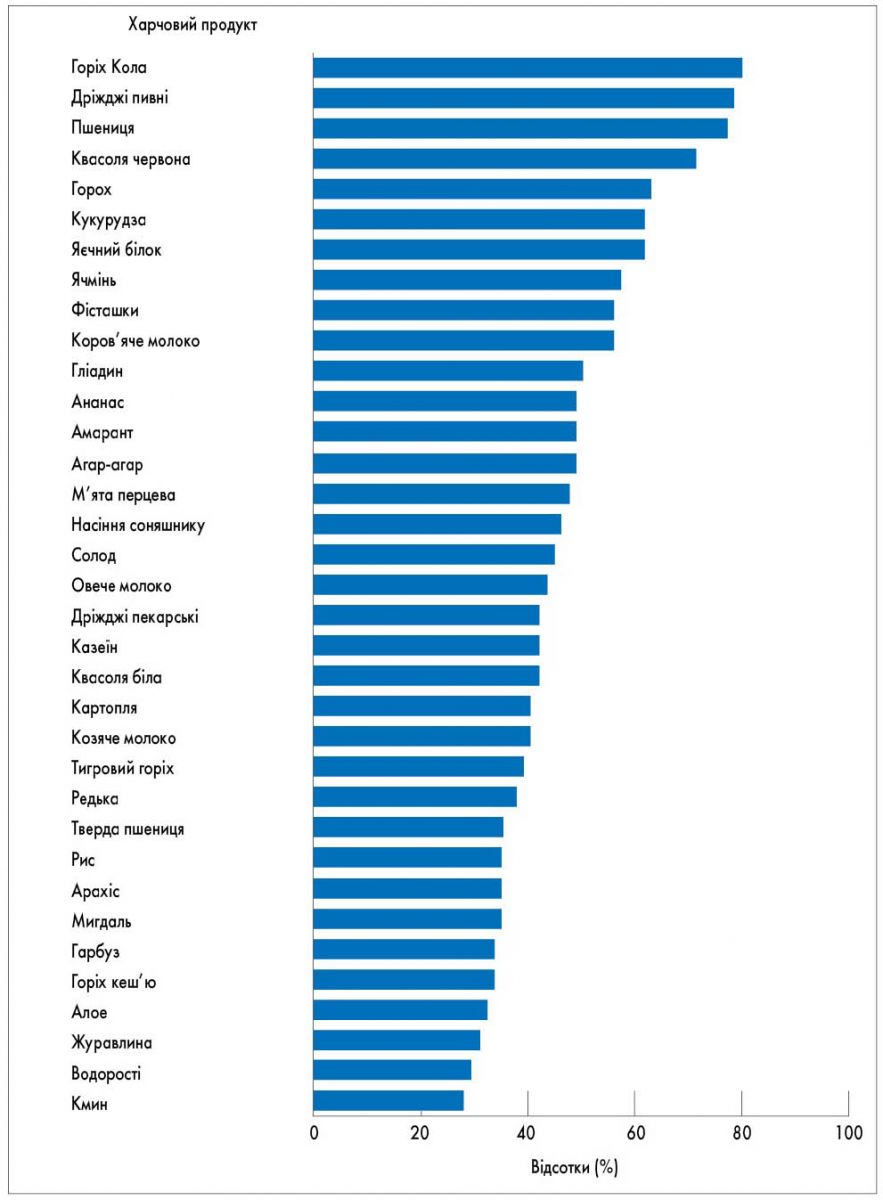 Рис. 1. Розподіл специфічних Ig G до харчових продуктів у пацієнтів із симптомами алергії (Z. Shakoor et al., 2016)
Рис. 1. Розподіл специфічних Ig G до харчових продуктів у пацієнтів із симптомами алергії (Z. Shakoor et al., 2016)
Нами був проведений аналіз рівнів специфічних Ig G у сироватці крові у 378 пацієнтів зі скаргами на тривалі порушення травлення, диспепсичні розлади, висипання на шкірі, що поєднувалися з відсутністю ефекту від традиційної протиалергічної терапії. Визначення специфічних Ig G проводилося методом ELISA (enzyme linked immunosorbent assay) – ферментний імуносорбентний аналіз FOX (Food Xplorer). Найчастіше нами визначалися підвищення рівнів Ig G, специфічних до наступних продуктів: яєчного білка – 319 (84,4%) пацієнтів, жовтка – 310 (82%) пацієнтів, ківі – 249 (65,9%) пацієнтів, м’якого сира – 233 (61,6%) пацієнта, моцарели – 229 (60,6%) пацієнтів, овечого молока – 225 (59,5%) пацієнтів, глютену – 224 (59,3%) пацієнта, часнику – 223 (59%) пацієнта, камамберу – 216 (57%) пацієнтів, гауди – 215 пацієнтів (56,9%), гірчиці – 209 пацієнтів (55,3%), коров’ячого молока – 213 пацієнтів (56,4%), пшениці – 192 пацієнта (50,8%), томатів – 191 пацієнт (50,5%), ікри – 189 (50%) пацієнтів (рис. 2). Рідше всього зустрічалися підвищені специфічні Ig G до груші, сливи, м’яти, апельсину, яблука, тунця, чаю, цибулі. Не зустрічалося підвищення специфічних Ig G до кави, винограду, грейпфрутів, кокосу, артишоку, алое, агар-агару.
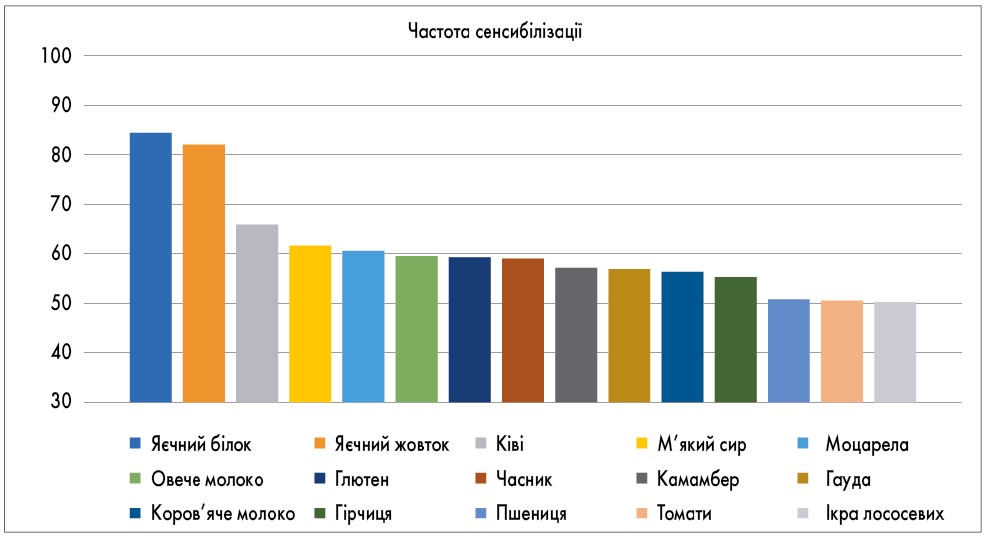 Рис. 2. Частота Ig G-опосередкованої сенсибілізації до харчових продуктів за даними FOX-діагностики
Рис. 2. Частота Ig G-опосередкованої сенсибілізації до харчових продуктів за даними FOX-діагностики
Враховуючи той факт, що Ig G4 синтезуються під час тривалого впливу антигенів, його визначення дозволяє контролювати ефективність алергенспецифічної імунотерапії (АСІТ; M. Akdis et al., 2014). При АСІТ відбувається регуляція рівнів Ig E та Ig G4, зменшення активності опасистих клітин та базофілів, зменшення кількості еозинофілів у тканинах, генерація регуляторних Т- і В-клітин замість ефекторних. При цьому важливим компонентом є IL-10-секретуючі клітини, які сприяють пригніченню ефекторних Т-клітин і селективній продукції Ig G4. Тобто продукція Ig G4 посідає одне з ключових місць у розвитку толерантності до алергенів, блокуючи зв’язування Ig E з алергенами.
Під час проведення АСІТ у пацієнтів відбувається зниження реакції на шкірні проби, що корелює з рівнями специфічних Ig E та Ig G. Як показано на рис. 3, на ранньому етапі (до 6-го місяця лікування) відбувається наростання титрів специфічних Ig E, після чого розпочинається зворотній процес. Специфічні Ig G4 у незначній кількості починають продукуватися вже на ранньому етапі АСІТ, досягаючи максимальних показників через 3-5 років. Разом зі змінами в рівнях Ig E/Ig G4 відбувається зменшення продукції опасистих клітин та еозинофілів із пригніченням вивільнення їх медіаторів. Це супроводжується зниженням реактивності шкірних проб.
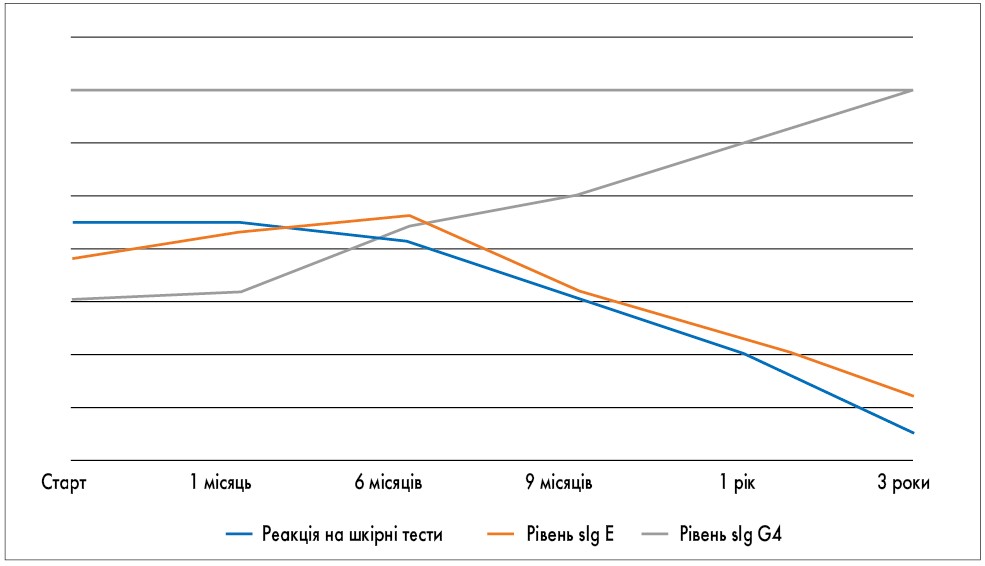 Рис. 3. Імунологічні зміни під час проведення АСІТ (M. Akdis et al., 2014)
Рис. 3. Імунологічні зміни під час проведення АСІТ (M. Akdis et al., 2014)
Після проведення АСІТ рівень Ig G4 у сироватці може підвищитися в 10-100 разів, при цьому поява Ig G4 збігається з розвитком толерантності (M. Akdis et al., 2014). Механізм розвитку толерантності до алергенів зумовлений особливостями Ig G4, а саме – високою спорідненістю до алергенів; нездатністю активовувати алергічний процес при зв’язуванні з алергеном; високою спорідненістю до інгібуючого рецептору FcγRIIb, розміщеного на ефекторних клітинах і антигенпрезентуючих клітинах; інгібуванням Ig E-опосередкованої презентації алергену шляхом прямої конкуренції. Разом ці особливості призводять до зниження вироблення Ig E, внаслідок чого протидіють алергічному запаленню та підтримують специфічну імунну толерантність до алергенів.
На даний момент більшість досліджень, пов’язаних із Ig G4, ставлять за мету вивчити динаміку імунологічних показників у хворих на Ig E-залежні захворювання, що отримують АСІТ. Це важливо для визначення ключових факторів, які дозволять прогнозовувати та оцінювати ефективність АСІТ на ранніх етапах.
У крос-секційному дослідженні M.H. Shamji та співавт. (2019) було встановлено тісний кореляційний зв’язок між рівнем Ig G4 та виразністю клінічних проявів алергії у пацієнтів, що отримували АСІТ. Для виявлення зв’язку вивчався матеріал із носових ходів та кров протягом сезону цвітіння трав у пацієнтів, що отримували АСІТ, та у двох контрольних групах. В одній із контрольних груп були пацієнти без ознак алергії, а в іншій – хворі з неконтрольованим сезонним алергічним ринітом (САР). Оцінка стану пацієнтів проводилася за допомогою спеціальних анкет та опитувальників (Rhinoconjunctivitis total symptom scores та Rhinoconjunctivitis Quality of Life Questionnaire). Результати показали, що рівні специфічних Ig E у назальному секреті та крові до Phl p 1 та Phl p 5 були вищими у пацієнтів із САР, які не отримували лікування, порівняно з групою контролю (р<0,001) та пацієнтами, які отримували АСІТ (р<0,001). Рівень назального Ig G4 був вищим у групі АСІТ порівняно з групою, що не отримувала лікування. Симптоми САР, що оцінювалися за допомогою анкет RTSS та RQLQ, були значно менш виражені в групі АСІТ порівняно з контрольними групами (р=0,009) і знижувалися в міру наростання титрів Ig G4.
Qiuju Huang та співавт. (2020) встановили зв’язок між ефективністю сублінгвальної АСІТ та рівнями Ig G4 у пацієнтів із алергічним ринітом, викликаним сенсибілізацією до кліщів домашнього пилу. Рівні специфічних Ig E та специфічних Ig G4 вивчалися до початку лікування, а також на шостому, дванадцятому та вісімнадцятому місяцях. Ефективність лікування оцінювалася за допомогою анкет, які фіксували зміни вираженості клінічних симптомів. Було встановлено, що сублінгвальна імунотерапія до Dermatophagoides Farinae є ефективною і значно підвищує експресію специфічних Ig G4 у пацієнтів із алергічним ринітом. Паралельно з підвищенням рівня Ig G4 покращувався стан пацієнтів, зменшувалася виразність клінічних симптомів та продовжувалася ремісія. Автори прогнозують, що найближчим часом оцінка специфічних Ig G4 стане розповсюдженим імунологічним методом для об’єктивної оцінки клінічної ефективності АСІТ.
Перспективним напрямком лікування алергічних захворювань, за неефективності АСІТ, є застосування моноклональних специфічних Ig G антитіл. У роботі Shamjі та співавт. (2021) встановлено, що одноразове застосування препарату моноклональних Ig G, нейтралізуючих специфічні Ig E до Fel d 1, призвело до зниження вираженості клінічних проявів алергії. Відмічалося, що моноклональні антитіла до Fel d 1 пригнічують зв’язування комплексу алерген-Ig E із В-клітинами, попереджуючи розвиток алергічних реакцій. Пацієнти, що отримували моноклональні антитіла, також мали значно меншу кількість цитокінів у сироватці крові і нижчі рівні маркерів запалення. Отримані результати підтверджують гіпотезу, що зміна співвідношення Ig G/Ig E відіграє значну роль у десенсибілізації пацієнтів.
Є дані, що високий рівень специфічних Ig G4 у матерів пов’язаний зі зниженням ризику розвитку алергії в їхніх дітей. Такі припущення були описані різними групами вчених протягом останніх кількох десятиліть.
Christian Lupinek та його колеги встановили (2019), що високі рівні Ig G4 у плазмі матері, грудному молоці і пуповинній крові можуть захищати їхніх дітей від розвитку сенсибілізації. У дослідженні вивчалися біологічні матеріали жінок до та після пологів та зразки плазми в їхніх дітей через 6, 12 та 60 місяців після народження. На першому етапі дослідження у матерів досліджували наявність специфічних Ig G до 164 алергенів. На другому етапі визначали наявність сенсибілізації за рахунок визначення специфічних до алергенів Ig E у дітей при досягненні ними 5-річного віку. Отримані результати дослідження свідчили, що у дітей, народжених у матерів із підвищеним рівнем у плазмі крові специфічних Ig G проти певного алергену, не відмічалися Ig E-опосередковані сенсибілізації проти цього алергену в 5-річному віці. Ці дані вказують на перспективу розробки нових методів профілактики алергії, аналогічних профілактичній імунізації при резус-конфлікті, яка існує сьогодні.
Отже, Ig G є антитілом із унікальними біологічними властивостями, яке відіграє важливу роль у механізмах виникнення і перебігу алергічних захворювань, внаслідок чого має великий діагностичний потенціал. Незважаючи на докази участі специфічних Ig G у розвитку харчової непереносимості, молекулярні основи цього процесу залишаються до кінця не вивченими. Також існують певні питання з приводу реалізації захисного ефекту Ig G4 при алергічних реакціях. Виходячи з цього, існує потреба в подальших дослідженнях для впровадження цих видів діагностики в широку клінічну практику.
Список літератури знаходиться в редакції.
Тематичний номер «Педіатрія» № 1 (62)-2 (63) 2022 р.