17 липня, 2015
Персоналізована медицина: фармакогенетика, фармакогеноміка, тераностика

 Ідея персоналізації (від лат. persona – особистість), тобто розуміння необхідності індивідуального підходу до кожного пацієнта, існувала ще з самого початку розвитку медицини. До сьогодні персоналізація полягала у призначенні пацієнтові «правильних», тобто потрібних саме йому лікарських засобів (ЛЗ) у правильних дозах [1].
Ідея персоналізації (від лат. persona – особистість), тобто розуміння необхідності індивідуального підходу до кожного пацієнта, існувала ще з самого початку розвитку медицини. До сьогодні персоналізація полягала у призначенні пацієнтові «правильних», тобто потрібних саме йому лікарських засобів (ЛЗ) у правильних дозах [1].
Потреба у переході на нову парадигму зумовлена тим, що традиційні ЛЗ, які виготовлялися для лікування конкретного захворювання, інколи виявляються неефективними, при цьому відмічається висока частота виникнення побічних ефектів [2].
Так, статистичні показники безуспішного застосування стандартних фармакотерапевтичних схем становлять 30-60% для лікування мігрені, 10-75% – артеріальної гіпертензії, 20-70% – виразкової хвороби, 40-75% – бронхіальної астми, 5-75% – цукрового діабету, 70-100% – онкологічної патології, 20-40% – депресії, 25-75% шизофренії [3]. Причини цього полягають у генетичних особливостях пацієнтів, які впливають на метаболізм ЛЗ або знижують чутливість до них рецепторів.
За результатами досліджень, несприятливі побічні реакції (НПР) на ЛЗ у США посідають 5-те місце серед причин смерті [4]. При цьому >2 млн випадків НПР на рік потребують госпіталізації, серед яких близько 100 тис. призводять до смерті. Вартість лікування НПР становить 78-117 блн доларів на рік, що перевищує щорічну вартість усіх витрат на лікування. У 30% випадків НПР стають причиною тривалої і стійкої непрацездатності або смерті, щорічно 26 тис. дітей помирають унаслідок виникнення НПР. У Великій Британії НПР на прийом ЛЗ становлять 7% усіх госпіталізацій у стаціонар і в середньому спостерігаються у 15% (11-22%) госпіталізованих пацієнтів. Це є приводом для формування національної мережі лікарської безпеки, в основу створення якої лягла гіпотеза, що значну частину тяжких випадків НПР викликають спадково детерміновані відмінності метаболізму.
У 2003 р. після реалізації проекту «Геном людини» важливу роль у розробці персоналізованих підходів до лікування виконують фармакогенетика та фармакогеноміка, які вивчають характер реакцій організму на ЛЗ залежно від спадкових факторів.
Це свідчить про те, що навіть незначні індивідуальні відмінності у ДНК двох пацієнтів можуть привести до того, що один ЛЗ буде діяти на них абсолютно по-різному [5]. Фармакогенетика пов’язує виникнення експресії конкретного гена або однонуклеотидного поліморфізму в геномі людини з ефективністю або токсичністю ЛЗ. З клінічної точки зору йдеться про те, щоб за допомогою генного аналізу встановити, чи варто взагалі приймати той чи інший ЛЗ. Наприклад, реакція на сальбутамол у пацієнтів із бронхіальною астмою залежить від поліморфізму Arg16Gly гена β2-адренорецепторів: у пацієнтів, гомозиготних за Arg16, більш виражена бронходилатаційна відповідь, ніж у гомозигот за Gly16 [6]. У хворих на артеріальну гіпертензію із генотипом I інтрону 16 гена ангіотензинперетворюючого ферменту незалежно від призначеного препарату (ірбесартан vs атенолол) відмічається більш суттєве зниження діастолічного артеріального тиску, ніж у пацієнтів із алелем D. У пацієнтів, які приймали ірбесартан, гомозиготний стан за ІІ був пов’язаний із більш суттєвим зниженням діастолічного артеріального тиску [7].
Фармакогеноміка займається пошуком нових ЛЗ з урахуванням знань про структуру геному людини. Генетична або геномна інформація може бути надзвичайно важливою у прийнятті рішень, чи є пацієнт хорошим кандидатом для застосування конкретного препарату.
Відомо, що персоналізована медицина (ПМ) – це цільова діагностика (геномна, протеомна, метаболомна, транскриптомна) і лікування (індивідуально орієнтовані впливи, у т. ч. клітинна терапія) хворого відповідно до результатів дослідження його генетичного профілю, яка робить фармакотерапію у пацієнтів максимально ефективною, безпечною та доступною [8].
При цьому відбувається поєднання діагностики, лікування та моніторингу результатів терапії [9]. З’явився новий підхід до одночасної діагностики і лікування окремих пацієнтів – тераностика (від грец. thera(peia) – турбота, догляд, лікування; (diag)nostikos – здатний розпізнавати), який полягає у перевірці пацієнтів щодо наявності можливих реакцій на застосування нових ЛЗ та формуванні способу лікування, ґрунтуючись на результатах тестування.
Протягом останніх років значення генетичних факторів у ПМ взагалі не враховується, активно вивчається роль інших індивідуальних чинників (у т. ч. психологічних), тобто ПМ об’єднує індивідуальну генетичну та іншу інформацію для прийняття рішення про попередження і лікування системних порушень [10, 11] у кожному конкретному клінічному випадку. Остаточні рішення щодо лікування приймаються не лише на основі результатів генетичного або геномного тесту [12], а й з урахуванням інформації щодо супутньої патології, ЛЗ, які застосовуються для її лікування, комплаєнсу пацієнта тощо. Це і сприяло формулюванню сучасного визначення: «ПМ – це модель організації медичної допомоги, яка базується на виборі діагностичних, лікувальних та профілактичних засобів з урахуванням генетичних, фізіологічних, біохімічних та інших особливостей пацієнта» [13].
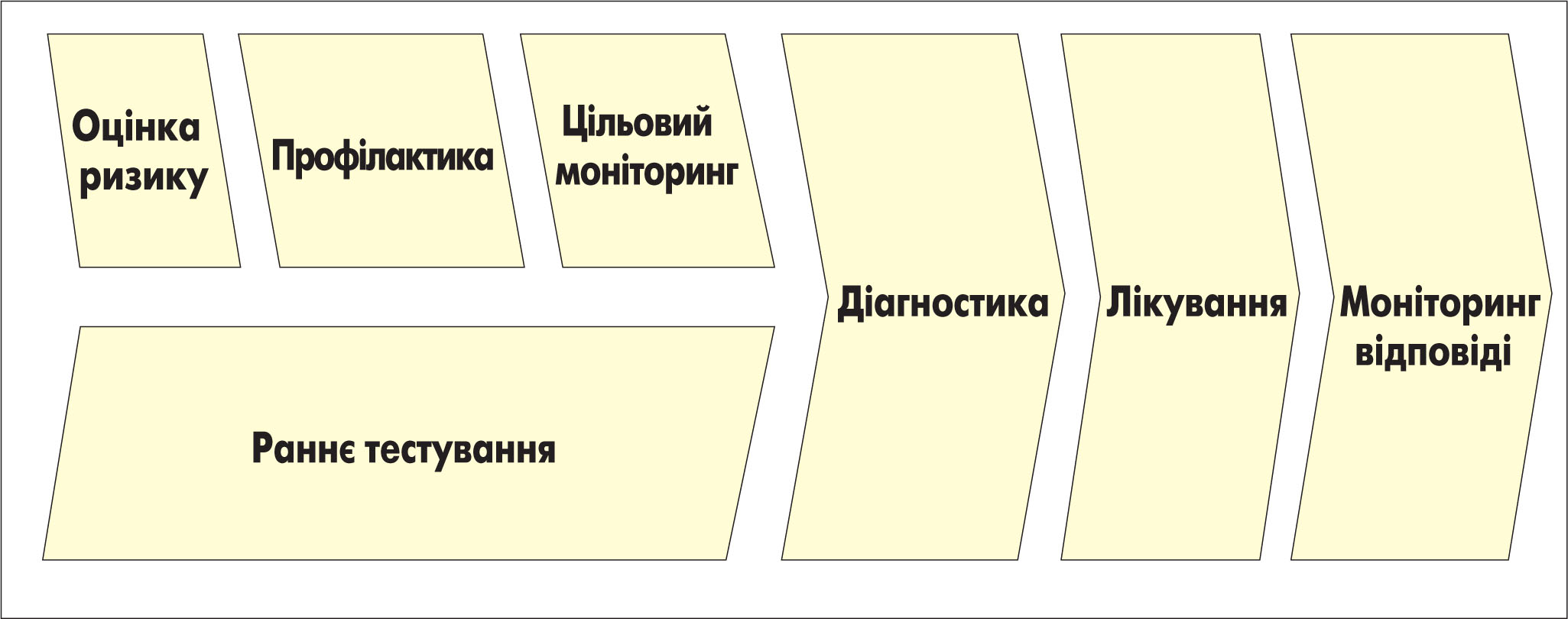
На рисунку схематично зображена сучасна парадигма ПМ. Для обстеження осіб груп високого ризику застосовуються скринінгові методи (мамографія, колоноскопія тощо), які доповнюються новими тестами (у т. ч. визначення генних мутацій). Первинна профілактика дає можливість здійснювати заходи для зниження ризику виникнення хвороби. Цільовий моніторинг полягає у зміні частоти обстежень (наприклад, жінкам із варіаціями в генах BRCA1 і BRCA2 необхідно частіше проводити мамографію).
Діагностика відповідно до цієї парадигми включає визначення генетичного підтипу. Нові молекулярні методи дають змогу краще оцінити прогноз і прийняти більш обґрунтовані рішення щодо лікування. Нові молекулярні інструменти дозволяють отримати інформацію щодо того, на який ЛЗ пацієнт краще відреагує.
На сьогодні існує кілька способів швидкого проспективного клінічного генотипування (результат отримується протягом 24 год). Способи досягнення мети різні: призначення альтернативного препарату, зміна дози ЛЗ, який зазвичай використовується, посилення моніторингу пацієнтів груп ризику щодо розвитку НПР, превентивні заходи (прийом антидотів проти продуктів обміну ЛЗ, що викликають тяжкі НПР).
Накопичено досвід персоналізованого підходу в клінічній практиці, зокрема у фармакотерапії онкологічних захворювань, артеріальної гіпертензії, лікуванні цукрового діабету, низки генетично зумовлених хвороб, застосуванні дієтотерапії тощо. Наприклад, пацієнт страждає на захворювання, яке спричинене певною рідкісною мутацією в генах. Інший випадок: хворі – носії рідкісних генетичних мутацій можуть не переносити лікарські препарати, які підходять більшості пацієнтів (ідіосинкразія). Тому у таких ситуаціях велике значення має ПМ, яка забезпечує вибір необхідних препаратів, які будуть ефективними лише у разі цієї мутації.
ПМ має широкі можливості у сфері розробки індивідуальної моделі хвороби, вибіркової доставки лікарських препаратів за допомогою нанотранспортерів та використання методів генної хірургії.
Фармакоекономічний аспект застосування ПМ також має велике значення. Так, відомо, що прихильність до лікування статинами з метою зниження рівня холестерину в крові є важливим елементом у попередженні розвитку повторного гострого коронарного синдрому. Однак пацієнти часто ігнорують призначення лікаря, оскільки для досягнення бажаного ефекту потрібно досить багато часу. У цьому разі дуже важливі системи дистанційного моніторингу (вартість – 1,2 тис. євро на рік), що забезпечують розсилку автоматичних нагадувань та оповіщень медичним співробітникам у випадку, якщо у хворого виникає ризик розвитку повторного гострого коронарного синдрому. При цьому у 2,5 рази збільшується кількість пацієнтів, яким вдалося уникнути розвитку гострого коронарного синдрому, зменшується кількість госпіталізацій на 10% і відмічається подвоєння комплаєнсу (вихідний рівень – 34%), що суттєво знижує вартість лікування [14].
Фармацевтичні компанії запроваджують у практику тести, які позначаються загальним терміном «супутня діагностика» (companion diagnostics) – методи і медичні пристрої, які допомагають лікарю в прийнятті рішення щодо того, чи підходить препарат конкретному пацієнту і в яких дозах його призначати [15]. Супутня діагностика стає невід’ємною умовою безпечного та ефективного застосування ЛЗ, і кожен такий тест має поєднуватися із використанням конкретного ЛЗ. Вони можуть застосовуватися ще на етапі клінічного дослідження нового ЛЗ, оскільки дають змогу відібрати для випробувань тих учасників, які дійсно підходять за своїм генотипом і можуть отримати користь від лікування.
Крім того, виникає можливість відразу виключити пацієнтів, у яких застосування нового препарату може бути небезпечним. Наприклад, Управління з контролю якості продуктів харчування та лікарських засобів США (Food and Drug Administration, FDA) схвалило генетичний тест для супутньої діагностики, який допомагає відібрати пацієнтів із метастатичним колоректальним раком, яким рекомендоване лікування препаратом Vectibix. Тест ідентифікує 7 мутацій у гені KRAS із пухлинних клітин хворого. Якщо в пухлині наявна мутація гена KRAS, то препарат Vectibix буде неефективним.
Отже, персоналізована медицина – це нова галузь сучасної медицини, яка сприяє розробці і використанню методів лікування, створених спеціально для застосування у конкретного пацієнта.
Напрями реалізації положень ПМ у сучасних умовах: перехід від традиційної клінічної до персоналізованої діагностики захворювання з урахуванням індивідуальних особливостей пацієнта, у т. ч. використання біомаркерів різної молекулярної природи з подальшим збереженням біологічного матеріалу протягом усього його життя; передбачення на основі геномних даних імовірності виникнення того чи іншого захворювання з розробкою профілактичної індивідуальної схеми; ідентифікація потенційних фармакотерапевтичних мішеней для селективного впливу вже на початковій стадії патологічного процесу; вибір тактики лікування з урахуванням індивідуальних особливостей пацієнта; моніторинг лікування за допомогою біомаркерів.
Нові технології дають можливість виявити причини виникнення НПР на генетичному рівні, запобігти їх розвитку, знизити витрати на лікування та суттєво підвищити безпеку терапії. Саме реалізація цих підходів у довгостроковій перспективі сприятиме значній економії коштів.
Список літератури знаходиться в редакції.