28 квітня, 2016
Oсобенности оказания хирургической помощи пострадавшим с травмой мирного времени

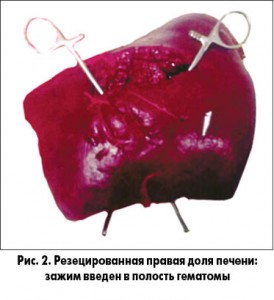
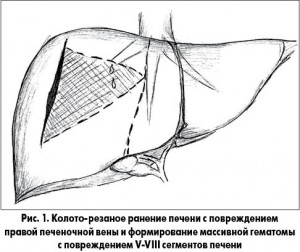 Выполнение анатомической резекции печени начинали с выделения и перевязки портальных долевых структур, после чего аккуратно мобилизовали соответствующую печеночную вену (правую или левую) в месте ее впадения в нижнюю полую вену, прошивали и перевязывали ее. Далее использовали Pringle-маневр в режиме «15 мин пережатия – 5 мин перерыв»; выполняли диссекцию паренхимы печени, используя метод clamp-crush. Трубчатые структуры печени тщательно выделяли, клипировали либо перевязывали. Гемостаз резекционной поверхности выполнялся с помощью биполярной или аргоноплазменной коагуляции. Использование подобной техники позволяло максимально быстро достичь хирургического гемостаза у пострадавших и выполнить диссекцию паренхимы с минимальной кровопотерей (рис. 2).
Выполнение анатомической резекции печени начинали с выделения и перевязки портальных долевых структур, после чего аккуратно мобилизовали соответствующую печеночную вену (правую или левую) в месте ее впадения в нижнюю полую вену, прошивали и перевязывали ее. Далее использовали Pringle-маневр в режиме «15 мин пережатия – 5 мин перерыв»; выполняли диссекцию паренхимы печени, используя метод clamp-crush. Трубчатые структуры печени тщательно выделяли, клипировали либо перевязывали. Гемостаз резекционной поверхности выполнялся с помощью биполярной или аргоноплазменной коагуляции. Использование подобной техники позволяло максимально быстро достичь хирургического гемостаза у пострадавших и выполнить диссекцию паренхимы с минимальной кровопотерей (рис. 2).
 Повреждение селезенки выявлено у 15 пострадавших. Из них спленэктомия выполнена 9 пациентам (60%), резекция селезенки – 2 (13,3%), ушивание ран селезенки – 4 (26,7%). Спленэктомия была показана всем пострадавшим с массивной травмой селезенки (размозжение, множественные разрывы или ранения). При этом необходимым условием считали удаление полностью всего органа при визуальном контроле. Неполное удаление органа, по нашему мнению, является предпосылкой рецидива кровотечения в послеоперационном периоде, формирования гематомы либо абсцесса в левом поддиафрагмальном пространстве. Обязательное условие выполнения органосохраняющих вмешательств – наличие современных средств диссекции тканей и гемостаза (ультразвуковой, водо- и пневмоструйный диссектор, аргоноплазменный коагулятор, радиочастотный аблятор и др.) и современного шовного материала. При этом резекцию органа выполняли при преимущественном повреждении одного из полюсов селезенки при условии адекватного кровоснабжения остающейся части органа и тщательном хирургическом гемостазе. Ушивание ран селезенки считали возможным при наличии единичных неглубоких повреждений либо разрывов органа протяженностью до 2 см.
Повреждения поджелудочной железы выявлены у 7 пострадавших. При этом ушивание ран или разрывов этого органа выполнено 4 пациентам (57%). В 1 случае (14,4%) при глубоком разрыве поджелудочной железы с повреждением главного панкреатического протока было выполнено антеградное дренирование протока с ушиванием раны поджелудочной железы на дренаже. Еще 2 пациентам (28,6%) выполнена дистальная резекция поджелудочной железы со спленэктомией при значительном разрушении хвоста железы в результате дорожной травмы (1 случай) и при колото-резаном ранении (1 случай).
Повреждение желудка было выявлено у 6 пострадавших. При этом ранение передней стенки выявлено у 3 пациентов, сквозное ранение с повреждением задней стенки – у 1, задней стенки и поджелудочной железы – у 2. Всем больным выполнено ушивание ран желудка. При ранении желудка считаем необходимым вскрытие сальниковой сумки (?) через желудочно-ободочную связку и ревизию задней стенки желудка и поджелудочной железы в связи с частыми «пропущенными» повреждениями указанных структур. Во всех случаях считаем обязательным трансназальную установку зонда в двенадцатиперстную кишку для декомпрессии желудка.
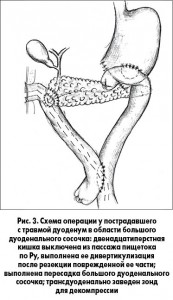
Одну из сложных задач хирургии повреждений представляют травмы двенадцатиперстной кишки, выявленные нами у 7 пострадавших. При этом наиболее опасными являются массивные повреждения, расположенные в зоне большого дуоденального сосочка. При травмах передней стенки двенадцатиперстной кишки (разрывы и раны), выявленной нами у 3 пострадавших (42,9%), использовали широкую мобилизацию кишки по Кохеру, ушивали ранения в поперечном направлении, выполняли ревизию ее задней стенки, нижней полой вены и головки поджелудочной железы. У 2 пациентов были выявлены ранения задней стенки, сочетавшиеся в 1 случае с ранением нижней полой вены, – выполнено ее ушивание обвивным швом. Необходимо отметить, что анатомо-физиологические особенности дуоденум определяют ее постоянное функциональное напряжение: с одной стороны пассаж пищи и желудочного сока из желудка и поступление желчи и панкреатического сока, а с другой – активация протеаз в просвете кишки. Эти факторы обусловливают высокий риск несостоятельности швов стенки двенадцатиперстной кишки в условиях массивной травмы. В случае тяжелого состояния пациента и массивного повреждения двенадцатиперстной кишки у 1 больного была сформирована холецистостома, ушиты раны кишки и в желудок трансназально установлен зонд для активной аспирации желудочного сока. Еще у 1 пациента с повреждением дуоденум в зоне большого дуоденального сосочка выполнена резекция поврежденной части двенадцатиперстной кишки с пересадкой большого дуоденального сосочка, дивертикулизацией кишки и ее выключением по Ру с формированием гастроэнтероанастомоза. Трансдуоденально в тонкую кишку был заведен зонд для декомпрессии (рис. 3).
Повреждение селезенки выявлено у 15 пострадавших. Из них спленэктомия выполнена 9 пациентам (60%), резекция селезенки – 2 (13,3%), ушивание ран селезенки – 4 (26,7%). Спленэктомия была показана всем пострадавшим с массивной травмой селезенки (размозжение, множественные разрывы или ранения). При этом необходимым условием считали удаление полностью всего органа при визуальном контроле. Неполное удаление органа, по нашему мнению, является предпосылкой рецидива кровотечения в послеоперационном периоде, формирования гематомы либо абсцесса в левом поддиафрагмальном пространстве. Обязательное условие выполнения органосохраняющих вмешательств – наличие современных средств диссекции тканей и гемостаза (ультразвуковой, водо- и пневмоструйный диссектор, аргоноплазменный коагулятор, радиочастотный аблятор и др.) и современного шовного материала. При этом резекцию органа выполняли при преимущественном повреждении одного из полюсов селезенки при условии адекватного кровоснабжения остающейся части органа и тщательном хирургическом гемостазе. Ушивание ран селезенки считали возможным при наличии единичных неглубоких повреждений либо разрывов органа протяженностью до 2 см.
Повреждения поджелудочной железы выявлены у 7 пострадавших. При этом ушивание ран или разрывов этого органа выполнено 4 пациентам (57%). В 1 случае (14,4%) при глубоком разрыве поджелудочной железы с повреждением главного панкреатического протока было выполнено антеградное дренирование протока с ушиванием раны поджелудочной железы на дренаже. Еще 2 пациентам (28,6%) выполнена дистальная резекция поджелудочной железы со спленэктомией при значительном разрушении хвоста железы в результате дорожной травмы (1 случай) и при колото-резаном ранении (1 случай).
Повреждение желудка было выявлено у 6 пострадавших. При этом ранение передней стенки выявлено у 3 пациентов, сквозное ранение с повреждением задней стенки – у 1, задней стенки и поджелудочной железы – у 2. Всем больным выполнено ушивание ран желудка. При ранении желудка считаем необходимым вскрытие сальниковой сумки (?) через желудочно-ободочную связку и ревизию задней стенки желудка и поджелудочной железы в связи с частыми «пропущенными» повреждениями указанных структур. Во всех случаях считаем обязательным трансназальную установку зонда в двенадцатиперстную кишку для декомпрессии желудка.
Одну из сложных задач хирургии повреждений представляют травмы двенадцатиперстной кишки, выявленные нами у 7 пострадавших. При этом наиболее опасными являются массивные повреждения, расположенные в зоне большого дуоденального сосочка. При травмах передней стенки двенадцатиперстной кишки (разрывы и раны), выявленной нами у 3 пострадавших (42,9%), использовали широкую мобилизацию кишки по Кохеру, ушивали ранения в поперечном направлении, выполняли ревизию ее задней стенки, нижней полой вены и головки поджелудочной железы. У 2 пациентов были выявлены ранения задней стенки, сочетавшиеся в 1 случае с ранением нижней полой вены, – выполнено ее ушивание обвивным швом. Необходимо отметить, что анатомо-физиологические особенности дуоденум определяют ее постоянное функциональное напряжение: с одной стороны пассаж пищи и желудочного сока из желудка и поступление желчи и панкреатического сока, а с другой – активация протеаз в просвете кишки. Эти факторы обусловливают высокий риск несостоятельности швов стенки двенадцатиперстной кишки в условиях массивной травмы. В случае тяжелого состояния пациента и массивного повреждения двенадцатиперстной кишки у 1 больного была сформирована холецистостома, ушиты раны кишки и в желудок трансназально установлен зонд для активной аспирации желудочного сока. Еще у 1 пациента с повреждением дуоденум в зоне большого дуоденального сосочка выполнена резекция поврежденной части двенадцатиперстной кишки с пересадкой большого дуоденального сосочка, дивертикулизацией кишки и ее выключением по Ру с формированием гастроэнтероанастомоза. Трансдуоденально в тонкую кишку был заведен зонд для декомпрессии (рис. 3).
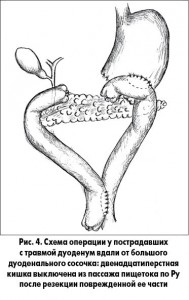
 Двум больным с массивным повреждением дуоденум вдали от Фатерова сосочка выполнена резекция поврежденной части двенадцатиперстной кишки с ее выключением по Ру и формированием гастроэнтероанастомоза (рис. 4).
Двум больным с массивным повреждением дуоденум вдали от Фатерова сосочка выполнена резекция поврежденной части двенадцатиперстной кишки с ее выключением по Ру и формированием гастроэнтероанастомоза (рис. 4).
 В подобных ситуациях считаем обязательным выключение двенадцатиперстной кишки по Ру для обеспечения функционального покоя дуоденум и повышения надежности герметичности швов кишки.
Повреждения тонкой и толстой кишки были выявлены в 28 и 16 случаях соответственно. Ушивание ранений тонкой кишки выполнено у 15 пострадавших (53,6%). Резекция тонкой кишки проведена 13 пострадавшим (46,4%). При этом первичный анастомоз сформирован у 8 пациентов (61,5%). В случае тяжелого состояния пациента выполнялась резекция тонкой кишки с формированием энтеростомы у 5 пострадавших (38,5%). При локализации повреждений в терминальном отделе тонкой кишки, по нашему мнению, следует обязательно выполнять интубацию тонкой кишки через аппендикоцеко- или цекостому для профилактики несостоятельности швов, что было выполнено 6 пострадавшим с повреждениями тонкой кишки (21,4%). Также интубацию тонкой кишки считаем показанной при множественных повреждениях, выявленных у 3 пострадавших (10,7%).
В случае выявления единичных повреждений толстой кишки выполнено их ушивание у 12 пострадавших (75%). Резекцию различных сегментов толстой кишки проводили при наличии множественных ран в пределах одного сегмента либо размозжения кишечной стенки, что было выявлено у 3 (18,8%) и 1 (6,2%) пострадавшего соответственно. У всех пациентов операция завершилась формированием колостомы.
В случае сочетанной торакоабдоминальной травмы показаны различные вмешательства на органах грудной клетки. У 2 пациентов выполнено дренирование плевральной полости по Бюлау, нижняя лобэктомия (1 случай) и ушивание ранения передней стенки левого желудочка (1 случай). В случае сопутствующей скелетной травмы выполнен экстра- и интрамедуллярный остеосинтез 7 пострадавшим: бедренной кости – 2, большеберцовой – 4, плечевой – 1. Нефрэктомия справа была выполнена 1 пострадавшему с сочетанной травмой, полученной в результате огнестрельного ранения.
Результаты
Тактика damage control применялась у 32 пострадавших (38,1%). При этом первый этап лечения оказался эффективным у 28 пациентов (87,5%). Из них у 25 (89,3%) удалось достичь стабилизации состояния на втором этапе, что позволило в срок от 24 до 48 часов выполнить окончательную коррекцию повреждений на третьем этапе лечения.
Ранние послеоперационные осложнения были выявлены у 38 пострадавших (45,2%) (табл. 1).
В подобных ситуациях считаем обязательным выключение двенадцатиперстной кишки по Ру для обеспечения функционального покоя дуоденум и повышения надежности герметичности швов кишки.
Повреждения тонкой и толстой кишки были выявлены в 28 и 16 случаях соответственно. Ушивание ранений тонкой кишки выполнено у 15 пострадавших (53,6%). Резекция тонкой кишки проведена 13 пострадавшим (46,4%). При этом первичный анастомоз сформирован у 8 пациентов (61,5%). В случае тяжелого состояния пациента выполнялась резекция тонкой кишки с формированием энтеростомы у 5 пострадавших (38,5%). При локализации повреждений в терминальном отделе тонкой кишки, по нашему мнению, следует обязательно выполнять интубацию тонкой кишки через аппендикоцеко- или цекостому для профилактики несостоятельности швов, что было выполнено 6 пострадавшим с повреждениями тонкой кишки (21,4%). Также интубацию тонкой кишки считаем показанной при множественных повреждениях, выявленных у 3 пострадавших (10,7%).
В случае выявления единичных повреждений толстой кишки выполнено их ушивание у 12 пострадавших (75%). Резекцию различных сегментов толстой кишки проводили при наличии множественных ран в пределах одного сегмента либо размозжения кишечной стенки, что было выявлено у 3 (18,8%) и 1 (6,2%) пострадавшего соответственно. У всех пациентов операция завершилась формированием колостомы.
В случае сочетанной торакоабдоминальной травмы показаны различные вмешательства на органах грудной клетки. У 2 пациентов выполнено дренирование плевральной полости по Бюлау, нижняя лобэктомия (1 случай) и ушивание ранения передней стенки левого желудочка (1 случай). В случае сопутствующей скелетной травмы выполнен экстра- и интрамедуллярный остеосинтез 7 пострадавшим: бедренной кости – 2, большеберцовой – 4, плечевой – 1. Нефрэктомия справа была выполнена 1 пострадавшему с сочетанной травмой, полученной в результате огнестрельного ранения.
Результаты
Тактика damage control применялась у 32 пострадавших (38,1%). При этом первый этап лечения оказался эффективным у 28 пациентов (87,5%). Из них у 25 (89,3%) удалось достичь стабилизации состояния на втором этапе, что позволило в срок от 24 до 48 часов выполнить окончательную коррекцию повреждений на третьем этапе лечения.
Ранние послеоперационные осложнения были выявлены у 38 пострадавших (45,2%) (табл. 1).
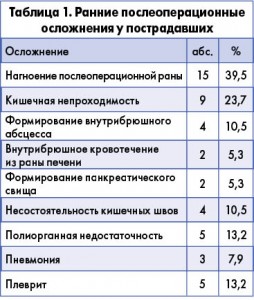 Наиболее часто наблюдались нагноение послеоперационной раны – 15 случаев (39,5%), кишечная непроходимость – 9 (23,7%), формирование внутрибрюшного абсцесса – 4 (10,5%), внутрибрюшное кровотечение из раны печени – 2 (5,3%), формирование панкреатического свища – 2 (5,3%), несостоятельность кишечных швов – 4 (10,5%), полиорганная недостаточность – 5 (13,2%), пневмония – 3 (7,9%), плеврит – 5 (13,2%). Таким образом, общее количество осложнений составило 49 – по 1,3 осложнения на одного пострадавшего.
Хирургическая коррекция в связи с возникшими осложнениями потребовалась 20 пострадавшим (52,6%). У 5 пациентов (55,6%) с ранней послеоперационной кишечной непроходимостью были выполнены релапаратомия, висцеролиз, интубация тонкой кишки. Из 4 пострадавших с внутрибрюшными абсцессами 3 выполнено дренирование абсцесса под ультразвуковой навигацией катетерами типа pig-tail, 1 – релапаротомия, вскрытие, санация и дренирование межпетельного абсцесса. Дополнительное ушивание раны печени с целью гемостаза выполнено 1 пострадавшему, еще 1 – атипичная резекция VI сегмента печени. 3 пострадавшим с несостоятельностью кишечных швов были выполнены резекция сегмента кишки с формированием энтеростомы, интубацией тонкой кишки через энтеростому, санация и дренирование брюшной полости. В 1 случае сформирован первичный тонко-тонкокишечный анастомоз в связи с ранней диагностикой возникшего осложнения и отсутствием выраженных признаков перитонита. У 5 пострадавших (33,3%) с нагноением послеоперационной раны потребовалось наложение вторичных швов на раны после их очищения.
Умер 21 пациент. У 7 пострадавших (33,3%) причиной летального исхода явилось коагулопатическое кровотечение, гипотермия и ацидоз вследствие массивной травмы. Полиорганная недостаточность стала причиной летального исхода у 8 больных (38,1%). Тромбоэмболия легочной артерии как причина смерти была выявлена у 3 пациентов (14,3%), острый инфаркт миокарда – у 2 (9,5%), пневмония – у 1 (4,8%). Общая летальность составила 25%.
Выводы
Таким образом, выбор объема хирургической помощи зависит от тяжести состояния пострадавших в момент поступления. Стабильное состояние пациента дает возможность выполнить одномоментную коррекцию всех повреждений. При тяжелом состоянии необходимо применять тактику damage control вне зависимости от уровня оказания медицинской помощи. Стабилизация состояния пострадавшего на фоне интенсивной терапии позволяет в дальнейшем проводить различные по объему хирургические вмешательства.
При травме паренхиматозных органов первоочередной задачей является остановка кровотечения. После стабилизации состояния возможны резекционные вмешательства на печени. При этом могут быть выполнены атипичные либо обширные анатомические резекции. Необходимое условие – адекватное анестезиологическое обеспечение и слаженность работы хирургической бригады, имеющей опыт плановых хирургических вмешательств на печени.
Отсутствие современных инструментальных методов гемостаза и диссекции тканей, а также шовного материала диктуют необходимость выполнения спленэктомии во всех случаях во избежание рецидивного массивного внутрибрюшного кровотечения. В ином случае возможно выполнение органосохраняющих вмешательств.
В случае значительного повреждения двенадцатиперстной кишки считаем необходимым ее выключение из пассажа пищетока по Ру. При повреждениях в зоне большого дуоденального сосочка показана его пересадка и дивертикулизация дуоденум для адекватной декомпрессии двенадцатиперстной кишки с целью профилактики несостоятельности кишечных швов.
Множественные повреждения тонкой кишки являются показанием для интубации тонкой кишки, при этом в случае локализации повреждений в области ее илеоцекального сегмента интубацию необходимо выполнять через аппендикоцеко- либо цекостому. Использование подобной тактики позволило достичь снижения летальности до 25% у данной категории тяжелых пациентов.
Литература
Наиболее часто наблюдались нагноение послеоперационной раны – 15 случаев (39,5%), кишечная непроходимость – 9 (23,7%), формирование внутрибрюшного абсцесса – 4 (10,5%), внутрибрюшное кровотечение из раны печени – 2 (5,3%), формирование панкреатического свища – 2 (5,3%), несостоятельность кишечных швов – 4 (10,5%), полиорганная недостаточность – 5 (13,2%), пневмония – 3 (7,9%), плеврит – 5 (13,2%). Таким образом, общее количество осложнений составило 49 – по 1,3 осложнения на одного пострадавшего.
Хирургическая коррекция в связи с возникшими осложнениями потребовалась 20 пострадавшим (52,6%). У 5 пациентов (55,6%) с ранней послеоперационной кишечной непроходимостью были выполнены релапаратомия, висцеролиз, интубация тонкой кишки. Из 4 пострадавших с внутрибрюшными абсцессами 3 выполнено дренирование абсцесса под ультразвуковой навигацией катетерами типа pig-tail, 1 – релапаротомия, вскрытие, санация и дренирование межпетельного абсцесса. Дополнительное ушивание раны печени с целью гемостаза выполнено 1 пострадавшему, еще 1 – атипичная резекция VI сегмента печени. 3 пострадавшим с несостоятельностью кишечных швов были выполнены резекция сегмента кишки с формированием энтеростомы, интубацией тонкой кишки через энтеростому, санация и дренирование брюшной полости. В 1 случае сформирован первичный тонко-тонкокишечный анастомоз в связи с ранней диагностикой возникшего осложнения и отсутствием выраженных признаков перитонита. У 5 пострадавших (33,3%) с нагноением послеоперационной раны потребовалось наложение вторичных швов на раны после их очищения.
Умер 21 пациент. У 7 пострадавших (33,3%) причиной летального исхода явилось коагулопатическое кровотечение, гипотермия и ацидоз вследствие массивной травмы. Полиорганная недостаточность стала причиной летального исхода у 8 больных (38,1%). Тромбоэмболия легочной артерии как причина смерти была выявлена у 3 пациентов (14,3%), острый инфаркт миокарда – у 2 (9,5%), пневмония – у 1 (4,8%). Общая летальность составила 25%.
Выводы
Таким образом, выбор объема хирургической помощи зависит от тяжести состояния пострадавших в момент поступления. Стабильное состояние пациента дает возможность выполнить одномоментную коррекцию всех повреждений. При тяжелом состоянии необходимо применять тактику damage control вне зависимости от уровня оказания медицинской помощи. Стабилизация состояния пострадавшего на фоне интенсивной терапии позволяет в дальнейшем проводить различные по объему хирургические вмешательства.
При травме паренхиматозных органов первоочередной задачей является остановка кровотечения. После стабилизации состояния возможны резекционные вмешательства на печени. При этом могут быть выполнены атипичные либо обширные анатомические резекции. Необходимое условие – адекватное анестезиологическое обеспечение и слаженность работы хирургической бригады, имеющей опыт плановых хирургических вмешательств на печени.
Отсутствие современных инструментальных методов гемостаза и диссекции тканей, а также шовного материала диктуют необходимость выполнения спленэктомии во всех случаях во избежание рецидивного массивного внутрибрюшного кровотечения. В ином случае возможно выполнение органосохраняющих вмешательств.
В случае значительного повреждения двенадцатиперстной кишки считаем необходимым ее выключение из пассажа пищетока по Ру. При повреждениях в зоне большого дуоденального сосочка показана его пересадка и дивертикулизация дуоденум для адекватной декомпрессии двенадцатиперстной кишки с целью профилактики несостоятельности кишечных швов.
Множественные повреждения тонкой кишки являются показанием для интубации тонкой кишки, при этом в случае локализации повреждений в области ее илеоцекального сегмента интубацию необходимо выполнять через аппендикоцеко- либо цекостому. Использование подобной тактики позволило достичь снижения летальности до 25% у данной категории тяжелых пациентов.
Литература
- Березка Н.И., Литовченко В.А., Гарячий Е.В. и др. Оптимизация хирургической тактики лечения пострадавших с политравмой с использованием шкал оценки тяжести состояния и повреждений // Научные ведомости. – 2014. – № 4 (175). – С. 116-119.
- Frequency, causes and pattern of abdominal trauma: A 4-year descriptive analysis / Suresh Arumugam, Ammar Al-Hassani, Ayman El-Menyar et al. // J Emerg Trauma Shock. – 2015. – № 8 (4). – Р. 193-198.
- Hemmila M.R., Wahl W.L. Management of injured patient. In: Dorethy GM, editor. Current Surgical Diagnosis and Treatment. New York: McGraw-Hill Medical; 2008. pp. 227-228.
- The epidemiology and clinical evaluation of abdominal trauma. An analysis of a multidisciplinary trauma registry / Costa G., Tierno S.M., Tomassini F. et al. // Ann Ital Chir. – 2010. – № 81. – Р. 95-102.
- Blunt abdominal trauma: Evaluation of diagnostic options and surgical outcomes / Karamercan A., Yilmaz T.U., Karmercan M.A. et al. // Turk J Trauma Emerg Surg. – 2008. – № 14. – Р. 205-210.
- Blunt abdominal trauma requiring laparotomy: An analysis of 342 polytraumatized patients / Hildebrand F., Winkler M., Griensven M.V. et al. // Eur J Trauma. – 2006. – № 32. – Р. 430-438.
- High Grade Penetrating Pancreatic Trauma – Case Report and Review of the Literature / I. Negoi, S. Paun, B. Stoica et al. // Chirurgia. – 2015. – № 6. – Р. 554-558.
- Serial Clinical Examinations of 100 Patients Treated for Anterior Abdominal Wall Stab Wounds: A Cross Sectional Study / Herfatkar M.R., Mobayen M.R., i Karimian M. et al. Trauma Mon. 2015 November; 20(4): e24844. doi: 10.5812/traumamon.24844 Published online 2015 November 23.
- Лебедев Н.В. Проблема объективной оценки тяжести сочетанной и множественной травмы // Нейрохирургия. – 2000. – № 4. – С. 54-58.
- Damage control surgery for abdominal emergencies / Weber D.G., Bendinelli C., Balogh Z.J. // BJS. – 2014. – № 101. – Р. e109-e118.
- Хоменко І.П., Майданюк В.П. Застосування тактики damage control у тяжко поранених і постраждалих в умовах бойових дій і мирного часу // Шпитальна хірургія. – 2014. – № 2. – С. 92-95.


