5 лютого, 2017
Биластин в лечении аллергического ринита и крапивницы: обзор новейшего антигистаминного препарата
Распространенность и негативные эффекты аллергических заболеваний остаются в значительной степени недооцененными. Ключевым медиатором аллергического ответа является иммуноглобулин Е (IgE), присутствующий на поверхности тучных клеток и базофилов. Взаимодействие аллергена с IgE и рецепторным комплексом приводит к активации этих клеток и высвобождению ряда субстанций, включая гистамин, который вызывает аллергические симптомы.
Учитывая центральную роль гистамина в развитии аллергического ответа при многих аллергических заболеваниях, в том числе при аллергическом рините (АР) и крапивнице, применяются антигистаминные препараты (АГП). Истории клинического применения этих лекарственных средств уже больше 70 лет; за этот период фармакологические характеристики препаратов подверглись значительному усовершенствованию.
Целью настоящей работы было суммировать фармакологические характеристики и клинические результаты биластина – нового АГП, отличающегося высокой селективностью к Н1-рецепторам гистамина.
Для проведения систематического обзора в базе данных PubMed был осуществлен поиск всех публикаций без ограничений по дате, содержащих ключевое слово bilastine в заголовке или абстракте. Для включения в обзор оценивали все доклинические и клинические исследования. Предпочтение отдавали рандомизированным контролированным испытаниям высокого методологического качества.
Аллергический ринит
АР – симптомное состояние носа, вызываемое воздействием аллергена и IgE-опосредуемым воспалением. По периодичности появления симптомов АР разделяют на интермиттирующий и персистирующий, по тяжести признаков – на легкий и умеренно-тяжелый. Ранее заболевание классифицировали как профессиональный, сезонный и круглогодичный АР, однако это распределение в настоящее время считается неточным, поскольку данные категории не являются взаимоисключающими. В 2001 г. руководство ARIA (Аллергический ринит и его влияние на астму) рекомендовало заменить термины «сезонный» и «круглогодичный» ринит на «интермиттирующий аллергический» и «персистирующий аллергический» ринит соответственно. При этом термины «интермиттирующий» и «персистирующий» не являются точными синонимами терминов «сезонный» и «круглогодичный».
Пациентов с АР часто наблюдают врачи первичного звена. Такие больные, как правило, отмечают, что АР оказывает выраженное негативное влияние на сон, социальные отношения, качество жизни, функционирование в школе или на работе. Проблемой также является то, что АР часто сопровождает другие аллергические заболевания, в частности астму. По данным эпидемиологических и клинических исследований, АР обнаруживается примерно у 75% больных астмой, приблизительно столько же пациентов с АР страдают астмой. Кроме того, доказаны коморбидные связи АР с синуситом, конъюнктивитом, средним отитом и назальным полипозом. Экономические потери, обусловленные АР, часто недооцениваются, хотя непрямые затраты на это заболевание очень велики.
АР является глобальной проблемой здравоохранения. В разных регионах его распространенность составляет 10-30%, в той или иной степени заболевание влияет на жизнь >500 млн человек во всем мире.
Крапивница
Еще одна распространенная патология – крапивница, симптомы которой включают появление волдырей, развитие ангионевротического отека (примерно у половины больных) или их сочетание. При длительности заболевания <6 мес оно считается острым, >6 мес или в случае рецидива – хроническим. Симптомы крапивницы могут нарастать в течение месяцев или лет. Наиболее частыми причинами острой крапивницы, которая в тот или иной период жизни наблюдается у 15-25% людей, являются вирусные инфекции (в частности, инфекции верхних дыхательных путей), пищевая аллергия и реакции на лекарственные препараты. Также крапивницу и ангионевротический отек могут вызывать физические воздействия, системная патология и длительные инфекции. У пациентов с хронической крапивницей заболевание часто является идиопатическим (55-80% случаев; описывается как хроническая спонтанная крапивница). Остальные случаи определяются как хроническая индуцибельная крапивница, которая вызывается различными стимулами (холодом, теплом, солнечным светом, давлением и др.).
Распространенность хронической спонтанной крапивницы составляет 0,5-1,0%. Пик заболеваемости приходится на возраст 20-40 лет, типичная продолжительность – 1-5 лет. Как и АР, хроническая крапивница значительно снижает качество жизни, в том числе такие его параметры, как сон, общий уровень активности, подвижность и социальное функционирование. Из-за выраженного эмоционального дистресса у пациентов с хронической спонтанной крапивницей часто возникают тревога и депрессия, а также соматоформные расстройства. В результате заболевание ассоциируется со значительными прямыми и непрямыми потерями. Многие пациенты с крапивницей получают неадекватное лечение, например повторные курсы пероральных кортикостероидов, связанные с выраженными побочными эффектами.
Роль гистамина и Н1-рецепторов при IgE-опосредуемых аллергических заболеваниях
Гистамин играет ключевую роль в патофизиологии аллергического воспаления. После воздействия аллергена у генетически предрасположенных лиц начинают продуцироваться специфические антитела класса IgE, взаимодействующие с рецепторами на поверхности базофилов и тучных клеток. В результате запускается каскад внутриклеточных реакций, завершающихся экзоцитозом и высвобождением гистамина и других воспалительных медиаторов, таких как фактор активации тромбоцитов и цитокины. Различные препараты (например, морфин) могут провоцировать выход гистамина из соответствующих гранул.
Последствия высвобождения гистамина включают рецепторопосредованное сокращение гладких мышц в гастроинтестинальном и респираторном тракте, стимуляцию сенсорных нервов, вазодилатацию, экстравазацию плазмы и миграцию клеток в очаги воспаления.
Помимо медиаторной активности при раннем аллергическом ответе гистамин стимулирует поздний аллергический ответ, вызывая продукцию молекул клеточной адгезии, антигенов II класса и цитокинов.
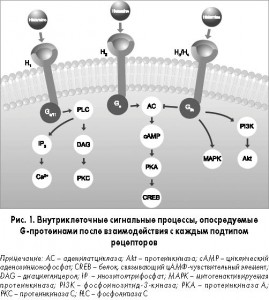
Существует четыре основных подтипа рецепторов гистамина: Н1, Н2, Н3 и Н4. Они передают внеклеточные сигналы с помощью G-протеина, который действует как посредник между рецепторами на поверхности клетки и внутриклеточными вторичными мессенджерами (рис. 1).
Н1- и Н2-рецепторы широко представлены по всему организму; Н3-рецепторы располагаются преимущественно в центральной нервной системе (ЦНС), а Н4-рецепторы – в гемопоэтических тканях. Аллергический ответ опосредуется главным образом Н1-рецепторами.
Н1-рецепторы являются убиквитарными; в частности, они экспрессируются в мозговом слое надпочечников, ЦНС, эндотелиальных и эпителиальных клетках, сердце, иммунных клетках, сенсорных нервах и гладких мышцах. В ЦНС большинство постсинаптических эффектов гистамина опосредуются Н1-рецепторами. Это объясняет влияние АГП на цикл «сон-бодрствование», а также седативные эффекты, которые свойственны АГП I поколения, проникающим через гематоэнцефалический барьер. Посредством Н1-рецепторов гистамин также вызывает сокращение гладкомышечных клеток в гастроинтестинальном и респираторном тракте и стимуляцию сенсорных нервов. Это проявляется зудом, чиханием, повышенной проницаемостью сосудов и отеком.
АГП не обладают структурной схожестью с гистамином и не являются конкурентными антагонистами его связывания с соответствующими рецепторами. Вместо этого они взаимодействуют с другими (отличными от гистамина) сайтами Н1-рецепторов и, по сути, являются обратными агонистами.
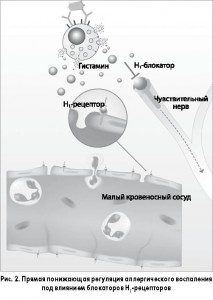
Связываясь с Н1-рецепторами, АГП предотвращают действие гистамина на чувствительные нейроны и малые кровеносные сосуды и таким образом подавляют аллергическое воспаление (рис. 2). Эта понижающая регуляция также осуществляется опосредованно через транскрипционный фактор NF-kВ и кальциевые ионные каналы.
История АГП
Гистамин был обнаружен в 1907 г. немецкими учеными Windaus и Vogt после декарбоксилирования аминокислоты гистидина. Двадцать лет спустя, в 1927 г., Emanuel установил, что гистамин в норме содержится в различных тканях, в частности в легких, а в 1937 г. Bovet и Staub впервые синтезировали агенты, блокирующие эффекты гистамина. В 1942 г. появился первый АГП, доступный для клинического применения, – фенбензамин. Через несколько лет арсенал АГП пополнили дифенгидрамин, бромфенирамин, хлорфенирамин, прометазин и гидроксизин.
В 1957 г. итальянский фармаколог швейцарского происхождения Даниеле Бове стал лауреатом Нобелевской премии по физиологии и медицине за вклад в исследования АГП. Ключевые научные открытия были сделаны в начале 1960-х гг., когда удалось обнаружить существование нескольких подтипов гистаминовых рецепторов.
В 1980-х гг. были синтезированы АГП II поколения. Эти средства позволили значительно усовершенствовать антигистаминную терапию, поскольку обладали минимальной седативной активностью (или были лишены ее), характеризовались высокой селективностью в отношении Н1-рецепторов и не проявляли антихолинергической активности. Однако вследствие различий в специфичности к транспортным белкам гематоэнцефалического барьера, в частности Р-гликопротеину, некоторые АГП II поколения могут в большей степени проникать в ЦНС. Так, цетиризин, дезлоратадин и лоратадин, особенно в высоких дозах, являются потенциально более седативными по сравнению с фексофенадином и левоцетиризином.
Еще одним существенным недостатком ряда АГП II поколения является обнаруженная в 1990-х гг. выраженная кардиотоксичность. Было установлено, что астемизол и терфенадин блокируют поздний ток K+ (IKr), необходимых для кардиальной реполяризации, и за счет этого могут пролонгировать интервал QT с развитием опасных для жизни аритмий, таких как torsades de pointes. В настоящее время астемизол и терфенадин отозваны с рынка в большинстве стран мира.
В целом эволюция АГП II поколения основывалась на экспериментах с АГП I поколения и их модификации. Так были синтезированы стереотаксический изомер цетиризина левоцетиризин и метаболит лоратадина дезлоратадин.
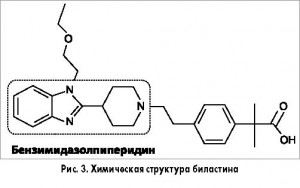
Принципиально новым АГП является биластин (рис. 3) – производное бензимидазолпиперидина с высокой селективностью в отношении Н1-рецепторов. В отличие от других АГП биластин является уникальным химическим соединением, структурно не связанным с более ранними АГП. Международный лонч биластина был осуществлен в 2011 г.
Свойства «идеального» АГП
В руководстве ARIA указывается, что при назначении фармакотерапии врач должен учитывать следующие характеристики препарата: эффективность, безопасность, соотношение «стоимость/эффективность», предпочтения пациента, цели лечения, предполагаемый комплайенс, тяжесть и уровень контроля заболевания, а также наличие сопутствующей патологии. В документе также приводится перечень свойств, какими должен обладать «идеальный» АГП для перорального приема (табл. 1). Из этих свойств фундаментальными являются: мощное и селективное блокирование активности Н1-рецепторов; быстрое начало и достаточная продолжительность действия; эффективность при аллергическом риноконъюнктивите и в отношении всех симптомов АР, включая заложенность носа; отсутствие взаимодействий с цитохромом Р450 (CYP); отсутствие седативных, антихолинергических, когнитивных и психомоторных побочных эффектов; безопасность для сердца и отсутствие тахифилаксического потенциала.
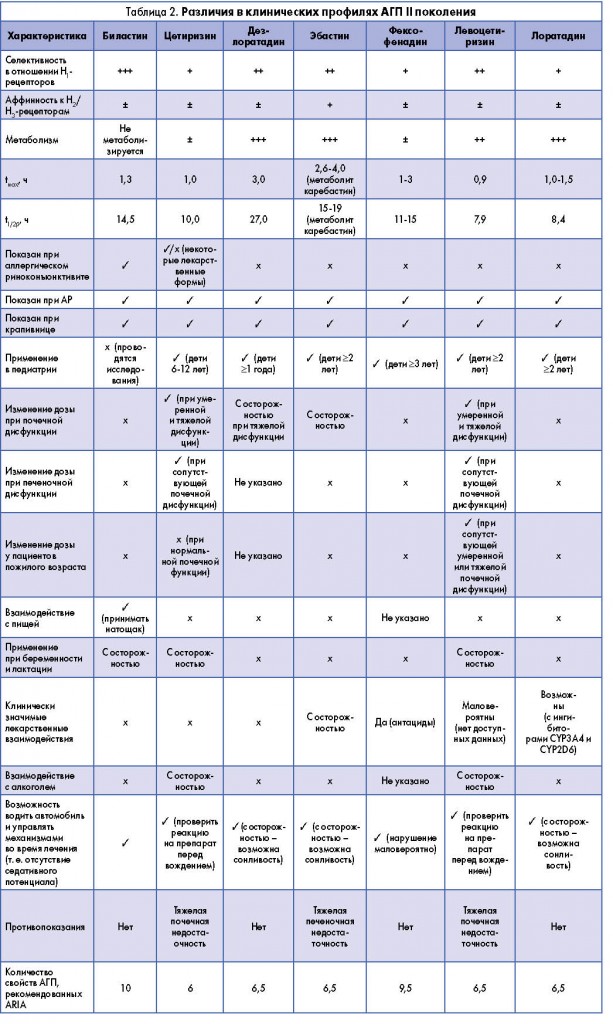
Биластин, современный АГП II поколения, соответствует наибольшему количеству вышеуказанных характеристик «идеального» АГП согласно международному руководству ARIA (табл. 2).
Фармакология биластина
Доклинические исследования
При изучении любых новых агентов с потенциальным клиническим применением в обязательном порядке проводятся доклинические исследования in vitro и in vivo с целью максимально полного описания фармакологического профиля. При подтверждении эффективности и отсутствии значимых проблем с безопасностью инициируют клинические исследования I фазы с участием здоровых добровольцев, а затем испытания II и III фазы у пациентов с соответствующими заболеваниями.
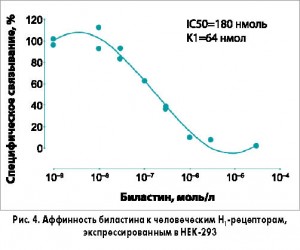
В случае новых АГП специфической целью исследований in vitro является подтверждение достаточной селективности (высокой аффинности) к Н1-рецепторам при минимальном влиянии на рецепторы других медиаторов и аминов. Биластин, обладающий константой ингибирования (Ki) 44 нмоль, дозозависимо подавлял связывание 3Н-пириламина с Н1-рецепторами мозжечка морских свинок с аффинностью, примерно в 3 раза превышающей таковую цетиризина (Ki 143 нмоль) и 4 раза – фексофенадина (Ki 246 нмоль). Аналогичные результаты были получены на линии клеток почки эмбриона человека – НЕК-293 (рис. 4; Ki 64 нмоль). В других исследованиях in vitro было продемонстрировано, что биластин не проявляет значимой антагонистической активности в отношении широкого спектра других рецепторов: гистаминовых Н2, Н3, Н4, серотониновых 5-НТ2А, брадикининовых В1, рецепторов лейкотриена D4, α1- и β2-адренорецепторов, мускариновых рецепторов М1-М5, а также вольтажзависимых кальциевых каналов N-типа.
В исследованиях in vivo на различных моделях биластин продемонстрировал антигистаминную активность и следующие эффекты: уменьшение гистамининдуцированной проницаемости капилляров у крыс, снижение капиллярной утечки в трахее морских свинок и дорсальной коже крыс, предотвращение гистамининдуцированного бронхоспазма, а также снижение летальности, спровоцированной гистамином или соединением 48/80, у морских свинок. В этих моделях эффекты биластина были сопоставимы с таковыми цетиризина и значительно превышали по выраженности влияние фексофенадина.
В экспериментах на крысах были также продемонстрированы другие противоаллергические свойства биластина. В частности, он уменьшал проницаемость сосудов, IgG- и IgE-зависимую кожную анафилаксию, пассивную реакцию Артюса и др. По силе этих эффектов биластин соответствовал цетиризину и превосходил фексофенадин.
Фармакокинетический профиль
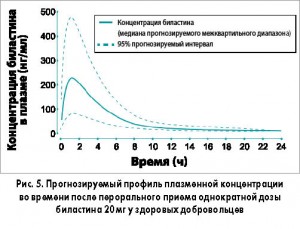
После перорального приема биластин быстро всасывается. В экспериментальных исследованиях антигистаминное действие начиналось через 30 мин после использования, максимальный клинический эффект сохранялся от 30 мин до 8 ч, общая продолжительность действия составляла ≥16 ч (рис. 5).
У здоровых добровольцев, получавших однократную пероральную дозу биластина 20 мг, средняя пиковая концентрация в плазме (Сmax) равнялась 220 мкг/л и достигалась через 1,3 ч после приема (tmax). Объемное распределение (Vd) составило 1,29 л/кг, период полувыведения (t1/2β) – 14,5 ч, общий плазменный клиренс – 18,1 л/ч, связь с белками плазмы – 84-90%.
Биодоступность биластина при пероральном приеме составляет примерно 60%. У здоровых добровольцев, которым препарат в дозе 20 мг назначался вместе с пищей, биодоступность снижалась на 30% (пища с высоким содержанием жиров) или 25% (пища с низким содержанием жиров) по сравнению с использованием натощак. Одновременное употребление грейпфрутового сока также снижало биодоступность биластина на 30%. Следовательно, препарат рекомендуется принимать натощак.
Как уже указывалось, одна из ключевых характеристик перорального АГП, по мнению ARIA, – отсутствие взаимодействия с CYP. Некоторые АГП для перорального приема, в частности лоратадин и рупатадин, подвергаются экстенсивной трансформации до активных метаболитов под действием изоферментов CYP в печени, что создает значительный потенциал лекарственных взаимодействий. В то же время биластин не является ни индуктором, ни ингибитором CYP и не подвергается значимому метаболизму у человека. Примерно 95% пероральной дозы биластина выводится в неизмененном виде с мочой (28%) и стулом (67%). Такой профиль элиминации существенно снижает вероятность лекарственных взаимодействий.
При пероральном назначении биластина можно не учитывать скорость клубочковой фильтрации. У пациентов с легкой, умеренной и тяжелой почечной недостаточностью необходимость в коррекции дозы отсутствует. Тем не менее пациентам с умеренной или тяжелой почечной недостаточностью, получающим ингибиторы Р-гликопротеина (циклоспорин, дилтиазем, эритромицин, кетоконазол, ритонавир), назначать биластин не следует, поскольку эти препараты могут повышать уровни биластина в плазме и таким образом увеличивать риск побочных реакций.
Поскольку биластин практически не метаболизируется (а выводится в неизмененном виде), печеночная недостаточность не повышает экспозицию препарата сверх безопасной границы. Следовательно, у пациентов с печеночной дисфункцией коррекция дозы не требуется.
Биластин является субстратом для ряда транспортных белков (Р-гликопротеина и переносчика органических анионов). Они оказывают значительное влияние на фармакокинетический профиль различных препаратов, поскольку Р-гликопротеин является эффлюксной помпой, а переносчик органических анионов облегчает захват препарата. Биластин обладает высокой аффинностью к эффлюксной помпе Р-гликопротеина; этот эффект препятствует проникновению препарата через гематоэнцефалический барьер и ограничивает седативный потенциал.
Различия между профилями связывания с транспортными белками АГП II поколения могут объяснять существенные различия в клинической активности и переносимости (табл. 2).
Эффективность биластина
Программа клинических испытаний биластина была спланирована до публикации руководства ARIA 2001 г., поэтому критерии включения пациентов основывались на применявшемся ранее разделении АР на сезонный и круглогодичный.
Сезонный АР (САР). В двух многоцентровых рандомизированных двойных слепых плацебо-контролированных исследованиях, включивших 1402 пациента с САР, эффективность биластина сравнивали с таковой цетиризина и дезлоратадина.
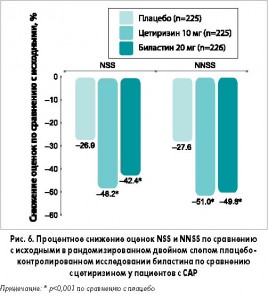
В первом исследовании на протяжении 2-недельного периода лечения биластин и цетиризин продемонстрировали одинаковую эффективность: оба препарата значительно снижали суммарную оценку симптомов (TSS = назальные симптомы [NSS] + неназальные симптомы [NNSS]) по сравнению с плацебо. Оценка NSS (заложенность носа, ринорея, чихание, зуд) снизилась значительно больше (р<0,001) в группе биластина (-42,4%) и цетиризина (-48,2%) по сравнению с группой плацебо (-26,9%). Аналогичная картина наблюдалась и для NNSS (слезотечение, покраснение и зуд в глазах): соответствующее снижение составило -49,8; -51,0 и -27,6% (рис. 6).
Во втором исследовании были получены схожие результаты для биластина и дезлоратадина по сравнению с плацебо за 2-недельный период лечения. Первичная конечная точка – площадь под кривой TSS (AUCTSS) – была значительно ниже (р<0,001) в группах биластина (98,4) и дезлоратадина (100,5) по сравнению с группой плацебо (118,4).
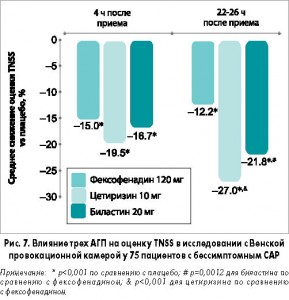
В исследовании с использованием Венской провокационной камеры 75 пациентам с бессимптомным САР непосредственно перед пробой с аллергеном назначали АГП или плацебо. Три АГП (биластин, цетиризин и фексофенадин) были значительно эффективнее плацебо (р<0,001) по снижению общей оценки NSS во всех временных точках, включая ранний (1-4 ч) и поздний (22-26 ч) периоды после приема. Однако в позднем периоде биластин (р=0,0012) и цетиризин (р<0,001) были значительно эффективнее фексофенадина (рис. 7).
В отличие от других АГП биластин показан для лечения аллергического риноконъюнктивита (табл. 2). Анализ клинических исследований показал, что этот препарат значительно превосходит плацебо по уменьшению глазных симптомов (р<0,001), включая зуд, слезотечение и покраснение.
Круглогодичный АР. В рандомизированном двойном слепом плацебо-контролированном исследовании, проведенном в Европе, Аргентине и Южной Африке, сравнивали эффективность биластина с таковой цетиризина и плацебо на протяжении 4 нед у 651 пациента с круглогодичным АР; в последующей открытой фазе 513 пациентов получали биластин 20 мг 1 р/сут в течение 12 меc (это самый продолжительный период наблюдения в исследованиях АГП). После 4 нед лечения статистически значимые различия по динамике AUCTSS между группами отсутствовали. В то же время полученные результаты зависели от региона: в Европе и Аргентине АГП были достоверно эффективнее плацебо (р=0,039), тогда как в Южной Африке разница была статистически незначимой вследствие относительно высокой частоты ответа на плацебо. Во время открытой фазы биластин достоверно снижал TSS, NSS и NNSS по оценке врачей и пациентов. Эта продленная фаза исследования также подтвердила высокую безопасность и хорошую переносимость биластина при длительном применении.
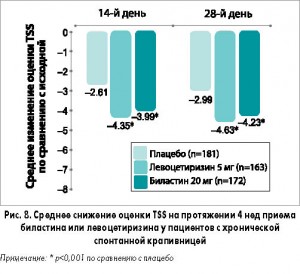
Крапивница. В 4-недельном многоцентровом рандомизированном двойном слепом плацебо-контролированном исследовании сравнивали эффективность биластина и левоцетиризина у 525 пациентов с хронической идиопатической крапивницей. Биластин и левоцетиризин были одинаково эффективны и значительно превосходили плацебо (р<0,001) в отношении снижения средней оценки TSS (тяжесть зуда, количество и максимальный размер волдырей) на протяжении 2 и 4 нед (рис. 8). Кроме того, по сравнению с плацебо биластин и левоцетиризин достоверно улучшали качество жизни, оцениваемое по дерматологическому индексу DLQI.
Биластин более эффективен, чем цетиризин, в ограничении раннего аллергического ответа. Так, в исследовании здоровым добровольцам перед провокационной пробой назначали однократную пероральною дозу биластина 20 мг, цетиризина 10 мг или плацебо. Через 1,5 ч волдыри и покраснение в группе биластина уменьшались значительно больше, чем в группах цетиризина и плацебо (р<0,02).
В рандомизированном двойном слепом плацебо-контролированном исследовании биластин назначали в широком спектре дозировок (от стандартной дозы 20 мг 1 р/сут до 80 мг 1 р/сут) у пациентов с крапивницей, индуцируемой холодом. После 7 дней лечения частота ответа (количество пациентов без симптомов) составила 60%. Частота побочных реакций при назначении всех доз биластина (20, 40 и 80 мг) была сопоставима с таковой при использовании плацебо, что свидетельствует о хорошей переносимости биластина даже в дозе, в 4 раза превышающей стандартную.
Применение биластина в супратерапевтических дозах при холодовой крапивнице согласуется с международными руководствами. В частности, в объединенных рекомендациях Европейской академии аллергии и клинической иммунологии (EAACI), Европейской глобальной сети по аллергии и астме (GA2LEN), Европейского дерматологического форума (EDF) и Всемирной организации аллергии (WAO) четко указывается, что современные АГП II поколения должны использоваться в первой линии терапии крапивницы, а в качестве второй линии следует применять дозы, до 4 раз превышающие стандартные. Цель этой рекомендации – достичь полного контроля симптомов, поскольку более чем треть пациентов с хронической крапивницей являются рефрактерными к стандартным дозам АГП.
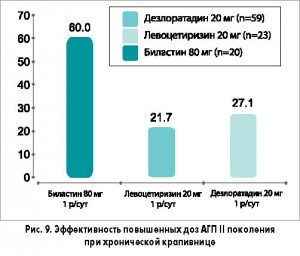
Сравнение клинических данных АГП II поколения при хронической крапивнице свидетельствует о том, что биластин в этой дозировке (80 мг/сут) является значительно более эффективным, чем дезлоратадин и левоцетиризин в супратерапевтических дозах (рис. 9). В то же время применение таких высоких доз может ассоциироваться с повышенным риском побочных эффектов. Например, седативный потенциал цетиризина, дезлоратадина и лоратадина значительно выше такового биластина, фексофенадина и левоцетиризина. Кроме того, при лечении высокими дозами АГП существует потенциал пролонгации интервала QT, особенно в свете имеющихся данных по астемизолу и терфенадину. Тем не менее следует отметить, что биластин как в терапевтических, так и в супратерапевтических дозах у здоровых добровольцев не оказывал сколько-нибудь значимого влияния на реполяризацию желудочков. Кроме того, биластин в дозах от 20 до 100 мг не осуществляет клинически значимого воздействия на интервал QTc. Биластин в дозе 20 мг также назначался совместно с кетоконазолом, не влияя на интервал QTc.
Безопасность биластина
База данных безопасности биластина включает >5 тыс. пациентов, принявших участие в хорошо спланированных клинических исследованиях. Больные получали препарат в дозе 20 мг 1 р/сут в течение 2-4 нед. Частота побочных эффектов, потенциально связанных с лечением, в группах биластина не отличалась от таковой в группах плацебо (12,7 vs 12,8% соответственно) и других АГП II поколения – цетиризина (14,3%), дезлоратадина (11,6%) и левоцетиризина (15,8%).
Частота побочных эффектов со стороны ЦНС для биластина также не отличается от таковой плацебо. В то же время цетиризин ассоциируется со значительно большим количеством эпизодов сонливости (7,6%; р<0,001) по сравнению с биластином.
В крупном рандомизированном двойном слепом исследовании, включившем 683 пациента с САР, биластин по сравнению с цетиризином ассоциировался с достоверно более низкой частотой всех побочных реакций, связанных с лечением (14,5 vs 24,6%; р≤0,01), патологической усталости (0,4 vs 4,8%; р≤0,01) и сонливости (1,8 vs 7,5%). Это означает, что в повседневной клинической практике профиль безопасности и терапевтический индекс биластина лучше таковых цетиризина.
Биластин в высоких дозах (40 и 80 мг), назначаемых согласно рекомендациям EAACI/GA2LEN/EDF/WAO, продемонстрировал высокую эффективность в лечении крапивницы. В исследовании с участием пациентов с холодовой крапивницей биластин хорошо переносился и не вызывал седации в дозах до 80 мг/сут.
Эффекты биластина в дозе 80 мг также оценивались у здоровых добровольцев. Результаты показали отсутствие влияния препарата на все субъективные тесты.
Отсутствие седации. В ряде исследований, в которых в качестве контрольной группы применялся гидроксизин, биластин в стандартной дозе (20 мг 1 р/сут) и в более высоких дозах (40 мг 1 р/сут, 80 мг однократно) не влиял на различные психомоторные параметры и способность водить автомобиль. При назначении биластина совместно с лоразепамом степень психомоторных нарушений была такой же, что и при монотерапии лоразепамом.
Биластин в стандартных дозах не усиливает эффекты алкоголя. Так, в плацебо-контролированном исследовании объективное тестирование показало, что психомоторные нарушения при приеме биластина 20 мг + алкоголь не отличались от таковых при приеме только алкоголя, тогда как гидроксизин и цетиризин в стандартных дозах значительно усиливали негативные эффекты алкоголя на психомоторную функцию.
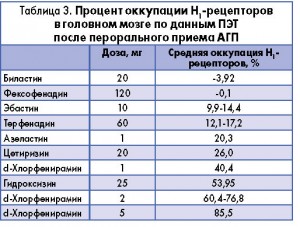
В исследовании, в котором с помощью позитронно-эмиссионной томографии (ПЭТ) оценивали оккупацию Н1-рецепторов в головном мозге у 12 здоровых добровольцев, было установлено, что при назначении биластина этот показатель был близок к нулю (-3,92%) и, следовательно, не отличался от такового при приеме плацебо. В то же время АГП I поколения гидроксизин ассоциировался со значительно более высокой оккупацией Н1-рецепторов (+54%). Результаты этого исследования подтверждают, что биластин практически не проникает через гематоэнцефалический барьер и не взаимодействует с Н1-рецепторами ЦНС. В целом накопленные на сегодня данные позволяют утверждать, что биластин обладает самой низкой способностью занимать Н1-рецепторы в головном мозге по сравнению со всеми доступными АГП (табл. 3).
Отсутствие пролонгации QTc. Кардиальная безопасность биластина была подтверждена в различных исследованиях, в том числе при одновременном назначении с ингибиторами CYP и Р-гликопротеина (кетоконазол, эритромицин, дилтиазем), причем эти исследования проводились в соответствии с руководством Международной конференции по гармонизации (ICH). На сегодня биластин является единственным АГП, эффекты которого на интервал QT исследованы согласно строгим критериям ICH E14. Результаты этих испытаний показали, что биластин не влияет на интервал QTc и обладает хорошим профилем кардиальной безопасности. Повышение дозы биластина вплоть до 220 мг и совместное назначение средства с ингибиторами CYP/P-гликопротеина не изменяют его профиль безопасности. В клинических исследованиях биластин также не ассоциировался со сколько-нибудь значимой пролонгацией интервала QTc.
Применение в педиатрии
При регистрации взрослой лекарственной формы биластина клинические исследования планировались в соответствии с рекомендациями Европейского агентства по лекарственным средствам (EMA), устанавливающими возрастную границу 12 лет. В настоящее время эффективность и безопасность биластина изучаются у детей младше этого возраста; публикация результатов этих исследований ожидается в ближайшем будущем.
Выводы
На сегодняшний день ведение аллергических состояний во многом остается неоптимальным, при этом многие пациенты испытывают седацию при использовании «старых» АГП. Значительным достижением в лечении стало появление АГП II поколения, обладающих минимальным седативным потенциалом или лишенных его.
Доказанные эффективность и безопасность, низкий потенциал к развитию побочных эффектов со стороны ЦНС при совместном назначении с алкоголем, отсутствие значимых лекарственных взаимодействий и потребности в коррекции дозы позволяют рассматривать биластин как препарат выбора в лечении крапивницы и АР, включая аллергический риноконъюнктивит (интермиттирующий и персистирующий).
Список литературы находится в редакции.
Wang X. Y. et al. Treatment of allergic rhinitis and urticaria:
a review of the newest antihistamine drug bilastine.
Therapeutics and Clinical Risk Management 2016; 12: 585-597.
Перевел с англ. Алексей Терещенко