2 квітня, 2017
Синдром раздраженного кишечника: современные подходы к диагностике и лечению
Последние 10 лет характеризуются значительным прогрессом в понимании патофизиологии функциональных нарушений желудочно-кишечного тракта (ЖКТ), за это время разработаны более эффективные способы диагностики и лечения пациентов.
В Римских критериях IV (2016) подчеркнута важность патофизиологического взаимодействия между кишечником и головным мозгом, а также внесен ряд уточнений и изменений.
Так, удален термин «функциональный» из названий разделов. Предложено по возможности отказаться от применения функциональной терминологии. Термин «функциональное недержание кала» заменен на «недержание кала», «функциональный абдоминальный болевой синдром» переименован в «центрально-опосредованный абдоминальный болевой синдром», понятие «функциональные заболевания ЖКТ» трансформировали в «нарушение взаимодействия «кишечник – головной мозг». Также разработаны новые дефиниции для некоторых функциональных патологий. В соответствии с новым определением к расстройству взаимодействия «кишечник – головной мозг» относится группа заболеваний, при которых появление патологической симптоматики обусловлено нарушением моторики, висцеральной гиперчувствительности, изменением функций слизистой оболочки и иммунной системы, нарушением кишечной микробиоты, изменением обработки сигналов в центральной нервной системе.
Введены новые диагнозы, что касается кишечника, это:
- опиоид-индуцированный запор – появление или ухудшение ранее существовавших проблем с замедленным опорожнением кишечника (дефекация плотными каловыми массами, редкий стул, натуживание при дефекации, чувство неполного опорожнения), возникающее только при приеме опиоидов;
- наркотический кишечный синдром – прогрессирующее и парадоксальное усиление абдоминальной боли, несмотря на продолжающийся прием или увеличение дозировки опиоидов, официально назначенных для купирования болевого синдрома, при этом клиническая симптоматика уменьшается после детоксикации.
Изменены диагностические критерии синдрома раздраженного кишечника (СРК). Ранее СРК диагностировали при наличии рецидивирующей абдоминальной боли или дискомфорта в течение 3 дней в месяц на протяжении 3 последних месяцев при условии, что состояние пациента улучшалось после дефекации или начало заболевания было ассоциировано с изменением частоты стула и/или формы кала. В новой редакции СРК изменена частота абдоминальной боли: теперь диагноз СРК правомочен, если пациент испытывает абдоминальную боль по меньшей мере 1 раз в неделю в течение 3 последних месяцев. Кроме того, из диагностических критериев СРК удалено понятие «дискомфорт», а дополнительное условие – «улучшение после дефекации» – заменено на «связанное с дефекацией».
Функциональные заболевания толстой кишки теперь рассматриваются как спектр кишечных симптомов, которые образуют 5 различных вариантов: СРК, функциональный запор, функциональную диарею, функциональное вздутие/растяжение и неспецифическое функциональное кишечное расстройство.
Определение подтипов СРК (с преобладанием запора, диареи, смешанный вариант) ныне основывается на определении пропорции измененного стула (комковатый/твердый или неоформленный/жидкий), а не всех каловых масс, которые могут содержать кал с нормальной консистенцией.
В основе функциональных нарушений лежит, прежде всего, нарушение моторики. Коррекция этих нарушений является важной составляющей лечения пациентов с СРК.
Тримебутин является агонистом периферических µ-, κ- и δ-опиатных рецепторов. В экспериментальных и клинических исследованиях показано модулирующее влияние тримебутина на моторную функцию ЖКТ, которое проявляется в его нормализующих эффектах как при гипо-, так и при гиперкинетических нарушениях моторики на всех уровнях ЖКТ. Установлено, что тримебутин может оказывать также обезболивающее действие.
Известно, что опиоидные пептиды усиливают сокращения в тонкой кишке, действуя непосредственно на опиатные рецепторы циркулярных гладких мышц, преимущественно m-типа. Индукция постоянных сегментирующих сокращений и подавление пропульсивной перистальтики приводят к задержке транзита содержимого по кишечнику. Локальные сокращения сегментов ЖКТ связаны с миогенным механизмом, в то время как координированная работа смежных отделов ЖКТ связана с регулирующим влиянием энтеральной нервной системы (ЭНС). ЭНС тонкой кишки отвечает за возникновение и распространение мигрирующего миоэлектрического комплекса (ММК), который обеспечивает пропульсивную координированную перистальтику и транзит кишечного содержимого в межпищеварительный период у животных и людей.
В связи с тем, что эндогенные опиоидные пептиды подавляют высвобождение возбуждающих и тормозных нейротрансмиттеров в ЭНС, а эти рецепторы расположены практически на всех нейронах ЭНС, то воздействие опиоидных пептидов и опиатных агонистов на моторику ЖКТ зависит от преобладания ингибиторных или возбуждающих влияний. Поэтому действие опиоидных пептидов или их агонистов в ЭНС является модулирующим в регуляции пропульсивной моторики.
В экспериментальных исследованиях in vitro показано, что тримебутин и его метаболит (N-десметил-тримебутин) обладают неспецифическим сродством к µ-, κ- и δ-опиатным рецепторам, влияние тримебутина на моторику ЖКТ обусловлено активацией периферических опиатных рецепторов.
Экспериментальные исследования по изучению влияния тримебутина на моторику ЖКТ показали, что внутривенное введение тримебутина в дозе 5 мг/кг вызывает внеочередную фазу III ММК натощак; тримебутин-индуцированная фаза III мигрирует вдоль тонкой кишки быстрее, чем спонтанная, и тримебутин-индуцированная фаза III сопровождается пиками концентраций мотилина в плазме крови.
Учитывая сродство тримебутина ко всем видам опиатных рецепторов и стимулирующее действие κ-опиатных рецепторов на моторику кишки и транзит содержимого, сниженные после лапаротомии и при экспериментальном перитоните, можно полагать, что прокинетический эффект тримебутина связан в основном с воздействием на κ-опиатные рецепторы.
Свойства тримебутина реализуются не только через аффинность к опиатным рецепторам (агонист периферических m-, d- и k-рецепторов). Тримебутин также обладает антисеротониновой активностью, особенно в отношении М-рецепторов, способствует высвобождению мотилина и других гастроинтестинальных пептидов – вазоактивного интестинального пептида, гастрина и глюкагона.
Под влиянием тримебутина имеет место коррекция нарушенной моторики кишечника путем индукции регуляции спонтанной активности без влияния на нормальную моторику: тримебутин не нарушает время нормального кишечного транзита, но регулирует ненормально низкую или высокую кишечную активность, возвращая время транзита в норму.
Тримебутин уменьшает время кишечного транзита у пациентов при его удлинении (с 105+9 до 60+11 ч) и не изменяет нормальное – ни до, ни после еды.
Рядом исследователей продемонстрированы положительные эффекты тримебутина прежде всего при СРК. Так, M. Galeone и соавт. (1986) установили, что тримебутин при приеме внутрь и внутривенном введении у пациентов с СРК синхронизирует моторику толстой кишки и восстанавливает ее нарушенные функции – повышает фазовые пропульсивные волны, понижает неэффективные транзиторные и вибрирующие сокращения, подавляет спонтанные сокращения.
По данным S. Shannon и соавт. (1989), прием тримебутина (200 мг) повышает постпрандиальную двигательную активность сигмовидной кишки у пациентов с СРК с запорами и не оказывает влияния у здоровых волонтеров.
Свойства тримебутина регулировать нарушенную моторику ЖКТ позволяют препарату оказывать эффект как при диарее, так и запорах, купировать и уменьшать интенсивность ассоциированных с нарушениями моторики симптомов – боли и вздутия живота.
Тримебутин наиболее часто используется при функциональных заболеваниях кишечника – СРК, функциональном запоре, функциональной диарее, и большинство исследований касаются именно этого показания (известно не менее 20 рандомизированных контролируемых исследований и 2 метаанализа). Исследовано действие тримебутина и показана эффективность в отношении коррекции симптомов СРК – запора, диареи, боли, вздутия.
Для оценки эффективности применения тримебутина нами была отобрана группа больных с различными вариантами СРК, которым на фоне диетотерапии был назначен прием тримебутина («Тримспа 200» производства «Маклеодс Фармасьютикалс Лимитед», Индия) по 1 таблетке 200 мг 3 раза в день во время или после еды в течение трех недель.
Среди больных у 21 (65,6%) был диагностирован СРК с запорами (СРК-З), у 4 (12,5%) – СРК с диареей (СРК-Д) и у 7 (21,9%) – смешанный вариант заболевания (СРК-М).
Согласно Римским критериям IV основной обязательной жалобой у пациентов с СРК является боль. При включении пациентов в исследование боль была выявлена у всех больных. Интенсивность боли оценивалась (по 5-балльной шкале) как умеренная, периодически усиливающаяся (3 балла) у большинства больных – 18 (56,2%). У 14 (43,8%) больных боль оценивалась как слабая (2 балла).
Чаще боль была связана с актом дефекации, приемом пищи, психоэмоциональными нагрузками. Длительность заболевания у обследованных больных была от впервые выявленного заболевания до 20 лет. Мужчин было 8, женщин – 24.
Все больные были обследованы для исключения других заболеваний ЖКТ, имеющих похожую клиническую картину.
Кроме болевого синдрома все больные отмечали нарушение стула, чаще в виде запоров. Необходимость периодически применять слабительные средства отмечали 16 пациентов с СРК-З, у пациентов с СРК-М стул характеризовался чередованием запоров и поносов, в том числе и во время одного акта дефекации.
Кроме выше перечисленных симптомов у 14 пациентов (43,7%) отмечалась психоэмоциональная лабильность различной степени выраженности, нарушение сна.
Среди сопутствующих заболеваний у обследованных больных были: хронический гастрит – у 9 (28,1%), дискинезия желчного пузыря – у 10 (31,2%).
Дисбиоз кишечника І-ІІ степени был выявлен у 22 больных (68,7%), ІІІ степени – у 5 (15,6%). Синдром избыточного бактериального обсеменения тонкой кишки был зарегистрирован у 4 больных (12,5%).
Высокая частота нарушений биоценоза, определяемая даже такими ориентировочными методами, как бактериальный посев, еще раз подтверждает связь состояния микрофлоры с нарушениями моторики кишечника. Нарушение кишечной моторики приводит к дестабилизации флоры, развитие же условно-патогенных и патогенных микроорганизмов влечет за собой появление/усугубление изменений моторики и развитие СРК.
Что первично, а что вторично – точно сказать сегодня не представляется возможным, но однозначно требует от врача комплексного подхода к ведению таких больных с обязательной индивидуальной коррекцией нарушенных функций кишечника, состояния микрофлоры.
Всем пациентам, включенным в исследование, рекомендовалось диетическое питание с учетом вариантов СРК, пищевой переносимости, вкусовых предпочтений.
Прежде всего, обязательным условием диетотерапии был ритм приема пищи (4-5 раз) с достаточным временным интервалом между приемами (3-4 ч) и объем разового приема пищи (до 300-350 мг). Завтрак включал достаточный объем пищи при индивидуально подобранной калорийности, дополнительно назначались пищевые волокна (ПВ).
Лучше больными переносилась клетчатка льна, добавленная в йогурт или другой кисломолочный продукт. В блюда, входящие в завтрак (каши), добавлялась 1-2 чайных ложки растительного масла для больных с СРК-З. Квота жира в пище, принимаемой утром, способствовала сокращению желчного пузыря и как следствие – нормализации стула.
Несмотря на усиление боли, вздутия у некоторых пациентов после приема ПВ в анамнезе, мы не исключили их из питания, а подбирали переносимый вариант ПВ, переносимую дозу (разделяли рекомендуемую дозу на несколько приемов).
Овощи и фрукты были обязательным компонентом питания. Но для того чтобы у пациентов с СРК не было избыточных реакций в виде, прежде всего, усиления боли, дискомфорта, вздутия, мы подбирали дозу, вид овощей и фруктов, вид кулинарной обработки индивидуально. Только полноценной, но индивидуально подобранной диетой возможна коррекция нарушений биоценоза и восстановление функций кишечника, увеличение эффективности проводимой медикаментозной терапии.
К сожалению, не все пациенты действительно выполняли все наши рекомендации. С большей степенью вероятности можно сказать о достигнутом комплайенсе у 24 пациентов (75%). У них наблюдались и более высокие показатели эффективности лечения.
На фоне диетотерапии пациентам был назначен препарат Тримспа (тримебутин), который, являясь универсальным регулятором, широко используется при нарушениях моторики различных отделов ЖКТ.
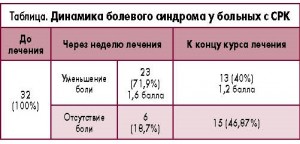
Через 3-4 дня приема препарата у 17 пациентов (53,12%) отмечалось существенное уменьшение болевого синдрома. К концу первой недели уменьшение или исчезновение боли отмечали 29 (90,6%) человек (табл.).
Через три недели лечения не предъявляли жалоб на боль 15 больных (46,87%), значительно снизилась выраженность этого синдрома у 13 (40%). Незначительно уменьшилась боль у 4 больных. Двое из этих пациентов на фоне лечения регулярно нарушали наши рекомендации, у двоих потребовалось дообследование.
К концу курса лечения облегчение акта дефекации (уменьшение времени натуживания, регуляция стула только коррекцией питания) имело место у 20 больных с СРК-З из 21 (95%), из них ежедневный самостоятельный стул отмечали 8 больных (25%).
У пациентов с СРК-Д кроме уменьшения или исчезновения болевого синдрома отмечалось уменьшение частоты актов дефекации и изменение консистенции каловых масс с типа 6 на тип 5 согласно Бристольской шкале формы стула.
Аналогичная положительная динамика наблюдалась у пациентов с СРК-М.
У большинства пациентов (30-93,7%) отмечалось улучшение общего состояния, работоспособности, настроения.
Большинство пациентов хорошо переносили прием Тримспы, 2 пациента жаловались на тошноту, которая уменьшилась к концу первой недели, что дало возможность закончить лечение.
Таким образом, СРК – это сложное, длительно текущее заболевание, снижающее качество жизни пациентов. Лечение должно быть комплексным, с обязательной коррекцией функций кишечника, состояния микрофлоры. Тримспа – эффективный препарат, который обеспечивает обезболивающее действие и способствует нормализации нарушенной моторной функции кишечника, которая имеет место у пациентов с СРК с сопутствующей патологией ЖКТ.
Литература
- Пиманов С.И., Силивончик Н.Н. Римские IV рекомендации по диагностике и лечению функциональных гастроэнтерологических расстройств: Пособие для врачей. – М., 2016. – 160 с.: ил.
- Drossman D.A., Hasler W.L. Rome IV-Functional GI Disorders: Disordersof Gut-Brain Interaction. Gastroenterology. 2016; 150 (6): 1257-61.
- Яковенко Э.П., Агафонова Н.А., Яковенко А.В. и др. Эффективность агониста опиатных рецепторов тримебутина в терапии нарушений моторной функции желчевыводящих путей // Consilium medicum. – 2008. – № 8. – С. 52-57.
- Zhong Y.Q., Zhu J., Guo J.N. et al. A randomized and case-control clinical study on trimebutine maleate in treating functional dyspepsia coexisting with diarrhea-dominant irritable bowel syndrome // Zhonghua Nei Ke Za Zhi. – 2007. – Vol. 46. – P. 899-902.
- Uchiyama M., Iwafuchi M., Yagi M. et al. Effects of trimebutine on intestinal motility after massive small bowel resection // J. Smooth Muscle Res. – 2000. – Vol. 36. – P. 117-126.
- Delvaux M., Wingate D. Trimebutine: mechanism of action, effects on gastrointestinal function and clinical results // J. Int. Med. Res. – 1997. – Vol. 25. – P. 225-246.
- Galeone M., Benazzi E., Bossi M. et al. Clinical and instrumental evaluation by multiple colonic manometry of tiropramide, trimebutine and octylonium bromide in the irritable colon: II. Repeated oral administration // Pharmacotherapeutica. – 1986. – Vol. 4. – P. 496-509.
- Shannon S., Hollingsworth J., Cook J.J., Collins S.M. Effects of trimebutine on postprandial colonic motor activity in healthy subjects and patients with irritable bowel syndrome // Gastrointestinal Motility. – 1989. – Vol. 2. – P. 9-14.
- Lacy B.E., Mearin F., Chang L. et al. Bowel disorders. Gastroenterology. 2016; 150: 1393-407.
- Palsson O.S., Whitehead W.E., van Tilburg M.A.L. et al. Development and validation of the Rome IV diagnostic questionnaire for adults. Gastroenterology. 2016; 150: 1481-91.
- Rao S.S.C., Bharucha A.E., Chiarioni G. et al. Anorectal disorders. Gastroenterology. 2016; 150: 1430-42.
- Keefer L., Drossman D.A., Guthrie E. et al. Centrally mediated disorders of gastrointestinal pain. Gastroenterology. 2016; 150: 1408-19.
- Drossman D.A. Functional gastrointestinal disorders: history, pathophysiology, clinical features and Rome IV. Gastroenterology. 2016; 150: 1262-79.