2 квітня, 2017
Неалкогольный стеатогепатит: механизмы развития и тактика лечения
 Наиболее распространенным среди хронических заболеваний печени является неалкогольная жировая болезнь печени (НАЖБП), которая встречается у 17-33% больных, а неалкогольный стеатогепатит (НАСГ) выявляется у 2-3% из общей популяции [2, 10]. По данным ряда авторов, при первичном обследовании пациентов уже в 30-40% случаев определяется фиброз печени [11], в 20-25% случаев НАСГ может прогрессировать до цирроза печени и 30-40% пациентов умирают от его осложнений [8, 10].
Наиболее распространенным среди хронических заболеваний печени является неалкогольная жировая болезнь печени (НАЖБП), которая встречается у 17-33% больных, а неалкогольный стеатогепатит (НАСГ) выявляется у 2-3% из общей популяции [2, 10]. По данным ряда авторов, при первичном обследовании пациентов уже в 30-40% случаев определяется фиброз печени [11], в 20-25% случаев НАСГ может прогрессировать до цирроза печени и 30-40% пациентов умирают от его осложнений [8, 10].
Важную роль в развитии НАСГ наряду со многими факторами отведено окислительному стрессу. По современным представлениям, центральную роль в повреждении клеток печени при НАСГ играет стресс эндоплазматического ретикулума, который сопровождается дисфункцией митохондрий [8, 11]. Основными биохимическими процессами, имеющими отношение к энергетическому обмену и происходящими в митохондриях, являются: цикл трикарбоновых кислот (цикл Кребса), β-окисление жирных кислот, карнитиновый цикл, транспорт электронов в дыхательной цепи и окислительное фосфорилирование. Любой из указанных процессов может нарушаться и быть причиной митохондриальной недостаточности [9].
Показано, что нарушения структурно-функциональной организации митохондрий при НАЖБП включают ультраструктурные нарушения мембранного аппарата митохондрий, нарушение структуры мито-ДНК, снижение активности комплекса дыхательной цепи и β-окисления свободных жирных кислот (СЖК) [7]. Образование продуктов перекисного окисления липидов (ПОЛ) в жировых депо способствует торможению дыхательной функции митохондрий. Последующие биохимические изменения ведут к нарушению клеточного дыхания, целостности митохондрий и повышают вероятность гибели гепатоцита.
Непосредственным толчком для развития стресса эндоплазматического ретикулума служит избыточное накопление СЖК, а индуцируемые ими события получили название «липотоксического стресса» или «липоапоптоза». Максимальным повреждающим потенциалом обладают насыщенные жирные кислоты – пальмитиновая и стеариновая, что, возможно, объясняется их более медленным включением в состав эфиров. При усилении ПОЛ повреждаются мембраны гепатоцитов, их прогрессирующая гибель запускает воспалительную реакцию, создает предпосылки для активации фиброгенеза. На этом фоне нарастает выработка провоспалительных цитокинов, которые, наряду с реактивными формами кислорода, дикарбоксильными кислотами и продуктами микросомального окисления, способствуют разобщению процессов окислительного фосфорилирования, истощению митохондриальной АТФ и, в конечном итоге, некрозу и апоптозу гепатоцитов. Продукты ПОЛ повышают продукцию макрофагами трансформирующего фактора роста β и продукцию коллагена, активируя звездчатые клетки, что приводит к активации фиброгенеза [4, 9]. Оксидативный стресс ведет к истощению антиоксидантных механизмов, в частности системы глутатиона, которая включает в себя глутатион и ферменты его метаболизма: каталазу, глутатионредуктазу, глутатионтрансферазу, глутатионпероксидазу. Данная система имеет следующие точки приложения: супероксиддисмутаза восстанавливает супероксид; глутатионпероксидаза и каталаза восстанавливают Н2О2; глутатионпероксидаза и глутатионтрансфераза восстанавливают органические гидропероксиды свободных жирных кислот, нуклеотидов, нуклеиновых кислот; глутатионтрансфераза, глиоксалаза и формальдегиддегидрогеназа обезвреживают вторичные продукты пероксидации и другие окисленные соединения [5, 7].
Субстратом реакций конъюгации и восстановления, катализируемых глутатион-S-трансферазой в цитозоле, микросомах и в митохондриях является глутатион. В организме система глутатиона обеспечивает:
· антиоксидантную защиту путем связывания свободных радикалов и защиты от активных форм кислорода;
· детоксикацию за счет выведения токсинов и химических веществ, которые уже абсорбировались и циркулируют в организме и нейтрализации токсинов в желудочно-кишечном тракте до их абсорбции, а также путем повышения устойчивости клеток к вредным воздействиям;
· иммуностимуляцию – стимуляцию естественных киллеров (NK-клеток) и активацию Т-лимфоцитов;
· образование, восстановление и изомеризацию дисульфидных связей;
· влияние на активность ферментов и других белков;
· поддержание функций мембран;
· коферментные функции;
· участие в обмене эйкозаноидов;
· глутатион выступает как резерв цистеина;
· оказывает влияние на синтез нуклеиновых кислот и белка;
· участвует в процессах пролиферации.
Система глутатиона восстанавливает продукты ПОЛ, фосфолипидов мембран, белков, нуклеиновых кислот и выводит их из организма в виде нетоксичных конъюгатов. Глутатион восстанавливает другие низкомолекулярные антиоксиданты, такие как витамины C и E, переводя их в активное состояние [1, 3].
В настоящее время существуют убедительные доказательства о вовлечении системы глутатиона в реакции воспаления и иммунного ответа. Глутатион реализует свои защитные функции, в том числе защиту клеток от оксидативного стресса через восстановленную форму. В последние 10-15 лет получены новые данные, относящиеся к системе глутатиона в эритроцитах и сыворотке крови. Изучается роль глутатиона при респираторных заболеваниях, воспалительных заболеваниях кишечника, интоксикациях любой этиологии, при лечении СПИДа, онкологической патологии, сахарном диабете, в процессах старения.
Таким образом, глутатион принимает активное участие в процессах детоксикации и выведения вредных веществ из организма: почек, печени, легких, а также способствует нормализации окислительно-восстановительного баланса при заболеваниях, сопровождающихся дисфункцией эндотелия и оксидативным стрессом [6, 11, 13].
Известно, что основным источником циркулирующего в плазме крови глутатиона является печень, поэтому при нарушении ее функций на фоне НАСГ возникает дефицит эндогенного глутатиона. Имеются результаты многочисленных клинических исследований, которые подтверждают терапевтическую эффективность применения глутатиона как при хронических заболеваниях печени, так и при различной патологии с целью восполнения его эндогенных концентраций в организме.
В настоящее время на фармацевтическом рынке Украины имеется препарат Гепавал – гепатопротектор, содержащий восстановленный L-глутатион. Препарат обладает антиоксидантными свойствами, иммуномодулирующим эффектом, нейтрализуют действие эндо- и экзотоксинов, обезвреживает более 3000 окисленных веществ (перекиси, продукты перекисного окисления липидов, фосфолипидов мембран, белков, нуклеиновых кислот, ксенобиотики) и выводит их из организма в виде нетоксичных конъюгатов, препятствуя повреждению клеток и обрывая каскад реакций оксидативного стресса, который является одним из патогенетических факторов развития НАСГ.
По данным J.J. Haddad и соавт. (2005), глутатион оказывает модулирующее действие в качестве противовоспалительной сигнальной молекулы в окислительно-восстановительных процессах при оксидативном стрессе. Авторы подчеркивают, что глутатион можно рассматривать в качестве репрезентативного маркера антиоксидантной способности клетки. Глутатион и окислительно-восстановительный потенциал клетки являются компонентами системы клеточной сигнализации, влияющей на транслокацию фактора транскрипции NF каппа В, который регулирует синтез цитокинов и молекул адгезии.
При сравнительном исследовании эффективности глутатиона и витамина С в качестве антиоксидантов при НАЖБП было показано достоверное снижение уровня аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), глутаминтрансферазы в сравнении с исходными значениями в группе пациентов, получавших глутатион. Общая эффективность лечения в основной и контрольной группах была оценена в 87,5 и 30,0% соответственно [6].
Двойное слепое плацебо-контролируемое исследование биомаркеров иммунной системы у здоровых добровольцев [14] показало, что длительный прием глутатиона (до 6 мес) достоверно повышал активность клеток врожденного иммунитета (естественных киллеров – NK-клеток), стимулировал пролиферацию Т-лимфоцитов и не сопровождался развитием побочных эффектов.
На клинической базе кафедры гастроэнтерологии Харьковской медицинской академии последипломного образования обследовано 36 больных с верифицированным диагнозом НАСГ. Возраст пациентов составлял от 31 до 60 лет, из них было 20 (55,6%) мужчин и 16 (44,4%) женщин. Пациенты были разделены на две группы – 1-я группа – 25 (69,4%) больных с НАСГ минимальной степени активности, 2-я группа – 11 (30,6%) пациентов с НАСГ умеренной степени активности. Контрольную группу составляли 20 здоровых лиц.
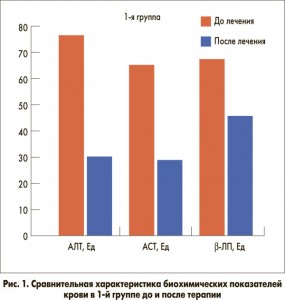
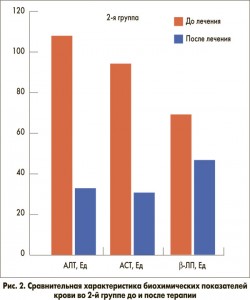
Пациенты получали монотерапию препаратом Гепавал перорально в суточной дозе 500 мг в течение 4 недель. Об эффективности применяемого препарата судили на основании динамики клинических симптомов и биохимических показателей печеночных проб в сыворотке крови (АЛТ, АСТ, липидного профиля: общего холестерина – ОХ, β-липопротеидов (β-ЛП), триглицеридов – ТГ, липопротеидов низкой плотности – ЛПНП, липопротеидов очень низкой плотности – ЛПОНП) (рис. 1, 2).
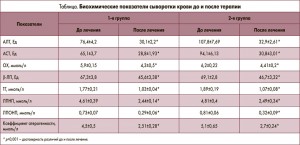
По данным лабораторных исследований, у всех больных выявлен синдром цитолиза: повышение активности аминотрансфераз в сыворотке крови – в 1-й группе показатель АЛТ составлял 76,4±4,2 Ед (р<0,001); АСТ – 65,1±3,7 Ед (р<0,001), во 2-й группе: АЛТ – 107,8±7,69 Ед (р<0,001); АСТ – 94,1±6,13 Ед (р<0,001). Средние значения отражающих функциональное состояние печени показателей, таких как белковые фракции сыворотки крови, уровень билирубина, его фракций, щелочной фосфатазы и тимоловой пробы, у пациентов не превышали показателей нормы. При анализе липидного профиля у всех больных отмечалось достоверное повышение показателей ОХ (1-я группа: 5,9±0,15 ммоль/л; p<0,001, 2-я группа: 6,2±0,22 ммоль/л; p<0,001), β-ЛП (1-я группа: 67,3±3,8 Ед; p<0,001, 2-я группа: 69,1±2,8 Ед; p<0,001), ТГ (1-я группа: 1,77±0,21 ммоль/л; p<0,001, 2-я группа: 1,89±0,19 ммоль/л; p<0,001), ЛПНП (1-я группа: 4,61±0,39 ммоль/л; p<0,001, 2-я группа: 4,81±0,4 ммоль/л; p<0,001), ЛПОНП (1 группа: 0,73±0,07 ммоль/л; p<0,001, 2 группа: 0,81±0,06 ммоль/л; p<0,001), коэффициента атерогенности (1-я группа: 4,5±0,5 ммоль/л; p<0,001, 2-я группа: 5,1±0,65 ммоль/л; p<0,001). Уровень ЛПВП достоверно не отличался от показателей контрольной группы.
Полученные данные свидетельствуют о наличии у пациентов синдрома цитолиза и дислипидемии, которые являются клиническими предикторами развития фибротических процессов в печени. Уровень гипертриглицеридемии >1,7 ммоль/л служит значимым фактором неблагоприятного течения НАСГ.
На фоне проводимой терапии в биохимических показателях отмечена положительная динамика. Достоверно снизилась активность цитолитических ферментов печени (p<0,001) в сравнении с исходными. Показатель АЛТ в 1-й группе снизился до 30,1±2,2 Ед (p<0,001), АСТ – 28,8±1,93 Ед (p<0,001), во 2-й группе эти показатели составили: АЛТ – 32,9±2,61 Ед (p<0,001), АСТ – 30,8±3,01Ед (p<0,001) (табл.). Применение препарата Гепавал восполняет дефицит эндогенного глутатиона при нарушениях функции печени, что приводит к нормализации уровней аминотрансфераз, уменьшает воспалительные процессы в печени и повреждение эндотелия гепатоцитов. Основные эффекты Гепавала связаны с его свойствами мощного детоксиканта, что приводит к устранению последствий окислительного стресса как основного патогенетического фактора прогрессирования НАЖБП.
Показатели липидного обмена после проведения комплексной терапии стали достоверно ниже, чем до лечения у всех пациентов. ОХ составил 4,3±0,5 ммоль/л (p<0,001) в 1-й группе и 4,41±0,2 ммоль/л (p<0,001) – во 2-й группе, β-ЛП соответственно – 45,6±3,38 Ед (p<0,001) и 46,7±3,32 Ед (p<0,001), ТГ – 1,03±0,04 ммоль/л (p<0,001) и 1,07±0,08 ммоль/л (p<0,001), ЛПНП – 2,44±0,14 ммоль/л (p<0,001) и 2,49±0,34 ммоль/л (p<0,001), ЛПОНП – 0,29±0,06 ммоль/л (p<0,001) и 0,32±0,09 ммоль/л (p<0,001), коэффициент атерогенности – 2,51±0,28 ммоль/л (p<0,001) и 2,7±0,24 ммоль/л (p<0,001). Гепавал тормозит синтез холестерина, восстанавливает гидроперекиси липидов в составе мембран, что предупреждает развитие стеатоза гепатоцитов и оказывает положительное влияние на энергетический и липидный обмен в печени.
Таким образом, нормализация биохимических показателей свидетельствует об уменьшении воспалительной реакции, дислипидемии под влиянием терапии препаратом Гепавал. Пероральный прием препарата является патогенетически обоснованным инструментом нормализации окислительно-восстановительного баланса при НАСГ. Восполнение дефицита эндогенного глутатиона сопровождается улучшением печеночных биомаркеров и положительной клинической динамикой у пациентов с НАСГ.
Литература
1. Бабак О.Я. Глутатион в норме и при патологии: биологическая роли и возможности клинического применения / О.Я. Бабак // Здоровье Украины. – 2015. – № 1. – С. 1-3.
2. Зайцева О.Е. Неалкогольный стеатогепатит. Больше чем просто стеатоз? / О.Е. Зайцева, О.И. Нишкумай, Л.Г. Карпович // Therapia. – 2016. – № 7-8. – С. 111.
3. Звягинцева Т.Д. Хронические заболевания печени и оксидативный стресс / Т.Д. Звягинцева, А.И. Чернобай // Здоровье Украины. – 2015. – № 2. – С. 58-59.
4. Променашева Т.Е. Роль оксидативного стресса и системы глутатиона в патогенезе неалкогольной жировой болезни печени / Т.Е. Променашева, Л.С. Колесниченко, Н.М. Козлова // Бюллетень ВСНЦ СО РАМН. – 2014. – № 5 (99). – С. 80-83.
5. Харченко Н.В. Современные подходы к лечению патологии печени: борьба с оксидативным стрессом / Н.В. Харченко // Здоровье Украины. – 2014. – № 21. – С. 40-41.
6. Effect of Reduced Glutathione in Treatment of Non-alcoholic Fatty Liver Disease. / J. Nuyun, Y. Xiaohu, S. Jianping // China Pharmaceuticals. – 2005. – Vol. 12. – P. 714-733.
7. Hashemi M., Eskandari-Nasab E. Fazaeli A., Bahari A. et al. Association of genetic polimorphisms of glutathione-S-transferase genes (GSTT1, GSTM1 and GSTP1) and susceptibility to nonalcoholic fatty liver disease in Zahedan, Southeast Iran // DNA Cell Biol. – 2012. – Vol. 31, N5. – Р. 7-672.
8. Heritability of nonalcoholic fatty liver disease. / J.B. Schwimmer, M.A. Celedon, J.E. Lavine et al. // Gastroenterology. – 2009. – Vol. 136 (5). – P. 1585-1592.
9. Hydrogen sulfide inhibits myocardial injury induced by homocysteine in rats / L. Chang, B. Geng, F. Yu et al. // Amino Acids. – 2008. – Vol. 34 (4). – P. 573-585.
10. Interaction of aldehydes derived from lipid peroxidation and membrane proteins / S. Pizzimenti, E. Ciamporcero, M. Daga et al. // Frontiers in Physiology. – 2013. – Vol. 4. – article 242.
11. Kleiner D. Non-alcoholic fatty liver disease: pathologic patterns and biopsy evaluation in clinical research. / D. Kleiner, E. Brunt // Semin Liver Dis. – 2012. – Vol. 32. – P. 003-013.
12. L-gamma-Glutamyl-L-cysteinyl-glycine and GSH-related enzymes in the regulation of pro- and anti-inflammatory cytokines: a signaling transcriptional scenario for redox immunologic sensor? / J.J. Haddad, H.L. Harb // Mol Immunol. – 2005. – 42 (9). – P. 987-1014.
13. Prevalence of risk factors of non–alcoholic fatty liver disease in potential living donors in Korea: a review of 589 consecutive liver biopsies in a single center. / J.Y. Lee, K.M. Kim, S.G. Lee et al. // J Hepatol. – 2007. – Vol. 47. – P. 239-244.
14. Randomized controlled trial of oral glutathione supplementation on body stores of glutathione. / J.P. Richie, S. Nichenametla, W. Neidig et al. // European Journal of Nutrition. – 2015. – Vol. 54 (2). – P. 251-263.