6 лютого, 2017
Особенности изменения системы гемостаза у беременных с гестационным сахарным диабетом
Продолжение. Начало в № 1.
Протромбогенные факторы эндотелия
Фактор Виллебранда синтезируется клетками эндотелия и циркулирует в плазме крови со средним периодом полураспада около 18 ч. В организме человека ФВ выполняет несколько функций. Во-первых, он образует нековалентный комплекс с фактором свертывания VIII в плазме крови. Он необходим для стабилизации фактора VIII в кровотоке и для его участия в качестве кофактора в образовании тромба. Во-вторых, он выполняет роль своеобразного мостика между субэндотелиальными структурами поврежденной стенки сосуда и тромбоцитами, а также между отдельными тромбоцитами на этапах адгезии, распластывания и агрегации тромбоцитов. Особая роль ФВ в гемостазе определяется его структурой, представляющей собой серию различных по размеру (от 500 тыс. до 20 млн Да) мультимеров, состоящих из многократно повторяющихся субъединиц, в которых имеются домены связывания с гликопротеиновыми (GP) рецепторами тромбоцитов (Ib и IIb/IIIa), коллагеном, гепарином, фактором свертывания крови VIII. Основная функция ФВ – обеспечение адгезии тромбоцитов к сосудистой стенке в месте ее повреждения, в том числе и тогда, когда поврежден преимущественно эндотелий.
Ингибитор активатора плазминогена 1 типа (PAI‑1), или серпин Е1, – основной ингибитор t-PA и урокиназы, является основным ферментом, подавляющим фибринолиз. PAI‑1 – один из важнейших составляющих механизма регуляции фибринолиза, вызывающих инактивацию активаторов плазминогена; продуцируется эндотелиальными клетками, гепатоцитами, гладкомышечными клетками, мегакариоцитами и мезотелиальными клетками, фибробластами. Уровень PAI‑1 в крови возрастает при многих патологических состояниях. В месте повреждения активированные тромбоциты выделяют избыточное количество PAI‑1, предотвращая преждевременный лизис фибрина. При повышении концентрации PAI снижается активность противосвертывающей системы крови, что приводит к увеличению риска тромбообразования. Резким повышением уровня PAI‑1 характеризуется синдром привычного невынашивания беременности.
Эндотелин – эндогенный 21-членный пептид, синтезируемый эндотелиальными клетками сосудов. Эффекты эндотелина реализуются даже в случае его присутствия в чрезвычайно малых дозах (в одну миллионную мг). Основной механизм действия заключается в высвобождении кальция, что вызывает стимуляцию всех фаз гемостаза (начиная с агрегации тромбоцитов и заканчивая образованием тромба), сокращение и рост гладкомышечных клеток сосудов, приводящие к утолщению стенки последних и уменьшению их диаметра. В организме присутствуют 3 изоформы эндотелина (эндотелин‑1, 2, 3). Синтез эндотелина стимулируется тромбином, адреналином, ангиотензином, ИЛ‑1 и различными факторами роста. В естественных условиях при повышении концентрации эндотелинов наблюдается вазоконстрикторный эффект, обусловленный сокращением гладкой мускулатуры сосудов. Эндотелин – один из факторов, играющих важную роль в механизмах развития диабета и других патологических процессов.
Ангиотензин IV. Механизм образования ангиотензина IV заключается в следующем. Ангиотензин I преобразуется в ангиотензин II под действием АПФ, который отщепляет две последние (C-концевые) аминокислоты. Так образуется активный октапептид из 8 аминокислот – ангиотензин II. Дальнейшая его деградация приводит к образованию еще меньших пептидов: ангиотензина III (7 аминокислот) и ангиотензина IV (6 аминокислот), которые обладают сниженной по сравнению с таковой ангиотензина II активностью. Ангиотензин IV является гексапептидом, он обладает протромботическим эффектом, регулируя адгезию и агрегацию тромбоцитов и синтез ингибиторов PAI‑1 и PAI‑2.
sE-селектин, или растворимый E-селектин, представляет собой гликопротеин с молекулярной массой 115 кДа; является первой индуцибельной адгезивной молекулой, выявленной на эндотелиальных клетках и характерной только для эндотелия. sЕ-селектин взаимодействует с сиалил-Lewis Х-углеводными остатками. Поверхностная экспрессия наблюдается приблизительно через 1 ч, достигает максимума через 4-8 ч и прекращается через 24-48 ч.
Молекула адгезии сосудистого эндотелия 1 типа (Vascular Cellular Adhesion Molecule‑1, s-VCAM‑1) является трансмембранным гликопротеином, членом семейства иммуноглобулинов. Этот белок экспрессируется в сосудистом эпителии при ряде воспалительных процессов и является одним из средств мобилизации лейкоцитов из крови в ткань. VCAM‑1 содержит 7 иммуноглобулинпoдобных доменов, экспрессируется на эндотелии, макрофагах, стромальных клетках костного мозга и некоторых других типах клеток. Экспрессия VCAM‑1 требует активации клеток цитокинами, достигает максимума через 6-12 ч и длительно сохраняется на высоком уровне. Функция VCAM‑1 – обеспечение адгезии лимфоцитов, моноцитов и эозинофилов (но не нейтрофилов) к активированному эндотелию с их последующей миграцией в очаг воспаления.
Молекула клеточной адгезии (Inter Cellular Adhesion Molecule 1, ICAM‑1) присутствует в низкой концентрации на мембранах лейкоцитов и эндотелиальных клеток. ICAM‑1 обеспечивает фиксацию лейкоцитов на поверхности эндотелия и последующий выход из сосудистого русла в ткани. Данный процесс определяется взаимодействием ICAM‑1 с β2-интегринами лейкоцитов. В организме ICAM‑1 существует в связанной с мембраной и растворимой форме. Последняя (s-ICAM‑1) обнаруживается в крови и других биологических жидкостях.
Т аким образом, ДЭ является первичным повреждением при инсулинорезистентности. Уже на начальных стадиях сосудистых осложнений у пациентов с нарушением углеводного обмена имеет место та или иная степень повреждения эндотелиальных клеток. Маркеры повреждения эндотелия при нарушении углеводного обмена указаны в таблице 5.
аким образом, ДЭ является первичным повреждением при инсулинорезистентности. Уже на начальных стадиях сосудистых осложнений у пациентов с нарушением углеводного обмена имеет место та или иная степень повреждения эндотелиальных клеток. Маркеры повреждения эндотелия при нарушении углеводного обмена указаны в таблице 5.
Тромбоциты
Тромбоциты – это безъядерные фрагменты цитоплазмы мегакариоцитов. Интактные тромбоциты имеют форму диска или пластины диаметром 2,8-3,4 мкм, толщиной 0,8-1,2 мкм и объемом 5,7-8,9 мкм3 (средний объем – 7,5 мкм3).
Рецепторы мембраны тромбоцитов
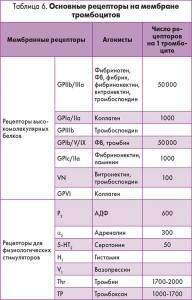
Специфические функции тромбоцитов реализуются посредством активного взаимодействия с другими клетками, плазменными протеинами и соединениями небелковой природы. Роль посредника в этих процессах принадлежит рецепторам тромбоцитов. Данные об основных рецепторах на поверхности мембраны тромбоцитов представлены в таблице 6.
Дисфункция тромбоцитов при ГСД
Тромбоциты циркулируют в крови в неактивном состоянии и не взаимодействуют с интактным эндотелием. При повреждении стенки сосуда запускается каскад процессов, которые приводят к образованию тромба из тромбоцитов и фибрина. Этот процесс состоит из 3 стадий.
Первой стадией свертывания крови является прилипание тромбоцитов к субэндотелиальному матриксу или активированному эндотелию. Данный процесс может быть инициирован повреждением стенки сосуда, вызываемой свободными радикалами, вирусной инфекцией, бактериальными токсинами, цитокинами, иммунными комплексами и др. При этом из эндотелиальных клеток в кровь высвобождается ФВ, который связывает и стабилизирует фактор VIII и обеспечивает связь между тромбоцитами и сосудистой стенкой (адгезия) и тромбоцитами (агрегация).
На второй стадии (стадии адгезии тромбоцитов) тромбоциты формируют более стабильный монослой над тромбогенной поверхностью. Данный процесс обеспечивается различными рецепторами. В области повреждения кровеносных сосудов обычно обнаруживается избыток коллагена. Рецепторы коллагена, такие как GPIa/IIa, в первую очередь вступают во взаимодействие с тромбоцитами и формируют комплекс, поддерживая связь тромбоцита с коллагеном.
Третьей стадией является агрегация тромбоцитов, в процессе которой множество тромбоцитов связываются между собой с помощью ФВ и фибриногена через активированные рецепторы тромбоцитов GPIIb/IIIa. Эта стадия является общей для большинства путей активации тромбоцитов. После связывания с данным рецептором фибриноген действует как мостик между прилегающими тромбоцитами. Управляемая тромбином трансформация фибриногена в фибрин стабилизирует этот агрегат тромбоцитов и формирует тромб.
Антикоагулянтный потенциал эндотелия способствует циркуляции тромбоцитов в неактивном состоянии при физиологической беременности. При нарушении углеводного обмена происходит активация агрегации тромбоцитов. Это приводит к изменению структуры поверхностной мембраны, что связано с процессом гликилирования белков мембраны и дислипидемией. В тромбоцитах изменяется метаболизм арахидоновой кислоты, способствующий повышению уровня тромбоксана А2 и, соответственно, усилению агрегационных свойств тромбоцитов. Ингибирование в мембранах тромбоцитов Na/K-АТФазы, активация протеинкиназы С, увеличение внутриклеточного уровня кальция нарушают текучесть мембран тромбоцитов. Тромбоциты производят меньше оксида азота и простациклина, которые подавляют их взаимодействие с сосудистой стенкой. Концентрация NO-синтазы в тромбоцитах у беременных с ГСД на 50% меньше, чем у беременных без диабета. Увеличение агрегационной активности тромбоцитов при диабете также может быть связано с активацией молекул адгезии, таких как активированный комплекс GPIIb/IIIa, лизосомальный Gp53, тромбоспондин и P-селектин.
Тромбоцитарный индекс
Для определения активности тромбоцитов и способности к видоизменениям используется один из тромбоцитарных индексов – средний объем тромбоцитов (mean plateled volume, MPV). В норме MPV составляет 8,9±1,4 фемтолитр. MPV – маркер функции тромбоцитов и их активации. У беременных с ГСД могут отмечаться изменение морфологии и функции тромбоцитов, а также увеличение MPV.
Плазменное звено гемостаза
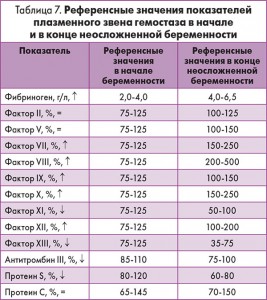 По мере прогрессировании беременности усиливается коагуляционный потенциал крови (табл. 7).
По мере прогрессировании беременности усиливается коагуляционный потенциал крови (табл. 7).
Как видно из данных, представленных в таблице 7, беременность не оказывает влияния на концентрацию в крови факторов II (протромбина), V (проакцелерина) и XIII (фибринстабилизующего фактора). В то же время отмечен существенный рост содержания факторов VII (проконвертина), VIII (антигемофильного глобулина), IX (фактора Кристмаса), X (фактора Стюарта-Прауэра), XII (фактора Хагемана) и снижение концентрации фактора XI (фактора Розенталя) во время беременности. Уровень фибриногена в плазме увеличивается с 3-го месяца гестации, достигая своего пика к моменту родов (4,0-6,5 г/л).
Нарушения коагуляционного звена гемостаза при ГСД
Установлено, что плазменные уровни многих факторов свертывания, среди которых фибриноген, факторы VII, VIII, XI, XII, калликреин и ФВ, повышены у больных с нарушением углеводного обмена. Многие исследователи выявили повышение концентрации фибриногена в плазме у беременных с ГСД и прямую связь между содержанием гликозилированного гемоглобина и уровнем фибриногена.
Состояние антикоагулянтной системы при ГСД
При ГСД происходит снижение активности одного из важных антикоагулянтов – антитромбина III (АТ III). Показано снижение активности АТ III у беременных с ГСД, и установлено, что активность АТ III обратно коррелирует со степенью гликозилирования белков плазмы. Причиной снижения активности АТ III является его неферментативное гликозилирование.
Данные относительно протеина С являются противоречивыми: некоторые исследователи показали снижение его активности при нарушении углеводного обмена, а другие – сообщили о повышении концентрации протеина С и его кофактора – протеина S. Установлена отрицательная корреляция между уровнем протеина С и значениями гликемии.
Фибринолиз
Помимо изменений в плазменной системе коагуляции, у беременных с ГСД также возникают нарушения системы фибринолиза, что проявляется снижением этого процесса и создает условия для развития прокоагулянтного состояния. PAI‑1 считается главным фактором, отвественным за ингибирование фибринолитической активности. Гипергликемия сопряжена с увеличением секреции PAI‑1. Это обусловливает снижение фибринолитической активности. Основной причиной повышения уровня PAI‑1 является инсулинорезистентность, которая приводит к развитию тромботических состояний.
При нарушении углеводного обмена возникают выраженные изменения со стороны всех звеньев системы гемостаза. Для беременных с ГСД характерны повышение активности сосудисто-тромбоцитарного, прокоагулянтного звеньев системы гемостаза и снижение активности фибринолиза. ГСД – важный предиктор развития нарушений в системе гемостаза и возможных венозных тромбоэмболий при беременности.
Медична газета «Здоров’я України 21 сторіччя» № 2 (399), січень 2017 р.