5 лютого, 2017
Особенности изменения системы гемостаза у беременных с гестационным сахарным диабетом
По данным глобального отчета Всемирной организации здравоохранения (2016), на сегодня во всем мире сахарным диабетом (СД) страдают 422 млн человек. СД признан одним из наиболее важных неинфекционных заболеваний, распространение которого приобрело характер пандемии. К 2035 г. количество больных данной патологией может достичь 592 млн человек. По состоянию на начало 2015 г. в Украине зарегистрировано 1,2 млн пациентов с СД. Учитывая тот факт, что на один зарегистрированный случай заболевания приходится 2-3 незарегистрированных, можно говорить о 2-2,5 млн больных СД.
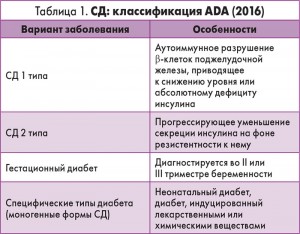 В соответствии с классификацией American Diabetes Association (ADA) выделяют 4 основных варианта СД (табл. 1).
В соответствии с классификацией American Diabetes Association (ADA) выделяют 4 основных варианта СД (табл. 1).
На данном этапе чрезвычайную остроту имеет проблема нарушения углеводного обмена во время беременности. Среди женщин репродуктивного возраста 0,3% пациенток исходно имеют СД. В зависимости от популяции на долю СД, который возникает во время беременности (гестационный сахарный диабет – ГСД), приходится 3-17% случаев заболевания. Причины возникновения ГСД окончательно не выяснены.
Считается, что во время созревания плаценты происходит постепенное нарастание инсулинорезистентности, обусловленное изменением концентрации таких гормонов, как плацентарный лактоген, прогестерон, эстрогены, кортизол, пролактин, содержание которых в крови повышается с увеличением сроков беременности. Одновременно отмечаются изменение метаболизма инсулина, его ускоренное разрушение и активация инсулиназы плаценты. Следствием этих процессов является повышение концентрации глюкозы в крови беременных. Актуальность проблемы нарушения углеводного обмена во время беременности связана с осложнениями, которые могут развиться на разных этапах гестации. Нежелательные исходы для матери и плода возможны при любом варианте нарушений углеводного обмена – как обнаруженных до беременности, так и диагностированых только во время беременности. Примерно у 10% женщин после родов сохраняются признаки заболевания, которое впоследствии трансформируется в СД 2 типа, а у 50% пациенток, перенесших во время беременности ГСД, на протяжении последующих 10-15 лет развивается инсулиннезависимый СД.
Изменение углеводного обмена в гестационном периоде объясняется тем обстоятельством, что растущий плод нуждается в энергетическом материале, главным образом в глюкозе. Более того, частично блокируется действие инсулина в результате увеличения уровня гормонов беременности, в первую очередь прогестерона, что проявляется на сроке ≥20 нед. Чтобы поддержать уровень глюкозы крови в пределах нормы, поджелудочная железа здоровой беременной вырабатывает повышенное количество инсулина. Если клетки поджелудочной железы не справляются с повышенной нагрузкой, возникает относительный или абсолютный дефицит инсулина и развивается ГСД.
После акушерско-гинекологических проблем, возникающих у беременных с ГСД, на втором месте по частоте стоят нарушения системы гемостаза. Хорошо известно, что при физиологической беременности отмечается повышение коагуляционных свойств крови, направленное на предупреждение фатального кровотечения в родах. Увеличение уровня маркеров тромбинемии во время гестации представляет собой конечный результат взаимодействия и противодействия различных звеньев системы гемостаза, обладающих прокоагулянтной, антикоагулянтной и фибринолитической активностью. При значительном изменении количества и/или активности многих участников гемостатических реакций этот период жизни женщины, как правило, не сопровождается тромбозом или кровотечениями благодаря формированию особого варианта гемостатического баланса. Гиперкоагуляция при физиологическом течении беременности остается всего лишь потенциальной (не сопровождается внутрисосудистым тромбообразованием, не нарушает реологических свойств крови). Гемостаз активируется одновременно с увеличением срока беременности.
Если гемостаз женщины изначально повышенно активен, то в ходе беременности могут образоваться микротромбы в сосудах матки или плаценты, что приводит к выкидышу либо к замершей беременности. Нарушения гемостаза у беременных с ГСД могут быть обусловлены изменениями функции эндотелия, активности тромбоцитов, плазменных факторов свертывания и системы фибринолиза.
Эндотелий
Эндотелий представляет собой активный эндокринный орган (однослойный пласт специализированных клеток). Вес эндотелия составляет около 1,8 кг, длина монослоя – примерно 7 км, площадь – 400 м2 (6 теннисных кортов). Количество эндотелиоцитов приближается к 1,5 трлн.
Эндотелий сосудов выполняет барьерную, секреторную, гемостатическую, вазотоническую функции; играет важную роль в процессах воспаления, ремоделирования сосудистой стенки, клеточного и гуморального иммунного ответа, синтеза факторов воспаления и их ингибиторов, миграции лейкоцитов в сосудистую стенку.
Фенотипы эндотелия
Необходимо отметить, что эндотелиальные клетки различаются по своему фенотипу как в сосудах различных органов, так и в пределах одного органа. Например, образование фактора фон Виллебранда (ФВ) в эндотелии разных сосудов существенно отличается. В легких, сердце, скелетных мышцах обнаружен высокий уровень т-РНК ФВ, тогда как в эндотелии сосудов почек и печени – низкий. При этом атромбогенные свойства сосудов легких связаны в основном с образованием тромбомодулина (ТМ), а атромбогенность сосудов сердца и печени ассоциирована с тканевым активатором плазминогена (t-PA).
Фенотип эндотелиальных клеток зависит от многих факторов, важнейшим из которых является механическое воздействие (величина давления в сосуде, скорость потока крови, характер кровотока).
Дисфункция эндотелия
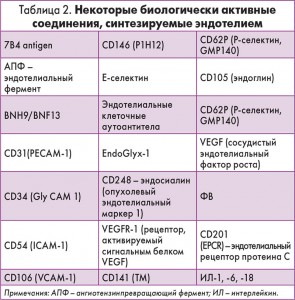 Дисфункция эндотелия (ДЭ) – важное патогенетическое звено таких патологических состояний, как атеросклероз, эндогенные и экзогенные интоксикации, нарушение липидного обмена, сепсис, хронические воспалительные процессы, тяжелые формы аутоиммунной патологии, антифосфолипидный синдром, гипергомоцистеинемия, ДВС-синдром и др. ДЭ связана также с нарушением углеводного обмена. При исследовании эндотелия обнаруживают все новые соединения, которые являются триггерами развития состояний, связанных с ДЭ. Некоторые из них перечислены в таблице 2.
Дисфункция эндотелия (ДЭ) – важное патогенетическое звено таких патологических состояний, как атеросклероз, эндогенные и экзогенные интоксикации, нарушение липидного обмена, сепсис, хронические воспалительные процессы, тяжелые формы аутоиммунной патологии, антифосфолипидный синдром, гипергомоцистеинемия, ДВС-синдром и др. ДЭ связана также с нарушением углеводного обмена. При исследовании эндотелия обнаруживают все новые соединения, которые являются триггерами развития состояний, связанных с ДЭ. Некоторые из них перечислены в таблице 2.
Биологически активные соединения, продуцируемые эндотелием, участвуют во многих механизмах гемостаза и регуляции местного кровотока. Состав этих соединений определяется состоянием эндотелиоцитов: в физиологическом состоянии они обеспечивают адекватный местный кровоток, синтезируя мощные антикоагулянты, вазодилататоры и другие вещества. При нарушении функции или структуры эндотелия существенно меняется спектр выделяемых им биологически активных соединений.
 Эндотелий начинает секретировать агреганты, коагулянты, вазоконстрикторы и другие факторы. При этом многие из них способствуют генерализации патологического процесса. Все соединения, синтезируемые эндотелием, разделяют в соответствии с их функциями (табл. 3).
Эндотелий начинает секретировать агреганты, коагулянты, вазоконстрикторы и другие факторы. При этом многие из них способствуют генерализации патологического процесса. Все соединения, синтезируемые эндотелием, разделяют в соответствии с их функциями (табл. 3).
С учетом принципов функционирования эндотелия факторы эндотелиального происхождения разделяют на несколько групп:
- факторы, постоянно образующиеся в эндотелии и выделяющиеся в кровь (оксид азота, простациклин);
- факторы, накапливающиеся в эндотелии и выделяющиеся из него при стимуляции, активации или повреждении (ФВ, Р-селектин, t-PA);
- факторы, в физиологических условиях практически не синтезируемые, но их продукция резко возрастает при активации эндотелия (эндотелин‑1, ICAM‑1, VCAM‑1, Е-селектин, ингибитор активатора плазминогена‑1 – PAI‑1).
Антикоагулянтные и прокоагулянтные свойства эндотелия обеспечиваются несколькими механизмами (табл. 4).
Антитромбогенные факторы эндотелия
 Оксид азота (NO) способен к быстрой диффузии и проникновению через плотные клеточные слои и межклеточное пространство. Образование NO в организме происходит при ферментативном окислении L-аргинина под действием цитохром P‑450-подобных гемопротеинов. Молекула NO содержит неспаренный электрон, имеет высокую химическую активность, легко вступает в реакцию со многими клеточными структурами и химическими компонентами. Это обусловливает чрезвычайное многообразие ее биологических эффектов, иногда противоположных. Оксид азота постоянно синтезируется из аминокислоты L-аргинина при участии ферментов NO-синтаз (NOS) и выделяется из эндотелия. Активность NOS наиболее выражена в эндотелии артериальных сосудов и минимальна в эндотелии капилляров и вен. В условиях in vivo период полураспада оксида азота составляет доли секунды.
Оксид азота (NO) способен к быстрой диффузии и проникновению через плотные клеточные слои и межклеточное пространство. Образование NO в организме происходит при ферментативном окислении L-аргинина под действием цитохром P‑450-подобных гемопротеинов. Молекула NO содержит неспаренный электрон, имеет высокую химическую активность, легко вступает в реакцию со многими клеточными структурами и химическими компонентами. Это обусловливает чрезвычайное многообразие ее биологических эффектов, иногда противоположных. Оксид азота постоянно синтезируется из аминокислоты L-аргинина при участии ферментов NO-синтаз (NOS) и выделяется из эндотелия. Активность NOS наиболее выражена в эндотелии артериальных сосудов и минимальна в эндотелии капилляров и вен. В условиях in vivo период полураспада оксида азота составляет доли секунды.
На ранней стадии дисфункции эндотелия уровень NO повышается, что свидетельствует о компенсаторной реакции организма. При истощении его компенсаторных возможностей происходит снижение уровня NO. Гипопродукция NO может возникать под действием высоких концентраций глюкозы и сопряжена с повышением тонуса сосудов и свертываемости крови. Инсулинорезистентность приводит к снижению инсулинстимулированной выработки NO эндотелиальными клетками. Избыток инсулина также может оказывать повреждающий эффект на сосудистую стенку посредством стимуляции различных факторов роста. Установлен факт тесной ассоциации инсулинорезистентности и эндотелиальной дисфункции.
Простациклин (PGI2). В эндотелиальных клетках из мембранных фосфолипидов под действием фосфолипаз высвобождается арахидоновая кислота, из которой при участии мультиферментного комплекса циклооксигеназы и простациклинсинтетазы синтезируется простациклин. Высвобождение простациклина из эндотелия стимулируют брадикинин, субстанция Р, тромбоцитарный и эпидермальный факторы роста, тромбин, ИЛ‑1, адениновые нуклеотиды, ангиотензин, гипоксия и увеличение напряжения сдвига.
Простациклин обладает свойством расширять сосуды. Механизм вазодилатирующего действия заключается в стимуляции синтеза цАМФ в гладкомышечных клетках сосудов и снижении их чувствительности к кальцию. Вазодилататорное действие простациклина обусловлено также активацией АТФ-зависимых калиевых каналов и гиперполяризацией гладкомышечных клеток сосудов. Между антиагрегационной способностью простациклина и проагрегационными эффектами тромбоксана А2 в нормальных условиях имеет место динамическое равновесие, регулирующее агрегацию тромбоцитов. При преобладании эффекта простациклина над активностью тромбоксана А2 агрегации тромбоцитов не происходит, а сниженная или утраченная продукция простациклина участком эндотелия может быть одной из причин агрегации тромбоцитов, их адгезии к стенке сосуда и формирования тромба. Синтез простациклинов в эндотелии усиливается при стрессе под влиянием тромбина.
Ингибитор пути тканевого фактора (TFPI) синтезируется различными клетками, но основным его источником является эндотелий. На поверхности эндотелиоцитов он связан с протеогликанами и активируется под влиянием гепарина. TFPI связывается с фактором Ха внутри комплекса ТФ/VII/Ха и ингибирует начальный этап гемокоагуляции – образование протромбиназы. Наряду с ТМ, протеинами С и S, антитромбином III и гепарином TFPI относится к естественным антикоагулянтам.
Тканевой активатор плазминогена является сериновой протеазой c молекулярной массой 67 кДа, секретируемой эндотелиальными клетками. t-PA катализирует превращение неактивного профермента плазминогена в активный фермент плазмин и является важным компонентом системы фибринолиза. Когда t-PA связывается с фибрином в формирующемся тромбе, его способность превращать плазминоген в плазмин возрастает в сотни раз.
Урокиназный активатор плазминогена (u-PA) – одноцепочечный белок с молекулярной массой 54 кДа, содержащий 411 аминокислотных остатков – обладает ферментативной активностью сериновых протеаз, специфически связывается с рецепторами на эндотелиальных клетках и тромбоцитах. Превращение одноцепочечного u-PA в двухцепочечный представляет систему положительной обратной связи, которая определяет скорость фибринолиза в условиях in vivo.
Аннексин V – белок с молекулярной массой 35,7 кДа, мощный антикоагулянт, активность которого обусловлена его высокой аффинностью к анионным фосфолипидам и способностью вытеснять факторы свертывания крови с поверхности фосфолипидных мембран. Аннексин V необходим для поддержания плацентарной целостности и может оказывать тромборегуляторный эффект при взаимодействии матери и плода. Антитела к аннексину V индуцируют прокоагулянтную активность эндотелиальных клеток. Антитела нейтрализуют действие аннексина V на поверхности эндотелиоцитов и клеток трофобласта, что может приводить к гиперкоагуляции и прерыванию беременности.
Тромбомодулин является трансмембранным белком, его молекулярная масса составляет 75 кДа. В стимулированных эндотелиальных клетках снижается количество ТМ, функция которого в норме состоит в связывании и инактивации тромбина, превращении его в мощный активатор одного из главных противосвертывающих механизмов – протеины С и S, которые инактивируют факторы свертывания крови V и VIII. В норме ТМ связан с мембраной эндотелиоцитов и практически отсутствует в кровеносном русле. Появление сколько-нибудь значимой концентрации ТМ в крови свидетельствует о повреждении эндотелиальных клеток.
Гепарансульфат входит в состав протеогликанов базальных мембран и является постоянным компонентом клеточной поверхности. Структура дисахаридной единицы гепарансульфата такая же, как у гепарина. Молекулярная масса цепи гепарансульфата колеблется от 5×103 до 12×103 Да. Гепарансульфат обладает мощным антикоагулянтым действием, являясь кофактором антитромбина. Комплекс гепарансульфат/антитромбин реализует наиболее мощное ингибирующее действие на процессы свертывания крови.
Продолжение следует.
Медична газета «Здоров’я України 21 сторіччя» № 1 (398), січень 2017 р.


