5 лютого, 2017
Антибиотикорезистентность – проблема, в решении которой может и должен помочь каждый врач
В последние десятилетия мы наблюдаем катастрофически быстрый рост устойчивости возбудителей инфекционных заболеваний к антибиотикам, за которым просто не успевают ученые и фармацевтические компании, занятые разработкой новых противомикробных средств. Действительно ли человечество находится на пороге новой серьезной войны с бактериями? Чья в этом вина и что медицинская общественность еще может предпринять для спасения ситуации? Постараемся разобраться в этой статье.
Антибиотикорезистентность как угроза безопасности человечества: аргументы и факты
Еще в 2000 г. в докладе экспертов ВОЗ появилась такая фраза: «Наши прадеды жили без антибиотиков, и может случиться так, что и наши правнуки будут жить без них». Звучит, как сценарий апокалиптического фильма, не правда ли? Но давайте оставим эмоции в стороне и рассмотрим факты.
Какие потери человечество несет в борьбе с устойчивыми возбудителями уже сегодня? Доказанный факт, что инфекции, вызванные резистентными штаммами микроорганизмов, характеризуются более тяжелым течением, чаще требуют госпитализации больного, увеличивают продолжительность пребывания его в стационаре, требуют применения комбинированной антибиотикотерапии с использованием резервных препаратов. Все это приводит к увеличению затрат на лечение, ухудшает прогноз для здоровья и жизни пациентов, а также создает благоприятные условия для возникновения эпидемий (Р.С. Козлов, 2008). По данным Центра по контролю и профилактике заболеваний, в США ежегодно не менее 2 млн человек инфицируются бактериями, устойчивыми к антибиотикам, из которых примерно 23 тыс. умирают вследствие этих инфекций. В Европе, по оценкам экспертов, ежегодное количество умерших от инфекций, вызванных резистентными патогенами, составляет приблизительно такое же количество, как в США, а общемировой показатель исчисляется сотнями тысяч. Инфекции, вызванные устойчивыми возбудителями, могут развиться у любого человека, включая здоровых взрослых в самом расцвете своих сил. И хоть и степень риска существенно варьирует, фактически никто на 100% не защищен от них. Кроме того, антибиотикорезистентные возбудители значительно увеличивают стоимость терапии. Например, по оценкам Европейского центра по профилактике и контролю заболеваний, только в странах Европейского союза дополнительный ущерб от устойчивых к антибиотикам бактерий достигает 1,5 млрд евро в год.
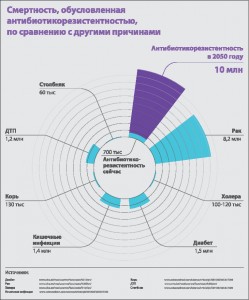
Каковы прогнозы на будущее? Увы, неутешительные. В Обзоре по устойчивости к противомикробным препаратам, подготовленном британскими экспертами под руководством Jim O’Neill в 2014 году, говорится о том, что если антибиотики продолжат терять свою эффективность сегодняшними темпами, устойчивые инфекции обойдутся мировой экономике в 100 трлн долларов за 2016-2050 гг., что сегодня эквивалентно 10 тыс. долларов на одного живущего человека. При сохранении сегодняшних тенденций к 2050 году антибиотикорезистентность будет становиться причиной гибели 10 млн человек ежегодно (рис.).
И ведь дело не только в том, что инфекционные заболевания, некогда взятые под контроль, снова поднимут голову и станут уносить миллионы жизней. Под угрозу будут поставлены многие другие виды лечения, включая хирургические вмешательства, химиотерапию и лечение аутоиммунных заболеваний, ведь их безопасность напрямую зависит от эффективности противомикробной профилактики.
Что человечество может противопоставить бактериям в этой пока еще равной борьбе? Стремительный научный прогресс, который обеспечил появление целого ряда новых групп противомикробных средств в 50-60-е годы прошлого века и эффективную модификацию уже имеющихся молекул на протяжении 1970-80-х годов, позволил нам поверить, что мы всегда будем оставаться впереди патогенных микроорганизмов. Однако на рубеже веков стало понятно, что наши ресурсы не бесконечны. Поток новых антибиотиков просто иссяк, а имеющиеся сегодня препараты стремительно теряют эффективность. Несмотря на все усилия ученых, за последние 25 лет арсенал врачей не пополнил ни один принципиально новый класс антибиотиков. И даже внутри классов ситуация неутешительна. Если в 1983-1987 гг. FDA одобрило 16 молекул противомикробных средств, то в текущем десятилетии речь идет об одном препарате на несколько лет. Затраты на разработку нового антибиотика, по оценкам экспертов, уже превышают 1 млрд долларов. При том что устойчивость к ним развивается очень быстро, фармацевтические компании всерьез задумываются о целесообразности дальнейших поисков.
Кто виноват?
Для начала стоит признать, что в сложившейся сегодня ситуации, безусловно, не обошлось без самих микроорганизмов. Природа наделила их способностью не только вырабатывать устойчивость к антибиотикам (причем задолго до открытия пенициллина Флемингом), но и делиться этой способностью с другими бактериями (путем горизонтального переноса генов).
Однако к приближению катастрофы приложил свою руку и человек – чрезвычайно широкое применение антибиотиков стимулировало микроорганизмы вырабатывать к ним устойчивость значительно более быстрыми темпами. Означает ли это, что внедрение в клиническую практику антибиотиков было ошибкой? Безусловно, нет. А вот нерациональное и избыточное их использование сыграло немаловажную роль в формировании проблемы антибиотикорезистентности.
Одной из наиболее важных причин сложившейся ситуации является легкая доступность антибиотиков населению во многих странах мира и высокая частота самолечения, которое очень часто является неадекватным. Так, по данным Европейского центра по профилактике и контролю заболеваний, 40% европейцев уверены в том, что антибиотики эффективны при простуде и гриппе.
Свой вклад в усугубление проблемы, к сожалению, вносят и врачи. Недостаточная осведомленность клиницистов относительно правил рациональной антибиотикотерапии, а иногда и неспособность устоять перед настойчивыми просьбами пациентов и их родителей приводят к неоправданным или неадекватным назначениям антибиотиков. Отсутствие просветительской работы с пациентами, в частности о необходимости завершения полного курса антибиотикотерапии, становятся причиной досрочного прерывания лечения. Все это способствует формированию и распространению устойчивых штаммов микроорганизмов.
Ситуацию также усугубляет недостаточный контроль за использованием противомикробных средств в ветеринарии и сельском хозяйстве. Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах и, как известно, приводит к повышению уровня резистентности микроорганизмов. Есть вероятность, что использование бактерицидных веществ в мыле и других косметических продуктах также способствует развитию устойчивости бактерий. И наконец, выброс антибиотиков в окружающую среду фармацевтическими предприятиями при ненадлежащей очистке сточных вод дополняет приведенный перечень.
В развивающихся странах, и в частности в Украине, есть свои дополнительные факторы риска роста антибиотикорезистентности. К ним, например, относится широкое использование более дешевых и не всегда качественных генерических антибактериальных препаратов, что обусловливает быструю селекцию резистентных штаммов микроорганизмов.
Что сегодня может сделать каждый практикующий врач для решения проблемы антибиотикорезистентности?
Назначая антибактериальный препарат, любой врач должен помнить о том, что перед ним стоит две важных задачи – тактическая (выбор средства с максимальным терапевтическим и минимальным токсическим потенциалом) и стратегическая (уменьшение риска селекции и распространения в популяции резистентных штаммов бактерий).
Рабочая группа Международного общества антимикробной терапии сформировала 10 рекомендаций для врачей общей практики, направленных на минимизацию риска селекции и распространения устойчивых микроорганизмов (2011):
- Назначать антибиотик только при наличии соответствующих показаний и помнить, что при вирусных инфекциях они неэффективны.
- Выбирать адекватный клинической ситуации противомикробный препарат.
- Учитывать фармакокинетический/фармакодинамический профиль антибиотиков и назначать максимально короткий курс лечения среди возможных.
- Способствовать повышению комплайенса пациентов, чтобы они полностью завершали курс лечения.
- Комбинировать антибиотики только в случае необходимости.
- Избегать использования противомикробных препаратов низкого/сомнительного качества.
- Убеждать пациентов не применять антибиотики по своему усмотрению.
- Соблюдать практические рекомендации по лечению тех или иных заболеваний, основанные на данных доказательной медицины.
- Использовать возможности микробиологической лаборатории.
- Принимать во внимание тенденции региональной антибиотикорезистентности при эмпирическом назначении антибактериальных препаратов.
Рациональная антибиотикотерапия инфекций дыхательных путей как одна из ключевых задач
Особого внимания заслуживает тот факт, что подавляющая доля антибиотиков в мире используется для лечения респираторных инфекций, причем зачастую такие назначения являются совершенно неоправданными. Врачам следует помнить четкие критерии необходимости назначения антибиотиков при остром среднем отите, синусите, фарингите, бронхите, которые в 85-90% случаев вызваны вирусами. Назначение антибактериальных средств с целью профилактики бактериальных осложнений при вирусных инфекциях не имеет научного обоснования и даже повышает риск неблагоприятных исходов, поэтому считается грубейшей ошибкой. Еще одна ситуация, в которой необоснованно применяются антибиотики, – здоровое бактерионосительство.
В случае эмпирического назначения антибиотиков при респираторных инфекциях, когда они действительно необходимы, следует ориентироваться на такие критерии:
- высокая природная чувствительность потенциальных возбудителей заболевания к данному антибиотику;
- низкая приобретенная устойчивость патогенов на общепопуляционном, региональном и локальном уровнях;
- доказанная клиническая эффективность;
- благоприятный профиль безопасности и хорошая переносимость;
- удобство применения;
- оптимальное соотношение стоимости и результативности.
Согласно результатам эпидемиологических исследований наиболее частыми бактериальными возбудителями внебольничных респираторных инфекций являются: S. pneumoniae, H. influenzaе, M. catarrhalis, M. pneumoniae и С. pneumoniae. Исходя из этого спектра, для эмпирической терапии внегоспитальных инфекций дыхательных путей рекомендованы β-лактамы, макролиды и респираторные фторхинолоны. Являются ли они равнозначным выбором? Обычно нет.
Прежде всего, следует помнить о том, что респираторные фторхинолоны считаются альтернативными средствами, которые нецелесообразно назначать в качестве стартовой терапии неосложненных респираторных инфекций. Обусловлено это тем, что некоторые классы антибиотиков обладают большим потенциалом в селекции устойчивых штаммов, чем другие. Так, например, повышение частоты обнаружения метициллинрезистентного стафилококка (MRSA) отмечается при широком использовании гликопептидов, цефалоспоринов и фторхинолонов.
В связи с этим в подавляющем большинстве случаев внебольничных инфекций дыхательных путей лечение начинают с β-лактамов или макролидов. К преимуществам класса макролидов относят способность проникать внутрь клеток и обусловленную этим высокую активность в отношении атипичных возбудителей, а также наличие дополнительных неантимикробных свойств (противовоспалительного и иммуномодулирующего эффектов). Не следует забывать о том, что β-лактамы неактивны в отношении атипичных патогенов, тогда как вероятность их участия в развитии респираторных инфекций достаточно высока (в среднем 10-15%). Макролиды способны воздействовать как на внутриклеточных (атипичных) возбудителей, так и на типичную микрофлору.
В разрезе проблемы антибиотикорезистентности стоит отметить два ключевых механизма устойчивости возбудителей (преимущественно стрепто- и стафилококков) к действию макролидов – модификацию мишени (метилирование рибосом) и эффлюкс (активное выведение из клетки). Интересно, что при наличии устойчивости микроорганизмов к 14- и 15-членным макролидам за счет модификации мишени они могут сохранять чувствительность к 16-членным препаратам. Устойчивость по механизму эффлюкса также чаще развивается к 14- и 15-членным макролидам.
Среди 16-членных макролидов особого внимания заслуживает спирамицин. Благодаря особенностям химического строения препарат обеспечивает надежную связь с 50s субъединицей рибосомы (сразу с 3 доменами), а соответственно, и стойкий противомикробный эффект. Спектр антибактериальной активности спирамицина включает все значимые респираторные патогены, включая Streptococcus spp. (в том числе S. pneumoniae и S. pyogenes), Staphylococcus spp. (кроме MRSA), C. diphtheriae, H. influenzaе, M. catarrhalis, B. pertussis, M. pneumoniae, С. pneumoniae, L. pneumophila и др. Несмотря на то что спирамицин является одним из наиболее старых представителей класса, устойчивость к нему не выше, а, по некоторым данным, даже ниже (как в исследованиях ПеГАС ІІ и ПеГАС ІІІ), чем к более новым макролидам. Возможно, это обусловлено особенностями развития устойчивости патогенов к разным макролидам, о которых было сказано выше.
Фармакодинамические особенности спирамицина обеспечивают ему высокую клиническую эффективность. Так, при умеренной активности in vitro клиническая эффективность этого антибиотика значительно выше, что получило название парадокса спирамицина. Обусловлен он тем, что этот макролид создает высокие тканевые (паренхима легких, миндалины и др.) и внутриклеточные концентрации (особенно в нейтрофилах и макрофагах), имеет наименьшую связь с белками плазмы, обеспечивает постантибиотический эффект (9 ч), проявляет иммуномодулирующие свойства и снижает адгезивность стрепто- и стафилококков (C.R. Smith, 1988; E. Bergone-Berezin, 1996).
Стоит отметить и высокий профиль безопасности макролидов, особенно спирамицина. Он выводится двумя путями (печенью и почками), поэтому не требует коррекции дозы при наличии недостаточности этих органов; не оказывает кардиотоксического действия; не вызывает фототоксичности; характеризуется низким аллергенным потенциалом; обладает наиболее низким среди макролидов потенциалом межлекарственных взаимодействий.
На украинском фармацевтическом рынке спирамицин представлен единственным лекарственным средством – оригинальным препаратом Ровамицин®, производимым известной европейской компанией Санофи. Это автоматически снимает проблему использования некачественных генериков, которые не только снижают вероятность терапевтического успеха, но и, как было отмечено выше, способствуют селекции устойчивых штаммов возбудителей.
Какой бы антибиотик врач не выбрал для лечения бактериальной респираторной инфекции, всегда следует помнить о необходимости соблюдения рекомендаций по длительности терапии. Как слишком короткие, так и слишком продолжительные курсы ассоциируются с повышением риска селекции устойчивых штаммов. Обычно курс лечения препаратом Ровамицин® составляет 5-7 дней, но может продлеваться при инфекциях, вызванных атипичными микроорганизмами.
Объединение усилий на глобальном уровне
Хотя от адекватных назначений врачей и отказа пациентов от самолечения во многом зависит успех борьбы с проблемой антибиотикорезистентности, этих шагов, к сожалению, недостаточно. Очень многие решения должны быть приняты на национальном уровне, как например: запрет на безрецептурный отпуск антибиотиков, усиление законодательства в отношении предотвращения производства и продажи фальсифицированных противомикробных препаратов, снижение применения антибактериальных средств в продовольственном животноводстве и т.д.
На национальном уровне о проблеме антибиотикорезистентности в развитых странах заговорили в 90-х гг. прошлого столетия, а на международный уровень обсуждение данной проблемы вышло на рубеже веков. Так, в 2001 году ВОЗ опубликовала свою Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам. Текущий же год запомнится тем, что вопрос борьбы с растущей угрозой антибиотикорезистентности был вынесен на повестку дня Генеральной Ассамблеи ООН – 21 сентября 2016 г. было проведено первое в ее истории заседание, полностью посвященное данной проблеме. Антибиотикорезистентность стала четвертой проблемой здравоохранения, вынесенной на обсуждение Генеральной Ассамблеи ООН, после ВИЧ-инфекции, лихорадки Эбола и неинфекционных заболеваний (таких как болезни сердца, сахарный диабет и другие).
Входящие в ООН государства в совместном заявлении обязались разработать национальные планы действий по противодействию устойчивости микроорганизмов к антимикробным препаратам. Это подразумевает усиление мониторинга лекарственно-устойчивых инфекций и контроля применения антибиотиков в медицине, ветеринарии и сельском хозяйстве, а также рост международного сотрудничества и финансирования. Также члены организации взяли на себя обязательства ужесточить законодательное регулирование применения антибиотиков, заниматься поиском рационального их использования (например, путем улучшения диагностики инфекций с учетом их чувствительности к препаратам) и широко внедрять меры профилактики инфекционных заболеваний (в частности, вакцинацию, очистку воды, санитарию, должный уровень гигиены в больницах и на фермах).
Еще одним знаменательным событием текущего года стало подписание ведущими международными фармацевтическими, диагностическими и биотехнологическими компаниями совместной декларации о принятии всеобъемлющих мер против инфекций, устойчивых к лекарственной терапии. Декларация была оглашена на Всемирном экономическом форуме в г. Давосе (Швейцария) и подписана на сегодняшний день почти 100 фармацевтическими компаниями.
Представители индустрии призывают правительства всех стран мира выйти за рамки заявлений о намерениях и в сотрудничестве с компаниями принять конкретные меры для поддержки инвестиций в разработку антибиотиков, средств диагностики, вакцин и других продуктов, имеющих жизненно важное значение для предотвращения и лечения лекарственно устойчивых инфекций. Одновременно с этим в Декларации устанавливаются обязательства подписавших сторон по дальнейшим действиям в области проблем лекарственной устойчивости. Компании обязуются: уменьшить воздействие на окружающую среду от производства антибиотиков; содействовать надлежащему применению новых и существующих антибиотиков, в том числе за счет поддержки рекомендаций по применению антибиотиков; продолжать и расширять научно-исследовательские разработки по созданию новых антибиотиков; поддерживать инициативы, направленные на обеспечение доступа к антибиотикам во всех частях света при любых уровнях доходов.
***
В заключение хотим обратиться к читателям с просьбой не оставаться в стороне от решения такой серьезной и реально угрожающей человечеству проблемы, как антибиотикорезистентность. Делайте все возможное из того, что зависит лично от вас, и тогда шанс не проиграть инфекциям получит все человечество. Помогая пациентам сегодня, помните о будущем!
Подготовила Наталья Мищенко