8 червня, 2017
МікроРНК та їхня роль при деяких аутоімунних захворюваннях
 Аутоімунні захворювання характеризуються патологічними імунними реакціями організму, які спрямовані на власні органи-мішені й спричиняють стійке запалення та пошкодження тканин. Відомо, що мікроРНК можуть відігравати ключову роль у регуляції аутоімунних реакцій. Вони по-різному експресуються при різних ревматичних захворюваннях. Цей літературний огляд присвячено сучасним дослідженням мікроРНК і їхньому зв’язку з деякими ревматичними хворобами.
Аутоімунні захворювання характеризуються патологічними імунними реакціями організму, які спрямовані на власні органи-мішені й спричиняють стійке запалення та пошкодження тканин. Відомо, що мікроРНК можуть відігравати ключову роль у регуляції аутоімунних реакцій. Вони по-різному експресуються при різних ревматичних захворюваннях. Цей літературний огляд присвячено сучасним дослідженням мікроРНК і їхньому зв’язку з деякими ревматичними хворобами.
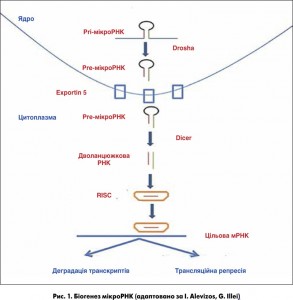
МікроРНК – це малі некодуючі РНК, розміром приблизно 22 нуклеотиди, які відіграють важливу регуляторну роль шляхом розщеплення чи трансляційного інгібування цільових мРНК. МікроРНК (міРНК) беруть участь в експресії генів на етапі посттранскрипції [1]. Перша мікроРНК, lin‑4, виявлена в C. elegans у 1993 році [2]. Відомо, що мікроРНК еволюційно була присутня в усіх видах живих організмів від нематоди до людини [3]. У геномі людини є понад 1000 мікроРНК, які регулюють понад 30% загальної кількості генів. Більшість мікроРНК отримано із самодостатніх генів мікроРНК або інтронів, що кодують білки, і більшість із них вступають у процес транскрипції за допомогою РНК-полімерази II для створення pri-мікроРНК. Після того як pri-мікроРНК проходять процесинг за допомогою рибонуклеаз Drosha та DGCR8, які розташовані в ядрі, попередники мікроРНК доставляються в цитоплазму, де структура мікроРНК обробляється ферментом Dicer, утворюючи подвійний комплекс мікроРНК. Один із ланцюгів РНК завантажується в невеликий РНК-індукований комплекс (RISC), а потім направляє цей комплекс у нетрансльовану ділянку (UTR) цільових мРНК, викликаючи пригнічення експресії білка-мішені [4]. МікроРНК бере участь у багатьох фізіологічних процесах і може регулювати клітинні процеси, такі як диференціація, проліферація й апоптоз [5].
Першим пунктом біогенезу мікроРНК ссавців є генерація первинних транскриптів мікроРНК (pri-мікроРНК), що зазвичай транскрибуються за допомогою РНК-полімерази II (рис. 1). Pri-мікроРНК – молекули змінних розмірів довжиною десятки тисяч нуклеотидів. Вони розщеплюються в ядрі навпіл до попередньо сформованої мікроРНК (зазвичай довжиною 70-100 нуклеотидів) і транспортуються в цитоплазму для подальшої обробки, щоб стати дволанцюжковою РНК довжиною 19-25 нуклеотидів. Потім одна нитка завантажується в білковий комплекс, названий RISC (RNA-induced silencing complex – РНК-індукований приглушений комплекс), що сприяє зв’язуванню мікроРНК з їхніми мішенями. Зв’язування РНК може привести або до деградації мРНК, або до репресії. Деградація відбувається шляхом деаденіляції й дестабілізації мРНК, а репресія трансляції відбувається в процесі синтезу білка в ініціальній або постініціальній фазі. Слід зазначити, що одна мікроРНК може контролювати трансляцію сотень генів одночасно.
Механізм дії мікроРНК
При виявленні перших мікроРНК (lin‑4 та let‑7) встановлено їхній вплив на 3’-нетрансльовану ділянку мРНК (3’UTR), і набула поширеності думка, що мікроРНК діє через повну/неповну комплементарність із послідовностями тільки 3’UTR. За неповної комплементарності потрібна ідеальна мішень з узгодженням із 2-го по 7-й нуклеотид. Пізніше виявлено, що мікроРНК можуть мати цільові послідовності в межах 5’UTR і кодувати різні послідовності мРНК. Це підтверджено дослідженням, яке продемонструвало, що гени, котрі беруть участь в ембріональній диференціації стовбурових клітин у мишей, пригнічуються за допомогою мікроРНК. Аналогічно мікроРНК‑148 впливає на кодування ДНК метилтрансферази‑3b – ферменту, який є важливим для метилювання ДНК наново. Існує також доказ того, що мікроРНК можуть впливати на сплайсинг (вирізання зі структури РНК) специфічних генів. Наслідки таких можливостей приголомшують і додають ще один рівень складності в регуляції експресії специфічних ізоформ усередині системи.
Функції мікроРНК
МікроРНК відіграють роль у розвитку, патогенезі й віддалених наслідках різних захворювань. Так, ембріональні стовбурові клітини жорстко регулюються експресією специфічних мікроРНК. Морфогенез шкіри, розвиток підшлункової залози, м’язова диференціація, нейронний розвиток та інші процеси регулюються мікроРНК. Велика кількість злоякісних пухлин пов’язані зі зміненими мікроРНК [6]. Існують дані про інші непухлинні захворювання, в яких показано роль мікроРНК, такі як хвороба Альцгеймера, психоневрологічні розлади, первинний біліарний цироз. Останнім часом виявлено значну роль мікроРНК при різних ревматичних аутоімунних захворюваннях, таких як системний червоний вовчак (СЧВ), ревматоїдний артрит (РА), ювенільний ідіопатичний артрит тощо [7].
МікроРНК та аутоімунітет
Як основні регулятори експресії генів, мікроРНК відіграють важливу роль у регуляції розвитку імунної системи, нормальної імунної відповіді й аутоімунних реакцій. Під час вивчення низки кровотворних клітин було виявлено багато мікроРНК, які диференційовано експресуються в цих клітинах, що жорстко регулюється під час кровотворення й клональної диференціації. Існує кілька думок щодо ролі мікроРНК у процесі розвитку імунної відповіді та аутоімунних і ревматичних захворювань, тому в цій статті ми зупинимося на огляді деяких нових досліджень, що стосуються можливого використання мікроРНК як біомаркерів.
Імунна відповідь при аутоімунній реакції характеризується підвищеною активацією імунних клітин і неефективною регуляцією імунної системи за допомогою Т-хелперів‑17 (Th17) і регуляторних Т-клітин (TREG), які мають захисну дію. Швидше за все, функціональний дисбаланс цих підтипів призводить до патологічних відповідей при аутоімунних захворюваннях [8].
Аберантна експресія мікроРНК може бути зумовлена хромосомними аномаліями, вставкою чужорідного генетичного матеріалу (наприклад, вірусного геному), мутацією чи одиничним нуклеотидним поліморфізмом (SNP), а також епігенетичними змінами й дефектами шляху біогенезу мікроРНК, про який викладено вище. Гомологія набору налічує приблизно 250 одиничних нуклеотидних поліморфізмів, які пов’язують із виникненням 15 основних поширених захворювань. Визначено приблизно 18 мікроРНК з очевидною схильністю до розвитку цих захворювань (послідовності мРНК-мішені), отримані з одного кодуючого білка гена – KPNA1 (karyopherin alpha 1, також відомий як імпортін альфа‑5), компонент імпорту ядерного шляху.
Іншою характеристикою мікроРНК є наявність мутацій і поліморфізмів не тільки в послідовності зрілого miRNAs55, а й у послідовності мікроРНК і «заготівлі» miRNAs56. Зміни послідовності можуть вплинути на біогенез мікроРНК або дію зрілих мікроРНК на цільові послідовності. Варіації можливі в обох 5’- і 3’-кінцях зрілої мікроРНК, які призводять до змін довжини мікроРНК. Це має важливе значення для використання мікроРНК як біомаркерів, для інтерпретації лабораторних аналізів, що мають чітко розрізняти поліморфізми між цими мікроРНК і дозволити точне вимірювання рівнів зрілих мікроРНК. Вивчення асоціацій між поліморфними чи мутованими мікроРНК і ревматичними хворобами перебуває на ранній стадії, але видається дуже перспективним.
МікроРНК та аутоімунні захворювання
Аутоімунні захворювання виникають через дефіцит імунологічної толерантності до аутоантигенів і, як наслідок, виникає патологічний стан, що пошкоджує органи-мішені чи декілька органів і систем. Поширеність аутоімунних захворювань у світі перевищує 3% населення, 80% з яких становлять жінки [9]. Зміни в експресії деяких мікроРНК виявлено в окремих дослідженнях, наприклад, при РА, цукровому діабеті 1 типу, розсіяному склерозі, синдромі Шегрена (СШ), СЧВ, запальних захворюваннях кишківника, псоріазі тощо.
МікроРНК і синдром Шегрена. СШ характеризується тривалим запаленням із переважним залученням екзокринних залоз. У більшості хворих СШ має повільно прогресуючий перебіг, і багато з них не потребують інтенсивної імуносупресії. СШ є важливою моделлю для вивчення багатьох аспектів впливу мікроРНК. У ході дослідження малих слинних залоз здорових людей було показано, що профілі експресії мікроРНК можуть бути маркерами диференціальної діагностики змін у залозах хворих на СШ та здорових людей, а також диференціювати пацієнтів із низьким і високим ступенем активності СШ [10].
В іншому дослідженні відзначали дисрегуляцію мікроРНК‑146 у пацієнтів із СШ і слинних залоз у мишей, хворих на СШ, через 8 і 20 тиж. МікроРНК‑146 може збільшувати фагоцитарну активність і пригнічувати продукцію запальних цитокінів [11]. У сукупності наведені вище дані показують, що цю мікроРНК можна використовувати як маркер ініціації та розвитку СШ. Gabor Illei, керівник Клініки з вивчення СШ у Національному інституті здоров’я (NIH) у м. Бетесда, штат Меріленд, США (Sjogren’s Syndrome Clinic at the National Institutes of Health in Bethesda), на сесії Європейської протиревматичної ліги (EULAR) 2012 року відзначив, що вивчення мікроРНК як біомаркерів має потенційну цінність, хоча їхню конкретну роль при ревматичних захворюваннях усе ще не визначено. На конгресі Gabor Illei з колегами обговорили дані своєї роботи з вивчення міРНК‑574 і 768-3p при СШ. У ході дослідження виявлено, що профілі експресії мікроРНК чітко корелюють у хворих на СШ [12]. Деякі профілі експресії мікроРНК пов’язані з дисфункцією слинних залоз, тоді як інші пов’язані із запальним процесом. Так, міРНК‑574 і 768-3p ідентифіковано як можливі біомаркери запалення. Подальша робота вчених за участю 87 пацієнтів, які спостерігалися в клініці NIH протягом двох років і яким виконано біопсію слинної залози, підтвердила цю кореляцію. Дослідники також виявили, що ниркова мікроРНК‑150 корелює з індексом хронізації вовчакового нефриту й негативно корелює з часом виникнення хронічного захворювання нирок.
З огляду на те що мішенню мікроРНК‑150 є ген супресора сигналізатора цитокінів‑1 (SOCS1, suppressor of cytokine signaling 1), вона може відігравати певну роль у розвитку фіброзу.
Ниркова мікроРНК‑150 може бути новим корисним кількісним біомаркером, що відображає структурні пошкодження нирок при вовчаковому нефриті, й бути прогностичним маркером прогресування хронічної хвороби нирок. Окрім того, надлишкова експресія ниркової мікроРНК‑150 може відігравати важливу роль у розвитку фіброзу нирок шляхом непрямого збільшення синтезу колагену 1 типу та фібронектину.
Одна з переваг використання мікроРНК як біомаркера, особливо на відміну від інформаційних РНК, – їх надзвичайна стабільність, що є дуже важливим для клінічних біомаркерів. Крім того, мікроРНК відіграють роль у розвитку лімфоцитів, контролі імунної відповіді, запалення, а отже, мають важливе значення в лікуванні захворювань сполучної тканини. Можна передбачити, що захворювання сполучної тканини будуть пов’язані зі змінами в експресії мікроРНК.
МікроРНК і системний червоний вовчак. СЧВ – хронічне мультифакторіальне аутоімунне захворювання з множинною клінічною симптоматикою. Аналіз експресії мікроРНК у клітинах периферичної крові хворих на СЧВ показав диференційовану вираженість 16 видів мікроРНК у таких хворих [13]. МікроРНК‑146a ідентифіковано як негативний модулятор природного імунітету, а її низька експресія негативно корелювала з клінічними проявами захворювання в пацієнтів із СЧВ. МікроРНК‑146а безпосередньо гальмувала трансактивацію інтерферону (ІФН) 1 типу на молекулярному рівні й цільового ІФН регуляторного фактора‑5 і STAT‑1 [14].
На сесії Американської колегії ревматологів (ACR) 2013 року доктор Шен представив результати дослідження, в якому вивчали терапевтичний потенціал мікроРНК‑146а на мишачій моделі СЧВ. Щораз більша кількість даних свідчить про дерегуляцію й дисфункцію мікроРНК у хворих на СЧВ та у мишей із цим захворюванням, а також про зв’язок мікроРНК із прогнозом і прогресуванням хвороби, що можуть служити майбутніми цілями для генної терапії.
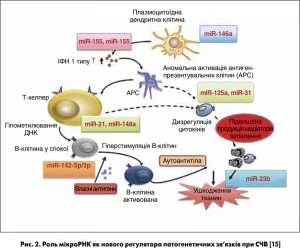
На рисунку 2 показано роль мікроРНК як нового регулятора патогенетичних зв’язків при СЧВ. Надлишкова експресія мікроРНК‑146а в мононуклеарних клітинах у пацієнтів із СЧВ пригнічує активацію ІФН 1 типу [15, 16]. Ці знахідки наштовхнули доктора Шена та його колег на висновок, що терапевтичний вплив на рівні мікроРНК‑146a може бути корисним у лікуванні СЧВ, і спонукали їх до проведення наступних досліджень з метою вивчення терапевтичного потенціалу мікроРНК‑146а у хворих на СЧВ за допомогою індукованої мишачої моделі захворювання.
У своєму поточному дослідженні доктор Шен і його колеги використовували добре вивчену прістан-індуковану мишачу модель СЧВ за участю аномальної активації інтерферонового шляху для вивчення легеневих капіляритів. Мишам вводили мікроРНК‑146а чи фосфатно-сольовий буферний розчин (ФСБР) у бічні вени хвоста. Методами полімеразної ланцюгової реакції в режимі реального часу чи аналізу профілю експресії генів оцінювали показники периферичної крові через 3, 7 і 14 днів після ін’єкції. Миші були розподілені на три групи: ті, які отримували три послідовні ін’єкції ФСБР (контрольна група; n=9); ті, які отримували мікроРНК‑146а за 3 дні до одноразового внутрішньочеревного введення прістану (група профілактики; n=19); і ті, що отримували мікроРНК‑146a через 7 днів після одноразового внутрішньочеревного введення прістану (група лікування; n=10).
Розвиток легеневої кровотечі підтверджували через 2 тиж після ін’єкції прістану з використанням гематоксиліну. Дослідження показало значне збільшення експресії мікроРНК‑146а в обох групах мишей, яким уводили мікроРНК‑146а, порівняно з мишами в контрольній групі. Гематоксилінове фарбування показало, що введення мікроРНК‑146а призводило до резистенції цих мишей до індукованих геморагічних легеневих капіляритів. Поширеність легеневої кровотечі знижено до 25% у мишей у групі лікування й повністю заблоковано в групі профілактики. У 56% мишей у контрольній групі дослідження закінчилося легеневою кровотечею. Крім того, дослідження показало, що в мишей із легеневою кровотечею значно нижчі рівні мікроРНК‑146а порівняно з мишами, в яких не розвивалася кровотеча (р<0,01), і що введення мікроРНК‑146а істотно пригнічувало відповідь ІФН і призводило до зниження продукції багатьох прозапальних цитокінів і хемокінів. Отже, мікроРНК‑146а має супресивну дію при прістан-індукованих легеневих кровотечах у мишей і підкреслює потенційну патогенну роль активації шляху ІФН 1 типу в розвитку легеневих капіляритів. Ці дані дають змогу припустити, що для пацієнтів із СЧВ та легеневою кровотечею може бути корисним подальше вивчення терапевтичного втручання для індукції експресії мікроРНК‑146а. Уже відомо, що мікроРНК‑21 бере участь у патологічному процесі при СЧВ за допомогою реакції Т-клітин і регуляції запрограмованої клітинної смерті (PDCD4) [17].
У хворих на СЧВ порушена регуляція експресії мікроРНК‑146а та мікроРНК‑155 [18]. МікроРНК‑148а та мікроРНК‑21 відіграють ключову роль у гіпометилюванні ДНК у хворих на СЧВ [19]. Крім того, нещодавні дослідження показали, що мікроРНК‑126 зумовлює розвиток СЧВ шляхом пошкодження процесу метилювання ДНК [20]. Одне дослідження показало, що мікроРНК‑15 посилює активність у клітинах селезінки й плазми у хворих на СЧВ мишей. У своїх висновках дослідники припустили, що деактивація мікроРНК може бути корисним методом лікування цього захворювання. Отже, мікроРНК‑15 може брати участь у патогенезі СЧВ [21].
Вивчення ролі мікроРНК в епігенетичних процесах у хворих на СЧВ триває. Наразі досліджують використання інгібіції мікроРНК як новий підхід до лікування деяких поширених захворювань. Отже, результати досліджень спонукають до подальшого вивчення ролі мікроРНК при аутоімунних захворюваннях, а терапія з використанням мікроРНК може мати значний вплив на їх перебіг, що потребує подальшого вивчення. Дослідження шляхів активації та пригнічення функції мікроРНК може мати важливе терапевтичне застосування, а також розкрити молекулярні й клітинні механізми, відповідальні за початок і прогресування ревматичних захворювань.
Література
1. Bartel D.P. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell, 2004; vol. 116, no. 2: 281-297.
2. Lee R.C., Feinbaum R.L., Ambros V. The C. elegans heterochronic gene lin‑4 encodes small RNAs with antisense complementarity to lin‑14. Cell, 1993; vol. 75, no. 5: 843-854.
3. Farh K.K.H., Grimson A., Jan C., et al. The widespread impact of mammalian microRNAs on mRNA repression and evolution. Science, 2005; vol. 310, no. 5755: 1817-1821.
4. Eulalio A., Huntzinger E., Izaurralde E. Getting to the root of miRNA-mediated gene silencing. Cell, 2008; vol. 132, no. 1: 9-14.
5. Ambros V. MicroRNA pathways in flies and worms: growth, death, fat, stress, and timing. Cell, 2003; vol. 113, no. 6: 673-676.
6. Spizzo R., Nicoloso M.S., Croce C.M., Calin G.A. MicroRNAs in cancer. Cell, 2009, May 1; 137 (3): 586-586, e1.
7. Pauley K.M., Cha S., Chan E.K.L. MicroRNA in autoimmunity and autoimmune diseases. Journal of Autoimmunity, 2009; vol. 32, no. 3-4: 189-194.
8. Kitani A., Xu L. Regulatory T cells and the induction of IL‑17. Mucosal. Immunol. 2008 Nov; 1 (Suppl. 1): S43-6.
9. Cooper G. S., Stroehla B. C. The epidemiology of autoimmune diseases. Autoimmunity Reviews, 2003; vol. 2, no. 3: 119-125.
10. Alevizos I., Bajracharya S.D., Alexander S., Turner R.J., Illei G.G. MicroRNA profiling of minor salivary glands identifies disease and inflammation biomarkers in Sjogren’s syndrome patients. Arthritis & Rheumatism, 2009; vol. 60: S733-S734.
11. Pauley K.M., Stewart C.M., Gauna A.E., et al. Altered miR‑146a expression in Sjogren’s syndrome and its functional role in innate immunity. European Journal of Immunology, 2011; vol. 41, no. 7: 2029-2039.
12. Alevizos I., Alexander S., Turner R.J., Illei G.G. MicroRNA expression profiles as biomarkers of minor salivary gland inflammation and dysfunction in Sjogren’s syndrome. Arthritis Rheum. 2011; 63: 535-544.
13. Dai Y., Huang Y.S., Tang M., et al. Microarray analysis of microRNA expression in peripheral blood cells of systemic lupus erythematosus patients. Lupus, 2007; vol. 16, no. 12: 939-946.
14. Tang Y., Luo X., Cui H., et al. MicroRNA‑146a contributes to abnormal activation of the type I interferon pathway in human lupus by targeting the key signaling proteins. Arthritis and Rheumatism, 2009; vol. 60, no. 4: 1065-1075.
15. Shen N., Liang D., Tang Y., et al. MicroRNAs – novel regulators of systemic lupus erythematosus pathogenesis. Nat. Rev. Rheumatol. 2012; 8 (12): 701-709.
16. Luo X.B., Yang W., Ye D. -Q., et al. A functional variant in MicroRNA‑146a promoter modulates its expression and confers disease risk for systemic lupus erythematosus. PLoS Genet. 2011; 7 (6): e1002128. Epub 2011 Jun 30.
17. Stagakis E., Bertsias G., Verginis P., et al. Identification of novel microRNA signatures linked to human lupus disease activity and pathogenesis: MiR‑21 regulates aberrant T cell responses through regulation of PDCD4 expression. Annals of the Rheumatic Diseases, 2011; vol. 70, no. 8: 1496-1506.
18. Wang G., Tam L.S., Li E.K.M., et al. Serum and urinary cell-free MiR‑146a and MiR‑155 in patients with systemic lupus erythematosus. Journal of Rheumatology, 2010; vol. 37, no. 12: 2516-2522.
19. Pan W., Zhu S., Yuan M., et al. MicroRNA‑21 and microRNA‑148a contribute to DNA hypomethylation in lupus CD4+ T cells by directly and indirectly targeting DNA methyltransferase 1. Journal of Immunology, 2010; vol. 184, no. 12: 6773-6781.
20. Zhao S., Wang Y., Liang Y., et al. MicroRNA‑126 regulates DNA methylation in CD4+ T cells and contributes to systemic lupus erythematosus by targeting DNA methyltransferase 1. Arthritis and Rheumatism, 2011; vol. 63, no. 5: 1376-1386.
21. Yuan Y., Kasar S., Underbayev C., et al. Role of microRNA‑15a in autoantibody production in interferon-augmented murine model of lupus. Molecular Immunology, 2012; vol. 52, no. 2: 61-70.