8 червня, 2017
Обзор рекомендаций Европейского общества кардиологов по ведению инфекционного эндокардита у пациентов с имплантированными внутрисердечными устройствами

Большое количество новых публикаций, посвященных инфекционному эндокардиту (ИЭ), первое рандомизированное исследование по хирургическому лечению данного заболевания, новые возможности визуализации и некоторые расхождения с прошлыми руководствами стали причиной пересмотра рекомендаций Европейского общества кардиологов по ведению пациентов с ИЭ. В ноябре 2015 г. в European Heart Journal была опубликована обновленная версия данных рекомендаций. Как обычно при создании подобного рода рекомендаций, их авторы руководствовались доказательной методологией с использованием общепринятых классов рекомендаций и уровней доказательств.
В новом документе большое внимание уделено инфекции сердца с вовлечением внутрисердечных имплантированных устройств – тяжелому заболеванию, ассоциированному с высокой смертностью. Возрастание темпов имплантации таких устройств, особенно у пациентов пожилого возраста с наличием сопутствующих заболеваний, создает предпосылки для быстрого распространения инфекции и увеличения частоты развития ИЭ у этих лиц.
В настоящее время выделяют ИЭ протезированного клапана (ЭПК), а также ИЭ с вовлечением имплантированных внутрисердечных электронных устройств.
Инфекционный эндокардит протезированного клапана
ЭПК – это самая тяжелая форма эндокардита, которая встречается у 1-6% пациентов с клапанными протезами. На ЭПК приходится около 10-30% всех случаев ИЭ в одинаковом соотношении механических и биологических клапанов. ЭПК всегда ассоциируется с трудностями в постановке диагноза, определении оптимальной терапевтической стратегии и плохим прогнозом.
Определение и патофизиология. ЭПК считается ранним, если возник в течение первого года после операции, и поздним – если возник позже. Тем не менее это искусственное разграничение. Важными являются состояние больного в периоперационном промежутке и вид возбудителя.
Патогенез ЭПК различается в зависимости от пути попадания инфекции и вида протезированного клапана. При периоперационном инфицировании в процесс обычно вовлекаются соединение между кольцом и межтрубным пространством, что часто приводит к абсцессу, псевдоаневризмам и свищам. При позднем ЭПК могут существовать дополнительные механизмы. Например, при позднем ИЭ биопротеза инфекция часто локализуется на створках, что осложняется появлением вегетаций, разрывом створок и их перфорацией. Риск развития ЭПК во время имплантации этого клапана увеличивается с использованием оротрахеальной интубации. Результатом ЭПК может являться новая регургитация, реже – обструкция клапанов вследствие крупных вегетаций.
Диагноз. Клиническая картина при ЭПК часто атипична, особенно в ранний послеоперационный период, когда могут наблюдаться лихорадка и воспалительные симптомы при отсутствии ИЭ. Однако стойкое повышение температуры должно вызывать подозрение. Как и при эндокардите нативного клапана (ЭНК), диагностика ЭПК базируется в основном на результатах эхокардиографии (ЭхоКГ) и посева крови. Трансэзофагеальная ЭхоКГ является обязательной при подозрении на ЭПК, хотя ее диагностическое значение ниже, чем при ИЭ естественного клапана. Весьма информативно сочетание позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой и компьютерной томографии (18F-ФДГ ПЭТ/КТ).
При ЭПК стафилококковые и грибковые инфекции встречаются чаще, а стрептококковые – реже, чем при ЭНК. Только при позднем ЭПК возбудители такие же, как и при ЭНК. Стафилококки и энтерококки являются наиболее распространенными микроорганизмами, вызывающими ЭПК во время имплантации клапана. Отмечается, что критерии Дьюка имеют меньшую чувствительность, чем при ЭНК.
Прогноз и лечение. При ЭПК уровень внутрибольничной смертности весьма высок и достигает 20-40%. К установленным факторам риска неблагоприятного исхода при этом эндокардите относят: пожилой возраст, сахарный диабет, внутрибольничные инфекции, стафилококковую или грибковую инфекции, ЭПК в анамнезе, инсульт и внутрисердечные абсцессы. Среди них самой неблагоприятной является стафилококковая инфекция. Такие больные нуждаются в более агрессивном комбинированном лечении, состоящем из антибактериальной терапии и ранней радикальной операции.
Антимикробное лечение при ЭПК такое же, как и при ЭНК, но должно быть более продолжительным (минимум 6 нед).
Золотистый стафилококк требует более длительной (6 нед) схемы антибиотикотерапии (обычно в сочетании с аминогликозидами) и частого использования рифампицина. Хирургическая тактика предусматривает удаление инфицированного материала и дренирование абсцессов.
Одним из основных препятствий при медикаментозной эрадикации инфекции является бактериальная резистентность к антибиотику. Резистентные возбудители не являются устойчивыми, то есть они сохраняют восприимчивость к лекарственному ингибированию роста, но могут избегать вызываемого приемом препаратов бактерицидного эффекта. Как и при ЭНК, отсчет времени лечения при ЭПК начинается с того дня, когда проявился эффект от препарата. Новый полный цикл лечения следует начинать при положительном анализе на культуру клапана, учитывая вид возбудителя и его чувствительность к антибиотику.
Хирургическое лечение при ЭПК имеет общие принципы с лечением ЭНК. Радикальная хирургическая обработка в этом случае означает удаление всех инфицированных инородных материалов, в том числе и оригинальных протезов.
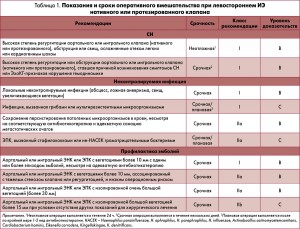
Хирургическое вмешательство рекомендовано пациентам с ЭПК высокого риска – с сердечной недостаточностью (СН), тяжелой дисфункцией протеза, абсцессом или постоянной лихорадкой. Экстренная операция показана только в случаях рефрактерной застойной СН, ведущей к отеку легких или шоку, как при ЭНК (табл. 1).
Инфекционный эндокардит с вовлечением имплантированных внутрисердечных электронных устройств
Инфекции сердца с вовлечением внутрисердечных имплантированных электронных устройств – это тяжелое заболевание, связанное с высокой смертностью. Как уже указывалось, возрастание темпов имплантации этих устройств у пациентов пожилого возраста с наличием сопутствующих заболеваний создает предпосылки для более быстрого распространения инфекции и увеличения частоты возникновения ИЭ у этих больных.
Классификация. Следует различать локальную инфекцию устройства и ИЭ с вовлечением внутрисердечного устройства. Локальная инфекция устройства определяется как инфекция, ограничивающаяся карманом сердечного устройства. Клинически ее можно заподозрить при наличии местных признаков воспаления в кармане генератора, например эритемы, температуры, флуктуации, зияния раны, эрозии, болезненности или гнойного содержимого в дренаже. ИЭ с вовлечением внутрисердечного устройства определяется как инфекция, распространяющаяся на электроды, створки клапанов или эндокардиальную поверхность.
Патофизиология. Инфицирование кармана устройства может произойти в момент имплантации, во время последующих хирургических манипуляций или в случае, если генератор или подкожные электроды выходят через кожу. Карманная инфекция может проходить вдоль внутрисосудистой части электрода, затрагивать внутрисердечную часть кардиостимулятора или имплантируемого кардиовертера-дефибриллятора. Кроме того, карман или внутрисердечная часть электрода могут инфицироваться гематогенным путем. Септические легочные эмболии – очень частое осложнение данного заболевания.
Факторы риска развития инфекций после имплантации внутрисердечного электронного устройства включают в себя: наличие почечной недостаточности, использование кортикостероидов, застойную СН, образование гематомы, сахарный диабет и прием антикоагулянтов. Также большое влияние оказывают вид оперативного вмешательства, ревизии устройства, место вмешательства, использование предоперационной временной электрокардиостимуляции, неэффективная предоперационная антимикробная профилактика, лихорадка в течение 24 ч перед имплантацией и опыт хирурга.
Микробиология. В 60-80% случаев главной причиной заболевания являются стафилококки, особенно коагулазонегативные. Corynebacterium spp., Propionibacterium acnes, грамотрицательные бактерии и кандиды крайне редко выступают в роли возбудителя инфекции у пациентов с имплантированным внутрисердечным устройством.
Диагностика. В клинической картине чаще доминируют респираторные и ревматологические симптомы, а также местные признаки развития инфекции. ИЭ с вовлечением имплантированных внутрисердечных электронных устройств должен быть заподозрен у больного при наличии необъяснимой лихорадки. Как и при других формах ИЭ, ЭхоКГ и посев крови на гемокультуру являются золотым стандартом диагностики. В ряде случаев единственным проявлением инфекции может быть бактериемия золотистого стафилококка.
Некоторые прогностические факторы, такие как экссудативный перикардит, вентрикулярная дисфункция и уровень давления в легочных сосудах, предпочтительнее определять при помощи трансторакальной ЭхоКГ, чем трансэзофагеальной. В свою очередь, трансэзофагеальная ЭхоКГ позволяет лучше визуализировать атипичные места расположения электрода кардиостимулятора (например, в проксимальной верхней полой вене), вовлечение в патологический процесс левых отделов сердца, околоклапанное распространение инфекции.
Наличие вегетаций вдоль электродов имплантированного кардиостимулятора ввиду их небольших размеров иногда можно подтвердить только с помощью трансэзофагеальной или внутрисердечной ЭхоКГ. В сложных ситуациях используют сцинтиграфию с мечеными лейкоцитами и 18F-ФДГ ПЭТ/КТ.
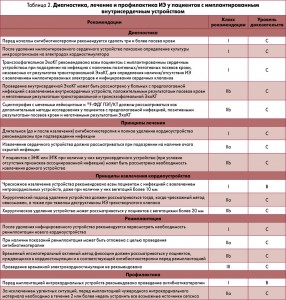
Лечение ИЭ у больного с имплантированным сердечным устройством заключается в пролонгированной антибактериальной терапии и удалении этого устройства. Антимикробная терапия должна носить индивидуальный характер и базироваться на результатах исследований культуры бактерий и их чувствительности к антибиотикам. Ввиду того что 50% стафилококков устойчивы к метициллину, первоначально эмпирически назначают ванкомицин. Даптомицин одобрен для применения при правостороннем ИЭ и бактериемии золотистого стафилококка. Внутривенная антибиотикотерапия должна назначаться до удаления имплантированного устройства, но после посева крови. Длительность терапии в большинстве случаев находится в пределах 4-6 нед. После извлечения инфицированного устройства парентеральная антибиотикотерапия рекомендуется еще в течение как минимум 2 нед (в тяжелых случаях – до 4 нед).
Извлечение имплантированного устройства. Полное извлечение устройства и его составляющих является рекомендованным вариантом лечения для пациентов с подтвержденным случаем инфекции и наличием внутрисердечного устройства. С учетом того, что открытое оперативное вмешательство сопряжено с высоким риском, предпочтение отдается чрезвенозному методу по удалению кардиостимулятора. Риск смертельного исхода при этом доступе в высокоспециализированных центрах составляет 0,1-0,6%.
Довольно частым осложнением при извлечении кардиостимулятора являются легочные эмболии, возникающие в результате смещения вегетаций больших размеров. Чаще всего такие эмболии протекают бессимптомно. В случаях, когда размеры вегетаций превышают 2 см, решение, каким методом удалять имплантированное устройство – чрескожным или хирургическим, принимается сугубо индивидуально.
Реимплантация. Первым шагом перед реимплантацией является переоценка необходимости имплантации внутрисердечного устройства. В ряде случаев она уже не нужна. Устройство должно быть реимплантировано на противоположной стороне. Сроки реимплантации зависят от следующих факторов: персистирующая бактериемия, вегетации, необходимость в кардиостимуляторе или кардиовертере-дефибрилляторе. Результаты посевов крови должны быть отрицательными по меньшей мере на протяжении 72 ч перед установкой нового устройства. При наличии признаков клапанной инфекции реимплантацию необходимо отложить как минимум на 2 нед.
Основные принципы диагностики и лечения ИЭ у пациентов с имплантированным внутрисердечным устройством обобщены в таблице 2.
Правосторонний инфекционный эндокардит
Правосторонний ИЭ составляет 5-10% всех случаев ИЭ. Хотя он может возникать у пациентов с кардиостимуляторами, кардиовертером-дефибриллятором, центральным венозным катетером или врожденными пороками сердца, правосторонний ИЭ характерен и для наркоманов, употребляющих внутривенные наркотики, особенно с сопутствующим серопозитивным вирусом иммунодефицита человека, а также для иммуносупрессивных лиц.
Самым частым возбудителем правостороннего ИЭ является золотистый стафилококк (60-90% случаев), особенно его метициллин-устойчивые штаммы. Частота полимикробных инфекций также возрастает. Чаще всего поражается трехстворчатый клапан, а госпитальная смертность составляет около 7%.
Диагностика и осложнения. К наиболее распространенным признакам правостороннего ИЭ относятся персистирующая лихорадка, бактериемия и множественные септические эмболии легких, которые обычно проявляются болью за грудиной, кашлем, кровохарканьем. При возникновении системных эмболий необходимо рассматривать вариант развития их парадоксальных форм или комбинации с левосторонним ИЭ. Изолированная правосторонняя СН развивается крайне редко.
Однако она может быть вызвана легочной гипертензией вследствие тяжелой правосторонней клапанной регургитации или обструкции. Легочная гипертензия может быть и вторичной по отношению к левостороннему ИЭ.
Трансторакальная ЭхоКГ позволяет оценить степень вовлечения трехстворчатого клапана, благодаря его переднему расположению и обычно большим вегетациям на нем. Для оценки евстахиевого и легочного клапанов лучше использовать трансэзофагеальную методику.
Прогноз и лечение. Длина вегетаций свыше 20 мм и грибковая этиология заболевания – основные предикторы смерти в большой ретроспективной когорте лиц с зависимостью от внутривенных наркотиков с правосторонним ИЭ.
Выбор эмпирической антибактериальной терапии зависит от предполагаемого возбудителя, типа наркотика, локализации инфекционного процесса и обязательной чувствительности к золотистому стафилококку, наличие которого нельзя исключать при развитии правостороннего ИЭ.
Начальная терапия включает в себя пенициллины, устойчивые к воздействию пенициллиназы, ванкомицин или даптомицин в комбинации с гентамицином. Если пациент является наркоманом, употребляющим пентазоцин, необходимо исключить наличие у него антипсевдомонадного агента. Если больной внутривенно вводил коричневый героин, разбавленный в лимонном соке, то необходимо рассматривать возможность наличия у него Candida spp. и необходимость добавления противогрибковой терапии.
Двухнедельное лечение оксациллином (или клоксациллином) без гентамицина является эффективным для большинства пациентов с изолированным ИЭ трехстворчатого клапана, если все из нижеследующих критериев совпадают:
• метициллин-чувствительный золотистый стафилококк;
• хороший ответ на применяемую терапию;
• отсутствие метастатических участков инфекции или эмпиемы;
• отсутствие кардиальных и экстракардиальных осложнений;
• отсутствие инфицирования протезированного клапана или левосторонних клапанов;
• вегетации длиной менее 20 мм;
• отсутствие тяжелой иммуносупрессии (CD4-лейкоциты – менее 200 клеток/мл).
Из-за ограниченной бактерицидной активности, плохого проникновения в вегетации и повышенного клиренса препарата у лиц с зависимостью от внутривенных наркотиков гликопептиды (ванкомицин) не должны использоваться в 2-недельной терапии.
Возможно применение 4-6-недельного стандартного режима терапии в следующих случаях:
• медленный клинический или микробактериологический ответ (свыше 96 час) на антибактериальную терапию;
• правосторонний ИЭ, осложненный СН, вегетациями более 20 мм, острой дыхательной недостаточностью, метастатическими септическими очагами вне легочной ткани (исключая эмпиему) или экстракардиальными осложнениями (например, острой почечной недостаточностью);
• использование других антибиотиков, кроме пенициллинов, устойчивых к пенициллиназе;
• внутривенные инъекции наркотиков с тяжелой иммуносупрессией (количество CD4 – менее 200 клеток/мл) с/без инфекции вирусом иммунодефицита человека;
• ассоциированный левосторонний ИЭ.
В случаях, когда применение внутривенной терапии невозможно, у лиц с зависимостью от внутривенных наркотиков с правосторонним ИЭ, вызванным золотистым стафилококком, возможно назначение внутрь ципрофлоксацина (750 мг 2 раза в сутки) и рифампицина (300 мг 2 раза в сутки).
Гликопептиды (например, ванкомицин) или даптомицин являются препаратами выбора при лечении инфекций, вызванных метициллин-устойчивым золотистым стафилококком. Ванкомицин может иметь более низкую эффективность в лечении инфекций, вызванных штаммами метициллин-устойчивого золотистого стафилококка, так как его минимальная доза, способная вызвать угнетение роста бактерий, составляет более чем 1 мг/мл. В этом случае препаратом выбора является даптомицин.
У лиц с зависимостью от внутривенных наркотиков лечение ИЭ, связанного с другими инфекционными агентами, отличными от золотистого стафилококка, практически не отличается от его лечения у обычных пациентов.
Оперативное лечение у лиц с зависимостью от внутривенных наркотиков целесообразно рассматривать при возникновении следующих ситуаций:
• правосторонняя СН, возникшая в результате тяжелой регургитации на трехстворчатом клапане с плохим ответом на диуретики;
• ИЭ, вызванный возбудителями, плохо поддающимися эрадикации (например, грибковое поражение), или же бактериемия, продолжающаяся не менее 7 дней, несмотря на адекватную антибактериальную терапию (например, золотистый стафилококк, синегнойная палочка);
• наличие вегетаций на трехстворчатом клапане размером от 20 мм, которые сохраняются после рецидивирующей легочной эмболии с/без сочетающейся правосторонней СН.
Недавно было показано, что чаще всего для оперативного лечения правостороннего ИЭ применяют метод замены трехстворчатого клапана биопротезом. Некоторые авторы предпочитают замене операцию по «восстановлению» клапана (избегая использовать какие-либо искусственные материалы), однако данный вид вмешательства не показал ожидаемых результатов. Удаление клапана без его протезирования применяется в исключительных случаях, так как может сопровождаться тяжелой постоперационной правосторонней СН, чаще всего у пациентов с легочной гипертензией. В этих случаях клапан может быть заменен впоследствии, когда будет эрадицирована инфекция и прекращен прием наркотиков.
Антитромботическая терапия при инфекционном эндокардите
Показания к антитромботической терапии у пациентов с ИЭ являются аналогичными таковым у лиц с другими заболеваниями (табл. 3), а опыт применения новых пероральных антикоагулянтов крайне мал. Тромболитическая терапия при ИЭ противопоказана, так как приводит к развитию тяжелых внутричерепных кровоизлияний, однако возможна тромбэктомия как альтернативный вариант лечения у пациентов с ишемическими инсультами, связанными с таким эндокардитом.
Риск развития внутричерепных кровоизлияний может повышаться у пациентов, которые уже находились на пероральном приеме антикоагулянтов до того, как у них был установлен диагноз ИЭ, особенно у больных с ЭПК, обусловленным воздействием золотистого стафилококка. С другой стороны, продолжающийся пероральный прием антикоагулянтных препаратов во время ИЭ может снизить тенденцию раннего появления эмболий.
Профилактика
Авторы новых рекомендаций считают, что у лиц с высоким риском возникновения ИЭ при выполнении вмешательств, которые могут сопровождаться бактериемией, должна проводиться антибиотикопрофилактика (табл. 4).
Несмотря на то что проведение антибиотикопрофилактики не рекомендовано пациентам с умеренным риском возникновения ИЭ (двутрального клапана, кальциноз аортального клапана и др.), пациенты как с высоким, так и с умеренным риском должны быть информированы о необходимости проведения неспецифической профилактики ИЭ. Она включает регулярные осмотры стоматолога, дезинфекцию ран, эрадикацию или уменьшение выраженности хронического бактериального источника, прием антибиотиков при наличии любого очага бактериальной инфекции, строгий контроль ее возникновения при проведении процедур любого риска, особенно высокого (табл. 5), отказ от пирсинга и татуировок, ограничение использования внутривенных катетеров и инвазивных процедур.
Системная антибиотикопрофилактика при нестоматологических вмешательствах (процедуры на дыхательном, желудочно-кишечном, мочеполовом трактах, мягких тканях, опорно-двигательном аппарате) оправдана лишь при выявлении очагов инфекции.
Основной целью антибиотикопрофилактики ИЭ при стоматологических процедурах у лиц с высоким риском возникновения ИЭ является эрадикация стрептококка ротовой полости.
Антибактериальные режимы для этой цели представлены в таблице 6.
При хирургических вмешательствах на сердце и сосудах антибиотикопрофилактика должна начинаться непосредственно перед операцией, повторяться во время операции, если вмешательство продлевается, и заканчиваться через 48 ч после него (табл. 7). Наиболее часто встречающимися возбудителями, поражающими протезированные клапаны в ранние сроки (менее года) после вмешательства, являются коагулазонегативный и золотистый стафилококки.
Всем больным перед реимплантацией внутрисердечного устройства рекомендуется курс антибиотикотерапии. Чаще всего применяют цефалоспорины первого поколения, такие как цефазолин (6 г/сут в течение 24-36 ч после вмешательства и парентерально за час до проведения процедуры).
Ванкомицин, тейкопланин и даптомицин могут быть использованы вместо цефазолина в случае высокой стафилококковой резистентности к оксациллину, у пациентов с высоким риском и при наличии противопоказаний к применению цефалоспоринов. Данные препараты всегда назначают перед процедурой.
Несмотря на то что антибактериальная профилактика перед большинством инвазивных процедур не рекомендуется, соблюдение правил асептики во время манипуляций с венозными катетерами снижает риск возникновения госпитального ИЭ.
Список литературы находится в редакции.
Кардіохірургія та інтервенційна кардіологія, № 4, 2016 р.