9 травня, 2017
Улучшение глобального метаболизма путем регуляции утилизации субстратов при сердечной недостаточности
Сокращенный вариант публикации «Effects on global metabolism by regulation of substrate utilization
in heart failure». Heart Metab. (2014); 64: 23-27.
Истощение подкожного жира и скелетной мускулатуры достаточно часто встречается среди пациентов с сердечной недостаточностью (СН) и свидетельствует об усиленной утилизации неуглеводных субстратов для выработки энергии [1]. Фактически у пациентов с СН в состоянии натощак наблюдается повышенное содержание кетоновых тел в крови [2], а также усиленное окисление жиров во время нагрузки [3]. Показано, что инсулинорезистентность ассоциируется с СН [4] и ведет к растормаживанию липолиза, который, в свою очередь, обусловливает развитие кетоацидоза и определяет сниженную эффективность метаболизма. Интенсивность захвата глюкозы миокардом и скелетными мышцами находится в обратной зависимости от сывороточного уровня свободных жирных кислот (СЖК) [5], и повышенный приток СЖК из жировых в нежировые ткани усиливает метаболические нарушения, характеризующие синдром инсулинорезистентности [6]. Новые данные свидетельствуют о том, что повышенное содержание СЖК не только нарушает захват глюкозы в сердце и скелетных мышцах, но также вызывает расстройства метаболизма сосудистого эндотелия, приводя к преждевременному развитию сердечно-сосудистых заболеваний [7].
Следуя обратной логике, путем улучшения утилизации глюкозы и лактата, которые являются эффективным «топливом» для реакций аэробного дыхания, возможно повысить эффективность использования кислорода миокардом и скелетными мышцами на 16-26% [8]. Триметазидин* проявил себя как прямой ингибитор окисления жирных кислот, блокируя 3-кетоацил-коэнзим-А-тиолазу (3-КАТ) – последний фермент в цепи реакций β-окисления. Показано, что триметазидин регулирует утилизацию субстратов миокарда – подавляет окислительное фосфорилирование и переключает выработку энергии с окисления СЖК на окисление глюкозы [9]. Некоторые исследования выявили потенциальную пользу данного препарата в отношении коррекции регионарной и глобальной миокардиальной дисфункции. Ингибирование 3-КАТ также может приносить пользу, оптимизируя метаболизм глюкозы как в сердечной, так и в скелетных мышцах.
Регуляция миокардиального метаболизма ингибиторами 3-КАТ при постишемической СН
Принимая во внимание свойства триметазидина способствовать утилизации глюкозы и нежировых субстратов митохондриями, исследователи сфокусировались на изучении эффектов данного препарата у пациентов с СН, при которой поддержка метаболической эффективности является важнейшей задачей.
Эффекты присоединения триметазидина к стандартной терапии пациентов с диабетом и ишемической дилатационной кардиомиопатией были исследованы по влиянию на симптомы, переносимость нагрузок и функцию левого желудочка (ЛЖ) в короткие и продленные сроки наблюдения [10]. Терапия триметазидином достоверно улучшала функцию ЛЖ и контроль симптомов по сравнению с плацебо. Эти результаты открыли дорогу дополнительным исследованиям, которые последовательно подтвердили положительные эффекты триметазидина у пациентов с постишемической дисфункцией ЛЖ [11-13].
Регуляция миокардиального метаболизма ингибиторами 3-КАТ при СН разной этиологии
Положительное влияние триметазидина на функцию ЛЖ объясняется поддержанием внутриклеточных концентраций фосфокреатина (ФКр) и аденозинтрифосфата (АТФ) [14]. Предыдущие клинические исследования, в которых использовалась магнитно-резонансная спектроскопия с изотопом фосфора 31Р для измерения соотношения ФКр/АТФ в миокарде, показали, что данное соотношение уменьшается при несостоятельности миокарда [15]. Соотношение ФКр/АТФ – это показатель энергообеспечения миокарда, и его снижение может отражать дисбаланс между поступлением кислорода в миокард и потребностью в нем.
Истощение общих запасов креатина – еще один известный феномен, возникающий при СН, – также может приводить к уменьшению соотношения ФКр/АТФ. У пациентов с СН разной этиологии, которые получали полную стандартную медикаментозную терапию, понижение функционального класса и улучшение функции ЛЖ, связанные с добавлением триметазидина в схему лечения, ассоциировались с восстановлением соотношения ФКр/АТФ, что поддерживает гипотезу о способности триметазидина сохранять внутриклеточные запасы макроэргичного фосфата в миокарде [16]. Эти результаты представляют большой интерес, особенно в свете предыдущих доказательств, согласно которым соотношение ФКр/АТФ является достоверным предиктором смертности [17].
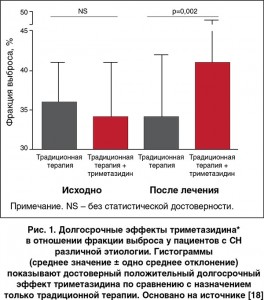
С учетом результатов данного пилотного исследования была предпринята попытка выяснить, обеспечивает ли преимущества назначение триметазидина дополнительно к обычному лечению у пациентов с систолической СН разной этиологии [18]. По сравнению с группой традиционной терапии у пациентов, которые получали триметазидин, отмечалось улучшение по функциональному классу, переносимости нагрузки, качеству жизни и функции ЛЖ (рис. 1). Плазменные уровни натрийуретического пептида В-типа (BNP) также достоверно снизились у пациентов, принимавших триметазидин, по сравнению с группой, в которой применялась только традиционная терапия. Два недавних метаанализа и международное многоцентровое исследование убедительно подтвердили эти результаты [19-21].
Регуляция метаболизма глюкозы ингибиторами 3-КАТ
Для пациентов с СН характерна инсулинорезистентность. В недавних исследованиях установлена прямая взаимосвязь между эндотелиальной дисфункцией и инсулинорезистентностью [22].
Инсулинорезистентность возникает как в сердечной, так и в скелетных мышцах [23]. В этом контексте возможной терапевтической опцией является прямое влияние на мышцы с целью уменьшения утилизации СЖК в пользу окисления глюкозы. Применение частичного ингибитора окисления жирных кислот может играть очень специфическую роль. Фактически ингибиторы 3-КАТ должны способствовать утилизации глюкозы и нелипидных субстратов в митохондриях. Помимо способности улучшать функцию ЛЖ у кардиологических пациентов, недавно было показано, что триметазидин также может улучшать глобальный метаболизм глюкозы, что является привлекательным свойством данного класса препаратов.
Состояние резистентности к инсулину, наблюдаемое у большинства кардиологических больных, выражено в еще большей степени у пациентов с явным диабетом. Это особенно справедливо в отношении пациентов с коморбидными диабетом и дисфункцией ЛЖ, ведь при таком сочетании в значительной степени снижаются как доступность кислорода, так и способность кардиомиоцитов и скелетных мышц метаболизировать глюкозу. Поскольку существенным фактором развития и прогрессирования СН является сниженная доступность АТФ, нарушения метаболизма глюкозы могут приводить к еще большему падению эффективности энергопродукции в кардиомиоцитах. Угнетая окисление жирных кислот, триметазидин стимулирует тотальную утилизацию глюкозы, включая гликолиз и окисление глюкозы. Таким образом, эффекты триметазидина в отношении метаболизма глюкозы могут зависеть и от повышения эффективности работы сердца, и от улучшения захвата и утилизации глюкозы на периферии. И наконец, учитывая известную связь между концентрацией эндотелина‑1 (ЭТ‑1) и нарушениями метаболизма глюкозы, наблюдаемые положительные эффекты триметазидина также можно частично объяснить его способностью снижать уровни ЭТ‑1.
На основании этих данных были изучены метаболизм глюкозы и липидов в мышцах предплечья, а также высвобождение эндотелиальных факторов вазодилатации и вазоконстрикции под действием длительного подавления β-окисления триметазидином у пациентов с постишемической дисфункцией ЛЖ. Триметазидин повышал и инсулин-индуцированное окисление глюкозы, и высвобождение циклического гуанозинмонофосфата, одновременно уменьшая высвобождение ЭТ‑1 [24]. Эти эффекты триметазидина на уровне скелетных мышц открывают новые перспективы в лечении пациентов с СН и инсулинорезистентностью.
Влияние ингибиторов 3-КАТ на функцию эндотелия
Триметазидин способен уменьшать высвобождение эндотелина у кардиологических пациентов [13, 24, 25]. Факторы роста, вазоактивные вещества и механические стрессы вовлечены в повышение образования ЭТ‑1 у пациентов с СН. Несмотря на известный адаптивный эффект поддержки сократимости несостоятельного миокарда, постоянно повышенная экспрессия ЭТ‑1 при СН играет дезадаптивную патофизиологическую роль и ассоциируется с тяжестью миокардиальной дисфункции [26]. Причинная роль ЭТ‑1 была установлена при сосудистой адаптации к декондиционированию скелетных мышц, а также наблюдается при других состояниях [27].
Свойство триметазидина уменьшать внутриклеточный ацидоз в ишемизированном миокарде может иметь значение для защиты не только мембран кардиомиоцитов, но и эндотелиальных мембран [28]. Предотвращая повреждение эндотелия, триметазидин может подавлять высвобождение ЭТ‑1 и таким образом уменьшать повреждение миокарда. Согласно второй гипотезе, только за счет противодействия эффектам хронической ишемии миокарда триметазидин может ингибировать образование ЭТ‑1. Кроме того, принимая во внимание тесную взаимосвязь между эндотелием и чувствительностью к действию инсулина, наблюдаемые эффекты триметазидина в отношении функции эндотелия также можно объяснить его положительным влиянием на глобальный метаболизм глюкозы [24].
Влияние триметазидина на общий энергетический обмен у пациентов с СН
У пациентов с СН наблюдается высокий уровень метаболизма в состоянии покоя [29-31], что, вероятно, вносит вклад в прогрессирование синдрома. Величина расхода энергии связана с повышенным окислением СЖК в плазме крови. Как расход энергии, так и интенсивность реакций окисления СЖК обратно коррелируют с фракцией выброса ЛЖ и положительно коррелируют с растущими концентрациями адреналина и норадреналина [32]. Норадреналин увеличивает общее потребление кислорода организмом, повышает концентрацию циркулирующих СЖК и интенсивность окисления СЖК [33]. Эти изменения связаны со стимуляцией гормон-чувствительной липазы в жировой ткани и стимуляцией потребления кислорода независимо от липолиза под действием норадреналина [34]. Эти данные в совокупности с тесными корреляциями между концентрацией норадреналина в плазме, расходом энергии в покое и окислением СЖК наиболее убедительно объясняют нарушения гомеостаза энергетических ресурсов при СН повышенной симпатической активностью. Поэтому вмешательства, направленные на оптимизацию глобального и кардиального метаболизма, могут разорвать порочный круг сниженной функции при высоких метаболических расходах у пациентов с различными заболеваниями сердца [35].
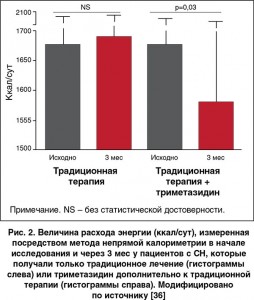
В недавно опубликованном исследовании было показано, что лечение триметазидином в течение 3 мес дополнительно к обычной терапии ассоциировалось с отчетливым снижением общего расхода энергии в состоянии покоя, а также улучшением функционального класса и повышением качества жизни и функции ЛЖ у пациентов с систолической СН, независимо от ее этиологии и наличия или отсутствия диабета (рис. 2) [36]. Поскольку наблюдавшееся положительное влияние триметазидина в отношении функции ЛЖ сопровождалось снижением глобального расхода энергии по сравнению с пациентами контрольной группы, возможно, что эффект триметазидина опосредован сокращением метаболической потребности на уровне периферических тканей и своего рода центральной (кардиальной) разгрузкой. Таким образом, снижение потребности всего организма в энергии может быть одним из главных механизмов, посредством которых триметазидин способен облегчать симптомы, повышать толерантность к физическим нагрузкам и улучшать функцию ЛЖ у пациентов с СН.
Заключение
Частичный ингибитор окисления жирных кислот триметазидин* может играть важную роль в лечебной стратегии у пациентов с СН, которые плохо переносят нагрузки. Переключение энергетического обмена с окисления СЖК на окисление глюкозы путем назначения триметазидина может быть дополнительным эффективным лечением для пациентов с СН, особенно в отношении улучшения метаболизма и функций ЛЖ и скелетных мышц. По-видимому, эти эффекты проявляются при всех синдромах СН, независимо от их этиопатогенетической основы, и не ограничиваются только СН ишемического происхождения.
*В исследованиях, представленных в данном обзоре, использовался оригинальный триметазидин. Усовершенствованная и един- ственная зарегистрированная сейчас в Украине форма оригинального триметазидина, который изучали в приведенных в обзоре исследованиях (Р. с. МЗ Украины № UA/3704/02/01), – Предуктал MR. Биоэквивалентность Предуктала и Предуктала MR доказана, представлена и подтверждена в процессе регистрации.
Литература
1. Neely J.R., Rovetto M.J., Oram J.F. Myocardial utilization of carbohydrate and lipids. Prog. Cardiovasc. Dis. 1972; 15: 289-329.
2. Lommi J., Kupari M., Koskinen P., et al. Blood ketone bodies in congestive heart failure. J. Am. Coll. Cardiol. 1996; 28: 665-672.
3. Riley M., Bell N., Elborn J.S., Stanford C.F., Buchanan K.D., Nicholls D.P. Metabolic response to graded exercise in chronic heart failure. Eur. Heart. J. 1993; 14: 1484-1488.
4. Paolisso G., De Riu S., Marrazzo G., Verza M., Varricchio M., D’Onofrio F. Insulin resistance and hyperinsulinemia in patients with chronic heart failure. Metabolism. 1991; 40: 972-977.
5. Nuutila P., Knuuti M.J., Raitakari M., et al. Effect of antilipolysis on heart and skeletal muscle glucose uptake in overnight fasted humans. Am. J. Physiol. 1994; 267: E941-E946.
6. Lewis G.F., Carpentier A., Adeli K., Giacca A. Disordered fat storage and mobilization in the pathogenesis of insulin resistance and type 2 diabetes. Endocrine Reviews. 2002; 23: 201-229.
7. Steinberg H.O., Baron A.D. Vascular function, insulin resistance and fatty acids. Diabetologia. 2002; 45: 623-634.
8. Lopaschuck G.D., Stanley W.C. Glucose metabolism in the ischemic heart. Circulation. 1997; 95: 313-315.
9. Fantini E., Demaison L., Sentex E., Grynberg A., Athias P. Some biochemical aspects of the protective effect of trimetazidine on rat cardiomyocytes during hypoxia and reoxygenation. J. Mol. Cell. Cardiol. 1994; 26: 949-958.
10. Fragasso G., Piatti P.M., Monti L., et al. Short and long-term beneficial effects of partial free fatty acid inhibition in diabetic patients with ischemic dilated cardiomyopathy. Am. Heart. J. 2003; 146: E18.
11. Rosano G.M., Vitale C., Sposato B., Mercuro G., Fini M. Trimetazidine improves left ventricular function in diabetic patients with coronary artery disease: a double-blind placebo-controlled study. Cardiovasc. Diabetol. 2003; 2: 16.
12. Vitale C., Wajngaten M., Sposato B., et al. Trimetazidine improves left ventricular function and quality of life in elderly patients with coronary artery disease. Eur. Heart. J. 2004; 25: 1814-1821.
13. Di Napoli R., Taccardi A.A., Barsotti A. Long-term cardioprotective action of trimetazidine and potential effect on the inflammatory process in patients with ischaemic dilated cardiomyopathy. Heart. 2005; 91: 161-165.
14. Lavanchy N., Martin J., Rossi A. Anti-ischemia effects of trimetazidine: 31P-NMR spectroscopy in the isolated rat heart. Arch. Int. Pharmacodyn. Ther. 1987; 286: 97-110.
15. Conway M.A., Allis J., Ouwerkerk R., Niioka T., Rajakopalan B., Radda G.K. Detection of low PCr to ATP ratio in failing hypertrophied myocardium by 31P magnetic resonance spectroscopy. Lancet. 1991; 338: 973-976.
16. Fragasso G., De Cobelli F., Perseghin G., et al. Effects of meta-bolic modulation by trimetazidine on left ventricular function and phosphocreatine/adenosine triphosphate ratio in patients with heart failure. Eur. Heart J. 2006; 27: 942-948.
17. Neubauer S., Horn M., Cramer M., et al. Myocardial phospho-creatine-to-ATP ratio is a predictor of mortality in patients with dilated cardiomyopathy. Circulation. 1997; 96: 2190-2196.
18. Fragasso G., Palloshi A., Puccetti P., et al. A randomized clinical trial of trimetazidine, a partial free fatty acid oxidation inhibitor, in patients with heart failure. J. Am. Coll. Cardiol. 2006; 48: 992-998.
19. Gao D., Ning N., Niu X., Hao G., Meng Z. Trimetazidine: a meta-analysis of randomised controlled trials in heart failure. Heart. 2011; 97: 278-286.
20. Zhang L., Lu Y., Jiang H., et al. Additional use of trimetazidine in patients with chronic heart failure: a meta-analysis. J. Am. Coll. Cardiol. 2012; 59: 913-922.
21. Fragasso G., Rosano G., Baek S.H., et al. Effect of partial fatty acid oxidation inhibition with trimetazidine on mortality and morbidity in heart failure: results from an international multicentre retrospective cohort study. Int. J. Cardiol. 2013; 163: 320-325.
22. Piatti P.M., Monti L.D., Galli L., et al. Relationship between endothelin‑1 concentrations and the metabolic alterations typical of the insulin resistance syndrome. Metabolism. 2000; 49: 748-752.
23. Crettaz M., Zaninetti D., Jeanrenaud B. Insulin-resistance in heart and skeletal muscles of genetically obese Zucker rats. Biochem. Soc. Trans. 1981; 9: 524-525.
24. Monti L.D., Setola E., Fragasso G., et al. Metabolic and endothelial effects of trimetazidine on forearm muscle in patients with type 2 diabetes and ischemic cardiomyopathy. Am. J. Physiol. Endocrinol. Metab. 2006; 290: E54-E59.
25. Fragasso G., Piatti P., Monti L., et al. Acute effects of heparin administration on the ischemic threshold of patients with coronary artery disease: evaluation of the protective role of the metabolic modulator trimetazidine. J. Am. Coll. Cardiol. 2002; 39: 413-419.
26. Yamauchi-Kohno R., Miyauchi T., Hoshino T., et al. Role of endothelin in deterioration of heart failure due to cardiomyopathy in hamsters: increase in endothelin production in the heart and beneficial effect of endothelin A antagonist on survival and cardiac function. Circulation. 1999; 99: 2171-2176.
27. Thijssen D.H., Ellenkamp R., Kooijman M., et al. A causal role for endothelin‑1 in the vascular adaptation to skeletal muscle deconditioning in spinal cord injury. Arterioscler. Thromb. Vase. Biol. 2007; 27: 325-331.
28. Maridonneau-Parini I., Harpey C. Effects of trimetazidine on membrane damage induced by oxygen free radicals in human red cells. Br. J. Clin. Pharmacol. 1985; 20: 148-151.
29. Peabody F.W., Meyer A.L., Du Bois E.F. The basal metabolism of patients with cardiac and renal disease. Arch. Int. Med. 1916; 17: 980-1009.
30. Riley M., Elborn J.S., McKane W.R., et al. Resting energy expenditure in chronic cardiac failure. Clin. Sci. 1991; 80: 633-639.
31. Poehlman E.T., Scheffers J., Gottlieb S.S., et al. Increased resting metabolic rate in patients with congestive heart failure. Ann. Intern. Med. 1994; 121: 860-862.
32. Lommi J., Kupari M., Yki-Jarvinen H. Free fatty acid kinetics and oxidation in congestive heart failure. Am. J. Cardiol. 1998; 81: 45-50.
33. Steinberg D., Nestel P.J., Buskirk E.R., et al. Calorigenic effect of norepinephrine correlated with plasma free fatty acid turnover and oxidation. J. Clin. Invest. 1964; 43: 167-176.
34. Landsberg L., Saville M.E., Young J.B. Sympathoadrenal system and regulation of thermogenesis. Am. J. Physiol. 1984; 247: E181-E189.
35. Beadle R.M., Frenneaux M. Modification of myocardial substrate utilisation: a new therapeutic paradigm in cardiovascular disease. Heart. 2010; 96: 824-830.
36. Fragasso G., Salerno A., Lattuada G., et al. Effect of partial inhibition of fatty acid oxidation by trimetazidine on whole body energy metabolism in patients with chronic heart failure. Heart. 2011; 97: 1495-1500.
Перевел с англ. Дмитрий Молчанов