9 травня, 2017
Эхокардиография в диагностике легочной гипертензии
Легочная гипертензия (ЛГ) – патологический симптомокомплекс, характеризующийся повышением давления в легочной артерии (ЛА) вследствие повышения легочного сосудистого сопротивления и/или наличием гемодинамически значимого лево-правого сброса при пороках сердца, когда давление в правых отделах сердца и легочных артериальных сосудах достигает значения системного. Морфологические и функциональные изменения, которые претерпевает правый желудочек (ПЖ) в создавшихся условиях, в конечном итоге приводят к развитию сердечной недостаточности (СН), инвалидности и летальному исходу.
ЛГ может быть самостоятельной патологией либо рассматриваться как синдром, вторичный по отношению к основному заболеванию.
В настоящее время общепризнанной является классификация ЛГ, принятая в 2008 году в г. Дана-Пойнт (Калифорния, США) на Всемирном симпозиуме по ЛГ. Согласно данной классификации выделяют пять основных групп ЛГ:
– легочная артериальная гипертензия (ЛАГ);
– ЛГ вследствие патологии левых отделов сердца;
– ЛГ вследствие заболеваний легких и/или гипоксии;
– хроническая тромбоэмболическая ЛГ;
– ЛГ вследствие невыясненных многофакторных механизмов.
На ежегодном конгрессе Европейского общества кардиологов (ESC), проходившем в 2015 году в г. Лондон (Великобритания), были представлены новые Рекомендации по диагностике и лечению ЛГ (Guidelines for the diagnosis and treatment of pulmonary hypertension), разработанные совместно ESC и Европейским респираторным обществом (ERS) (ESC/ERS, 2015) [1], которые стали результатом анализа ряда крупных исследований, проводившихся после выхода в свет предыдущего издания рекомендаций (Guidelines for the diagnosis and treatment of pulmonary hypertension ESC/ERS/ISHLT, 2009).
В данном документе с позиций доказательной медицины представлены лечебные стратегии при наличии у пациента ЛГ и с учетом конкретной клинической ситуации и соотношением риска и пользы диагностических процедур и медикаментозных средств.
Эксперты ERS рекомендуют диагностировать ЛГ при увеличении среднего давления в легочной арте-
рии (PAPm) ≥25 мм рт. ст. в покое по результатам катетеризации правых отделов сердца. Как известно, средние значения PAPm в покое в норме колеблются в пределах 14±3 мм рт. ст. с максимальным значением 20 мм рт. ст. Клиническое значение PAPm в интервале 21-24 мм рт. ст. не определено. В случае отсутствия явных клинических симптомов ЛГ при данных значениях PAPm необходимо проводить мониторинг состояния пациента [2, 3].
Как и прежде, ЛГ рассматривают как патофизиологическое состояние, осложняющее течение многих сердечно-сосудистых и респираторных заболеваний.
Эксперты ESC подчеркивают, что ЛГ – патофизиологическое и гемодинамическое состояние, а не клинический диагноз. В качестве клинического диагноза можно рассматривать только ее особую форму – идиопатическую (наследственную) ЛАГ, остальные группы ЛГ являются вторичными состояниями при различных заболеваниях и патологических нарушениях.
ЛАГ диагностируют у пациентов, у которых имеет место уровень среднего давления в ЛА ≥25 мм рт. ст. в покое, величина давления заклинивания в легочных капиллярах (PAWP) ≤15 мм рт. ст., а также легочное сосудистое сопротивление (PVR) >3 ед. С анатомической точки зрения ЛАГ представляет собой прекапиллярную ЛГ, которая развивается самостоятельно, без каких-либо провоцирующих заболеваний внутренних органов – хронические легочные заболевания (хроническое обструктивное заболевание легких –ХОЗЛ, интерстициальные поражения легких, синдром обструктивного апноэ сна, тромбоэмболия ЛА –ТЭЛА и пр.) [2].
В рекомендациях 2015 года предложена «гемодинамическая» классификация ЛГ, в которой разновидности ЛГ систематизированы с учетом величин давления в ЛА, давления заклинивания в легочных капиллярах, величины сосудистого сопротивления в малом круге кровообращения, а также сердечного выброса, измеренных в состоянии покоя (табл. 1).
Согласно Международной классификации болезней 10-го пересмотра (МКБ‑10) ЛАГ (группа 1 ЛГ) классифицируется как «болезни системы кровообращения» с кодами 127.0 – идиопатическая ЛАГ и 127.8 – ЛАГ, ассоциированная с врожденными пороками сердца; резидуальная ЛАГ; синдром Эйзенменгера; персистирующая ЛАГ новорожденных; ЛАГ, ассоциированная с системными заболеваниями соединительной ткани; ЛАГ, ассоциированная с ВИЧ-инфекцией; ЛАГ, ассоциированная с портальной гипертензией; ЛАГ, ассоциированная с шистосомозом; легочная веноокклюзионная болезнь или легочный веноакклюзионный гемангиоматоз.
Данная патология встречается достаточно редко, что и явилось основанием отнести ее к группе редких, или орфанных, заболеваний.
В Европе данную патологию диагностируют у 15-60 человек на 1 млн населения, заболеваемость в течение года – 5-10 случаев на 1 млн населения [4]. В регистрах у 50% пациентов диагностирована идиопатическая ЛАГ или ЛАГ, обусловленная приемом некоторых медикаментозных препаратов. Из заболеваний соединительной ткани наиболее частой причиной ЛАГ является склеродермия (системный склероз) [5]. Средний возраст пациентов – 50-65 лет (в регистре 1981 года указан средний возраст установления диагноза – 36 лет). Преобладание женщин в пожилом возрасте, по результатам последних исследований, сомнительно.
Наибольшую по численности больных составляет группа 2 ЛГ – как следствие заболевания левых отделов сердца. Распространенность ЛГ у пациентов группы 2 возрастает с появлением и по мере прогрессирования признаков СН. Повышение давления в ЛА определяют у 60% пациентов с тяжелой систолической дисфункцией левого желудочка (ЛЖ) и у 70% пациентов с СН и сохраненной фракцией выброса (ФВ) ЛЖ. Из приобретенных клапанных пороков практически все случаи стеноза митрального клапана осложняются посткапиллярной ЛГ и 65% случаев гемодинамически значимого стеноза аортального клапана [6-8].
При заболеваниях легких и/или гипоксемии (группа 3 ЛГ) часто встречается мягкая, редко – тяжелая ЛГ, преимущественно при сочетании эмфиземы и распространенного фиброза. Чаще всего причиной ЛГ является ХОЗЛ [9].
Распространенность ЛГ при хронической ТЭЛА составляет 3,2 случая на 1 млн населения. У выживших после острой ТЭЛА ЛГ диагностируется в 0,5-3,8% случаев [10, 11].
Вместе с тем на сегодняшний день существует проблема крайне малого количества информации о демографии и течении заболевания у данной части популяции больных ЛГ, что диктует необходимость создания региональных и государственных регистров в качестве методологического подхода к изучению проблемы.
Актуальной задачей является своевременная диагностика синдрома ЛГ, а также информирование об этой патологии широкого круга специалистов, поскольку, как уже подчеркивалось, она способна осложнять различные заболевания.
Рекомендации ERS (2015) предлагают диагностировать ЛГ на основании клинических данных, включающих анамнез, развитие симптомов и физикальное исследование. Важная роль в подтверждении диагноза ЛГ отводится результатам инструментальных методов исследования, интерпретированным опытными специалистами.
Диагностический алгоритм выстраивается на результатах, подтверждающих или исключающих заболевания, сопровождающиеся развитием ЛГ (группы 2-5).
Инструментальные методы диагностики ЛГ включают как неинвазивные (электрокардиография (ЭКГ), рентгенография органов грудной клетки, трансторакальная эхокардиография (ЭхоКГ), спирография, компьютерная томография высокого разрешения), так и инвазивные методы диагностики (вентиляционно-перфузионная сцинтиграфия легких, ангиопульмонография, катетеризация правых отделов сердца с определением давления в сосудах малого круга кровообращения).
Целесообразность использования каждого из диагностических методов прежде всего обусловлена этиологией ЛГ.
Каковы же место и роль ЭхоКГ в данном процессе? Ультразвуковое исследование сердца позволяет решить главную задачу и определить дальнейшую терапевтическую тактику: установить, на каком уровне отмечается поражение – либо это артерии малого круга кровообращения и речь идет о прекапиллярной ЛГ, либо это посткапиллярная ЛГ с первичным повышением давления в левых отделах сердца и легочных венах.
Американский консенсус и Европейские рекомендации по диагностике и лечению ЛГ предлагают рассматривать ЭхоКГ как метод скрининга для верификации данной патологии [12-14].
ЭхоКГ позволяет объяснить причину повышения давления в правых отделах сердца (выявляет предсердные и желудочковые шунты, врожденные аномалии, клапанные поражения, ТЭЛА, хроническую СН и пр.), оценить степень гипертензии малого круга, определить структурно-функциональные нарушения со стороны ПЖ при ЛГ.
С помощью метода трансторакальной ЭхоКГ оценивают состояние сердечной мышцы и камер сердца для выявления гипертрофии и дилатации правых отделов сердца, диагностики патологии миокарда и клапанного аппарата, нарушений гемодинамики (табл. 4). В последних рекомендациях говорится, что трансторакальной ЭхоКГ недостаточно для суждения о мягкой или малосимптомной ЛГ в связи с методическими неточностями исследования и индивидуальными особенностями пациентов. В клиническом контексте результаты ЭхоКГ-исследования необходимы для принятия решения о выполнении катетеризации сердца [15-17].
Чреспищеводную ЭхоКГ используют у пациентов с наличием ЛГ, чаще всего с целью уточнения причины, ее вызвавшей. Так, с помощью данной методики удается выявить дефекты межпредсердной перегородки с локализацией у места впадения нижней и верхней полых вен (дефекты венозного синуса), наличие частичного аномального дренажа легочных вен, а также подтвердить диагноз тромбоэмболической ЛГ – визуализировать наличие тромботических масс в ветвях ЛА. В целом чреспищеводная ЭхоКГ не имеет преимуществ в диагностике ЛГ перед трансторакальной ЭхоКГ.
У пациентов с ЛГ развиваются нарушения морфометрических и гемодинамических параметров, которые можно обнаружить методом трансторакальной ЭхоКГ, проводимой по стандартным методикам, рекомендуемым американским и европейским обществами по эхокардиографии [13, 14].
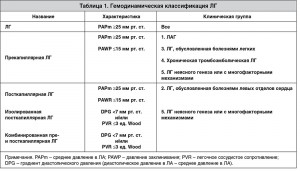
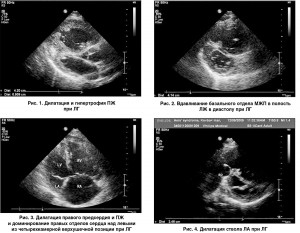
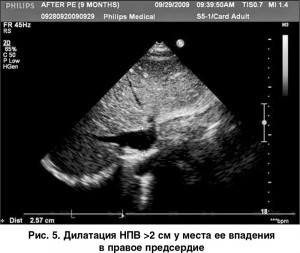
Ультразвуковыми признаками ЛГ являются: дилатация полости ПЖ >2,6 см, измеренной по длинной оси из парастернального доступа, гипертрофия его свободной стенки >0,5 см (рис. 1), вдавливание базального сегмента межжелудочковой перегородки (МЖП) в полость ЛЖ в диастолу вследствие повышения давления в правых отделах сердца (рис. 2), увеличение соотношения медиально-латеральных размеров ПЖ и ЛЖ сердца, измеренных из верхушечной четырехкамерной позиции, дилатация правого предсердия (рис. 3), дилатация ствола >3 см и ветвей ЛА (рис. 4), дилатация нижней полой вены (НПВ) >2 см с коллабированием ее на вдохе менее чем на 50% (рис. 5).
Допплерографическое исследование внутрисердечной гемодинамики существенно повышает диагностическую ценность ЭхоКГ в выявлении ЛГ, поскольку позволяет оценить степень гипертензии малого круга кровообращения. С помощью допплерографии можно рассчитать систолическое давление в ЛА (СДЛА), которое эквивалентно СД в ПЖ при отсутствии стеноза ЛА. СДЛА вычисляют по формуле:
СДЛА (мм рт. ст.) = СДПЖ (мм рт. ст.) + ДПП (мм рт. ст.), где СДПЖ – систолическое давление в ПЖ; ДПП – давление в правом предсердии.
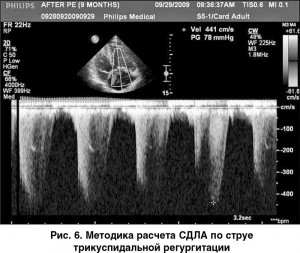
СДПЖ равняется градиенту давления (ΔР) между ПЖ и правым предсердием, которое определяют по максимальной скорости струи трикуспидальной регургитации (СТР), измеренной в режиме постоянноволнового допплера (рис. 6), с помощью уравнения Бернулли:
ΔР = 4V2, где V – максимальная скорость допплеровского спектра (м/с).
Для расчета давления в правом предсердии измеряют размеры НПВ приблизительно на расстоянии 2 см от места ее впадения в правое предсердие. Кроме абсолютных размеров НПВ, необходимо определить уровень ее коллабирования (%) на вдохе. Величины этих значений определяют величину ДПП:
НПВ ≤2,1 см; уровень спадения на вдохе ≥50%; ДПП=0-5 мм рт. ст. (норма);
НПВ >2,1 см; уровень спадения на вдохе ≥50%; ДПП=6-10 мм рт. ст.;
НПВ >2,1 см; уровень спадения на вдохе <50%; ДПП=10-15 мм рт. ст.;
НПВ >2,1 см; спадение на вдохе отсутствует; ДПП >15 мм рт. ст.
Однако, учитывая неточности оценки ДПП с использованием производных переменных, эксперты ESC/ERS рекомендуют применять постоянноволновое допплеровское картирование для измерения скорости СТР, а не расчетного СДЛА в качестве основного показателя для определения вероятности ЛГ по данным ЭхоКГ.
При затруднениях определения СТР из-за невыраженности ТР рекомендуется использовать так называемую
ЭхоКГ с контрастированием. В качестве контраста применяют физиологический раствор, который взбалтывают до образования мелких пузырьков газа с последующим его внутривенным введением. Наличие газов в полости правого предсердия позволяет более четко выявить регургитацию на трикуспидальном клапане, если таковая имеет место.
В то же время авторы рекомендаций акцентируют внимание на том, что ЛГ нельзя достоверно исключить по значению СТР, определенному эхокардиографически. Поэтому при постановке диагноза ЛГ даже при казалось бы невысоких значениях СТР следует принимать во внимание другие ЭхоКГ-признаки данной патологии (табл. 2).
Измерение среднего давления в ЛА (ДЛАср) методом допплерографии. ДЛАср определяют по спектру кровотока в ЛА, измеренного на уровне ее клапанов в режиме импульсноволнового допплера (PW-допплер).
Существуют различные формулы для расчета ДЛАср:
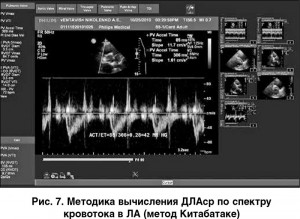
– наиболее распространен метод Китабатаке: AcT/ET (рис. 7), где AcT – время ускорения кровотока в ЛА (мс); ET – общая длительность кровотока в ЛА (мс). Полученное соотношение подставляют в специальную номограмму и рассчитывают ДЛАср. Чем выше среднее давление в ЛА, тем короче АсТ:
– ДЛАср = 0,61 СДЛА + 2;
– ДЛАср = 79-0,45 × АсТ;
– ДЛАср = 2/3 ДДЛА + 1/3 СДЛА, где ДДЛА – диастолическое давление в ЛА (мм рт. ст.).
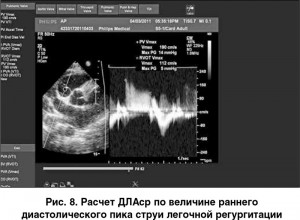
При наличии регургитации на клапане ЛА, что нередко наблюдается вследствие дилатации ее ствола при ЛГ, ДЛАср можно вычислить по раннему диастолическому пику струи легочной регургитации. Градиент давления между ЛА и ПЖ, рассчитанный по формуле Бернулли, отражает среднее давление в ЛА (рис. 8).
Допплер-ЭхоКГ позволяет также неинвазивно оценить ДДЛА, которое отражает давление заклинивания в легочных капиллярах.
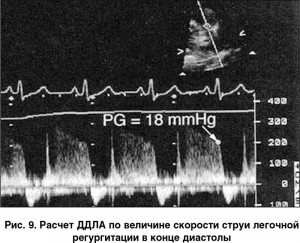
ДДЛА = конечно-диастолический градиент легочной регургитации + давление в правом предсердии.
Конечно-диастолический градиент давления легочной регургитации определяют с помощью уравнения Бернулли, по скорости струи легочной регургитации в конце диастолы (рис. 9); ДПП рассчитывают по методике, приведенной выше.
Определение резистентности легочных сосудов (pulmonary vascular resistance, PVR) методом допплер-ЭхоКГ. PVR – важный гемодинамический показатель, необходимый для диагностики ЛГ. Расчет PVR дает возможность определить этиологию ЛГ (пост- или прекапиллярная), оценить эффективность ее лечения и прогноз.
Несмотря на то что катетеризация правых отделов сердца является наиболее точным методом измерения PVR, допплер-ЭхоКГ позволяет неинвазивно определить этот параметр.
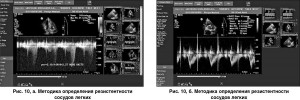
Резистентность сосудов измеряют в единицах Вуда (Wood’s units, wu):
PVR (Wood’s units) = [Peak TR velocity (m/s) / RVOT velocity time integral (cm)] × 10 + 0,16, где Peak TR velocity – максимальная СТР (рис. 10, а); RVOT – интеграл «время-скорость» спектра кровотока в выходном отделе ПЖ (рис. 10, б).
В норме PVR <3 wu.
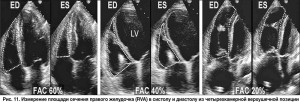
ЭхоКГ-оценка функции ПЖ. Сложная геометрия ПЖ затрудняет оценку его объемных параметров и сократительной способности. Изменение площади сечения ПЖ, измеренной в четырехкамерной верхушечной позиции (RV fractional area – RVFA, %), – наиболее простой метод оценки сократительной способности этой камеры сердца (рис. 11).
RVFA (%) = конечно-диастолическая площадь сечения ПЖ – конечно-систолическая площадь сечения ПЖ / конечно-диастолическая площадь сечения ПЖ. Этот показатель сильно коррелирует с ФВ ПЖ, измеренной методом магнитно-резонансной томографии – МРТ (r=0,88).
В таблице 3 представлен диапазон значений параметров ПЖ, которые характеризуют степень его структурно-функционального ремоделирования.
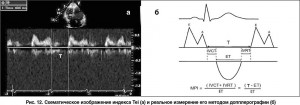
Для оценки глобальной сократительной функции ПЖ используют также индекс Tei (1996) – негеометрический индекс глобальной сократительной функции желудочка, который не зависит от пред- и постнагрузки (рис. 12). Его вычисляют на основании трех временных интервалов: изоволюмического времени сокращения ПЖ (IVCT), изоволюмического времени расслабления ПЖ (IVRT) и времени изгнания из ПЖ (ET) по формуле: MPI = (IVRT + IVCT) / ET.
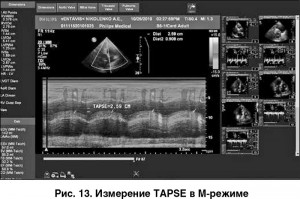
Высокой диагностической ценностью при оценке сократительной функции ПЖ обладает ЭхоКГ-параметр, измеряемый в М-режиме (tricuspid annular plane systolic excursion, TAPSE), – амплитуда движения кольца трикуспидального клапана в систолу. При наличии тканевого допплера визуализация движения кольца трикуспидального клапана более четкая, что облегчает измерение TAPSE (рис. 13).
В норме амплитуда движения кольца трикуспидального клапана к верхушке составляет 1,5-2 см; снижение экскурсии <1,5 см ассоциируется с неблагоприятным прогнозом при ЛГ. TAPSE сильно коррелирует с ФВ ПЖ, установленной методом МРТ в реальном времени (r=0,62). Этот параметр можно рассматривать в качестве прогностического критерия выживаемости пациентов с ЛГ:
– TAPSE >18 мм: годичная выживаемость – 94%, двухлетняя – 88%;
– TAPSE <18 мм: годичная выживаемость – 60%, двухлетняя –50%.
В рекомендациях 2015 года подчеркивается, что ЭхоКГ должна установить уровень вероятности ЛГ по совокупности ряда ультразвуковых критериев, если у пациента есть клинические симптомы, характерные для данной патологии (табл. 3).
Определены также ЭхоКГ-параметры, которые необходимо использовать наряду с СТР для определения степени вероятности ЛГ (табл. 4).
Как указывалось выше, метод ЭхоКГ может успешно применяться для уточнения этиологии ЛГ, в частности для подтверждения дефектов перегородок и патологических сбросов на уровне магистральных сосудов, стенотических поражений камер сердца и клапанного аппарата.
В случаях выявления диастолической дисфункции ЛЖ следует прицельно оценить другие параметры, позволяющие установить диагноз ЛГ. Это крайне важно для выбора тактики лечения пациентов с сохранной систолической функцией ЛЖ, но с клиническими признаками застоя в малом круге кровообращения, обусловленном наличием изолированной диастолической СН (АГ, гипертрофическая кардиомиопатия и др).
В рекомендациях ESC/ERS указывается, что катетеризацию правых отделов сердца следует рассматривать в качестве подтверждающего диагностического метода, если диагноз остается не до конца выясненным после применения неинвазивных методов исследования.
Также диагностическая ценность ЭхоКГ и допплерографического исследования на сегодняшний день остается не до конца установленной при выявлении ультразвуковых признаков ЛГ на фоне физической нагрузки. Авторы рекомендаций указывают, что для окончательного решения данного вопроса необходимо проведение дополнительных проспективных исследований.
ЭхоКГ-критерии – TAPSE, наличие выпота в перикарде, сердечный индекс (СI) и давление в правом предсердии наряду с динамикой прогрессирования патологического процесса, результатами нагрузочных тестов (тест с 6-минутной ходьбой), кардиопульмонального тестирования с определением газового состава крови и уровнем мозгового натрийуретического пептида (BNP) и его предшественника (pro-BNP) предложены в качестве основных прогностических критериев течения ЛГ. Этот факт, несомненно, является подтверждением того, что ЭхоКГ нельзя рассматривать лишь как метод скрининга ЛГ. Данный метод играет основную роль в диагностическом процессе, обеспечении динамического контроля за течением заболевания и эффективностью лечебных мероприятий.
Литература
1. Galiе N. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension / N. Galiе, M. Humbert, J.-L. Vachiery et al. – Available at: http://dx.doi.org/10.1093/eurheartj/ehv317.
2. Hoeper M.M., Bogaard H.J., Condliffe R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol 2013; 62 (Suppl): D42-D50.
3. Kovacs G., Berghold A., Scheidl S., et al. Pulmonary arterial pressure during rest and exercise in healthy subjects. A systematic review. Eur Respir J. 2009; 34: 888-894.
4. Peacock A.J., Murphy N.F., McMurray J.J.V., et al. An epidemiological study of pulmonary arterial hypertension. Eur Respir J. 2007; 30: 104-109.
5. Humbert M., Sitbon O., Chaouat A., et al. Pulmonary arterial hypertension in France: results from a national registry. Am J Respir Crit Care Med. 2006; 173: 1023-1030.
6. Badesch B.D., Champion H. C., Gomez-Sanchez M.A., et al. Diagnosis and assessment of pulmonary arterial hypertension. J Am Coll Cardiol. 2009; 54 (Suppl): S55-S56.
7. Oudiz R.J. Pulmonary hypertension associated with left-sided heart disease. Clin Chest Med. 2007; 28: 233-241.
8. Vahanian A., Alfieri O., Andreotti F., et al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J. 2012; 33: 2451-2496.
9. Hurdman J., Condliffe R., Elliot C.A., et al. Pulmonary hypertension in COPD: results from the ASPIRE registry. Eur Respir J. 2013; 41: 1292-301.
10. Pengo V., Lensing A.W., Prins M.H., et al. Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism. N Engl J Med. 2004; 350: 2257-2264.
11. Pepke-Zaba J., Delcroix M., Lang I., et al. Chronic thromboembolic pulmo-
nary hypertension (CTEPH): results from an international prospective registry. Circulation. 2011; 124: 1973-1981.
12. Rudski L.G., Lai W.W., Afilalo J., et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2010; 23: 685-713.
13. Lang R. M., Badano L.P., Mor-Avi V., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015; 16:
233-271.
14. Foale R., Nihoyannopoulos P., McKenna W., et al. Echocardiographic measurement of the normal adult right ventricle. Br Heart J. 1986; 56: 33-44.
15. Arcasoy S.M., Christie J.D., Ferrari V.A., et al. Echocardiographic assessment of pulmonary hypertension in patients with advance lung disease. Am J Respir Crit Care Med. 2003; 167: 735-740.
16. Fisher M.R., Forfia P.R., Chamera E., et al. Accuracy of Doppler echocardiography in the hemodynamic assessment of pulmonary hypertension. Am J Respir Crit Care Med. 2009; 179: 615-621.
17. Nathan S.D., Shlobin O.A., Barnett S.D., et al. Right ventricular systolic pressure by echocardiography as a predictor of pulmonary hypertension in idiopathic pulmonary fibrosis. Respir Med. 2008; 102: 1305-310.