14 березня, 2017
Можливості оптимізації застосування метаболічних кардіопротекторів у хворих на гострий інфаркт міокарда зі стійкою елевацією сегмента ST
Серцево-судинні захворювання, зокрема гострий інфаркт міокарда (ГІМ), незважаючи на значний прогрес у діагностиці та лікуванні, залишаються на першому місці серед причин смертності та втрати працездатності як в Україні, так і у світі (Стрес і хвороби системи кровообігу, 2015; A.S. Go, 2014). Одним із найважливіших завдань фармакотерапії ГІМ з елевацією сегмента ST (ГІМелST), виконання якого здатне покращити наслідки захворювання, вважається максимально можливе збереження маси життєздатного міокарда (G. Heusch, 2012). Цього можна досягти шляхом застосування процедур механічного та хімічного відкриття артерії, що зумовила інфаркт, і лікарських засобів із кардіопротекторними властивостями (D.J. Hausenloy, 2013; H.M. Piper, 2012).
Відкриття нових патофізіологічних складових процесу ішемічно-реперфузійного пошкодження привело до появи нових фармакологічних засобів кардіопротекції (циклоспорин-А, ексенатид, абсиксимаб, еритропоетин тощо) та кращого розуміння кардіопротекторної дії вже відомих (метопролол, глюкозо-інсуліно-калієва суміш). Ефекти більшості зазначених метаболічних кардіопротекторів (МК) опосередковані їхньою здатністю впливати на якийсь один із багатьох патофізіологічних механізмів: абсиксимаб і мелатонін блокують нейтрофіл- та тромбоцит-опосередковане пошкодження клітин, глюкозо-інсуліно-калієва суміш і натрійуретичний пептид зменшують перевантаження клітин кальцієм, аденозин та ексенатид зменшують оксидативний стрес (A. Dominguez-Rodriguez, 2014). Хоча в експериментальних дослідженнях ці препарати зменшували розмір некрозу міокарда, проте не виправдали сподівань у клінічних дослідженнях: смертність хворих та довгостроковий прогноз достовірно не змінювалися (P.Z. Gerczuk, 2012). Зважаючи на багатовекторність і різноспрямованість патофізіологічних процесів в організмі людини під час розвитку ГІМелST, можна припустити, що більшість МК із «точковим» механізмом дії просто не можуть повною мірою реалізувати свій кардіопротекторний потенціал або ж їхній вплив на метаболічні процеси виявляється спотвореним.
Показовим прикладом є застосування аргініну: хоча були всі підстави очікувати позитивних ефектів від його призначення, останній метааналіз клінічних досліджень із пероральним додаванням аргініну до стандартної терапії хворим на ГІМ показав відсутність його достовірного впливу на смертність (T. Sun, 2009) чи навіть спостерігалась асоціація з її зростанням (S.P. Schulman, 2006). Тому логічним видається припущення, що чим ширший спектр механізмів дії МК, тим вища ймовірність отримання позитивного ефекту від його призначення в клінічних умовах. Серед МК рослинного походження прикладом такого препарату може бути кверцетин, який у клінічних дослідженнях не тільки зменшував розмір некрозу, а й позитивно впливав на комбіновану кінцеву точку (загальна смертність, нефатальний ГІМ, госпіталізація з приводу нестабільної стенокардії) впродовж трирічного спостереження (А.А. Мойбенко, 2008). На тлі лікування кверцетином також спостерігали зниження інтенсивності та частоти ангінозних нападів, меншу частоту застосування наркотичних аналгетиків, розвитку атріовентрикулярних блокад і небезпечних шлуночкових аритмій, покращення постінфарктного ремоделювання лівого шлуночка (ЛШ) та функції нирок у хворих на ГІМ та серцеву недостатність (СН) (О.М. Пархоменко, 2004, 2010). Такий позитивний вплив кверцетину пов’язують із його здатністю чинити потужну антиоксидантну дію, зменшувати швидкість апоптозу, захищати ДНК, модулювати активність синтази оксиду азоту (NOS) та підвищувати рівень NO в плазмі й тканинах, пригнічувати активність мембранозв’язаних ліпоксигеназ, нейтрофілів та макрофагів (M. Akhlaghi, 2012; H.B. Jin, 2012; H. Liu, 2014). Водночас результати нещодавніх досліджень in vitro свідчать, що біологічні ефекти кверцетину можуть бути різноспрямованими й полягати, з одного боку, в пригніченні апоптозу, протизапальній дії та захисті від оксидативного стресу, а з другого – в прооксидантному ефекті, індукції апоптозу, зупинці клітинного циклу, антипроліферативній та мутагенній дії (A.A. Mahbub, 2013; K.J.A. Lemmens, 2014). Реалізація того чи іншого напряму дії препарату залежить від активності процесів його метилювання, глюкуронідації, сульфування з утворенням активних метаболітів (F. Perez-Vizcaino, 2009) та від індивідуального метаболічного тла – стану ендогенних систем кардіопротекції (G. Heusch, 2013). Одним із ключових, інтегральних маркерів персонального біохімічного «портрета» пацієнта вважають амінокислотний спектр плазми (АСП) крові (C. Bachmann, 2008; Y.-M. Go, D.P. Jones, 2011; W. Xie, 2013), оскільки амінокислоти є як субстратами біохімічних реакцій, так і регуляторами активності ферментів. Наприклад, показано, що зміни рівнів проліну, гліцину, серину та фенілаланіну дають змогу з високою точністю прогнозувати раннє відторгнення серцевого трансплантата (M. Tao, 2013), а розвиток ендотеліальної дисфункції та патологічного ремоделювання ЛШ під час ГІМ асоціюється з дефіцитом глутатіону, який синтезується з гліцину, серину та глутамінової кислоти (Т. Kobayashi, 2010; Y. Watanabe, 2013).
Отже, є теоретичні підстави припускати, що аналіз АСП у хворих на ГІМелST може бути корисним для ідентифікації пацієнтів, у яких слід очікувати найбільшого позитивного ефекту від призначення МК.
Метою нашої роботи є дослідження значущості показників АСП у прогнозуванні отримання позитивного ефекту від призначення МК у хворих на ГІМелST.
Матеріали та методи
Робота ґрунтується на проспективному обстеженні 85 хворих на ГІМелST віком від 34 до 74 років (середній вік 60,1±8,9 року), серед яких було 59 (69,4%) осіб чоловічої статі. Усі хворі перебували на стаціонарному лікуванні в кардіологічному відділенні для хворих на інфаркт міокарда Київської міської клінічної лікарні № 3 у період із жовтня 2006 по червень 2011 року. Діагноз ГІМелST встановлювали на підставі клінічних, електрокардіографічних (ЕКГ) та біохімічних критеріїв згідно з «Протоколом надання медичної допомоги хворим із гострим коронарним синдромом з елевацією ST (інфарктом міокарда із зубцем Q)» (Наказ МОЗ України № 436 від 3 липня 2006 року) та рекомендаціями Європейської кардіологічної асоціації (F. Van de Werf, 2008). Середній час від появи перших симптомів захворювання до моменту госпіталізації становив 12,7±9,1 год, тривалість стаціонарного лікування – у середньому 22,1±8,1 доби.
Критеріями залучення пацієнтів у дослідження були підтверджений діагноз ГІМелST у перші 3 доби від появи перших симптомів, вік до 74 років та письмова інформована згода пацієнтів на участь у дослідженні.
Критеріями незалучення пацієнтів у дослідження були проведення реваскуляризаційної терапії, наявність постійної форми фібриляції передсердь, гемодинамічно значущих вад клапанів серця, гострої лівошлуночкової недостатності (ЛШН) IV стадії за класифікацією T. Кillip і J. Kimball (1969) у день госпіталізації, хронічної СН (ХСН) ІІБ-ІІІ стадії, цукрового діабету (ЦД) 1 типу або тяжкої форми ЦД 2 типу в стадії декомпенсації, хронічного обструктивного захворювання легень, бронхіальної астми, хронічної супутньої патології інших внутрішніх органів у стадії декомпенсації, рівень гемоглобіну <100 г/л, швидкість клубочкової фільтрації (ШКФ) <30 мл/хв. Невключення в дослідження хворих після реваскуляризаційної терапії обумовлено різко вираженими змінами АСП, які спостерігали після такого лікування; крім того, навіть сьогодні не менш як третина хворих із ГІМелST з різних причин не отримують реперфузійної терапії, і для них питання збереження життєздатності ішемізованого міокарда залишається особливо актуальним.
Пацієнти отримували медикаментозне лікування, яке включало ацетилсаліцилову кислоту, тієнопіридини, гепарини, β-адреноблокатори, нітрати, інгібітори ангіотензинперетворювального ферменту, статини, симптоматичну терапію.
Усім хворим у день госпіталізації та на десяту добу виконували ехокардіографію з використанням ультразвукової системи ALOKA SSD‑1700 (Японія) за загальноприйнятою методикою (Х. Фейгенбаум, 1999). У разі фракції викиду ЛШ ≤40% діагностували систолічну дисфункцію ЛШ (СДЛШ). Порушення регіонарної скоротливості оцінювали кількісно за індексом регіонарної скоротливості ЛШ (ІРСЛШ).
Стійку/пізню ЛШН діагностували на третю добу госпітального періоду та пізніше за класифікацією T. Кillip і J. Kimball (1969). Окремо виділяли групу ішемічних ускладнень (рання постінфарктна стенокардія та/або рецидив ГІМ) та аритмічних ускладнень (шлуночкова екстрасистолія високих градацій (ІІІ-V класи), шлуночкова тахікардія, фібриляція шлуночків).
В усіх пацієнтів дослідили вміст вільних амінокислот у плазмі венозної крові в день госпіталізації методом іонообмінної рідинно-колонкової хроматографії з використанням автоматичного амінокислотного аналізатора моделі ААА‑339 фірми Mikrotechna (Чехія) за класичною методикою Штейна й Мура (Т.Д. Козаренко, 1975).
Усіх хворих було рандомізовано за принципом послідовності госпіталізації в дві групи: основну групу (n=51) та групу порівняння (n=34). В основній групі (група кверцетину) хворим, окрім стандартної медикаментозної терапії, додатково призначали внутрішньовенну (в/в) форму інгібітора 5-ліпоксигенази кверцетину «Корвітин» (виробництва ЗАТ НВЦ «Борщагівський ХФЗ») за схемою: початкову дозу – 0,5 г препарату, розчиненого в 50 мл 0,9% розчину NaCl, уводили в/в крапельно впродовж 30-45 хв, далі інфузію повторювали через 2 і 12 год у тій самій дозі. На другу й третю добу препарат уводили інфузійно по 0,5 г з інтервалом 12 год, на четверту й п’яту добу – в дозі 0,5 г з інтервалом 24 год. У групі порівняння призначали лише базисні препарати. Сформовані групи не відрізнялися за вихідними демографічними клініко-анамнестичними та лабораторно-інструментальними даними й частотою призначення базових медикаментозних засобів.
Головним критерієм відповіді на лікування вважали зміну маси життєздатного міокарда – динаміку ІРСЛШ з першої (ІРСЛШ1) по десяту добу (ІРСЛШ10) госпітального періоду: ΔIРCЛШ = ІРСЛШ1 – ІРСЛШ10. Зниження ІРСЛШ на десяту добу на мінімальну величину ΔIРCЛШ=1/16 (=0,0625) означало перехід одного акінетичного сегмента ЛШ у стан гіпокінезу або одного гіпокінетичного сегмента в стан нормокінезу. Показник ΔІРСЛШ ≥0,0625 оцінювали як маркер позитивної відповіді на лікування. Хворі з ΔІРСЛШ <0,0625, тобто з відсутністю динаміки чи негативною динамікою ІРСЛШ, сформували підгрупи «невідповідачів».
Було застосовано методи описової статистики, непараметричного кореляційного аналізу, міжвибіркових порівнянь (з обчисленням критеріїв χ2, Манна-Уїтні та Уїлкоксона), логістичний регресійний аналіз (із розрахунком відношення шансів (ВШ) та 95% довірчого інтервалу – ДІ) та ROC (Receiver Operator Characteristic) аналіз (з оцінкою площі під ROC-кривою – AUC).
Результати й обговорення
Позитивну динаміку ΔІРСЛШ (група відповідачів) спостерігали у 60,8% хворих, яким призначали кверцетин, порівняно з 38,2% хворих у групі порівняння (p<0,05). У відповідачів у групі кверцетину значно рідше виявляли в анамнезі ХСН порівняно з невідповідачами цієї групи (45,2 проти 75,0%, p<0,05). У групі порівняння відповідачі та невідповідачі за демографічними й анамнестичними даними вірогідно не відрізнялися. Підгрупи відповідачів та невідповідачів не відрізнялися за кількістю хворих, госпіталізованих у перші 12 год від моменту виникнення перших симптомів захворювання: у групі кверцетину – 64,6 та 70,0% відповідно (p=0,685), у групі порівняння – 46,2 та 57,1% (р=0,533). Не було також виявлено статистично значущих відмінностей за кількістю хворих, госпіталізованих у ранні строки, між підгрупами відповідачів та невідповідачів, які отримували різне лікування.
Підгрупи відповідачів та невідповідачів у групах кверцетину та порівняння не відрізнялися за частотою передньої локалізації ГІМ, частотою призначення наркотичних засобів у день госпіталізації, часом від виникнення перших симптомів захворювання до моменту госпіталізації, величинами систолічного та діастолічного артеріального тиску (АТ), частотою випадків синусової тахікардії. За частотою реєстрації порушень ритму та провідності в день госпіталізації не було виявлено статистичних відмінностей між відповідачами та невідповідачами як у межах однієї групи, так і в разі порівняння підгруп хворих різних груп. За ЕКГ-показниками пошкодження міокарда в день госпіталізації підгрупи невідповідачів і відповідачів у групах з однаковим лікуванням також не відрізнялися.
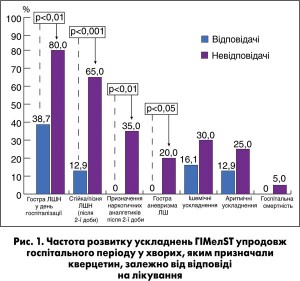
Аналіз клінічних даних показав, що у невідповідачів групи кверцетину достовірно частіше спостерігали ускладнений перебіг захворювання порівняно з відповідачами цієї групи (рис. 1).
Міжгруповий аналіз виявив, що за частотою стійкої/пізньої ЛШН відповідачі групи кверцетину достовірно відрізнялися від відповідачів групи порівняння (12,9 проти 53,9% відповідно, p<0,05). Наведені дані про гірший клінічний перебіг ГІМ зі стійкою елевацією ST у невідповідачів у групі, де призначали кверцетин, можуть свідчити про недоцільність призначення цього препарату певній категорії хворих і, відповідно, необхідність розроблення методів передбачення результатів такої фармакотерапії.
За вихідними рівнями амінокислот невідповідачі та відповідачі групи кверцетину достовірно не відрізнялися між собою. У відповідачів групи порівняння спостерігали достовірно вищу сумарну аміноацидемію (52,66±13,53 мг/дл) порівняно з невідповідачами своєї групи (33,33±21,51 мг/дл, p<0,05), відповідачами групи кверцетину (36,47±19,50 мг/дл, p<0,05) та здоровими особами (28,34±8,31 мг/дл, p<0,001) за рахунок достовірно вищих рівнів більшості амінокислот.
Аналіз амінокислотних співвідношень (у яких числівник і знаменник були представлені вихідним субстратом та кінцевим продуктом однієї хімічної реакції або в яких амінокислоти були пов’язані конкурентними взаємовідносинами за систему транспорту в клітину) виявив, що у відповідачів групи кверцетину порівняно зі здоровими особами були значно вищими вихідні співвідношення глутамін/аргінін (5,52±4,34 і 2,19±1,45 відповідно, p<0,001) і глутамінова кислота / аспарагінова кислота (7,78±4,13 і 3,62±1,57, p<0,001), тоді як у невідповідачів цієї групи різниці зі здоровими особами не було.
Під час проведення субаналізу АСП залежно від часу госпіталізації встановлено, що в групах кверцетину та порівняння рання госпіталізація (≤12 год) асоціювалася з тенденцією до меншої сумарної аміноацидемії за рахунок менших абсолютних концентрацій майже всіх амінокислот порівняно з пізньою госпіталізацією (>12 год). При цьому статистично значущими були такі відмінності: у групі кверцетину – рівнів аргініну (1,236±0,768 мг/дл у хворих із ранньою госпіталізацією проти 2,058±0,951 мг/дл у хворих із пізньою госпіталізацією, р=0,015), орнітину (1,574±0,930 мг/дл проти 2,182±0,748 мг/дл відповідно, р=0,041) та аланіну (4,149±2,270 мг/дл проти 5,897±2,492 мг/дл, р=0,028). У групі порівняння всі відмінності рівнів амінокислот були статистично недостовірними. У групі кверцетину відповідачі, госпіталізовані в ранні строки, відрізнялися меншими рівнями аргініну (1,003±0,680 мг/дл), серину (1,370±0,711 мг/дл) та проліну (0,910±0,717 мг/дл), а також меншою величиною співвідношення фенілаланін/тирозин (1,48±0,63) порівняно з невідповідачами, госпіталізованими в такий самий часовий період (1,555±0,796 мг/дл, р=0,027; 2,000±0,722 мг/дл, р=0,041; 2,152±1,805 мг/дл, р=0,009; 2,23±0,55, р=0,009 відповідно). У групі порівняння відповідачі та невідповідачі, госпіталізовані в ранні строки, не мали значущих відмінностей за вихідними значеннями показників АСП, так само як і відповідачі та невідповідачі різних груп, госпіталізовані пізніше 12 год.
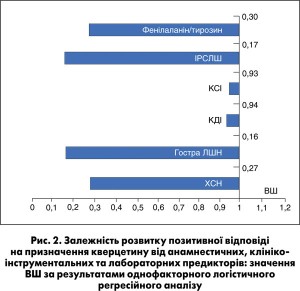
За даними логістичного регресійного аналізу, позитивну відповідь на лікування в групі кверцетину з більшою ймовірністю спостерігали у хворих із відсутністю ХСН в анамнезі, без ознак гострої ЛШН у день госпіталізації, з меншими вихідними значеннями кінцево-діастолічного індексу (КДІ), кінцево-систолічного індексу (КСІ), ІРСЛШ (рис. 2).
Згідно з результатами багатофакторного логістичного регресійного аналізу з покроковим виключенням показників та ROC-аналізу вихідне співвідношення фенілаланін/тирозин виявилося єдиним амінокислотним маркером, що корелював із результатом лікування хворих у групі кверцетину незалежно від наявності інших чинників, за якими достовірно відрізнялися підгрупи відповідачів і невідповідачів цієї групи (табл.).
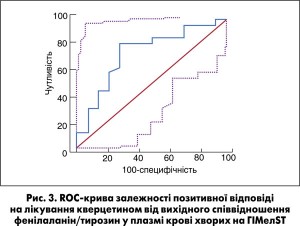
ROC-аналіз виявив добру якість логістичної регресійної моделі з включенням співвідношення фенілаланін/тирозин для прогнозування позитивної відповіді на лікування в групі кверцетину (табл.). Значення співвідношення фенілаланін/тирозин ≤2,06 (95%ДІ 1,29-2,06) у плазмі крові в день госпіталізації характеризувалося чутливістю (81,8%) і специфічністю (71,4%) у прогнозуванні позитивної відповіді у хворих, які отримують кверцетин (рис. 3).
Отже, величина співвідношення фенілаланін/тирозин у плазмі крові виявилася незалежним предиктором отримання позитивної відповіді на лікування кверцетином у хворих на ГІМелST. Подальший аналіз клінічного матеріалу та літературних даних дав змогу сформулювати гіпотезу про значення співвідношення фенілаланін/тирозин як маркера стану ендогенних механізмів кардіопротекції та уявити патогенетичні механізми, що можуть лежати в основі знайдених закономірностей.
C. Murr і співавт. (2014) у когортному дослідженні LURIC за участю 1196 пацієнтів, спрямованих на коронарографію, виявили вірогідно більші величини співвідношення фенілаланін/тирозин у плазмі крові хворих із великовогнищевим ГІМ порівняно з пацієнтами з дрібновогнищевим ГІМ і кореляцію величини співвідношення з індексом маси тіла, систолічним та діастолічним АТ і ШКФ (C. Murr, 2014). Відповідно до сучасних уявлень співвідношення фенілаланін/тирозин характеризує інтенсивність синтезу допаміну ниркового походження (з властивими йому натрійуретичним та діуретичним ефектами), активність запальної реакції та біодоступність тетрагідробіоптерину (ВН4) – кофактора багатьох ферментів, зокрема ендотеліальної NOS, що відіграють ключову роль у збереженні життєздатності кардіоміоцитів (A. Ferreira, 2000; U. Lichter-Konecki, 1999; H. Mangge, 2013; C. Murr, 2014). Наведені дані дають підстави припустити, що співвідношення фенілаланін/тирозин у плазмі крові може відбивати стан ендогенних механізмів кардіопротекції (фрагмент індивідуального біохімічного «портрета» пацієнта) та справляти незалежний вплив на перебіг ГІМелST.
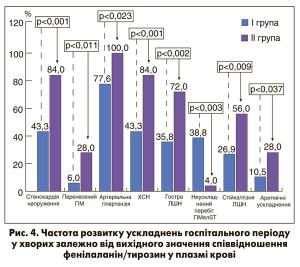
З огляду на отримані нами дані про величину співвідношення фенілаланін/тирозин у плазмі крові ≤2,06 як незалежного предиктора ефективності кверцетину та припущення про універсальність цього маркера стану ендогенних механізмів кардіопротекції, проведено аналіз перебігу ГІМелST у 92 хворих залежно від величини вказаного співвідношення. Пацієнтів розподілили на дві клінічні групи: до І групи увійшли хворі, у яких вихідне співвідношення фенілаланін/тирозин дорівнювало ≤2,06 (n=67), до ІІ – хворі з величиною цього співвідношення >2,06 (n=25). Усі пацієнти отримували базисне медикаментозне лікування й за його змістом істотно не відрізнялися. Крім базисного лікування, 39,1% хворих додатково отримували кверцетин (у І групі – 22 (32,8%), у ІІ – 14 (56,0%), р=0,056), 33,7% хворих – 2-етил‑6-метил‑3-гідроксипіридину сукцинат (у І групі – 24 (35,8%), у ІІ – 7 (28,0%), р=0,647) згідно з офіційними схемами призначення. Хворі на ГІМелST зі значенням плазмового співвідношення фенілаланін/тирозин у день госпіталізації >2,06 характеризувалися низкою достовірних відмінностей від альтернативної групи хворих: у них в анамнезі частіше траплялися стенокардія напруження, перенесений ГІМ, артеріальна гіпертензія та ХСН; у день госпіталізації у них частіше діагностували гостру ЛШН, синусову тахікардію (48,0 проти 25,4%, р=0,038), був виразнішим запальний синдром (вище значення ШОЕ: 17,3±13,3 мм/год проти 10,9±9,2 мм/год, р<0,01) та не була характерною гіпертензивна реакція; у них спостерігали гіршу динаміку сегментарної скоротливості ЛШ та значно більшу частоту ускладнень госпітального періоду (рис. 4).
Звичайно, не всі ці відмінності можна пояснити з позицій прямого причино-наслідкового зв’язку, однак сучасні уявлення про роль фенілаланіну, тирозину та їх взаємозв’язку з кофактором конвертувального ферменту – ВН4 у регуляції вільнорадикальних реакцій, продукції NO, відновленні функцій міокарда та ендотелію після гострих серцево-судинних подій дають змогу уявити можливі патогенетичні механізми, що лежать в основі знайдених закономірностей (G. Szabo, 2011; L. Rochette, 2013).
Як відомо, кверцетин реалізує один із найважливіших своїх кардіопротекторних ефектів через запобігання зниженню активності ендотеліальної та нейрональної NOS, що супроводжується зменшенням ендотеліальної та міокардіальної дисфункції в умовах окислювального стресу (S.R. Challa, 2011). Зважаючи на це, пацієнти з вищим вихідним співвідношенням фенілаланін/тирозин у плазмі крові ймовірно мають дефіцит ВН4, в умовах якого кверцетин не може реалізувати свій вплив на активність NOS повною мірою. У такій ситуації аргінін метаболізується переважно через посередництво аргінази з продукцією сечовини та через посередництво протеїн-аргінін-метилтрансферази з продукцією метильованих дериватів, зокрема асиметричного диметиларгініну (АДМА), що посилює окислювальний стрес (J.K. Bendall, 2014). В експерименті метильовані деривати аргініну в умовах достатньої кількості субстрату (аргініну) зменшували продукцію NO через посередництво нейрональної NOS на 75 і 79%, а в разі дефіциту ВН4 – на 100% (A.J. Cardounel, 2005). Відомо, що кверцетин здатен пригнічувати активність аргінази в умовах ГІМ (А.А. Мойбенко, 2008). Отже, можна припустити, що призначення кверцетину в ситуації дефіциту ВН4 може погіршувати окислювальний стрес через різке підвищення концентрації АДМА, оскільки за умов зниження активності обох ферментів (NOS і аргінази) метаболізм аргініну відбувається переважно шляхом утворення метильованих дериватів.
Підтвердженням цього припущення можна вважати наші дані про гірший клінічний перебіг захворювання в осіб, яких вважали невідповідачами на лікування кверцетином.
Отже, аналіз АСП у хворих на ГІМелST може давати клінічно значущу інформацію про стан ендогенних механізмів кардіопротекції та використовуватися для обґрунтованого застосування МК. Зокрема, кверцетин доцільно призначати пацієнтам, у яких співвідношення фенілаланін/тирозин становить ≤2,06, адже лише за цих умов препарат здатен реалізувати свій потенціал збереження життєздатності ішемізованих кардіоміоцитів.
Підтвердження доцільності оцінки АСП з метою передбачення позитивної клінічної відповіді отримано нами й стосовно іншого МК – 2-етил‑6-метил‑3-гідроксипіридину сукцинату. Встановлено, що позитивна відповідь (за тими самими критеріями, що й для кверцетину) корелювала, незалежно від інших чинників, із вихідним значенням співвідношення гомоцистеїн/метіонін (ВШ=0,22; p=0,002). Величина цього співвідношення ≤0,33 у день госпіталізації була чутливим (77,3%) та специфічним (77,8%) чинником прогнозування позитивної відповіді на лікування 2-етил‑6-метил‑3-гідроксипіридину сукцинатом. Як і у випадку з кверцетином, це може бути зумовлено тим, що саме ці амінокислоти задіяні в процесах реалізації метаболічної дії цього препарату.
Відомо, що 2-етил‑6-метил‑3-гідроксипіридину сукцинат належить до групи похідних 3-гідроксипіридину, які є структурними аналогами сполук групи вітаміну В6 (піридоксол, піридоксаль, піридоксамін), дефіцит котрого асоціюється з гіпергомоцистеїнемією та є незалежним чинником ризику розвитку судинних захворювань (O.A. Obeid, 2005). У свою чергу, активна форма вітаміну В6 (піридоксаль‑5-фосфат) є складовою частиною багатьох амінотранфераз, зокрема цистатіонін-β-синтази. Зазначене вище може бути поясненням того, що саме стан метаболізму сірковмісних амінокислот виявився потужним маркером прогнозування ефективності цього препарату.
Висновки
Ефективність кардіопротекторної терапії у хворих із ГІМелST значною мірою залежить від АСП, насамперед умісту та співвідношення амінокислот, задіяних у процесах реалізації метаболічної дії препаратів. Аналіз АСП перед призначенням МК дає можливість оптимізувати цю складову фармакотерапії – підвищити шанси отримання кардіоміоцит-зберігального ефекту та уникнути небажаних наслідків. Зокрема, позитивний ефект від призначення кверцетину очікується насамперед у хворих із вихідним співвідношенням фенілаланін/тирозин у плазмі крові ≤2,06. Значення цього співвідношення >2,06 (у 1,4 рази вище значення у здорових осіб; трапляється у 27% пацієнтів) є непрямим маркером дефіциту ВН4 та обмежених можливостей ендогенних систем кардіопротекції й асоціюється з відсутністю ефекту чи навіть негативним результатом від призначення кверцетину, а також значно гіршим прогнозом щодо неускладненого перебігу госпітального періоду та відновлення регіональної скоротливості ЛШ. Позитивний ефект від призначення 2-етил‑6-метил‑3-гідроксипіридину сукцинату можна отримати у хворих із величиною співвідношення гомоцистеїн/метіонін ≤0,33.
Література
1. Козаренко Т.Д. Ионообменная хроматография аминокислот. – Новосибирск: Наука, 1975. – 134 с.
2. Мойбенко А.А., Досенко В.Е., Пархоменко А.Н. Эндогенные механизмы кардиопротекции как основа патогенетической терапии заболеваний сердца. – К.: Наукова думка, 2008. – 520 с.
3. Пархоменко А.Н., Иркин О.И., Брыль Ж.В. и др. Кардиозащитное действие блокатора липоксигеназного пути метаболизма арахидоновой кислоты при остром коронарном синдроме с подъемом сегмента ST: влияние на размер некроза, параметры гемодинамики и результаты программируемой стимуляции желудочков сердца // Укр. терапевт. журн. – 2004. – № 2. – С. 48-55.
4. Пархоменко О.М., Кожухов С.М., Іркін О.І. та ін. Нові можливості фармакологічного впливу на прогноз у хворих на інфаркт міокарда з елевацією сегмента ST та гострою серцевою недостатністю // Укр. мед. часопис. – 2010. – № 4 (78). – С. 34-37.
5. Стрес і хвороби системи кровообігу: посібник / Під ред. В.М. Коваленка та В.М. Корнацького. – К., 2015. – 354 с.
6. Фейгенбаум Х. Эхокардиография: пер. с англ. / Под ред. В.В.Митькова. – 5-е изд. – М.: Видар. – 1999. – 512 с.
7. Akhlaghi M., Bandy B. Preconditioning and acute effects of flavonoids in protecting cardiomyocytes from oxidative cell death // Oxidative Medicine and Cellular Longevity. – 2012. – Vol. 2012, Article ID782321, 9 p. – Doi: 10.1155/2012/782321.
8. Bachmann C. Interpretation of plasma amino acids in the follow-up of patients: the impact of compartmentation // J. Inherit. Metab. Dis. – 2008. – V. 31 (1). – P. 7-20.
9. Bendall J.K., Douglas G., McNeill E., et al. Tetrahydrobiopterin in Cardiovascular Health and Disease (review) // Antioxid. Redox Signal. – 2014. – V. 20. – No. 18. – Р. 3040-3077.
10. Cardounel A.J., Xia Y., Zweier J.L. Endogenous methylarginines modulate superoxide as well as nitric oxide generation from neuronal nitric-oxide synthase: differences in the effects of monomethyl- and dimethylarginines in the presence and absence of tetrahydrobiopterin // J. Biol. Chem. – 2005. – V. 280. – P. 7540-7549.
11. Challa S.R., Akula A., Metla S., et al. Partial role of nitric oxide in infarct size limiting effect of quercetin and rutin against ischemia-reperfusion injury in normal and diabetic rats // Indian J. Exp. Biol. – 2011. – V. 49. – No. 3. – P. 207-210.
12. Dominguez-Rodriguez A. Cardioprotection and pharmacological therapies in acute myocardial infarction: Challenges in the current era / Alberto Dominguez-Rodriguez, Pedro Abreu-Gonzalez, Russel J Reiter // World J Cardiol. – 2014. – V. 26. – No. 6 (3). – Р. 100-106. – Doi: 10.4330/wjc.v6.i3.100.
13. Ferreira A., Bettencourt P., Pestana M., et. al. Renal synthesis of dopamine in asymptomatic post-infarction left ventricular systolic dysfunction // Clinical Science. – 2000. – V. 99. – P. 195-200.
14. Gerczuk P.Z., Kloner R.A. An update on cardioprotection: A review of the latest adjunctive therapies to limit myocardial infarction size in clinical trials // J Am Coll Cardiol. – V. 59, No. 11. – P. 969-978. – Doi: 10.1016/j.jacc.2011.07.054.
15. Go A.S., Mozaffarian D., Roger V.L., et al. Heart disease and stroke statistics‑2014 update: a report from the American Heart Association // Circulation. – 2014. – V. 129. – P. e28-e292.
16. Go Y.-M., Jones D.P. Cysteine/cystine redox signaling in cardiovascular disease // Free Radic. Biol. Med. – 2011. – V. 50 (4). – P. 495-509.
17. Hausenloy D.J., Botker H.E., Condorelli G., et al. Translating cardioprotection for patient benefit: position paper from the Working Group of Cellular Biology of the Heart of the European Society of Cardiology // Cardiovascular Research. – 2013. – V. 98. – P. 7-27.
18. Heusch G. Cardioprotection: chances and challenges of its translation to the clinic // The Lancet. – 2013. – V. 281 (Issue 9861). – P. 166-175.
19. Heusch G., Kleinbongard P., Skyschally A., et al. The coronary circulation in cardioprotection: more than just one confounder // Cardiovascular Research. – 2012. – V. 94. – P. 237-245.
20. Jin H.B., Yang Y.B., Song Y.L., et al. Protective roles of quercetin in acute myocardial ischemia and reperfusion injury in rats // Mol. Biol. Rep. – 2012. – V. 39 (12). – P. 11005-11009. – Doi: 10.1007/s11033-012-2002-4.
21. Kobayashi Т., Watanabe Y., Saito Y., et al. Mice lacking the glutamate-cysteine ligase modifier subunit are susceptible to myocardial ischaemia-reperfusion injury // Cardiovascular Research. – 2010. – V. 85. – P. 785-795.
22. Lemmens K.J.A., Vrolijk M.F., Bouwman F.G., et al. The minor structural difference between the antioxidants quercetin and 4’O-methylquercetin has a major impact on their selective thiol toxicity // Int. J. Mol. Sci. – 2014. – V. 15. – P. 7475-7484.
23. Lichter-Konecki U., Hipke C.M., Konecki D.S. Human phenylalanine hydroxylase gene expression in kidney and other nonhepatic tissues // Molecular Genetics and Metabolism. – 1999. – V. 67. – No. 4. – Р. 308-316.
24. Liu H., Guo X., Chu Y., et al. Heart protective effects and mechanism of quercetin preconditioning on anti-myocardial ischemia reperfusion (IR) injuries in rats // Gene. – 2014. – V. 545 (1). – P. 149-155. – Doi: 10.1016/j.gene.2014.04.043.
25. Mahbub A.A., Le Maitre C.L., Haywood-Small S.L., et al. Differential effects of polyphenols on proliferation and apoptosis in human myeloid and lymphoid leukemia cell lines // Anti-Cancer Agents in Medicinal Chemistry. – 2013. – V. 13, No. 10. – Р. 1601-1613.
26. Mangge H., Schnedl W.J., Schreocksnadel S., et al. Immune activation and inflammation in patients with cardiovascular disease are associated with elevated phenylalanine to tyrosine ratios // Pteridines. – 2013. – V. 24. – P. 51-55.
27. Murr C., Grammer T.B., Meinitzer A., et al. Immune activation and inflammation in patients with cardiovascular disease are associated with higher phenylalanine to tyrosine ratios: The Ludwigshafen Risk and Cardiovascular Health Study // Journal of Amino Acids. – 2014. – [Електронний ресурс]. – Режим доступу: http://dx.doi.org/10.1155/2014/783730.
28. Obeid O.A. Plasma amino acid concentrations in patients with coronary heart disease: a comparison between UK Indian Asian and Caucasian men // Int. J. Vitam. Nutr. Res. – 2005. – V. 75 (4). – P. 267-273.
29. Perez-Vizcaino F., Duarte J., Jimenez R., et al. Antihypertensive effects of the flavonoid quercetin (review) // Pharmacological Reports. – 2009. – V. 61. – P. 67-75.
30. Piper H.M., Garcia-Dorado D. Reducing the impact of myocardial ischaemia/reperfusion injury // Cardiovascular Research. – 2012. – V. 94. – P. 165-167.
31. Rochette L., Lorin J., Zeller M., et al. Nitric oxide synthase inhibition and oxidative stress in cardiovascular diseases: possible therapeutic targets? // Pharmacol Ther. – 2013. – V. 140. – No. 3. – Р. 239-257.
32. Sun T. Oral L-arginine supplementation in acute myocardial infarction therapy: A meta-analysis of randomized controlled trials / Tao Sun, Wen-bai Zhou, Xin-ping Luo, Yao-liang Tang, Hai-ming Shi // Clin. Cardiol. – 2009. – V. 32, No. 11. – P. 649-652. – Doi: 10.1002/clc.20616.
33. Schulman S.P., Becker L.C., Kass D.A., et al. L-Arginine therapy in acute myocardial infarction. The vascular interaction with age in myocardial infarction (VINTAGE MI) randomized clinical trial // JAMA. – 2006. – V. 295. – No. 1. – P. 58-64.
34. Szabo G., Seres L., Soos P., et al. Tetrahydrobiopterin improves cardiac and pulmonary function after cardiopulmonary bypass // Eur. J. Cardiothorac. Surg. – 2011. – V. 40. – P. 695-700.
35. Tao M., Xiu D.R. Metabonomic analysis of rats with acute heart rejection // Transplant. Proc. – 2013. – V. 45. – No. 2. – P. 618-624.
36. Van de Werf F., Bax C.J., Betriu A., et al. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation // Eur. Heart J. – 2008. – V. 29. – P. 2909-2945.
37. Xie W., Wood A.R., Lyssenko V., et al. Genetic variants associated with glycine metabolism and their role in insulin sensitivity and type 2 // Diabetes. – 2013. – V. 62. – P. 2141-2150.
38. Watanabe Y., Watanabe K., Kobayashi T., et al. Chronic depletion of glutathione exacerbates ventricular remodelling and dysfunction in the pressure-overloaded heart // Cardiovascular Research. – 2013. – V. 97. – P. 282-292.