24 березня, 2017
Современные возможности терапии второй линии при немелкоклеточном раке легкого
Одним из наиболее важных механизмов борьбы со злокачественными клетками является образование специфических Т-лимфоцитов. Комплексы антиген-представляющих клеток активируют Т-лимфоциты, и активированные CD4 и CD8 клетки разрушают опухоль. Понимание того, что опухолевые клетки для ухода от надзора иммунной системы используют механизмы, которые в норме служат с целью контроля выраженности и длительности иммунного ответа, стало предпосылкой для создания нового класса иммунотерапевтических препаратов. Настоящим прорывом в терапии злокачественных новообразований, в том числе при немелкоклеточном раке легкого (НМРЛ), стала разработка препаратов моноклональных антител, действие которых направлено не на разрушение опухолевых клеток, а на устранение вызванной опухолью иммуносупрессии.
Внедрение в клиническую практику современных иммунотерапевтических препаратов позволило изменить прогноз для многих больных злокачественными новообразованиями. Ингибиторы иммунных контрольных точек предотвращают ускользание опухолевых клеток от иммунного надзора. Иммунные контрольные точки – это сигнальные молекулы, которые регулируют защитные реакции организма и могут как подавлять, так и активировать иммунную систему. В настоящее время наиболее изучены два ингибирующих сигнальных пути, при помощи которых опухолевые клетки уклоняются от иммунного надзора – CTLA‑4 и PD‑1/PD-L1.
CTLA‑4 фокусируется на регулировании активации Т-лимфоцитов, в то время как PD‑1 подавляет активность Т-лимфоцитов в периферических тканях, с тем чтобы избежать аутоиммунных реакций. Рецептор PD‑1 на поверхности Т-лимфоцитов, отвечающий за отрицательную регуляцию сигнала, имеет два лиганда – PD-L1 и PD-L2.
В ответ на иммунную атаку раковые клетки избыточно экспрессируют PD-L1 и тем самым подавляют активность Т-лимфоцитов в микроокружении опухоли, обеспечивая себе выживание и пролиферацию. Сигнальный путь PD‑1/PD-L1 регулирует подавление иммунитета посредством индукции апоптоза активированных Т-лимфоцитов или снижения их выживаемости [1].
При НМРЛ избыточная экспрессия PD‑1 на CD8+ Т-лимфоцитах предполагает уменьшение их пролиферации и продукции различных цитокинов. Аномальная экспрессия PD-L1 при НМРЛ наблюдается в 19-100% случаев и связана с плохим прогнозом. Было выявлено, что экспрессия PD-L1 на опухолевых клетках при НМРЛ значительно выше по сравнению с прилегающей паренхимой легкого.
Разработаны препараты – ингибиторы иммунных контрольных точек, воздействующие соответственно на PD‑1 и PD-L1 и предотвращающие ускользание опухоли от иммунного надзора. Блокирование PD‑1 и PD‑L1 дает сходные результаты, но блокирование PD-L1 связано с меньшим риском аутоиммунных реакций, поскольку остается активным PD‑1/PD-L2 путь регуляции иммунной системы. Следовательно, блокирование PD-L1 приводит к восстановлению противоопухолевого иммунитета и позволяет опухоль-специфическим Т-лимфоцитам раскрыть полный арсенал возможностей в отношении раковых клеток и минимально воздействовать на здоровые клетки [2].
Основной целью системной терапии при распространенном НМРЛ является уменьшение клинических проявлений заболевания, увеличение качества и продолжительности жизни при минимальной токсичности. За последние десятилетия с одобрением новых препаратов подход к терапии второй линии значительно изменился.
В 2015-2016 гг. в США для клинического применения при НМРЛ во второй линии терапии были одобрены препараты с анти-PD‑1 (ниволумаб и пембролизумаб) и анти-PD-L1 активностью (атезолизумаб). Прогноз пациентов с распространенным НМРЛ с прогрессированием заболевания после платиносодержащей терапии значительно улучшился с появлением этих препаратов.
Применение второй линии терапии в НМРЛ стало возможным в 2000 г. после публикации результатов двух рандомизированных исследований: доцетаксел во второй линии терапии показал увеличение выживаемости, качества жизни, контроль симптомов по сравнению с лучшей поддерживающей терапией и химиотерапией с винорелбином или ифосфамидом.
К 2009 г. в руководстве по системной терапии рака IV стадии Американского общества клинических онкологов (ASCO) были указаны четыре препарата для терапии второй линии: доцетаксел, пеметрексед, эрлотиниб и гефитиниб.
Пеметрексед ассоциируется с лучшей выживаемостью при неплоскоклеточной карциноме, а доцетаксел – при плоскоклеточном раке. Метаанализ шести рандомизированных исследований показал, что дуплетная химиотерапия не улучшает показателей выживаемости по сравнению с монотерапией, но ассоциирована с большей токсичностью. Несмотря на опции, доступные во второй линии терапии, клинические исходы долгое время оставались неблагоприятными. Частота ответа в среднем составляла <10%, а средняя продолжительность жизни – 7-9 мес от начала терапии второй линии [3].
Активное изучение возможностей таргетной терапии привело к созданию нового класса препаратов – ингибиторов тирозинкиназы. Активация EGFR запускает внутриклеточные сигнальные каскады, которые приводят к увеличению пролиферации раковых клеток, стимуляции процессов инвазии ангиогенеза и метастазирования. Препараты блокируют каскад сигнальных реакций, в результате чего угнетается пролиферация клеток и запускается внутренний путь клеточной гибели (Yarden et al., 2001, Jorissen et al., 2003).
Исследование III фазы BR.21 продемонстрировало увеличение выживаемости на фоне приема эрлотиниба во второй линии терапии по сравнению с плацебо (6,7 мес против 4,7). Таким образом, у пациентов с неопределенным типом EGFR, которые не являются кандидатами для дальнейшей ХТ, эрлотиниб может быть показан в качестве второй или третьей линии терапии. Хотя гефитиниб не превосходит плацебо в отношении выживаемости и качества жизни, он продемонстрировал сходные с доцетакселом результаты во второй линии терапии при НМРЛ [4].
Настоящим прорывом во второй линии терапии при НМРЛ стала разработка препаратов моноклональных антител, действие которых направлено не на разрушение опухолевых клеток, а на устранение иммуносупрессии, вызванной опухолью. Так, на фоне приема ниволумаба удалось достичь медианы выживаемости без прогрессирования (ВБП) 2,3 мес, а медианы общей выживаемости (ОВ) – 9,9 мес. При сравнении пембролизумаба с доцетакселом медиана ОВ составила 10,4 мес в группе терапии пембролизумабом в дозе 2 мг/кг, 12,7 мес в группе терапии пембролизумабом 10 мг/кг и 8,5 мес в группе доцетаксела. Точно так же атезолизумаб демонстрирует впечатляющие результаты: по сравнению с доцетакселом, медиана выживаемости составила 12,6 мес против 8,9.
Выбор режима системной терапии второй линии при НМРЛ у пациентов с прогрессированием заболевания во время или после терапии первой линии основывается на данных о специфической генетической мутации, гистологическом подтипе и клиническом течении заболевания, а также на общем состоянии пациента (функциональном статусе – ФС).
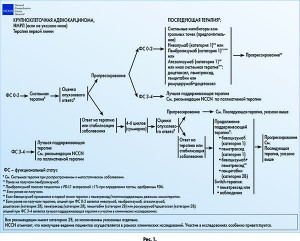
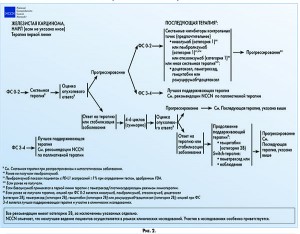
Вторая линия терапии применяется при прогрессировании заболевания после 4-6 циклов химиотерапии. Согласно рекомендациям NCCN (рекомендации по ведению пациентов с НМРЛ, 4.2017), ингибиторы контрольных точек (ниволумаб, пембролизумаб, атезолизумаб) предпочтительны во второй и последующей линиях терапии у пациентов с метастатическим НМРЛ при ФС 0-2, пембролизумаб показан пациентам с PD-L1 экспрессией ≥1% при определении тестом, одобренным Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) (рис. 1 и 2). Применение ингибиторов контрольных точек ассоциировано с лучшей выживаемостью, более длительным ответом на терапию и меньшим количеством побочных явлений по сравнению с цитостатической химиотерапией. Возможными вариантами системной терапии являются доцетаксел (категория 2B), пеметрексед (категория 2B), гемцитабин (категория 2B) или рамуцирумаб+доцетаксел (категория 2B); при ФС 3-4 показана лучшая поддерживающая терапия и участие в клинических исследованиях.
Если опухоль отвечает на терапию первой линии или наблюдается стабилизация заболевания, то возможно проведение дальнейшей поддерживающей терапии в том же режиме. При крупноклеточной аденокарциноме это бевацизумаб, пеметрексед, бевацизумаб+пеметрексед, гемцитабин. При железистой карциноме – гемцитабин, в режиме Switch-терапии может использоваться пеметрексед [6].
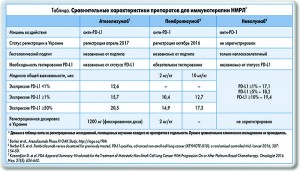
Рекомендация ниволумаба (категория 1) в качестве последующей терапии при железистом и нежелезистом НМРЛ основана на данных рандомизированного исследования III фазы (CheckMate‑057). Пембролизумаб показан согласно данным рандомизированных исследований II/III фазы (KEYNOTE‑10) и исследования KEYNOTE‑001. Атезолизумаб рекомендован при метастатическом железистом и нежелезистом НМРЛ по данным рандомизированного исследования III фазы OAK, а также исследования II фазы POPLAR. Все три препарата одобрены FDA и могут использоваться при НМРЛ. Выбор препарата для конкретного пациента производится с учетом особенностей действия этих препаратов, показаний, преимуществ и недостатков (табл.).
Предполагается, что использование PD-L1 в качестве терапевтической мишени будет сопровождаться меньшей токсичностью благодаря модуляции иммунного ответа селективно в микроокружении опухоли. Ингибирование PD-L1 является многообещающим направлением в иммунотерапии различных онкологических заболеваний, в том числе и НМРЛ.
Атезолизумаб представляет собой IgG1 антитело анти-PD-L1, способное препятствовать клеточно-опосредованной цитотоксичности в отношении нормальных активированных Т-клеток с экспрессией PD-L1. Он одобрен FDA для лечения пациентов с метастатическим НМРЛ, которые прогрессировали во время или после платиносодержащей химиотерапии. У пациентов с мутацией EGFR или ALK должны прогрессировать заболевания на соответствующей таргетной терапии перед приемом атезолизумаба.
В первом исследовании III фазы OAK применение ингибитора PD-L1 атезолизумаба у пациентов с НМРЛ, ранее получавших лечение, привело к значимому увеличению ОВ по сравнению со стандартной химиотерапией.
В исследовании OAK приняли участие 1225 пациентов с НМРЛ, которые ранее получили по крайней мере 1-2 линии химиотерапии, одна из которых включала в себя препараты платины. У всех пациентов предварительно определялся статус PD-L1. Проводилась также стратификация в зависимости от уровня экспрессии PD-L1, количества и схем предшествующей химиотерапии, а также данных гистологического исследования. Пациенты были рандомизированы на две группы в соотношении 1:1, одна группа получала атезолизумаб внутривенно в дозе 1200 мг каждые 3 недели, вторая – доцетаксел в дозе 75 мг/м2 каждые 3 недели.
Первичной конечной точкой была оценка ОВ:
– у всех пациентов, принимавших участие в исследовании;
– у пациентов в подгруппах ИК1/2/3 или ОК1/2/3 (с уровнем экспрессии PD-L1 ≥1% в иммунных и опухолевых клетках – ИК и ОК соответственно).
Вторичная конечная точка включала в себя частоту объективного ответа (ЧОО), ВБП, длительность ответа (ДО) и безопасность.
Первичный анализ данных 850 пациентов показал увеличение ОВ на 27% у тех, кто получал атезолизумаб, в сравнении с группой доцетаксела, независимо от уровня экспрессии PD-L1, в том числе с экспрессией PD-L1 <1%.
Медиана общей продолжительности жизни в общей популяции пациентов составила 13,8 мес в группе атезолизумаба и 9,6 мес в группе доцетаксела. После стратификации пациентов в зависимости от уровня экспрессии PD-L1 у пациентов с высоким уровнем экспрессии (55% участников) атезолизумаб показал увеличение ОВ на 59% по сравнению с пациентами, получавшими доцетаксел: медиана выживаемости составила 15,7 и 10,3 мес соответственно.
Значительное преимущество в ОВ наблюдалось у пациентов с максимальной экспрессией PD-L1 (ОК3 и ИК3), а это 16% больных: медиана выживаемости 20,5 мес против 8,9 в группе доцетаксела. Даже у PD-L1-негативных пациентов (ОК0 и ИК0) на фоне приема атезолизумаба ОВ была на 25% выше, чем у тех, кто принимал доцетаксел. Медиана выживаемости составила 12,6 (против 8,9 мес в группе доцетаксела). Преимущество в ОВ не зависело от данных гистологического заключения; улучшение показателей ОВ было сходным у больных с плоскоклеточным и неплоскоклеточным раком. Медиана продолжительности жизни у пациентов с неплоскоклеточным раком легкого составила 15,6 мес в группе атезолизумаба по сравнению с 11,2 мес в группе доцетаксела, аналогично и у пациентов с плоскоклеточным раком легкого – 8,9 и 7,7 мес.
Побочные эффекты 3-4 степени наблюдались у 15% пациентов группы атезолизумаба; на фоне терапии доцетакселом частота побочных эффектов составила 43%.
По результатам исследования, атезолизумаб был предложен в качестве второй линии терапии для пациентов с НМРЛ вне зависимости от статуса экспрессии PD-L1 клетками опухоли.
Таким образом, иммунотерапия при НМРЛ открывает новые возможности. По результатам многих исследований, применение моноклональных антител к PD-1/PD‑L1 значительно увеличивает ОВ. В исследовании OAK применение анти-PD-L1 антитела – атезолизумаба – привело к значимому увеличению ОВ по сравнению со стандартной химиотерапией. По результатам этого исследования атезолизумаб одобрен FDA для лечения пациентов с метастатическим НМРЛ, который прогрессировал во время или после платиносодержащей химиотерапии независимо от уровня PD-L1 экспрессии и гистологического подтипа опухоли.
Литература
1. He J., Hu Y. Development of PD‑1/PD-L1 Pathway in Tumor Immune Microenvironment and Treatment for Non-Small Cell Lung Cancer, 2015.
2. Ji M., Liu Y. PD‑1/PD-L1 pathway in non-small-cell lung cancer and its relation with EGFR mutation, 2015.
3. Historical Evolution of Second-Line Therapy in Non-Small Cell Lung Cancer, Chiara Lazzari, 2017.
4. Chan B.A., Hughes B.G. Targeted therapy for non-small cell lung cancer: current standards and the promise of the future, 2015.
5. Gettinger S. Immunotherapy of non-small cell lung cancer with immune checkpoint inhibition, 2017.
6. NCCN Guidelines Version 4.2017, Non-small cell lung cancer, 2017.
7. Rittmeyer A. et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial, 2016.
Подготовила Екатерина Марушко