22 березня, 2017
Герцептин® для подкожного введения: краткий обзор исследований
Таргетный препарат Герцептин® (трастузумаб) является стандартом терапии HER2-положительного рака грудной железы (РГЖ) во всем мире. Способность трастузумаба изменить прогноз заболевания послужила основанием для дальнейшей эволюции этого препарата, которая происходит по двум направлениям: создание конъюгата с химиопрепаратом (трастузумаб – эмтанзин) и создание новой лекарственной формы, предназначенной для подкожного (ПК) введения.
Герцептин для ПК введения (Герцептин® SC) назначается в фиксированной дозе 600 мг (независимо от массы тела пациента) в фиксированном объеме 5 мл. В основе утверждения новой лекарственной формы лежит ряд исследований, посвященных сравнению эффективности, безопасности и других особенностей применения двух лекарственных форм препарата Герцептин®, предназначенных соответственно для ПК и внутривенного (ВВ) введения.
Для справки
Инъекционный объем ПК лекарственной формы составляет 5 мл. Введение объемов >2 мл обычно сопровождается болезненными ощущениями и ограничивается физиологией внеклеточного матрикса подкожной ткани. Включение в состав препарата рекомбинантной гиалуронидазы человека (rHuPH20) позволяет временно устранить этот барьер, что обеспечивает легкость и безболезненность ПК введения.
Начальная нагрузочная доза при ПК введении препарата Герцептин® не требуется.
Исследования показали, что назначение фиксированной дозы 600 мг позволяет поддерживать достаточную концентрацию в крови и насыщение рецепторов HER2 уже с первого цикла лечения.
Эффективность
Для сравнения эффективности двух лекарственных форм проведено ключевое исследование III фазы HannaH, охватившее 81 медицинский центр Европы, Америки, Азии, Африки в период с 19 октября 2009 г. по 1 декабря 2010 г.
В это исследование были включены 596 пациентов с HER2-положительным неметастатическим местнораспространенным РГЖ, которые в дополнение к неоадъювантной химиотерапии получали трастузумаб ПК в фиксированной дозе 600 мг (n=297) или трастузумаб ВВ (8 мг/кг нагрузочная доза, затем 6 мг/кг) (n=299) 1 раз в 3 недели. Двести тридцать пять пациентов в группе ВВ и 234 в группе ПК введения трастузумаба были включены в протокол фармакокинетического анализа. В итоге было показано, что трастузумаб для ПК введения не уступает ВВ трастузумабу с точки зрения концентрации в сыворотке крови: среднее геометрическое соотношение было 1,33 (90% доверительный интервал – ДИ – 1,24-1,44). Изменчивость концентраций в сыворотке крови также была аналогична в обеих группах. Почти все пациенты в предоперационном периоде достигли концентраций, превышающих целевой терапевтический уровень 20 мкг/мл. Так, сывороточная концентрация препарата непосредственно перед хирургическим вмешательством составила 69 нг/мл в группе ПК и 51,8 нг/мл в группе ВВ введения.
В протокол анализа эффективности лечения были включены 263 пациента в группе ВВ и 260 в группе ПК введения трастузумаба. Было показано, что ПК форма трастузумаба не уступает ВВ с точки зрения ответа на лечение: 118 (45,4%) из 260 пациентов в группе ПК и 107 (40,7%) из 263 в группе ВВ введения трастузумаба достигли полного патологического ответа (ППО). Различие между группами (ПК минус ВВ) составило 4,7% (95% ДИ 4,0-13,4). Аналогичные результаты были получены для общего ответа – ОО (в том числе ответа в подмышечных лимфоузлах – разница между исследуемыми группами составила 5%). После хирургического вмешательства пациенты получали 10 циклов адъювантной терапии трастузумабом ПК или ВВ до завершения 1 года лечения. Показатель бессобытийной выживаемости и безопасность терапии также оценивались с учетом различий в массе тела пациентов (по квартилям) с целью исследования правомерности применения фиксированной дозы трастузумаба.
Анализ обновленных результатов исследования, представленный в 2015 г. на конгрессе Американского общества клинических онкологов (ASCO), показал, что достижение ППО, определяемого как отсутствие опухолевых клеток в грудной железе и подмышечных лимфоузлах, ассоциировалось с достоверно высшей бессобытийной выживаемостью независимо от способа введения трастузумаба. Медиана наблюдения составила 40,3 мес в группе, получавшей трастузумаб ПК (диапазон 0,3-50,7), и 40,6 мес в группе, получавшей ВВ форму препарата (1-51).
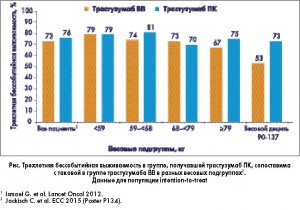
Медиана массы тела пациентов составила 66 кг в группе трастузумаба ВВ и 68 кг в группе трастузумаба ПК. В дополнение к данным первого анализа было показано, что достижение ППО и ОО (включая лимфоузлы) не зависело от массы тела пациентов как при общей оценке эффективности терапии в соответствии с протоколом исследования, так и в популяции intention-to-treat. Показатель трехлетней бессобытийной выживаемости составил 74% (218 из 294 пациентов) в группе, получавшей трастузумаб ПК, и 73% (217 из 297) в группе ВВ трастузумаба (отношение рисков 0,95; 95% ДИ 0,69-1,30). Бессобытийная выживаемость оказалась одинаковой в обеих сравниваемых группах, а также не различалась в зависимости от массы тела пациентов, что подтверждает правомерность фиксированной дозы трастузумаба (рис.). Профиль безопасности трастузумаба в исследовании HannaH соответствовал изученному ранее в других исследованиях; количество побочных реакций было сопоставимым.
Приверженность к лечению
Изучению предпочтений пациентами той или иной лекарственной формы трастузумаба, удовлетворенности медперсонала, а также затрат времени и ресурсов здравоохранения было посвящено исследование PrefHer. Результаты исследования показали, что подавляющее большинство (88,9%) пациентов предпочли ПК введение трастузумаба, в то время как ВВ способ – только 9,6% (р<0,0001); 1,5% не смогли отдать предпочтение тому или иному методу. Предпочтение трастузумаба ПК не зависело от последовательности назначения каждой из лекарственных форм. В качестве наиболее важных причин выбора ПК формы пациенты назвали экономию времени (80,3%) и уменьшение боли от манипуляции (34,3%). Опрос медицинского персонала показал: 77% предпочли ПК путь введения, 3% – ВВ форму и 20% не определились с предпочтениями относительно способа введения препарата.
Основным ожидаемым преимуществом лечения ПК формой является экономия времени. Пациенты с HER2-положительным РГЖ ранних стадий получают трастузумаб в качестве адъювантной терапии на протяжении 1 года; у больных с метастатическим РГЖ лечение продолжается до прогрессирования заболевания или дольше.
Для оценки экономии времени при ПК введении трастузумаба проведено неинтервенционное субисследование PreferHer-Time-and-Motion. Полученные результаты существенно различались в разных странах, принимавших в нем участие, но во всех клиниках наблюдалась значительная экономия времени пациента при использовании трастузумаба ПК. В среднем каждая манипуляция длилась на 34-95 мин меньше по сравнению с ВВ введением. Активное время медицинского персонала включало сумму времени, затрачиваемого на все задачи, связанные с подготовкой и введением трастузумаба. По этому показателю трастузумаб ПК также продемонстрировал значительные преимущества: экономия времени при проведении 1 манипуляции составила 7,4-18,7 мин, при проведении 18 циклов для 1 пациента (1 год терапии) – 2,3-5,5 ч. Эти же данные подтверждены при анализе опыта 7 медицинских центров Германии.
В целях дальнейшего совершенствования лекарственной формы предложен автоматический аппарат для ПК введения препарата Герцептин, который предположительно смогут использовать сами пациенты.
Иммуногенность
По результатам мониторинга антител на протяжении всего исследования HannaН, иммуногенность трастузумаба ПК была низкой. Большинство пациентов в обеих группах не имели антител к трастузумабу: таковые обнаружились только у 68 пациентов из 523 включенных в анализ, из них 24 пациента входили в группу, получавшую трастузумаб ВВ, и 44 – в группу ПК введения. Трехлетняя бессобытийная выживаемость в группе пациентов, получавших трастузумаб ВВ, составила 74% при негативном иммунном статусе и 71% при наличии антител к трастузумабу; в группе ПК введения эти показатели были соответственно 75 и 80%.
Таким образом, лекарственная форма для ПК введения (Герцептин® SC) представляет собой полноценную альтернативу ВВ лекарственной форме с доказанной сопоставимой эффективностью и безопасностью, но значительными преимуществами для пациентов и медицинского персонала.
Литература
- Ismael G., Hegg R., Muehlbauer S. et al. Subcutaneous versus intravenous administration of (neo)adjuvant trastuzumab in patients with HER2-positive, clinical stage I-III breast cancer (HannaH study): a phase 3, open-label, multicentre, randomised trial. Lancet Oncol 2012; 13: 869-78.
- Hegg R., Pienkowski T., Chen S.-T. et al. Immunogenicity of trastuzumab intravenous and subcutaneous formulations in the phase III HannaH study. ESMO Congress Abstracts 2012: 273P.
- Jackisch C., Hegg R., Stroyakovskiy D., Ahn J., Melichar B., Chen S., Crepelle-Flechais A., Heinzmann D., Shing M., Pivot X. Subcutaneous versus intravenous trastuzumab in early breast cancer: 2-year follow-up of HannaH/The Breast 24S1 (2015) S87-S150.
- Jackisch C., Muller V., Dall P. et al. Subcutaneous Trastuzumab for HER2-positive Breast Cancer – Evidence and Practical Experience in 7 German Centers. Geburtshilfe Frauenheilkd. 2015 Jun; 75(6): 566-573.
Подготовила Катерина Котенко