22 березня, 2017
Туберозный склероз: этиология, клиническая манифестация, диагностика
Туберозный склероз (ТС) – мультисистемное генетически гетерогенное заболевание (аутосомно-доминантное, с неполной пенетрантностью и вариабельной экспрессивностью). Для него характерна высокая частота возникновения новых (спонтанных) мутаций, которые обнаруживаются в 68% всех случаев ТС, клинически дебютирующих в раннем возрасте. Учитывая системность поражения, клиническую манифестацию и существующие подходы к диагностике, часто используется термин «комплекс туберозного склероза».
Клинические симптомы
Это заболевание характеризуется широким спектром клинических проявлений с развитием доброкачественных неинвазивных опухолеподобных очагов поражения (гамартом), локализованных в тканях головного мозга, сердца, почек, легких, печени и кожи.
Распространенность ТС среди новорожденных составляет приблизительно 1 на 6000 вне зависимости от пола или расы. Некоторые исследования показали, что мужчины чаще имеют поражения центральной нервной системы (ЦНС), но это не было окончательно доказано. Симптомы ТС могут проявиться в любом возрасте. У новорожденных и детей до 7 лет ТС диагностируется при тяжелой эпилепсии, аутизме или сердечной недостаточности. У пожилых пациентов могут наблюдаться клинические варианты с поражением почек, легких либо кожи и слизистых оболочек.
В зависимости от возраста пациента превалируют те или иные клинические варианты заболевания с локализацией поражения в разных системах органов.
• Поражение сердца происходит во время внутриутробного развития или в неонатальном периоде. Рабдомиома может регрессировать в течение долгого времени.
• Эпилепсия, задержки психического развития, аутизм манифестируют в раннем детстве до подросткового периода.
• Поликистоз почек, как правило, проявляется в младенчестве или раннем детстве.
• Ангиомиолипома (АМЛ) почек может быть диагностирована в любом возрасте.
• Лимфоангиомиоматоз (ЛАМ) легких обычно отмечается в третьем или четвертом десятилетии жизни пациента.
Точную оценку заболеваемости и распространенности ТС затрудняют недостаточная диагностика менее тяжелых фенотипов высокая спонтанная частота мутаций (примерно две трети всех случаев). Кроме того, на выявляемость заболевания влияет вариабельность симптоматики (даже в пределах известного семейного анамнеза пациентов), а также нежелание родителей/родственников, у которых симптомы отсутствуют, проходить генетическое тестирование. Разнообразие клинических признаков ТС, вариабельность фенотипа, тот факт, что манифестация проявлений заболевания зависит от возраста пациента, существенно затрудняют диагностику и требуют мультидисциплинарного подхода.
Практически всегда при ТС поражается ЦНС, вызывая инвалидизирующие неврологические нарушения. В их числе:
• эпилепсия, которая наблюдается у 90% пациентов, страдающих ТС;
• образование субэпендимальных узлов (СЭУ) – у 90-100%;
• субэпендимальные гигантоклеточные астроцитомы (СЭГА) – у 5-20%;
• замедление умственного развития (у 44-64%);
• микроструктурные аномалии белого вещества головного мозга.
Другими манифестациями ТС, не затрагивающими нервную систему, являются гипопигментные пятна и ангиофибромы лица, наличие кист почек и/или АМЛ, лимфангиолейомиомы легких, рабдомиомы сердца, гамартомы сетчатки и ангиомы печени. У 85% пациентов, страдающих ТС, выявляют мутации одного из двух генов, подавляющих рост опухолей, – TSC1 (кодирующего гамартин) или TSC2 (кодирующего туберин). Гамартин и туберин участвуют в регуляции пролиферации и дифференциации клеток. Они образуют физический и функциональный комплекс, активирующий гуанозин трифосфатазу, вследствие чего снижается активность гомолога белка Ras (Rheb) и ингибируются сигнальные пути мишени для рапамицина млекопитающих (mTOR). Сигнальные пути mTOR регулируют процессы биосинтеза белков и жиров, а также цикл развития клеток, зависящих от факторов роста.
В нормальных условиях гамартин и туберин активируются в процессе биосинтеза, опосредованного комплексом mTORC1, включающим mTOR, субъединицу mTOR – raptor (белок, выполняющий регуляторные функции mTOR), mLST8 и PRAS40 (богатый пролином Akt субстрат 40). Следствием мутации генов TSC1 или TSC2 является избыточная активация сигнального пути mTOR. Нисходящий киназный сигнальный каскад, который запускается в результате мутации данных генов, становится причиной аномалий развития различных клеток, в том числе нарушения клеточного цикла, транскрипции, трансляции и метаболического контроля (рис.).
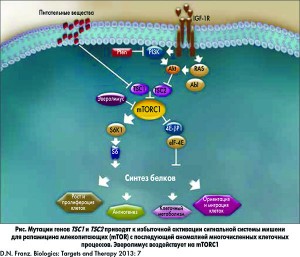
Прогресс в изучении молекулярных основ патофизиологического механизма ТС и выявление критической роли избыточной активации mTOR проложили путь к развитию новых терапевтических стратегий, основанных на применении ингибиторов mTOR.
Выделяют ТС 1 типа, обусловленный мутацией гена TSC1, и ТС 2 типа, обусловленный мутацией гена TSC2. Считается, что мутации в гене TSC2 ассоциированы с более тяжелыми клиническими вариантами заболевания, у пациентов с мутацией TSC1 заболевание протекает легче. Внешние факторы риска для развития ТС отсутствуют.
Диагностика ТС
Диагностика основана на сочетании клинических симптомов и данных лабораторных исследований, но ключевое значение при постановке диагноза имеет комплекс клинических данных. Фенотип пациента с ТС зависит от количества, локализации и размера гамартом. При постановке диагноза также важен возраст пациента, поскольку разные проявления заболевания манифестируют в разные возрастные периоды. Многообразие клинических проявлений, вариабельность фенотипа и зависимость клинических вариантов манифестации заболевания от возраста пациента существенно затрудняют диагностику. Поэтому при постановке диагноза ТС требуется подробный сбор анамнеза, консультации смежных специалистов, а также осмотр родственников пациента. Генетические исследования являются дополнительным методом диагностики и не всегда доступны для широкого применения в клинической практике из-за высокой стоимости.
Для упрощения диагностики ТС были предложены алгоритмы, представленные в Международных рекомендациях (TSC Clinical Consensus Conference 2012). С помощью первичных и вторичных признаков можно с высокой долей вероятности диагностировать ТС.
Диагноз ТС не вызывает сомнений при наличии у пациента двух первичных признаков или одного первичного и двух вторичных.
Первичные (большие) признаки:
• ангиофибромы лица (не менее трех) или фиброзные бляшки на лбу;
• гипопигментные пятна (в количестве не менее трех и не менее 5 мм в диаметре);
• нетравматические околоногтевые фибромы (не менее двух);
• участок «шагреневой кожи»;
• множественные гамартомы сетчатки;
• корковые дисплазии (не менее трех): корковые туберы и миграционные тракты в белом веществе головного мозга;
• субэпендимальные узлы (не менее двух);
• субэпендимальная гигантоклеточная астроцитома;
• рабдомиомы сердца множественные или одиночные;
• лимфангиолейомиоматоз легких;
• множественные АМЛ почек (не менее двух).
Что касается двух последних критериев, то само по себе наличие ЛАМ легких, АМЛ почек или их сочетание может быть не связано с ТС. Для подтверждения диагноза необходимо выявление и других признаков.
Вторичные (малые) признаки:
• многочисленные углубления в эмали зубов (не менее трех);
• фибромы в полости рта (не менее двух);
• гамартомы внутренних органов;
• ахроматический участок сетчатой оболочки глаза;
• пятна «конфетти» на коже;
• множественные кисты почек.
Возможный диагноз ставится на основании наличия одного первичного признака или двух (и более) вторичных. В настоящее время разработано молекулярно-генетическое тестирование. Подтвержденная патогенная мутация TSC1 или TSC2 является дополнительным критерием, достаточным для постановки диагноза ТС в спорных случаях при неполноте клинических данных. В оптимальных условиях генетическое тестирование выявляет мутации у 75-80% пациентов, страдающих ТС. Поэтому отрицательный генетический результат теста не исключает диагноза ТС. Молекулярно-генетическое тестирование полезно в неопределенных или сомнительных случаях, для пренатальной диагностики, а также при скрининге членов семьи и родственников пациента.
Клинические варианты ТС
Поражение ЦНС
Чаще всего поражение ЦНС манифестирует у новорожденных. Приступы судорог, аутизм и задержки физического развития – первые симптомы, требующие исключения ТС. Часто формируются резистентные к терапии варианты эпилепсии. Осложнения, вызванные поражением ЦНС, являются наиболее распространенными причинами смертности при ТС. Это обусловлено главным образом резистентной эпилепсией, эпилептическим статусом, а также формированием гидроцефалии при СЭГА.
Туберы встречаются у 95-100% больных ТС, представляют собой участки фокальной корковой дисплазии со сниженным числом ГАМК-эргических нейронов и характеризуются потерей классической 6-слойной цитоархитектуры коры мозга. Туберы бывают единичные или множественные, размером от нескольких миллиметров до нескольких сантиметров, и располагаются над единичной или несколькими прилегающими бороздами. В 54% случаев туберы кальцифицированы. Существует топографическая связь между наличием фокуса на электроэнцефалограмме и тубером, выявленным при исследовании методом магнитно-резонансной томографии. Приступы могут исходить из окружающей тубер нормальной коры, которая является зоной «перевозбужденных» нейронов. В некоторых случаях тубер может быть «немым», то есть неэпилептогенным.
СЭУ встречаются у 95-98% больных ТС. Они множественные, размером 2-10 мм, локализуются в стенках боковых желудочков, частично или полностью кальцифицированы и бессимптомные. Существует прямая зависимость между тяжестью эпилепсии при ТС и числом корковых туберов и СЭУ. Число туберов (8 и более) является фактором риска манифестации эпилепсии в первые два года жизни ребенка.
Поражение белого вещества головного мозга, или так называемые радиальные миграционные тракты встречаются у 30-95% больных ТС. Они представляют собой группы гетеротопических кластерных клеток, которые соединяют эпендиму стенок желудочков и туберы, соответствуют миграционным путям спонгиобластов во время эмбриогенеза, являются эпилептогенными зонами.

СЭГА встречаются с частотой 5-20% и представляют собой доброкачественную опухоль, которая наблюдается у пациентов с ТС. СЭГА – медленно растущая глионейрональная опухоль, которая не способна к спонтанной регрессии, располагается преимущественно у отверстия Монро (редко – в задних отделах тела боковых желудочков, у височных рогов, в 3 и 4 желудочках) и зачастую имеет >5 мм в диаметре.
Чаще всего СЭГА наблюдаются при мутации TSC2, реже при TSC1. Обычно они образуются у детей в возрасте 4-10 лет, но иногда выявляются антенатально или в период новорожденности. Трансформация СЭУ в СЭГА чаще всего происходит в первые два десятилетия жизни, пик трансформации приходится на пубертатный период. СЕГА обычно имеют круглую или овальную форму и в большинстве случаев не инфильтрируют вещество мозга. Данная опухоль хорошо выявляется с помощью компьютерной томографии с контрастированием.
При увеличении диаметра до ≥10 мм опухоли могут нарушать циркуляцию спинномозговой жидкости и приводить к прогрессирующему увеличению размеров боковых желудочков и развитию тяжелой гидроцефалии.
Симптоматическая эпилепсия наблюдается у 92% больных ТС в течение жизни. У 63% больных эпилептические приступы появляются на первом году жизни. Инфантильные спазмы (относятся к «катастрофическим формам» эпилепсии, приводят к инвалидизации пациентов) регистрируются у 38% пациентов с ТС, при этом пик дебюта заболевания приходится на 3-5 мес жизни. Фокальные приступы предшествуют, сопутствуют инфантильным спазмам и/или следуют за ними. Эпилептические приступы резистентны к противоэпилептической терапии у трети больных ТС. Эпилепсия приводит к нарушению познавательных и социальных функций, интеллекта, слуховой и зрительной памяти, внимания, к трудностями обучения (проблемы с чтением, письмом, арифметическими действиями), а также к жестким социальным ограничениям.
Нарушение обучения встречается у 50% пациентов с ТС. Чем раньше дебютирует ТС, захватывая период от первых месяцев жизни до 1,5 года, тем более выраженно снижается умственное развитие. Нарушения поведения – аутизм (возникает после инфантильных спазмов у 45% пациентов), агрессия и/или аутоагрессия – наблюдаются у 13% больных ТС, также для них характерна гиперактивность. Со временем развивается эмоциональное потускнение наряду с безразличием к родным. Периодически меняется эмоциональное состояние: сниженное настроение обычно сочетается с раздражительностью, агрессивностью; значительно реже наблюдаются дисфория с дурашливостью, недовольством. Также при ТС может отмечаться нарушение сна в виде проблем с засыпанием, частых и ранних пробуждений, сомнамбулизма.
Поражение кожи
Для ТС характерны поражения кожи, которые проявляются в виде гипопигментных пятен, ангиофибром лица, участков «шагреневой кожи», околоногтевых фибром, фиброзных бляшек, а также белых прядей волос.
Гипопигментные пятна – одно из наиболее частых кожных проявлений ТС – встречаются в 90% случаев. Они нередко обнаруживаются с рождения и служат одним из первых манифестных признаков заболевания. С возрастом наблюдается тенденция к увеличению их числа. Гипопигментные пятна при ТС преимущественно локализуются на туловище и ягодицах, реже на лице. Характерной особенностью является асимметричность их расположения. Отмечена вариабельность числа, размера и формы этих пятен. Число гипопигментных пятен варьирует от 3-4 до ≥100. Чаще всего встречаются полигональные пятна размером 0,5-2 см, напоминающие отпечатки большого пальца руки. Наиболее характерная форма пятен – овальная, похожая на лист ясеня, размер их варьирует от 1 до 12 см. Реже встречается большое количество мелких пятен размером 1-3 мм, которые группируются и принимают вид рассыпанного конфетти.
Белые пряди волос, ресниц и бровей (полиозис), как и гипопигментные пятна, представляют собой характерный признак ТС. Наряду с гипопигментными пятнами при ТС в 16% случаев встречаются пигментные пятна цвета кофе с молоком, что не превышает средних популяционных значений. При ТС эти пятна обычно единичные, овальные или округлые, плоские, размером 1-5 см.
Ангиофибромы лица встречаются в 47-90% случаев у детей >5 лет и развиваются, как правило, после 2-5 лет. Внешне они представляют собой папулы 1-4 мм в диаметре с гладкой поверхностью розового или красного цвета. Ангиофибромы располагаются на лице симметрично с двух сторон – на щеках и носу, на подбородке по типу «крыльев бабочки». Иногда ангиофибромы образуют сливные участки.
Участок «шагреневой кожи» представляет собой соединительнотканный невус, служит облигатным признаком ТС и встречается у 50% больных. В большинстве случаев такие участки появляются на втором десятилетии жизни, располагаются преимущественно в пояснично-крестцовой области, имеют плотную консистенцию и желтовато-коричневый или розовый цвет, умеренно выступают над поверхностью окружающей кожи.
Фиброзные бляшки обычно бежевого цвета, шероховатые на ощупь и несколько выступают над окружающей кожей. Они часто образуются уже на первом году жизни и являются одним из первых клинических симптомов заболевания. Чаще всего фиброзные бляшки локализуются на лбу, но иногда встречаются на волосистой части головы. Размер и число бляшек могут варьировать.
Околоногтевые фибромы (опухоли Коэнена) являются облигатным признаком ТС. Они представляют собой тусклые красные или цвета сырого мяса папулы/узлы, растущие от ногтевого ложа или вокруг ногтевой пластинки. В большинстве случаев околоногтевые фибромы появляются на втором десятилетии жизни и склонны к прогрессивному росту и возобновлению даже после их удаления.
Мягкие фибромы встречаются у 30% больных. Это множественные или единичные мягкие образования на ножках, имеющие мешотчатую форму и растущие на шее, туловище и конечностях. Другой вариант мягких фибром – множественные, несколько приподнятые над поверхностью кожи (и такого же цвета) мелкие образования размером меньше булавочной головки, располагающиеся на туловище и шее и напоминающие гусиную кожу.
Поражение сердца
Рабдомиомы относятся к гамартомам – опухолевидным узловым образованиям, представляющим собой тканевую аномалию развития, возникающую в связи с неправильным формированием эмбриональных тканевых комплексов при ТС. Рабдомиомы – один из вариантов манифестации заболевания с поражением сердца.
Клинические симптомы рабдомиом у детей различаются в зависимости от возраста, относительных размеров и локализации опухоли.
Поражение органа зрения
У 50% пациентов с ТС диагностируются гамартомы сетчатки. Встречаются как одно-, так и двусторонние гамартомы. Билатеральные поражения отмечаются примерно у половины пациентов. Обнаружить гамартомы у детей с ТС можно уже в первые дни жизни. Редко гамартомы сетчатки сопровождаются развивитием осложнения, сопровождающиеся снижением зрения: субретинальная экссудация, макулярный отек, кровоизлияния в стекловидное тело, неоваскулярная глаукома.
Патология почек
Как правило, поражение почек при ТС носит прогрессирующий характер, приводя к формированию хронической почечной недостаточности. Она занимает второе место в причинах смертности при ТС после патологии нервной системы. Типичным поражением почек являются АМЛ и кисты. К редким видам патологии относятся онкоцитома и почечноклеточный рак, а также неопухолевые заболевания: нефролитиаз, фокально-сегментарный гломерулосклероз, сосудистые дисплазии, мезангиокапиллярный гломерулонефрит.
АМЛ – наиболее частая патология почек при ТС, которая выявляется у 75% детей и 80% взрослых при ультразвуковом исследовании. АМЛ состоят из количественно вариабельных эндотелиальных гладкомышечных клеток и жировой ткани. Это доброкачественная опухоль, редко выявляемая при рождении и обычно диагностируемая в возрасте 5-10 лет. Обычно АМЛ развивается в обеих почках и имеет тенденцию к росту в юношеском возрасте. Размеры новообразования могут достигать 30 см и редко прорастают в окружающие ткани. У пациентов с ТС АМЛ почек часто сочетаются с ЛАМ легких (прогрессирующим кистозным поражением легких, встречающимся преимущественно у женщин).
Кисты почек при ТС могут развиваться в любом отделе нефрона и бывают как единичными, так и множественными. У большинства пациентов кисты невелики по размеру и не представляют значительного риска для здоровья. Однако в 2-5% случаев присутствуют изменения, аналогичные таковым при аутосомно-доминантной поликистозной болезни. Это связано с делецией генов ТSC2 и PKD1, расположенных на коротком плече 16 хромосомы и непосредственно примыкающих друг к другу. При этом патология почек проявляет себя в более раннем возрасте, может быть диагностирована пренатально при УЗИ плода и протекает более тяжело, чем при аутосомно-доминантной поликистозной болезни, связанной только с мутацией гена PKD1. Кисты интенсивно растут, достигая ≥5 см в диаметре и приводя к артериальной гипертензии и хронической почечной недостаточности уже к подростковому возрасту.
Поражение желудочно-кишечного тракта, эндокринной и костной систем
Изменения в органах желудочно-кишечного тракта при ТС разнообразны, встречаются относительно часто и проявляются патологией ротовой полости, печени, селезенки, поджелудочной железы и прямой кишки. Наиболее типичными нарушениями, выявляемыми при исследовании ротовой полости, являются узловые опухоли, фибромы или папилломы. Они локализуются в основном на переднем крае десен, преимущественно на верхней челюсти, но также встречаются на губах, слизистой оболочке щек, спинке языка и небе.
Дефекты эмали зубов отмечаются практически у всех больных ТС. Одним из наиболее типичных нарушений является дефект эмали зубов в виде углублений, число которых варьирует от 1 до 11 на каждом зубе (в среднем по 3 углубления на зуб). Преимущественные зоны локализации данных дефектов не определяются.
При ТС у 25% больных в печени появляются одиночные или множественные АМЛ и липомы. В поджелудочной железе АМЛ выявляются реже.
Изменения в кишечнике при ТС проявляются в основном ректальными полипами, которые встречаются, по данным разных авторов, в 50-78% случаев. Как правило, ректальные полипы выявляются у больных >20 лет. Полипы чаще многочисленные, розового цвета, размером 2-4 мм. Локализуются в прямой кишке преимущественно у аноректального соединения. Полипы при ТС обычно прогностически благоприятны.
Дисфункция желез внутренней секреции возникает вследствие роста опухолей. Наиболее часто при ТС обнаруживается патология надпочечников, проявляющаяся преимущественно в виде АМЛ (у 25% больных). Реже встречаются одиночные или множественные аденомы коры надпочечников. Нередко дисфункция желез внутренней секреции при ТС носит плюригландулярный характер.
Патология костной системы при ТС проявляется участками склероза костей свода черепа, чаще в лобной или теменной костях. Они обыкновенно выявляются после десятилетнего возраста и представляют собой образования округлой формы размером 0,2‑2 см. Схожие образования развиваются в телах позвонков и тазовых костях с тенденцией к расположению у крестцово-подвздошного сочленения. Участки склероза, расположенные диффузно по периферии тазовых костей, имеют плохо очерченные границы, вследствие чего могут быть ошибочно приняты за метастазы остеобластомы.
Связанные с ТС патологические образования в костях конечностей отличаются от образований в других частях скелета, представлены участками кистозного разрежения и часто сочетаются с периостальной (надкостничной) дополнительной новой костью. Кистозные образования встречаются преимущественно на руках и выявляются на фалангах пальцев в раннем детском возрасте. Периостальные дополнительные кости, наоборот, появляются в зрелом возрасте чаще на плюсневых, чем на пястных костях. Они плотные, солидные и имеют специфический волнистый контур. Поражение ребер и длинных трубчатых костей для ТС нехарактерно.
Поражение легких
Приблизительно в 30-40% случаев, при ТС развивается ЛАМ, встречаясь преимущественно у женщин репродуктивного возраста; описаны единичные случаи у мужчин и детей. После поражения ЦНС и почек ЛАМ является третьей причиной смерти при ТС. В зависимости от степени выраженности и распространения заболевания макроскопические изменения варьируют от единичных кист до диффузных кистозных изменений с обеих сторон от верхушек до оснований легких. Кистозные изменения в легких могут сопровождаться изменениями в подмышечных лимфатических узлах с формированием кист с жидкостным содержимым. Гистопатологически ЛАМ характеризуется кистами и пролиферацией незрелых гладкомышечных клеток.
Таким образом, ТС представляет собой генетическое мультисистемное заболевание, проявляющееся нарушением клеточной дифференцировки, пролиферации и миграции клеток на ранних стадиях развития, приводит к образованию гамартом практически во всех системах органов человеческого тела и обусловливает разнообразие клинического проявления заболевания. Вариабельность клинического фенотипа пациента требует мультидисциплинарного подхода к диагностике ТС. Сегодня разработаны современные методы таргетной терапии пациентов с некоторыми формами ТС, базирующиеся на использовании специфических ингибиторов, блокирующих mTOR сигнальный путь, активация которого лежит в основе клинико-патогенетических изменений, сопровождающих данное заболевание.
Список литературы находится в редакции.
Подготовила Катерина Котенко


