11 квітня, 2017
Синдром циклічного блювання: сучасні напрями патогенетичної терапії
Синдром циклічного блювання (СЦБ) вперше у 1882 р. описав Samuel Gee як хронічний функціональний розлад невідомої етіології, що характеризується пароксизмальними повторними епізодами блювання [22].
Деякі науковці визначають СЦБ як первинний ацетонемічний синдром [1, 3], обґрунтовуючи це ідентичністю зазначених патологічних станів. У вітчизняній педіатричній практиці та науковій літературі використовуються терміни «ацетонемічний синдром», «синдром ацетонемічного блювання», у світовій – термін «синдром циклічного блювання» [2].
Основні ознаки. Нудота, часте блювання, дегідратація та інтоксикація, гемодинамічні порушення, гіпоглікемія [5], тому пацієнти здебільшого потребують надання невідкладної допомоги.
Епідеміологія. Частота СЦБ серед дітей – 1,9-2,3% [22], у середньому перші епізоди реєструють у дітей віком 4,8 років, хоча можуть спостерігатися у дітей віком 6 днів, а також у дорослих старше 73 років [19].
Етіологія. На сучасному етапі СЦБ розглядають як поліетіологічне захворювання, в основі якого – порушення гіпоталамо-гіпофізарно-надниркової системи та мітохондріальна дисфункція.
На підставі результатів відповідних досліджень доведено спадковий характер СЦБ та наявність тісного зв’язку між схильністю до мігрені та СЦБ [15]. Майже у всіх пацієнтів із цим синдромом серед членів сім’ї є хворі на мігрень, а у 28-44% з них він розвивається в подальшому [15, 21].
Серед факторів, які провокують СЦБ, часто відмічають такі: інфекція, стрес (у тому числі надмір позитивних емоцій), голодування, надлишкове споживання білкової та жирної їжі при дефіциті вуглеводів, споживання деяких харчових продуктів (шоколаду, сиру тощо), недосипання, інсоляція. Доведено, що під час літніх канікул у пацієнтів із СЦБ часто настає тривала ремісія.
Патогенез. Центр блювання центральної нервової системи (ЦНС) можуть стимулювати подразнення шлунково-кишкового тракту (ШКТ) або вестибулярного апарату. При цьому основними медіаторами є дофамін, який підвищує активність хеморецепторної тригерної зони (ХТЗ) та ацетилхолін у центрі блювання. Вивільнення серотоніну 5-НТ з ентерохромафінних клітин у ШКТ може ініціювати епізод блювання. Серотонін 5-НТ зв’язується з 5-HT3-рецепторами, які стимулюють вагусні нейрони, які, у свою чергу, передають сигнали до центру блювання, що приводить до нудоти та блювання [22].
За даними магнітно-резонансної томографії у пацієнтів із СЦБ у стані спокою виявлено зміни функціональних зв’язків між поясною і нижньою лобовою звивинами головного мозку, що відповідає нейронному відображенню нудоти [9].
Такі симптоми СЦБ, як блідість шкірних покривів, гіперемія, лихоманка, млявість, слиновиділення і пронос, вказують на роль симпатичної гіперчутливості та вегетативної дисфункції в його патогенезі [22], а стрес є тригером виникнення цих епізодів. Підвищення рівня аденокортикотропного гормона (АКТГ) і кортизолу в поєднанні з млявістю і гіпертензією відмічається до початку блювання, тоді як високий рівень кортикотропін-рилізинг-фактора асоціюється із блюванням і гастропарезом [22].
Сьогодні СЦБ розглядається як мітохондріальна патологія [4, 11, 20, 24]. Мітохондріальний ланцюг перенесення електронів породжує мітохондріальний мембранний потенціал, необхідний для вироблення клітинної енергії аденозинтрифосфату (АТФ). Зниження мітохондріального дихання та енергетичного стану виявлено при багатьох патологічних станах, у тому числі при СЦБ. Під час таких епізодів відмічається підвищення рівня сечової кислоти в крові, лактату й порушення обміну органічних кислот. Аналогічні зміни реєструють у хворих із відомими мітохондріальними захворюваннями. А оскільки мітохондрії – це своєрідні «енергетичні станції клітини», то при СЦБ спостерігаються порушення енергетичного обміну.
Відомо, що в умовах гіпоксії, стресу блокується окисне фосфорилювання, активується гліколіз, при метаболізмі однієї молекули глюкози замість 38 утворюється лише 2 молекули АТФ, внаслідок чого виникає дефіцит енергії.
Доведено генетичну зумовленість мітохондріальної дисфункції при СЦБ, зокрема у літературі описано мутації мітохондріальної ДНК (мтДНК), які сприяють розвитку цього синдрому і пов’язаних із ним розладів (наприклад, мігрені та синдрому хронічної втоми). У дітей із СЦБ у 6 разів частіше зустрічається поліморфізм 16519T і у 17 разів частіше – 3010A мтДНК [22].
У звичайних умовах також відбувається синтез кетонових тіл, але в незначній кількості [26]. При станах, що супроводжуються зниженням рівня глюкози у крові, у клітин органів і тканин починається енергетичний голод. Надходження великої кількості жирних кислот у печінку також стимулює утворення кетонових тіл.
Жирні кислоти з цитозолю гепатоциту потрапляють у мітохондрії та окиснюються з утворенням кетонів. Оскільки окиснення жирних кислот є «трудомістким» процесом, а нервова тканина взагалі нездатна окиснювати жирні кислоти, то печінка полегшує використання цих кислот тканинами, заздалегідь окиснюючи їх до оцтової кислоти і перетворюючи останню в транспортну форму – кетонові тіла [26].
Синтез ацетоацетату відбувається тільки в мітохондріях печінки, потім він або відновлюється до 3-гідроксибутирату, або спонтанно декарбоксилюється до ацетону. Всі три сполуки надходять у кров і розносяться до тканин. Кетонові тіла використовують клітини всіх тканин, крім печінки та еритроцитів. Особливо активно, навіть у нормі, їх споживає міокард і кірковий шар надниркових залоз. Ацетон як летка речовина легко видаляється з повітрям, що видихається, і з потом. Усі кетонові тіла можуть виділятися з сечею.
Отже, кетонові тіла є засобом транспорту ацетильної групи. Цей процес істотно активується в умовах енергодефіциту. Блювання і кетонемія приводять до дегідратації та інтоксикації організму.
Клініка. СЦБ характеризується стереотипністю епізодів блювання у різні за тривалістю періоди повної нормалізації стану здоров’я пацієнта.
Стереотипний епізод СЦБ здебільшого починається з продрому з нудотою і блідістю шкірних покривів. Протягом 1-ї години відмічається часте блювання, протягом наступних 4-8 год частота зменшується. Епізоди зазвичай трапляються вночі (о 2.00-4.00) або після пробудження (о 6.00-8.00). У дітей період відновлення – від завершення блювання до спроможності вживати їжу та гратися – триває близько 5 год [22]. Однак така періодичність відмічається лише у половини пацієнтів, для решти характерні спорадичні епізоди.
Майже у всіх хворих спостерігається млявість і блідість, інколи виражена сонливість. Крім блювання, у пацієнтів доволі часто відмічається біль у животі (інколи досить інтенсивний) та нудота (або позиви на блювання). Такі симптоми, як лихоманка, діарея, надмірне слиновиділення, виявляються у третини пацієнтів із СЦБ [17].
Близько половини хворих скаржаться на головний біль, третина – на фото- і фонофобію, 26% – на запаморочення [19].
У 90% дорослих пацієнтів із СЦБ діагностують порушення вегетативної нервової системи з постуральною тахікардією і судинно-моторною дисфункцією, тоді як їх парасимпатична система функціонує нормально [23].
Діагностика. Відповідно до Римських критеріїв III у дітей із СЦБ обов’язково відмічаються як мінімум 2 епізоди інтенсивної нудоти і блювання тривалістю від однієї години до кількох діб та повернення до звичайного стану здоров’я, яке триває кілька тижнів або місяців [22].
Північно-Американське товариство педіатричної гастроентерології, гематології і нутріціології (NASPGHAN) запропонувало такі критерії СЦБ у дітей [18]: як мінімум 5 епізодів загалом або як мінімум 3 епізоди протягом 6 міс; епізодичні напади інтенсивної нудоти і блювання тривалістю від однієї год до 10 діб, що трапляються як мінімум 1 раз на тиждень; стереотипність симптомів у конкретного пацієнта; блювання під час епізодів відбувається як мінімум 4 р/год протягом не менше однієї години; в період між епізодами – повернення до звичайного стану здоров’я; симптоми не є проявами інших захворювань.
Відповідно до Римських критеріїв III у дорослих із СЦБ відмічаються: стереотипні щодо початку (гострий) і тривалості (<1 тижня) епізоди блювання; як мінімум 3 дискретні епізоди за попередній рік; відсутність нудоти і блювання між епізодами; відсутність структурних або біохімічних порушень обміну речовин, ШКТ або ЦНС [22].
Додатковим діагностичним критерієм СЦБ можна вважати мігрень в анамнезі.
У клінічній практиці для виявлення кетонемії використовують переважно якісні та напівкількісні проби. Наявність ацетоацетату у клінічному аналізі сечі оцінюється від одного («+») до чотирьох плюсів («++++»)[6].
В амбулаторних умовах для визначення рівня кетонових тіл у сечі використовують спеціальні діагностичні тести, проведення яких не вимагає спеціальних медичних знань та попередньої підготовки: забарвлення тест‑смужки у фіолетовий колір свідчить про наявність кетонемії [6].
Рівень кетонових тіл у сечі – непрямий показник кетонемії, рівень «+++» у сечі відповідає підвищенню рівня кетонових тіл у крові у 400 разів, а «++++» – у 600 разів [6]. Необхідно враховувати те, що результат дослідження залежить від об’єму вжитої дитиною рідини (прийом нею більшого об’єму рідини дає псевдонегативний результат, меншого – псевдопозитивний). Тому тест для визначення рівня кетонових тіл у сечі слід провести до введення внутрішньовенних розчинів глюкози.
З метою диференціальної діагностики проводять дослідження для виключення шлунково-кишкових розладів та інших патологічних станів (у тому числі неврологічних захворювань).
Перебіг блювання при СЦБ є більш тяжким, ніж при шлунково-стравохідному рефлюксі. У дітей із цим синдромом порівняно з дітьми з хронічним блюванням значно більше епізодів блювання за годину (12,6 проти 1,9) і значно менше епізодів на місяць (1,5 проти 36) [19].
Лікування. Лікування СЦБ включає такі напрями:
· уникнення тригерів;
· профілактичну та невідкладну терапію;
· підтримуючу терапію при нападах;
· консультування сім’ї.
Відомо, що у багатьох випадках можна запобігти епізодам блювання у дитини без застосування ліків – тільки завдяки обмеженням у вживанні шоколаду і сиру [22].
Медикаментозну терапію використовують для запобігання нападам блювання або зменшення їх частоти, а також для ослаблення інтенсивності епізодів у разі їх виникнення. Профілактичні лікарські засоби зазвичай застосовують у пацієнтів при наявності >1 епізоду СЦБ протягом місяця або у тому випадку, коли напади тривають ≥3 днів та характеризуються тяжким перебігом. З профілактичною метою призначають ципрогептадин, амітриптилін, протисудомні лікарські засоби (топірамат, фенобарбітал тощо), пропранолол [22].
Згідно з рекомендаціями NASPGHAN як препарат першої лінії у дітей віком менше 5 років застосовують ципрогептадин (під контролем маси тіла), у дітей старше 5 років і підлітків – амітриптилін [17]. За результатами відкритого дослідження 41 пацієнта з СЦБ, яке проводилося протягом 1-2 років, було встановлено, що при тривалій терапії трициклічними антидепресантами значно зменшувалися частота і тривалість епізодів і, відповідно, кількість відвідувань хворими відділення невідкладної допомоги і госпіталізацій [10].
У випадку виникнення епізодів СЦБ на тлі стресу доцільно навчити пацієнта стратегіям подолання стресу. Крім цього, на ранній стадії епізоду ефективним може бути застосування транквілізаторів – лоразепаму, діазепаму та ін. [22]. Вважається також, що раціональна консультація гастроентеролога без медикаментозної терапії може зменшити частоту епізодів блювання на 70% [16]. І близько 80% пацієнтів із СЦБ, у яких наявна мігрень у сімейному анамнезі, відповідають на антимігренозну терапію [21].
Для переривання епізодів СЦБ застосовують ондансетрон, прометазин, прохлорперазин, триптани [22]. Ондансетрон є антагоністом рецепторів 5-НТ 3 і діє безпосередньо на ХТЗ і аферентні сигнали блукаючого нерва із ШКТ, тому переривається активний епізод СЦБ [22]. Його необхідно застосовувати тільки під контролем електрокардіографії, оскільки може подовжуватись інтервал QT.
Наявність ортостатичної інтолерантності розглядається як показання для призначення бета-адреноблокаторів [22]. Для забезпечення сну і зменшення нудоти використовуються дифенгідрамін, лоразепам і хлорпромазин. Застосування комбінації лоразепаму та ондансетрону є більш ефективним, ніж тільки ондансетрону [22]. Для зменшення абдомінального болю можна призначити нестероїдні протизапальні препарати [22].
У кризовий період захворювання обов’язковими компонентами медикаментозної терапії є регідратація та корекція кислотно-лужного стану. Доведено, що застосування розчину глюкози внутрішньовенно зменшує тяжкість епізодів на 42% внаслідок зниження кетозу [16].
Для корекції мітохондріальної недостатності при СЦБ віднедавна стали застосовувати амінокислоти – аргінін та бетаїн [2].
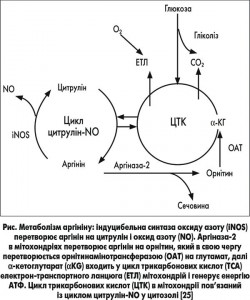
Амінокислота аргінін відіграє важливу роль в орнітиновому циклі утворення сечовини (здатна підсилювати його в кілька разів порівняно з дією інших амінокислот), а також в утворенні енергії в циклі трикарбонових кислот (сприяє синтезу 38 молекул АТФ з однієї молекули глюкози). Крім цього, аргінін поліпшує роботу цитохромоксидазної системи (цитохром Р450), підсилюючи детоксикаційну функцію печінки. Важливою є роль аргініну як субстрату для синтезу оксиду азоту – основного вазодилатуючого фактора. Метаболізм аргініну схематично зображено на рисунку.
Амінокислота бетаїн (триметилгліцин, TMG) – похідна гліцину (амінооцтової кислоти), що має 3 метильні групи, які зумовлюють фізіологічну роль цього з’єднання. Концентрація бетаїну всередині клітин є значно вищою, ніж у плазмі крові, тому бетаїн перешкоджає виходу води з клітини, коли осмолярність міжклітинної рідини підвищується. Збереження нормального градієнта осмотичного тиску забезпечує функціонування мембранних білків (рецепторів, іонних каналів, специфічних транспортерів тощо), а також протеїнів, розташованих усередині клітини.
У ході проведення відповідних експериментальних досліджень на лабораторних тваринах і клітинних культурах було показано, що збільшення осмолярності міжклітинної рідини на 10-15% приводить до 7-10-кратного збільшення експресії циклооксигенази‑2, продукції простагландинів і тромбоксану клітинами Купфера, а бетаїн нівелює ці ефекти [7].
Бетаїн поліпшує стан ліпідного і вуглеводного метаболізму, зменшує стрес ендоплазматичного ретикулуму [8]. Вплив бетаїну на ліпідний обмін полягає в активації та відновленні рівня АМФ-активованої протеїнкінази. Остання, впливаючи на інактивацію ацетилкоензиму-А-карбоксилази, зменшує синтез жирних кислот у печінці [12]. Бетаїн також бере участь в утворенні ендогенного фосфатидилхоліну і відновлює мембрани клітин печінки. Регулярний прийом бетаїну і збільшення концентрації метионіну посилює синтез цистеїну і глутатіону, який є основним внутрішньоклітинним антиоксидантом [13]. Бетаїн як донор метильних груп у цілій низці біохімічних процесів захищає клітини від впливу шкідливих епігенетичних факторів навколишнього середовища [12, 13].
Доведено, що бетаїн поліпшує регуляцію мітохондріального дихання, що сприяє відновленню мітохондріальної функції [14].
Фармацевтична компанія «Фармак» випустила дієтичну добавку Гепаргін, яка містить амінокислоти аргінін та бетаїн. Її можна рекомендувати до застосування для корекції епізодів СЦБ. Для цього слід (дітям старше 3 років і дорослим) вміст одного флакону розвести в половині склянки (100 мл) питної води та приймати по 1 чайній ложці кожні 10-15 хв 2 флакони на добу. Прийом вказаних амінокислот сприяє корекції мітохондріальної функції у пацієнтів із СЦБ, а отже, перешкоджає підвищеному утворенню кетонових тіл. Іони цитрату, що входять до складу препарату Гепаргін, підсилюють ацетилюючу здатність ацетил-коензиму А і нормалізують кетогенез; олужнюють рН сечі, сприяючи виведенню сечової кислоти; поліпшують процеси травлення; чинять антиоксидантну дію.
Таким чином, в основі патогенезу СЦБ – мітохондріальна дисфункція, яка в умовах дії тригерного фактора (голодування, інфекція, стрес, вживання певних продуктів харчування тощо) приводить до енергетичної недостатності. Надлишковий синтез кетонових тіл можна вважати компенсаторною реакцією на утворення транспортної форми енергії. Тому саме корекція мітохондріальної дисфункції, так само як регідратація, є важливим напрямом патогенетичної терапії СЦБ. Доцільним є застосування з цією метою амінокислот аргініну та бетаїну.
Література
1. Бережной В.В., Корнева В.В., Козачук В.Г. и др. Ацетонемический синдром у детей – тактические шаги доктора-практика // Современная педиатрия. – 2012. – № 2 (42). – С. 1-6.
2. Денисова М.Ф., Чернега Н.В., Музыка Н.Н. Бетаргин® в комплексном лечении ацетонемического синдрома у детей // Современная педиатрия. – 2014. – № 8 (64). – С. 1-6.
3. Ігнатко Л.В., Порташ Л.Ю., Томей А.І. Сучасні аспекти виникнення та перебігу синдрому циклічного блювання у дітей // Проблеми клінічної педіатрії. – 2013. – № 1 (19). – С. 80-83.
4. Майданник В.Г., Іванишин Л.М. Клінічні рекомендації з діагностики та лікування функціональних гастроінтестинальних розладів у дітей. – К., 2013. – 66 с.
5. Рикало Н.А., Рауцкіс В.А. Ацетонемічний синдром у дітей: патогенез, раціональна інфузійна терапія // Український журнал гематології та трансфузіології. – 2012. – № 4 (15). – С. 53-56.
6. Шадрін О.Г. Синдром ацетонемічної блювоти у дітей, терапевтичні підходи до лікування // Современная педиатрия. – 2014. – № 6 (62). – С. 108-111.
7. Burg M.B., Ferraris J.D. Intracellular organic osmolytes: function and regulation. J. Biol. Chem. 2008 Mar 21; 283 (12): 7309-13.
8. Day C.R., Kempson S.A. Betaine chemistry, roles, and potential use in liver disease. BBA – General Subjects(2016), doi:10.1016/j.bbagen.2016.02.001.
9. Erica A. Samuel, Arash Babaei, Anna Patel, Robert M. Siwiec, Mark Kern, Thangam Venkatesan et al. Cyclic Vomiting Syndrome is Associated With Alterations of Brain Connectivity. Gastroenterology. May/2012. 142: S‑552-S‑553.
10. Hejazi R.A., Reddymasu S.C., Namin F., Lavenbarg T., Foran P., McCallum R.W. Efficacy of tricyclic antidepressant therapy in adults with cyclic vomiting syndrome: a two-year follow-up study. J Clin Gastroenterol. 2010 Jan. 44 (1): 18-21 [Medline].
11. Gelfand A.A., Gallagher R.C. Cyclic Vomiting Syndrome versus Inborn Errors of Metabolism: A Review With Clinical Recommendations. Headache. 2016 January; 56 (1): 215-221. doi:10.1111/head.12749.
12. Kathirvel E., Morgan K., Nandgiri G., Sandoval B.C., Caudill M.A., Bottiglieri T. et al. Betaine improves nonalcoholic fatty liver and associated hepatic insulin resistance: a potential mechanism for hepatoprotection by betaine. Am. J. Physiol. Gastrointest. Liver Physiol. 2010 Nov; 299 (5): G1068-1077.
13. Kim S.K., Kim Y.C. Effects of betaine supplementation on hepatic metabolism of sulfur-containing amino acids in mice. J. Hepatol. 2005 Jun; 42 (6): 907-13.
14. Lee I. Betaine is a positive regulator of mitochondrial respiration. Biochem Biophys Res Commun. 2015 Jan 9; 456 (2): 621-5. doi: 10.1016/j.bbrc.2014.12.005. Epub 2014 Dec 8.
15. Levinthal D.J. The Cyclic Vomiting Syndrome Threshold: A Framework for Understanding Pathogenesis and Predicting Successful Treatments. Clinical and Translational Gastroenterology. 2016) 7, e198; doi:10.1038/ctg.2016.55.
16. Li B.U. Cyclic vomiting syndrome and abdominal migraine: periodic syndromes with gastrointestinal symptoms. Int Semin Pediatr Gastroenterol Nutr. 2000. 9(3):1-8]
17. Li B.U., Balint J.P. Cyclic vomiting syndrome: evolution in our understanding of a brain-gut disorder. Adv Pediatr. 2000. 47: 117-60.
18. Li B.U., Lefevre F., Chelimsky G.G. et al. North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition consensus statement on the diagnosis and management of cyclic vomiting syndrome. J Pediatr Gastroenterol Nutr. 2008 Sep. 47 (3): 379-93.
19. Li B.U., Misiewicz L. Cyclic Vomiting Syndrome: a brain-gut disorder. Gastroenterol Clin N Am. 2003. 32: 997-1019.
20. Moses J., Keilman A., Worley S., Radhakrishnan K., Rothner A.D., Parikh S. Approach to the diagnosis and treatment of cyclic vomiting syndrome: a large single-center experience with 106 patients. Pediatr Neurol. 2014; 50: 569-573. [PubMed: 24842256]
21. Hikita T., Kodama H., Ogita K., Kaneko S., Nakamoto N., Mimaki M. Cyclic Vomiting Syndrome in Infants and Children: A Clinical Follow-Up Study. Pediatr Neurol. 2016 Apr; 57: 29-33. doi: 10.1016/j.pediatrneurol.2016.01.001. Epub 2016 Jan 7.
22. Venkatesan T. et al. Cyclic Vomiting Syndrome. 2016 http://emedicine.medscape.com/article/933135-overview
23. Venkatesan T., Prieto T., Barboi A., Li B., Schroeder A., Hogan W. Autonomic nerve function in adults with cyclic vomiting syndrome: a prospective study. Neurogastroenterol Motil. 2010 Dec. 22 (12): 1303-7, e339. [Medline].
24. Venkatesan T., Zaki E.A., Kumar N., Sengupta J., Ali M., Malik B., Szabo A., van Tilburg M.A., Boles R.G. Quantitative pedigree analysis and mitochondrial DNA sequence variants in adults with cyclic vomiting syndrome. BMC Gastroenterol. 2014; 14:181 [PubMed: 25332060].
25. Weiling Xu, Serpil Erzurum, «Pathobiological Links Discovered Between Asthma and Metabolism», 2016.
26. http://biokhimija.ru/lekcii-po-biohimii/24-stroenie-obmen-lipidov/149-ketonovye-tela.html