5 лютого, 2017
Предотвращение клинически значимых ухудшений при ХОЗЛ с помощью умеклидиниума/вилантерола
Больным ХОЗЛ c бронхообструкцией от умеренной до тяжелой степени без частых обострений в анамнезе рекомендована монотерапия холинолитиком длительного действия. Однако большинство пациентов, получающих монотерапию длительно действующим бронхолитиком, продолжают жаловаться на умеренную или выраженную одышку и регулярно используют бронхолитики короткого действия для купирования симптомов. Альтернативным вариантом лечения для пациентов с выраженными симптомами ХОЗЛ является поддерживающая терапия комбинацией холинолитика и β2-агониста длительного действия. Цель данной работы – установить, снижает ли двойная бронходилатационная терапия умеклидиниумом и вилантеролом риск развития клинически значимых ухудшений при ХОЗЛ по сравнению с плацебо и монотерапией бронхолитиками длительного действия.
По данным ряда исследований сочетание холинолитика длительного действия умеклидиниума (UMEC) и β2-агониста длительного действия вилантерола (VI) обеспечивает статистически и клинически значимое уменьшение выраженности одышки, улучшение показателей функции легких и самочувствия пациентов с ХОЗЛ по сравнению с плацебо. Комбинация UMEC/VI также показала более выраженное улучшение функции легких и оценки исходов пациентами (patient-reported outcomes, PROs) по сравнению с тиотропием (TIO). Подобное улучшение функции легких и PROs, а также аналогичные профили безопасности были отмечены и для других комбинаций холинолитиков и β2-агонистов длительного действия по сравнению с монотерапией бронхолитиком длительного действия.
Однако не все исследования, сравнивавшие комбинации бронхолитиков с монотерапией их отдельными компонентами, продемонстрировали статистически значимое улучшение PROs. Кроме того, величина изменения PRO была меньше общепринятого минимального клинически значимого различия (minimal clinically important difference, MCID). Хотя следует отметить, что значение MCID традиционно используется для сравнения с плацебо, поэтому вполне вероятно, что при сравнении между группами активной терапии величина улучшения будет меньше, чем MCID.
В клинических исследованиях бронходилататоров при ХОЗЛ обычно оценивают степень улучшения функции легких и PROs. Но важно также определить, позволяет ли применяемое лечение замедлить снижение функции легких и предотвратить прогрессирование заболевания, снизить риск развития обострений. Обострения и быстрое снижение функции легких признаны важными маркерами неблагоприятного долгосрочного прогноза ХОЗЛ. Кроме того, значимым прогностическим критерием является показатель состояния здоровья по Респираторному опроснику госпиталя св. Георгия (SGRQ). Ухудшение показателя SGRQ более величины MCID в течение года является предиктором повышения частоты госпитализаций и смертности в течение 2 последующих лет. Поэтому авторы разработали новую комбинированную конечную точку для оценки эффективности терапии ХОЗЛ – клинически значимое ухудшение (clinically important deterioration, CID), которое включает ухудшение функции легких и показателя SGRQ не менее MCID, а также частоту развития умеренных или тяжелых обострений ХОЗЛ.
Для оценки эффективности фиксированной комбинации UMEC/VI в отношении предупреждения CID был проведен ретроспективный анализ данных двух наиболее крупных 6-месячных рандомизированных контролируемых многоцентровых исследований III фазы, сравнивавших UMEC/VI с плацебо, монотерапией UMEC, VI (исследование А) или тиотропием (исследование В) у симптоматичных пациентов с ХОЗЛ (группы B и D) и степенью бронхообструкции от умеренной до очень тяжелой.
Материалы и методы
В исследовании А (DB2113373; NCT01313650) пациенты были рандомизированы в соотношении 3:3:3:2 в четыре группы (во всех группах использовался в качестве доставочного устройства сухопорошковый ингалятор ELLIPTA™, GSK):
– UMEC/VI 62,5/25 мкг (доставляемая доза 55/22 мкг);
– UMEC62,5 мкг (доставляемая доза 55 мкг);
– VI 25 мкг (доставляемая доза 22 мкг);
– плацебо.
В исследовании B (ZEP117115; NCT01777334) пациенты были рандомизированы в соотношении 1:1 в две группы лечения:
– UMEC/VI 62,5/25 мкг с помощью сухопорошкового ингалятора ELLIPTA™,
– TIO 18 мкг с помощью доставочного устройства HandiHaler® (Boehringer Ingelheim).
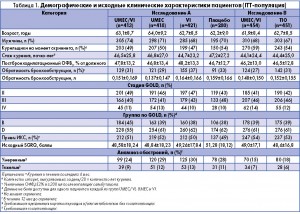
Основными критериями включения в обоих исследованиях были: возраст ≥40 лет; диагноз ХОЗЛ в соответствии с рекомендациями Американского торакального общества/Европейского респираторного общества; соотношение объема форсированного выдоха за 1 секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ) <0,70; постбронходилатационный показатель ОФВ1 ≤70% от должного; выраженность одышки по модифицированной шкале MRC (Medical Research Council) ≥2 баллов.
Основными критериями исключения были: диагноз бронхиальной астмы или других респираторных заболеваний; госпитализации по поводу ХОЗЛ или пневмонии в течение 12 недель до первого визита; использование запрещенных препаратов.
Первичной конечной точкой в обоих исследованиях был пребронходилатационный (через 23-24 часа после приема последней дозы) показатель ОФВ1 на 169-й день лечения. Также оценивался показатель SGRQ на 168-й день.
В качестве первичной конечной точки данного ретроспективного анализа было выбрано время до первого CID – комбинированной конечной точки, которая включала как минимум одно из указанных событий:
- снижение пребронходилатационного показателя ОФВ1 ≥100 мл по сравнению с исходным уровнем;
- ухудшение качества жизни (увеличение показателя SGRQ ≥4 баллов от исходного уровня);
- умеренное или тяжелое обострение ХОЗЛ (острое прогрессирование симптомов ХОЗЛ, требующее применения дополнительного лечения, включая пероральные кортикостероиды, антибиотики, неотложную помощь, или госпитализации).
Изменение пребронходилатационного показателя ОФВ1 от исходного уровня оценивали на 7 визитах после рандомизации (дни 2, 28, 56, 84, 112, 168 и 169), показателя SGRQ – на 3 визитах (дни 28, 84 и 168).
Отдельно оценивали время до начала развития каждого из трех компонентов CID.
Еще одной конечной точкой было время до первого устойчивого CID, определяемого как CID на двух или более следующих друг за другом визитах (с интервалом в 4 недели), или ухудшение, отмечаемое не менее чем на половине последующих визитов. При этом дни 168 и 169 расценивались как один визит для оценки снижения ОФВ1. Протоколы обоих исследований предусматривали исключение пациентов после умеренного или тяжелого обострения ХОЗЛ, поэтому первое обострение расценивалось как устойчивое CID.
Оценка безопасности в обоих исследованиях подразумевала мониторирование нежелательных явлений (НЯ).
Результаты
Количество пациентов, включенных в лечение (intent-to-treat, ITT) составило 1 532 (исследование А) и 905 человек (исследование В). Демографические и исходные клинические характеристики были сходными во всех сравниваемых группах (таблица 1).
Эффективность
Изменение пребронходилатационного ОФВ1 и показателя SGRQ. Значительное улучшение на заключительном визите было отмечено в группах UMEC/VI, UMEC и VI по сравнению с плацебо в исследовании А и в группе UMEC/VI по сравнению с TIO в исследовании B.
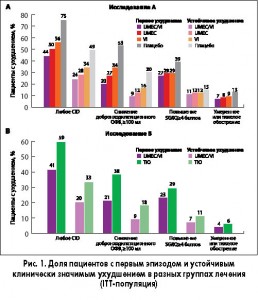
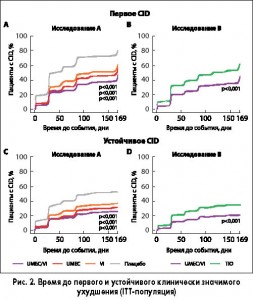
Время до первого комбинированного CID в исследовании А. Доля пациентов с первым комбинированным CID варьировала от 44% в группе UMEC/VI до 75% в группе плацебо (таблица 2, рисунок 1А).
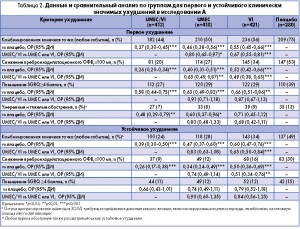
Во всех группах активного лечения риск развития первого комбинированного CID был достоверно ниже по сравнению с группой плацебо: в группе UMEC/VI – на 63% (ОР 0,37; 95% ДИ 0,30-0,45; р<0,001), в группе UMEC – на 54% (ОР 0,46; 95% ДИ 0,38-0,56; р<0,001), в группе VI – на 45% (ОР 0,55; 95% ДИ 0,45-0,66; р<0,001)(таблица 2, рисунок 2А). В группах UMEC/VI и UMEC также отмечалось статистически значимое снижение риска всех трех компонентов CID по сравнению с плацебо (р<0,05) (таблица 2). В группе VI достоверно снизился риск клинически значимого ухудшения пребронходилатационного показателя ОФВ1 и показателя SGRQ по сравнению с плацебо (р<0,01) (таблица 2).
При сравнении групп активного лечения было установлено, что риск первого комбинированного CID в группе UMEC/VI был на 20% ниже по сравнению с группой UMEC (ОР 0,80; 95% ДИ 0,65-0,97; р<0,05) и на 33% ниже по сравнению с группой VI (ОР 0,67; 95% ДИ 0,55-0,81; р<0,001) (таблица 2). Также в группе UMEC/VI был достоверно ниже риск снижения пребронходилатационного показателя ОФВ1 по сравнению с группами UMEC и VI (таблица 2).
Время до первого CID в исследовании В. Доля пациентов с первым комбинированным CID составила 41% в группе UMEC/VI и 59% в группе TIO (таблица 3, рисунок 1В).
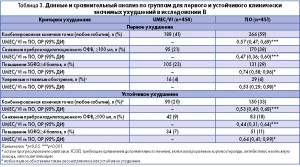
Комбинация UMEC/VI обеспечила снижение риска развития первого комбинированного CID по сравнению с группой TIO на 43% (ОР 0,57; 95% ДИ 0,47-0,69; р<0,001) (таблица 3; Рисунок 2B). Статистически значимое снижение риска первых ухудшений в группе UMEC/VI по сравнению с группой TIO отмечалось также для всех трех компонентов CID (р<0,05) (таблица 3).
Время до устойчивого комбинированного CID в исследовании А. Доля пациентов с устойчивым комбинированным CID была примерно в 2 раза ниже, чем доля пациентов с первым CID: в группе UMEC/VI – 24%, UMEC – 28%, VI – 34%, плацебо – 49% (таблица 2; рисунок 1А).
Во всех группах активного лечения риск устойчивого комбинированного CID был достоверно ниже по сравнению с группой плацебо: в группе UMEC/VI – на 61% (ОР 0,39; 95% ДИ 0,30-0,5; р<0,001), в группе UMEC – на 53% (ОР 0,47; 95% ДИ 0,37-0,6; р<0,001), в группе VI – на 40% (ОР 0,60; 95% ДИ 0,47-0,76; р<0,001) (таблица 2, рисунок 2С). В группах UMEC/VI, UMEC и VI был также достоверно ниже риск клинически значимого ухудшения пребронходилатационного показателя ОФВ1 по сравнению с группой плацебо (р<0,001) (таблица 2).
Комбинация UMEC/VI обеспечила также снижение риска развития устойчивого комбинированного CID на 35% по сравнению с группой VI (ОР 0,65; 95% ДИ 0,50-0,84; р<0,001) (таблица 2).
Время до устойчивого CID в исследовании B. Доля пациентов с устойчивым комбинированным CID составила 20% в группе UMEC/VI и 33% в группе TIO (таблица 3, рисунок 1В). Она была примерно в два раза ниже, чем доля пациентов с первым CID (таблица 3).
Комбинация UMEC/VI обеспечила снижение риска развития устойчивого комбинированного CID на 47% по сравнению с группой TIO (ОР 0,53; 95% ДИ 0,40-0,68; р<0,001) (таблица 3, рисунок 2D). Также в группе UMEC/VI наблюдалось статистически значимое снижение риска устойчивого ухудшения пребронходилатационного показателя ОФВ1 и показателя SGRQ по сравнению с группой TIO (р<0,05) (таблица 3). Анализ по подгруппам в зависимости от тяжести заболевания по классификации GOLD и сопутствующего применения ингаляционных кортикостероидов в исследованиях А и В. В исследовании А доля пациентов с первым CID была выше у пациентов, получавших плацебо, во всех подгруппах (69-80%) по сравнению с лечением UMEC/VI (40-48%), UMEC (47-53%) и VI (54-58%). Все виды активного лечения статистически значимо снижали риск развития первого CID по сравнению с плацебо во всех подгруппах (р<0,001). Комбинация UMEC/VI обеспечила достоверное снижение риска первого комбинированного CID по сравнению с лечением UMEC и VI в подгруппе пациентов категории GOLD D и у лиц, получавших ИКС (р<0,01). Сходные результаты были получены в отношении устойчивого комбинированного CID с тем лишь исключением, что терапия UMEC/VI не привела к статистически значимому снижению риска устойчивого CID в подгруппе лиц, получавших ИКС, по сравнению с UMEC.
В исследовании B доли пациентов с первым CID были примерно одинаковы во всех подгруппах при применении TIO (55-64%) и UMEC/VI (40-43%). Во всех подгруппах лечение UMEC/VI статистически значимо снижало риск развития первого комбинированного CID по сравнению с TIO (р<0,01). Сходные результаты были получены в отношении устойчивого CID.
Безопасность
Частота НЯ и серьезных НЯ была сопоставима во всех сравниваемых группах в обоих исследованиях.
Анализ чувствительности времени до первого и устойчивого CID в исследовании B
Был проведен еще один анализ с исключением показателей ОФВ1 в 4 из 7 визитов, во время которых не оценивали SGRQ. Доля пациентов с первым комбинированным CID составила 37% (n=169) в группе UMEC/VI и 52% (n=236) в группе TIO, доля с ухудшением пребронходилатационного ОФВ1 – 15% (n=67) и 27% (n=122) соответственно. Комбинация UMEC/VI снижала риск CID на 39% по сравнению с терапией TIO (ОР 0,61; 95% ДИ 0,50-0,75; р<0,001).
Доля пациентов с устойчивым CID составила 17% (n=75) в группе UMEC/VI и 27% (n=123) в группе TIO, доля с устойчивым ухудшением пребронходилатационного ОФВ1 – 6% (n=26) и 11% (n=50) соответственно. Комбинация UMEC/VI статистически достоверно снижала риск устойчивого CID на 45% по сравнению с терапией TIO (ОР 0,55; 95% ДИ 0,41-0,73; р<0,001).
Эти тенденции были сходны с первичным анализом.
Обсуждение
Основными задачами лечения ХОЗЛ являются: уменьшение выраженности симптомов, улучшение общего состояния здоровья, повышение толерантности к физической нагрузке, предотвращение обострений, замедление прогрессирования болезни. Так как показатели функции легких, состояние здоровья и частота обострений вносят вклад в долгосрочный прогноз при ХОЗЛ, то в руководствах по ведению пациентов с ХОЗЛ рекомендуется в первую очередь учитывать именно эти параметры при оценке прогрессирования и тяжести заболевания. Этот анализ с использованием новой комбинированной конечной точки CID показал, что 75% больных в группе плацебо в исследовании А и 59% пациентов в группе TIO в исследовании В испытали клинически значимое ухудшение в течение 24-недельного периода наблюдения. Применение комбинации UMEC/VI обеспечивало достоверное снижение риска первого CID по сравнению с TIO, UMEC, VI и плацебо.
Из трех компонентов CID наиболее частым было ухудшение функции легких (снижение пребронходилатационного ОФВ1), вторым по частоте – ухудшение состояния здоровья (SGRQ), третьим – умеренные и тяжелые обострения ХОЗЛ. Такая закономерность во многом объясняется более частым измерением функции легких по сравнению с оценкой состояния здоровья, а также включением в исследование пациентов без частых обострений в анамнезе.
В исследовании А комбинированная терапия UMEC/VI и монотерапия UMEC снижали риск первого комбинированного CID и всех его отдельных компонентов (снижение функции легких, ухудшение состояния здоровья и развитие умеренных или тяжелых обострений) по сравнению с плацебо. При монотерапии VI также наблюдалось снижение риска первого CID, однако при этом не снижался риск развития обострений. В целом комбинация UMEC/VI лучше предотвращала развитие CID и снижала риск ухудшения пребронходилатационного ОФВ1 по сравнению с монотерапией UMEC и VI, вероятно, за счет улучшения проходимости дыхательных путей.
В исследовании В было показано статистически значимое преимущество комбинации UMEC/VI по сравнению с тиотропием в предотвращении развития как первого комбинированного CID, так и ухудшения каждого из трех отдельных компонентов. Это свидетельствует о том, что двойная бронходилатационная терапия обеспечивает большую эффективность у симптоматичных пациентов с ХОЗЛ, чем рекомендованная в качестве первой линии лечения монотерапия бронхолитиком. Полученные результаты также показывают, что двойная комбинация UMEC/VI помимо статистически значимого улучшения функции легких и PROs по сравнению с TIO, также в большей мере предотвращает последующие ухудшения.
Ухудшение функции легких и состояния здоровья у пациентов с ХОЗЛ может быть транзиторным или устойчивым. В исследованиях А и В приблизительно у половины всех пациентов, у которых было отмечено первое снижение функции легких, и у трети больных с первым ухудшением состояния здоровья такое ухудшение было устойчивым. В исследовании А комбинация UMEC/VI и ее отдельные компоненты снижали риск устойчивого CID по сравнению с плацебо. При этом наибольшее снижение риска обеспечивала комбинированная терапия UMEC/VI со статистически значимой разницей с группами VI и плацебо. В исследовании B применение UMEC/VI в большей мере предотвращало развитие устойчивого CID, а также устойчивого ухудшения пребронходилатационного показателя ОФВ1 и состояния здоровья. В целом эти результаты свидетельствуют о более надежной профилактике развития устойчивого CID при применении UMEC/VI по сравнению с монотерапией бронходилататорами.
В настоящее время остается неясным, имеет ли устойчивое CID более весомые клинические последствия или более высокую прогностическую ценность, чем первые эпизоды CID. Кроме того, дальнейшего изучения требует долгосрочное влияние CID на другие аспекты заболеваемости и смертности при ХОЗЛ. В то же время известно, что о многих обострениях ХОЗЛ пациенты не сообщают врачам, в результате чего они остаются без лечения, что ассоциируется с ухудшением показателей SGRQ. Вполне вероятно, что в данном исследовании ухудшения показателей ОФВ1 и SGRQ могли быть незарегистрированными обострениями и иметь негативные долгосрочные последствия. Дальнейшего изучения требуют также пороговые значения, при которых те или иные ухудшения могут считаться клинически значимыми. В настоящем исследовании были использованы общепринятые MCIDs для показателей легочной функции и общего состояния здоровья, а в будущих клинических исследованиях могут быть изучены альтернативные MCIDs.
Частота CID в целом не зависела от исходной степени бронхообструкции, а результаты по сопутствующему применению ИКС оказались противоречивыми. Так, у пациентов категорий GOLD B (с выраженными симптомами ХОЗЛ, умеренной степенью бронхообструкции и низким риском обострений) и GOLD D (выраженные симптомы, тяжелая или очень тяжелая степень бронхообструкции и высокий риск обострений) была отмечена одинаковая частота первого CID в группе плацебо в исследовании А и в группе TIO в исследовании В. В группе плацебо в исследовании А более высокая частота первого CID была отмечена у пациентов, применявших ИКС (80%), по сравнению с теми, кто не использовал их (69%). В то же время в исследовании В доля пациентов с первым CID, получавших TIO в комбинации с ИКС, была меньше (55%) по сравнению с теми, кого лечили TIO без ИКС (64%). Эти контрастные результаты означают, что мы не можем пока ни подтвердить, ни исключить влияние ИКС на стабилизацию ХОЗЛ, поэтому необходимы дальнейшие исследования для выяснения этого вопроса.
Независимо от группы по классификации GOLD или сопутствующего применения ИКС двойная комбинация и монотерапия бронхолитиками снижали риск развития первого эпизода и устойчивого CID по сравнению с плацебо в исследовании А. Кроме того, в исследовании А лечение UMEC/VI привело к снижению риска CID по сравнению с UMEC и VI и устойчивого CID по сравнению с VI в подгруппах пациентов GOLD D и при сопутствующем применении ИКС. В исследовании В комбинация UMEC/VI обеспечила статистически значимое снижение первого эпизода и устойчивого CID во всех подгруппах по сравнению с TIO. Снижение риска CID на фоне терапии UMEC/VI по сравнению с монотерапией бронхолитиком было более последовательным во всех подгруппах в исследовании В, чем в исследовании А. Это позволяет предположить наличие различий между отдельными бронхолитиками (UMEC, VI и TIO) по способности предотвращать CID.
Выводы
Результаты этого исследования показывают, что у пациентов с ХОЗЛ имеют место частые клинически значимые ухудшения показателей функции легких и состояния здоровья, а также умеренные и тяжелые обострения. Двойная бронхолитическая терапия умеклидиниумом и вилантеролом позволяет снизить риск этих ухудшений по сравнению с плацебо и монотерапией бронхолитиками длительного действия.
Перевод с английского Натальи Мищенко
Список литературы находится в редакции.
Статья печатается в сокращении.
D. Singh, M.R. Maleki-Yazdi, L. Tombs et al. Prevention of clinically important deteriorations in COPD with umeclidinium/vilanterol. International Journal of COPD2016: 11 1413-1424