7 червня, 2017
Внутривенная иммунотерапия и ее эффективность в ревматологии
В последние годы во всем мире увеличивается использование в лечении широкого спектра заболеваний аутоиммунной природы препаратов иммуноглобулинов (ИГ), полученных из сыворотки большого количества доноров. Первые результаты использования этого метода были опубликованы в 1983 году. На первых этапах внедрения иммунотерапии в клиническую практику ее чаще применяли при аутоиммунных неврологических заболеваниях (синдром Гийена-Барре, хроническая воспалительная демиелинизирующая полинейропатия, мультифокальная моторная нейропатия и некоторые другие состояния).
Общность патологических механизмов и неудовлетворенность получаемыми результатами заставила ревматологов обратить внимание на внутривенную иммунотерапию как на перспективный метод лечения, особенно в случаях рефрактерности к стандартной терапии, и полученный опыт оказался успешным. Внедрению данного метода способствовала также его высокая безопасность и развитие высокотехнологичных методов очистки препаратов крови, в связи с чем риск заражения больных гепатитами или вирусом иммунодефицита человека был практически сведен к нулю. Доказательные исследования показали возможность и успешность такой терапии у пациентов со многими ревматическими заболеваниями.
Более широкому внедрению внутривенной иммунотерапии в ревматологическую практику способствует также увеличение числа пациентов со множественными коморбидными и иммунодефицитными состояниями, при которых использование стандартной базисной терапии и иммунобиологических препаратов ограничено. Как показывает практика, в таких случаях можно успешно использовать внутривенное введение ИГ.
Настоящая статья представляет собой краткий критический обзор опыта современного применения внутривенной иммунотерапии в ревматологии.
Механизмы действия концентрированных ИГ крови при ревматических заболеваниях
Хотя механизм действия ИГ до конца не изучен, считается, что эффекты этих препаратов опосредуются четырьмя путями:
1. Активация Fc-рецепторов иммунных клеток пациента через взаимодействие с Fc-фрагментом ИГ (модуляция или блокада рецепторов моноцитов и макрофагов).
2. Связывание комплемента больного Fc-фрагментом ИГ с ингибированием комплементарного каскада и предупреждением образования так называемого мембранолитического атакующего комплекса (что особенно важно при миозитах).
3. Присутствие цитокинов, цитокиновых рецепторов и молекул (главного комплекса гистосовместимости) в лекарственном препарате.
4. Действие через антигенсвязывающие фрагменты – Fab (нейтрализация аутоантител).
Приоритеты использования в ревматологии
В последнее десятилетие департаменты здравоохранения некоторых стран (США, Великобритании, Канады, Австралии, Уэльса) опубликовали рекомендации по применению внутривенной иммунотерапии, основанные на данных доказательной медицины и открытых нерандомизированных исследований, а также на мнениях экспертов. В соответствии с этими рекомендациями были определены «цветные» показания-индикаторы для каждого диагноза, с которыми врачи должны «сверять» свои намерения по использованию ИГ при ревматических заболеваниях. Соответственно, «красные» индикаторы имеют наивысший приоритет, «синие» индикаторы – следующий (чуть более низкий) уровень приоритета. «Серые» индикаторы имеют еще более низкий приоритет и указывают на те случаи, при которых отсутствуют доказательства эффективности ИГ, поэтому их использование рассматривается и поддерживается только в исключительных обстоятельствах и на индивидуальной основе (табл. 1). «Черный» индикатор указывает на отсутствие доказательств эффективности в настоящий момент и отсутствие оснований для применения.
Подчеркивается, что эти документы не носят запретительного характера, однако использование ИГ при низком приоритете может рассматриваться и поддерживаться только индивидуально.
Использование внутривенной иммунотерапии при различных заболеваниях и ее эффективность
«Красный» (высокий) приоритет применения ИГ
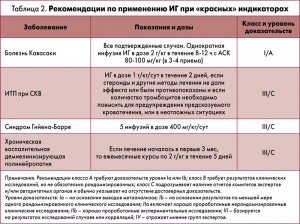
Болезнь Кавасаки
Болезнь Кавасаки является одним из наиболее частых васкулитов у детей, и при отсутствии лечения примерно у четверти пациентов развиваются серьезные аневризмы коронарных артерий. Первый успешный отчет об использовании ИГ в лечении болезни Кавасаки у 14 пациентов был получен в 1983 году. Метаанализ клинических исследований подтвердил, что высокодозная терапия ИГ в сочетании с ацетилсалициловой кислотой (АСК) весьма эффективна в снижении риска развития аневризм коронарных артерий.
В одном из Кохрановских обзоров были проанализированы 59 исследований и установлено, что даже однократное введение высокой дозы ИГ (2 г/кг) уже через 30 дней приводит к уменьшению количества аневризм коронарных артерий (R.M. Oates-Whitehead et al., 2003), и сделан вывод о важности использования у пациентов с болезнью Кавасаки препаратов ИГ и АСК, особенно в первые 10 дней от момента начала симптомов.
Иммунная тромбоцитопения (ИТП), хроническая воспалительная демиелинизирующая полинейропатия и синдром Гийена-Барре, ассоциированные с СКВ
Первая публикация об эффективном использовании ИГ у молодого пациента с ИТП появилась в 1981 году: описывался случай, когда после введения ИГ количество тромбоцитов крови неожиданно повысилось (Р. Imbach, 1981). Это побудило использовать внутривенную иммунотерапию при других аутоиммунных заболеваниях. В настоящее время Британское общество гематологов предлагает применять ИГ в качестве терапии первой линии у пациентов с ИТП, если количество тромбоцитов достаточно низкое и есть предсказуемый риск кровотечения, а также в неотложных ситуациях. При ИТП, ассоциированной с СКВ, у 65% пациентов, получавших высокие дозы ИГ, наблюдалось увеличение уровня тромбоцитов до >50 г/л, хотя этот эффект был относительно кратковременным. Следовательно, ИГ следует рассматривать в тяжелых и резистентных случаях волчаночной тромбоцитопении, когда восстановление тромбоцитов должно быть достигнуто очень быстро, прежде чем будут приняты долгосрочные меры.
В руководстве Американской академии неврологии (2012) рекомендовано применение ИГ в лечении синдрома Гийена-Барре и хронической воспалительной демиелинизирующей полинейропатии (уровень доказательств А). Существует также большое количество данных, подтверждающих целесообразность использования ИГ при первичном синдроме Гийена-Барре и относительно небольшое количество сообщений, которые описывают благоприятные исходы при ассоциированном с волчанкой синдроме. Поэтому рекомендуется использовать ИГ у больных СКВ с хронической воспалительной демиелинизирующей полинейропатией или с синдромом Гийена-Барре в первые 3 мес от начала симптомов (табл. 2).
Идиопатические воспалительные
миопатии
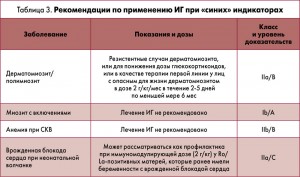
Идиопатические воспалительные миопатии включают в себя полимиозит, дерматомиозит, ювенильный миозит и миозит с включениями. Результаты лечения при миозитах оценивают по улучшению мышечной силы, нормализации уровней мышечных ферментов крови и уменьшению кожных проявлений заболевания. Краеугольным камнем терапии были и остаются внутривенные или пероральные глюкокортикоиды с введением модифицирующих течение иммунодепрессивных агентов, таких как метотрексат, азатиоприн и гидроксихлорохин.
Нередко миозиты (дерматомиозит, полимиозит) оказываются устойчивыми к лечению высокими дозами глюкокортикоидов и базисных препаратов. В 1993 году в небольшом исследовании показано, что у 9 из 12 пациентов, получавших ИГ, наблюдалось значительное улучшение по сравнению с 3 из 11 пациентов, получавших только плацебо (М.С. Dalakas et al., 1993). Пациенты, получавшие пользу от ИГ, нуждались в повторных инфузиях каждые 6 нед. Кроме того, в открытом исследовании продемонстрировано, что у 25 из 35 пациентов с резистентным полимиозитом, получавших по 2 инфузии в месяц (1 г/кг/сут) на протяжении 4-6 мес, отмечено значительное улучшение, и у всех пациентов доза глюкокортикоидов была снижена более чем на 50%. Из них 12 респондентов остались в полной ремиссии после периода наблюдения, без лечения или применения даже низких доз глюкокортикоидов. Никаких серьезных побочных эффектов не было, и авторы пришли к выводу, что ИГ являются безопасными и эффективными для долгосрочного лечения резистентного полимиозита.
К сожалению, при миозите с включениями отмечается лишь незначительное улучшение силы некоторых групп мышц. Этот вывод сделан на основании результатов двойного слепого рандомизированного исследования 22 пациентов, в котором не обнаружено значимых различий между лечением и плацебо-контролем через 3 мес, что указывает на то, что лечение миозита с включениями с помощью ИГ может иметь только незначительный эффект.
Европейский дерматологический форум и Европейская федерация неврологических обществ рекомендуют использовать ИГ при резистентном дерматомиозите в терапии второй линии или в качестве средства, позволяющего снизить дозу глюкокортикоидов, а при угрожающем жизни дерматомиозите – в качестве препаратов первой линии. Они также предлагают ИГ в терапии второй линии при полимиозите, если иммуносупрессивное лечение неэффективно. Европейская федерация неврологических обществ не рекомендует использование ИГ при миозите с включениями, в то время как Европейский дерматологический форум все же советует их применять, предлагая введение 2 г/кг за 2-5 дней в месяц на протяжении как минимум 6 мес, но, если улучшение не наблюдается, введение ИГ следует прекратить.
Аутоиммунная гемолитическая анемия при СКВ
Аутоиммунную гемолитическую анемию обнаруживают у 12% пациентов с СКВ. Анемия не так отчетливо реагирует на применение ИГ, как при ИТП. В одном из исследований было показано, что только у 40% пациентов после введения ИГ состояние улучшалось, что регистрировали при увеличении уровня гемоглобина на 20 г/л в течение 10 дней. Из тех, кто лучше всего ответил на ИГ, чаще были пациенты с гепатомегалией или с тяжелой анемией. Последние рекомендации по использованию ИГ позволяют предположить, что их можно использовать только в тяжелых случаях аутоиммунной гемолитической анемии, хотя фактические данные ограничиваются небольшим числом сообщений по этой теме. В одной из работ было установлено, что ИГ стабилизируют уровни гемоглобина у пациентов, резистентных к глюкокортикоидам (M.J. Wondergem et al., 2006). В другой же работе из 28 пациентов только у троих отмечено улучшение, притом преходящее (Е. Gomard-Mennesson et al., 2006). Таким образом, на сегодня имеется недостаточно доказательств, подтверждающих эффективность ИГ в лечении аутоиммунной гемолитической анемии при СКВ (табл. 3).
Использование ИГ при «серых» индикаторах
СКВ
В настоящее время чаще всего терапия ИГ при СКВ используется в качестве терапии «последней надежды» при наличии тяжелых органных проявлений волчанки, а положительные результаты показаны при нейропсихиатрическом люпусе, панникулите, иммунных цитопениях и тяжелом серозите. В последнее время с появлением биологических агентов отмечены случаи, когда моноклональные антитела были эффективны даже при отсутствии улучшения от ИГ. Хорошо известно, что положительные отчеты публикуют чаще, чем отрицательные, и поэтому результаты отчетов о случаях, когда ИГ используются в качестве последнего средства с успехом, следует интерпретировать с осторожностью.
Два клинических испытания протестировали эффективность ИГ при СКВ; кроме того, опубликованы четыре открытых и одно ретроспективное исследование. Эти исследования включили в общей сложности 150 пациентов. В последней работе исследовали реакцию беременных женщин с СКВ на введение ИГ в сравнении с применением только преднизолона и нестероидных противовоспалительных средств. Пациенты в группе лечения получали в общей сложности 11 инфузий ИГ (500 мг/кг каждые 3 нед до 33-й недели гестации). Активность волчанки во время лечения в исследуемой группе значительно снизилась (с 0,72 до 0,13), тогда как значительных изменений в контроле не было (с 0,88 до 0,66). Также не зарегистрированы серьезные побочные эффекты. Авторы пришли к заключению, что применение ИГ улучшает исход беременности и снижает активность СКВ.
Во всех неконтролируемых открытых испытаниях сообщается о положительных результатах от применения ИГ. На основании полученных результатов можно предположить, что ИГ может быть полезным при острых «вспышках» СКВ, причем наибольшая выгода наблюдается в наиболее тяжелых случаях. Показано, что введение ИГ способствует уменьшению усталости, лихорадки и болевых синдромов.
Наконец, Sherer и соавт. провели ретроспективное исследование с участием пациентов с СКВ, получавших ИГ. Симптоматика у больных была разнообразной: язвы слизистых оболочек, лихорадка, сыпи, плевриты и перикардиты. В ходе лечения применяли однократное введение ИГ в дозе 500 мг/кг. При этом отмечен очень хороший результат, свидетельствующий о выраженном противовоспалительном эффекте: индекс SLEDAI снизился в среднем с 15 до 5. В целом результаты этого испытания оказались весьма многообещающими, хотя, к сожалению, авторы не предоставили информации о точном режиме дозирования ИГ в каждом отдельном случае и о других методах лечения, которые пациенты получали одновременно с ИГ.
Антифосфолипидный синдром
АФС может приводить к ранним срывам беременности, мертворождениям или артериальным/венозным тромбозам. В мае 2012 года министерство здравоохранения Великобритании создало Национальную программу управления спросом (NDMP) и обновило клинические рекомендации, согласно которым больше не разрешено использование ИГ у беременных с АФС, хотя данный метод по-прежнему разрешен при катастрофическом АФС и инсульте.
Европейский форум по антифосфолипидным антителам создал Реестр случаев катастрофического АФС с целью помощи в разработке стратегий лечения. Реестр показал, что пациенты, получающие антикоагулянты, глюкокортикоиды, плазмаферез, препараты ИГ, имеют наилучшую выживаемость (75%), тогда как среди пациентов, принимающих только антикоагулянты и глюкокортикоиды, выживаемость составляет 20%. К сожалению, введение ИГ изредка сопровождается тромбоэмболиями (частота – до 2%). Большинству пациентов, у которых развивалась тромбоэмболия, назначали высокие дозы ИГ с быстрыми темпами введения, и они имели множество других факторов риска. Поэтому было высказано предположение, что большую дозу (2 г/кг) ИГ следует вводить в течение 5 дней и продолжительность каждой инфузии должна составлять минимум 8 ч, поскольку эти меры снижают риск развития тромбоэмболии.
ANCA-ассоциированные васкулиты
Гранулематоз с полиангиитом, микроскопический полиангиит и эозинофильный гранулематоз с полиангиитом (синдром Churg-Strauss) составляют группу ассоциированных с ANCA васкулитов. Индукцию ремиссии обычно проводят с помощью циклофосфамида в сочетании с высокими дозами глюкокортикоидов. Однако применение циклофосфамида ассоциируется с риском овариальной недостаточности и бесплодия, даже в случае курсового лечения. Ритуксимаб не уступает циклофосфамиду по частоте индукции ремиссии при лечении ANCA-ассоциированного васкулита (исследование RAVE).
Поддерживающая терапия обычно включает глюкокортикоиды, а также азатиоприн, метотрексат или лефлуномид.
В силу высокой токсичности перечисленных препаратов ИГ рассматривали среди альтернативных вариантов лечения.
В 1991 году Jayne и соавт. сообщили о положительных результатах применения ИГ у 7 пациентов с рефрактерностью к лечению, у которых на фоне применения ИГ симптомы улучшались в течение 2 дней – 3 нед. В другом открытом исследовании тех же авторов у 13 из 26 больных гранулематозом с полиангиитом была достигнута полная ремиссия, а у 13 из 26 – частичная ремиссия через 8 нед терапии, которая сохранялась на протяжении 12 мес после начала лечения.
Напротив, Richter и соавт. обнаружили, что только 6 из 15 пациентов частично ответили на ИГ через 4 нед, при этом ни у одного не было полной ремиссии. Тонкие различия между респондентами и не ответившими в этом исследовании привели авторов к гипотезе о том, что введение ИГ внутривенно может оказывать влияние на васкулит, но не на гранулематозный компонент заболевания. В первом исследовании, в котором изучали эффекты ИГ при персистирующем системном васкулите, был продемонстрирован значимый ответ через 3 мес, при этом снижение активности заболевания более чем на 50% отмечено у 14 из 17 пациентов.
Современное руководство Британского общества ревматологов и Британских специалистов здравоохранения в области ревматологии рекомендует рассматривать лечение ИГ при ANCA-ассоциированных васкулитах как альтернативную терапию у пациентов, рефрактерных к лечению, или у тех, кому стандартная терапия противопоказана, например, при наличии тяжелых инфекций, у тяжелобольных или во время беременности. Таким образом, ИГ может быть важной и безопасной «мост-терапией» при тяжелом активном васкулите с наличием выраженной иммуносупрессии.
Резюме показаний к применению ИГ при «серых» индикаторах можно найти в таблице 4.
«Черный» приоритет применения ИГ
В Великобритании NDMP не одобряет использование ИГ для лечения ревматоидного артрита и синдрома хронической усталости. Это связано с тем, что имеются достаточно эффективные методы лечения этих состояний, тогда как эффект ИГ не доказан. В случае ревматоидного артрита влияние ИГ на продукцию цитокинов противоречиво, а доказательства улучшения течения болезни основаны на неофициальных сообщениях. Аналогичным образом в 1990-е годы поначалу наблюдался определенный интерес к использованию ИГ в лечении синдрома хронической усталости, однако в 1997 году в хорошо спланированном двойном слепом рандомизированном исследовании у 99 пациентов не было установлено отчетливых преимуществ ИГ над плацебо (1% раствором альбумина).
Выводы
• Внутривенная иммунотерапия с применением концентрированных ИГ крови – перспективный метод лечения аутоиммунных заболеваний, которому, к сожалению, сегодня уделяется незаслуженно мало внимания. В то же время он может быть эффективным инструментом в арсенале современного ревматолога.
• Препараты ИГ высокоэффективны в лечении болезни Кавасаки, идиопатической тромбоцитопении, катастрофического АФС с высоким уровнем доказательств. Существуют также доказательства эффективности использования ИГ в качестве препаратов второй линии при дерматомиозите/полимиозите и «мост-терапии» при ANCA-ассоциированных васкулитах.
• Внутривенная иммунотерапия эффективна в некоторых подгруппах пациентов с СКВ, особенно во время обострения болезни.
• Общий профиль безопасности ИГ очень хороший, и в литературе описаны лишь нетяжелые трансфузионные реакции. Тем не менее в ревматологической практике следует учитывать возможность повышенного риска развития тромбоэмболий, который составляет менее 2% при применении ИГ в высоких дозах. Эффективным методом профилактики тромбоэмболических осложнений является медленная инфузия ИГ с наименьшей доступной концентрацией.
• Учитывая особую важность хорошей переносимости внутривенных ИГ, стоит отметить наличие в Украине высокоочищенного поливалентного IgG-содержащего ИГ для внутривенного введения (препарат Октагам компании Octapharma, Швейцария). Хорошая переносимость препарата Октагам была доказана в ходе 11-летнего проспективного наблюдательного исследования.
• Кроме того, для препарата Октагам характерны высокая максимально допустимая скорость введения (0,08 мл/кг/мин), высокий уровень вирусной безопасности и удобные условия хранения (от +2 до +25 °C).
• Существует очевидная необходимость в дальнейшем изучении эффектов внутривенной иммунотерапии при различных ревматических заболеваниях.
Список литературы находится в редакции.