1 травня, 2017
Остеопороз в практике семейного врача
Остеопороз (ОП) – это прогрессирующее системное дегенеративно-метаболическое заболевание скелета, характеризующееся снижением прочности, массы и нарушением микроархитектоники костной ткани, что приводит к увеличению хрупкости кости и повышенному риску переломов. При этом заболевание никак себя не проявляет до первого перелома, а наиболее тяжелые осложнения ОП (переломы позвонков и шейки бедра) ассоциируются с повышенным риском летального исхода.
Прогредиентное увеличение численности населения с преобладанием женской популяции, старение с одновременным удлинением периода инволютивного дефицита половых гормонов, а также непростые современные реалии способствуют усугублению социально-экономических последствий ОП.
В итоговом докладе Международного комитета остеопороза (IOF, 2016) подчеркивается, что в ближайшие 40 лет проблема ОП и связанных с ним переломов будет особенно актуальной для стран с невысоким уровнем дохода, поэтому национальные правительства, специалисты и общественные организации должны иметь возможность получения адекватной эпидемиологической информации, которая ляжет в основу принятия решений в этих странах. Кроме того, в отличие от других хронических неинфекционных заболеваний на проблемах ОП сосредоточено значительно меньше внимания со стороны медицинских работников и госструктур. Поэтому во всех странах профилактика ОП и низкоэнергетических переломов уже сегодня должна стать одним из приоритетов национальной политики в сфере здравоохранения, поскольку через 10 и более лет социально-экономические потери вследствие ОП станут неконтролируемыми.
По данным ВОЗ, ОП занимает 4-е место среди неинфекционных заболеваний после патологии сердечно-сосудистой системы (ССС), онкопатологии и сахарного диабета (СД). Эксперты IOF оценивают распространенность ОП согласно простой формуле «каждая 3-я женщина и каждый 5-й мужчина старше 50 лет». Установлено, что каждые три секунды в мире происходит один остеопоротический перелом; у женщин риск перелома бедра превышает суммарный риск возникновения рака молочной железы, яичников и матки, а у мужчин – рака предстательной железы. Примерно у 50% людей, перенесших один остеопоротический перелом, в будущем случится второй, а риск последующих переломов возрастает экспоненциально. Все эти факты позволяют говорить о «молчаливой эпидемии» ОП.
Для Украины в последние десятилетия из-за резкого увеличения числа людей пожилого и старческого возраста, в т. ч. женщин, пребывающих в периоде постменопаузы, проблема ОП начинает приобретать все более угрожающие масштабы. По данным президента Украинской ассоциации остеопороза профессора В. В. Поворознюка:
- каждый 2-й взрослый житель нашей страны имеет остеопению, а каждый 4-й – ОП;
- инволютивный ОП, связанный с менопаузой, развивается у почти 50% женщин; риск развития переломов у женщин старше 50 лет составляет 39,7%;
- у украинских женщин 50-59 лет минеральная плотность костной ткани на уровне позвоночника и бедренной кости ниже таковой у женщин США и европейских стран, что можно объяснить недостаточной профилактикой в нашей стране потери костной ткани у женщин в пре- и постменопаузе;
- смертность среди пациентов с остеопоротическими переломами бедра составляет 18,6%, при этом 47% из них умирают в течение первых 6 мес после возникновения перелома;
- в силу сложившихся климатических и некоторых других особенностей развития южных и западных регионов риск остеопоротических переломов у жителей этих областей наиболее высок.
Статистические данные касаются в основном популяции в возрасте 50 лет и старше. Однако потеря костной массы начинается гораздо раньше. Максимальный (пиковый) ее показатель достигается в среднем – к 25 годам. При этом скелетная масса определяется целым рядом факторов онтогенеза, которые реализуются в процессе роста человека: генетическая программа, гормональный статус, характер питания, механическая нагрузка на скелет. Достигнутая в процессе роста костная масса имеет резервное значение, определяя в дальнейшем устойчивость и склонность к переломам. По достижении пика показатель костной массы сохраняется несколько лет (эффект плато). Затем, после 35 лет у женщин и после 40 – у мужчин, происходит ассоциированное с возрастом постепенное снижение костной массы – инволютивный ОП. Следует иметь в виду, что у женщин в первые 5 лет менопаузы вследствие исчезновения остеотропного влияния эстрогенов потеря костной массы резко ускоряется. К 65-70 годам она снижается, составляя в среднем 0,3-0,5% в год, и к 80 годам костная ткань уменьшается на ≥30% (Nicander R. et al., 2010). У мужчин продукция андрогенов сохраняется до глубокой старости, поэтому инволютивный ОП у них встречается реже.
 В норме костный метаболизм является сбалансированным процессом, на который, тем не менее, влияют различные экзо- и эндогенные факторы, приводящие к его нарушениям. Факторы риска ОП делятся на модифицируемые (условно контролируемые) и немодифицируемые (табл. 1).
В норме костный метаболизм является сбалансированным процессом, на который, тем не менее, влияют различные экзо- и эндогенные факторы, приводящие к его нарушениям. Факторы риска ОП делятся на модифицируемые (условно контролируемые) и немодифицируемые (табл. 1).
Что касается семейного анамнеза, то значение имеет наличие остеопороза и/или низкоэнергетических (вследствие действия минимальной травмирующей силы) переломов у родственников старше 50 лет.
У пожилых лиц, как правило, имеется сочетание нескольких этиологических факторов ОП. Склонность к падениям эксперты IOF (2016) рассматривают как независимый фактор риска переломов при ОП.
В последние годы к модифицируемым факторам риска развития ОП (особенно у женщин) добавились так называемые современные причины, обусловленные массовой культурой потребления и «модными» предпочтениями: несбалансированные диеты и экстремальное похудение; высококалорийное питание с большим количеством рафинированных продуктов и низким содержанием микронутриентов (особенно Са). При этом специалисты акцентируют, что риск развития ОП особенно высок у рослых женщин худощавого телосложения.
В основе патогенеза ОП лежат следующие процессы:
- нарушение равновесия между синтезом и резорбцией костного вещества;
- снижение ремоделирования кости, сопровождающееся деминерализацией костной ткани с нарушениями ее микроархитектоники: истончение и/или потеря костных пластинок;
- уменьшение толщины компактного и разрежение губчатого вещества. Эти патологические изменения приводят к снижению устойчивости кости к механическому воздействию и нагрузкам, повышению хрупкости костной ткани и более высокому риску низкоэнергетических переломов.
В клинической практике используется классификация ОП, основанная на этиопатогенетических факторах:
- тип I (первичный, менопаузальный) развивается у женщин в менопаузе;
- тип II (сенильный) встречается с одинаковой частотой у женщин и мужчин старше 70 лет;
- идиопатический ювенильный;
- вторичный – как осложение многих тяжелых хронических заболеваний, сопровождающихся дефицитом Са, нарушением его всасывания и усиленным выведением из организма (эндокринная патология, ревматические болезни, заболевания желудочно-кишечного тракта, болезни почек, органов дыхания и ССС, онкопатология).
Клинические проявления ОП практически отсутствуют вплоть до появления переломов, которые являются лишь «верхушкой айсберга». Основные проявления неосложненного ОП – повышенная утомляемость, общая слабость и паравертебральные боли. Многие пациенты (и некоторые врачи) ассоциируют ОП с артритом, однако это коморбидные заболевания, часто развивающиеся одновременно.
Для ОП характерными являются низкоэнергетические компрессионные переломы позвонков, дистального отдела лучевой кости и проксимального отдела бедра. Компрессионные переломы позвонков манифестируют острыми, а затем хроническими болями в спине, при этом выраженность компрессии не коррелирует с интенсивностью боли; до 60% женщин с такими переломами не подозревают о них и болей практически не ощущают. Очевидными признаками в данном случае являются грудной кифоз и уменьшение роста.
Учитывая, что перелом является основным неблагоприятным клиническим исходом при ОП, способность определить вероятность его наступления имеет большое практическое значение.
Для удобства скрининга в рутинной клинической практике рекомендуется использовать разработанный ВОЗ (2008) метод оценки риска переломов FRAX, основанный на индивидуальной для каждого человека модели, включающей клинические факторы риска и МПКТ в шейке бедра.
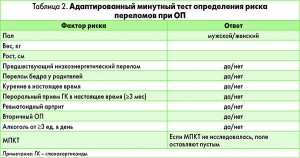 Результатом подсчета является 10-летняя вероятность основных остеопоротических переломов (табл. 2).
Результатом подсчета является 10-летняя вероятность основных остеопоротических переломов (табл. 2).
Если выявлено ≥2 фактора, вероятность переломов в любом возрасте возрастает на ≥30%. Сочетание нескольких факторов риска имеет кумулятивный эффект. Выявление хотя бы одного фактора риска в доклиническом периоде является показанием для проведения костной денситометрии – основного метода инструментальной диагностики, позволяющего определить МПКТ.
В настоящее время золотым стандартом определения МПКТ является биэнергетическая рентгеновская абсорбциометрия (DXA); для мониторинга МПКТ при фармакотерапии ОП используется центральная DXA бедра или позвоночника.
Диагностическими критериями считаются два показателя:
- Т-индекс – отклонение от нормы, соответствующей пику костной массы здорового взрослого, у пациентов в возрасте старше 50 лет;
- Z-индекс – отклонение МПКТ от среднестатистической возрастной нормы у детей и взрослых пациентов в возрасте до 50 лет.
Согласно рекомендациям ВОЗ значение Т-индекса в пределах от -1 до -2,5 стандартных отклонений свидетельствует об остеопении, более -2,5 – о наличии ОП.
Костная денситометрия является единственным надежным методом ранней диагностики ОП (1-2% потери костной массы) в отличие от рентгенографического обследования (30% потери костной массы).
Несмотря на диагностическую и прогностическую ценность костной денситометрии, массовый скрининг экономически не оправдан. Кроме того, в Украине нет достаточного количества денситометров и доступа к ним пациентов в различных регионах. Дополнительными методами оценки состояния костной ткани являются: количественная компьютерная томография (ККТ), количественная ультразвуковая денситометрия, определение биохимических маркеров костного метаболизма (кальций и фосфор, витамин D сыворотки крови, щелочная фосфатаза, клиренс креатинина, тестостерон (у мужчин), маркеры резорбции, маркеры новообразования и др.).
Учитывая особенности диагностики ОП, в клинической практике большое значение имеет оценка риска переломов по алгоритму FRAX. По своей прогностической значимости выявление факторов риска ОП равно измерению артериального давления для прогнозирования коронарных и церебральных катастроф, поэтому должно стать для семейного врача таким же рутинным.
Так как остеопения наблюдается при большом количестве состояний и развивается постепенно, в рекомендациях IOF (2016) предложена пошаговая стратегия профилактики и лечения ОП:
- Здоровое питание для костей (ежедневное употребление Са в дозе 1200 мг/сут, витамина D 400-800 МЕ/сут, а для лиц старше 60 лет – 800-1000 МЕ/сут и белка в количестве 1,5 г на 1 кг веса).
- Регулярные физические упражнения (индивидуальные нагрузки соответственно возрасту, имеющимся заболеваниям, при необходимости – под наблюдением специалистов).
- Обращение к врачу для прохождения минутного теста и выявления факторов риска ОП.
- Модификация образа жизни и избавление от вредных привычек.
- При выявлении ОП и назначении лечения продолжать прием препаратов согласно рекомендациям врача.
Патогенетическая терапия ОП включает препараты Са, витамин D и антирезорбтивные препараты.
Особое место в патогенетической терапии и профилактике ОП занимают препараты Са, которые:
- назначают в качестве базисной терапии всем пациентам с ОП независимо от его этиологии и приема антиостеопоротических препаратов;
- повышают эффективность антирезорбтивных препаратов в комплексном лечении ОП (изолированная антирезорбтивная терапия вызывает гипокальциемию).
Усвоение Са является недостаточным в любом возрасте, а суточная потребность в этом минерале значительно выше, чем могут предложить современные диеты (Heaney R. P. et al., 2000). В Украине потребление Са составляет около 600 мг/сут, или 42% от нормы (Поворознюк В. В. и соавт., 2002).
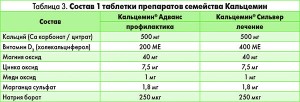
Для профилактики и лечения ОП (независимо от его этиологии), а также остеопении в нашей стране успешно используются препараты Кальцемин® Адванс и Кальцемин® Сильвер (Bayer, Германия).
 Одним из преимуществ препаратов семейства Кальцемин является то, что Са карбонат является солью с наибольшим содержанием кальция; Са цитрат повышает бидоступность препарата. Кроме того, Са цитрат тормозит секрецию паратиреоидного гормона, в результате чего антирезорбтивное действие препаратов Кальцемин® Адванс и Кальцемин® Сильвер усиливается. Длительный прием Са цитрата снижает степень риска развития нефролитиаза, так как камнеобразование в почках – это дозозависимый процесс.
Одним из преимуществ препаратов семейства Кальцемин является то, что Са карбонат является солью с наибольшим содержанием кальция; Са цитрат повышает бидоступность препарата. Кроме того, Са цитрат тормозит секрецию паратиреоидного гормона, в результате чего антирезорбтивное действие препаратов Кальцемин® Адванс и Кальцемин® Сильвер усиливается. Длительный прием Са цитрата снижает степень риска развития нефролитиаза, так как камнеобразование в почках – это дозозависимый процесс.
Согласно классификации профессора В. В. Поворознюка комплексы Са, витамина D и микроэлементов относятся к препаратам Са третьего поколения, так как включение этих веществ потенцирует благоприятные эффекты Са и положительно влияет на метаболизм костной и хрящевой ткани (табл. 4).
Включение витамина D3 и микроэлементов в состав препаратов Кальцемин® Адванс (дети с 12 лет и взрослые до 50 лет) и Кальцемин® Сильвер (пациенты старше 50 лет) позволяет значительно расширить сферу их применения:
- снижение темпов остеопении, коррекция нарушений обмена Са, профилактика остеопоротических переломов у лиц старше 50 лет;
- лечение патологии и травм опорно-двигательного аппарата, болезней зубов;
- как базисное средство при антирезорбтивной терапии ОП;
- профилактика ОП на фоне длительной терапии ГК и комплексного лечения состояний, сопровождающихся системной остеопенией;
- в составе комплексной терапии у пациентов с поражением опорно-двигательного аппарата.
Клиническая эффективность и широкий профиль безопасности комбинированных препаратов Кальцемин® Адванс и Кальцемин® Сильвер позволяют семейному врачу использовать их для профилактики и лечения ОП разной этиологии, а также в комплексной терапии при патологии опорно-двигательного аппарата.
Подготовила Наталия Позднякова
Медична газета «Здоров’я України 21 сторіччя» № 7 (404), квітень 2017 р.