10 травня, 2017
ЕССО 2017: новые достижения колопроктологии

 15-18 февраля в Барселоне состоялся 12-й конгресс ЕССО, посвященный воспалительным заболеваниям кишечника (ВЗК) – неспецифическому язвенному колиту (НЯК) и болезни Крона (БК). В этом году организаторы приняли рекордное количество научных публикаций – всего было подано 1203 и принято 922 абстракта. Предлагаем ознакомиться с наиболее интересными докладами, прозвучавшими на конгрессе и представленными на сайте ЕССО: www.ecco-ibd.eu.
15-18 февраля в Барселоне состоялся 12-й конгресс ЕССО, посвященный воспалительным заболеваниям кишечника (ВЗК) – неспецифическому язвенному колиту (НЯК) и болезни Крона (БК). В этом году организаторы приняли рекордное количество научных публикаций – всего было подано 1203 и принято 922 абстракта. Предлагаем ознакомиться с наиболее интересными докладами, прозвучавшими на конгрессе и представленными на сайте ЕССО: www.ecco-ibd.eu.
Эпигенетические маркеры для диагностики неоплазии при НЯК: результаты исследования I фазы ENDCAP-C
Хронический воспалительный процесс, сопровождающий НЯК, провоцирует появление про-неопластических изменений в толстом кишечнике, что сопряжено со значительным увеличением риска возникновения инвазивных опухолей по сравнению с общей популяцией. Несмотря на существующие стандарты эндоскопического динамического наблюдения, в 50% случаев выявляют инвазивный рак вместо обнаружения первых признаков неоплазии. В работах различных авторов зафиксирована взаимосвязь между эпигенетическими изменениями (в виде метилирования) в генах, задействованных в сигнальном пути Wnt (sFRP1, sFRP2, WIF‑1 и др.), и возникновением неоплазии толстого кишечника у пациентов с НЯК.
ENDCAP-C – это обсервационное многоцентровое исследование, проведенное в два этапа. I фаза исследования была посвящена изучению прогностической значимости целого ряда маркеров в ретроспективной когорте больных НЯК для определения целесообразности их последующего использования во II фазе – в проспективном клиническом исследовании.
Биоптаты толстого кишечника получали у всех больных НЯК во время эндоскопического динамического наблюдения. В зависимости от результатов гистологического исследования биоптатов пациентов классифицировали на имеющих «неоплазию» (любой вид аденокарциномы, дисплазия легкой/высокой степени) или «не-неопластические изменения» (участки неизмененной слизистой, расположенные ниже неопластического поражения). Больных с неизмененной слизистой оболочкой с/без признаков хронического воспаления, у которых в ходе обследования не было выявлено неопластическое поражение толстого кишечника, включили в состав контрольной группы. ДНК, выделенную из биоптатов, затем подвергали бисульфитному пиросеквенированию для обнаружения 11 маркерных генов (SFRP1, SFRP2, SRP4, SRP5, WIF1, TUBB6, SOX7, APC1A, APC2, MINT1, RUNX3).
В общей сложности было получено 569 блоков, из них 113 – с признаками неоплазии, 113 – с не-неопластическими изменениями и 343 контрольных образца. Структурный анализ неоплазий выявил преобладание диспластических изменений (78/113) над аденокарциноматозным перерождением (35/113). Эффективность определения маркерных генов составила >90% (за исключением генов SFRP1, MINT1 и RUNX3, которые не использовались в дальнейшей работе). По данным однофакторного анализа, пять маркерных генов – SFRP2, SFRP4, WIF1, APC1A и APC2 – точно определяли как наличие дисплазии (р<0,0001), так и неоплазии (р<0,0001).
Многофакторный логистический анализ доказал, что прогностическая модель, основанная на определении пяти указанных генов, обладает высокой диагностической точностью (AUC=0,87, 95% ДИ 0,82-0,92; p<0,0001).
Таким образом, метилирование пяти маркерных генов достаточно точно прогнозирует вероятность развития дисплазии и неоплазии у больных НЯК. Определение указанных генов позволит повысить эффективность динамического наблюдения за больными НЯК во II фазе этого исследования.
Абстракт ОР002, Т. Iqbal и соавт. (Великобритания)
Высокий риск острых артериальных событий у молодых пациентов с тяжелым течением ВЗК: национальное французское когортное исследование
Независимые факторы риска острых артериальных событий (ОАС) у больных ВЗК еще окончательно не определены; группа ученых под руководством J. Kirchgesner внесла свой вклад в исследование этой проблемы.
Исследователи изучили французскую национальную базу данных выписных эпикризов за 2008-2013 гг. и отобрали пациентов ≥15 лет с подтвержденным диагнозом ВЗК. Ученые проанализировали распространенность ОАС, наличие кардиоваскулярных факторов риска (гипертония, гиперлипидемия, сахарный диабет, ожирение, курение, алкоголизм), перенесенные хирургические вмешательства, частоту повторных госпитализаций, спровоцированных ВЗК. Под ОАС понимали ишемическую болезнь сердца (ИБС), цереброваскулярную патологию, заболевания периферических артерий, острую мезентериальную ишемию. Исследователи рассчитали частоту возникновения первого ОАС у больных ВЗК, установили ожидаемую заболеваемость в каждом регионе, определили гендерные и возрастные особенности по сравнению с основной популяцией.
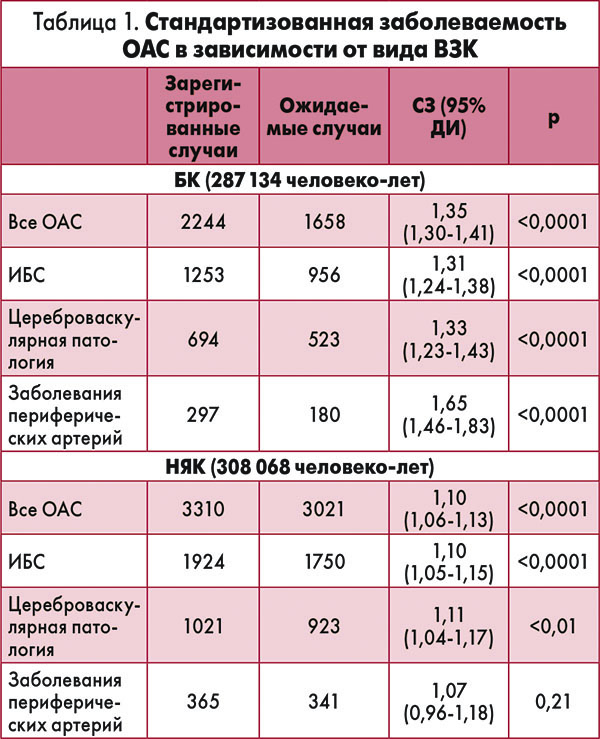 В исследование было включено 210 162 пациента с ВЗК (из них с БК – 97 708 человек; с НЯК – 112 454 больных). На протяжении 595 202 человеко-лет диспансерного наблюдения у 5554 больных ВЗК развились ОАС (11,9%). Высокий риск возникновения ОАС зафиксирован как у пациентов с БК (стандартизованная заболеваемость (СЗ) 1,35; 95% ДИ 1,30-1,41), так и у больных НЯК (СЗ 1,10; 95% ДИ 1,06-1,13) (табл. 1).
В исследование было включено 210 162 пациента с ВЗК (из них с БК – 97 708 человек; с НЯК – 112 454 больных). На протяжении 595 202 человеко-лет диспансерного наблюдения у 5554 больных ВЗК развились ОАС (11,9%). Высокий риск возникновения ОАС зафиксирован как у пациентов с БК (стандартизованная заболеваемость (СЗ) 1,35; 95% ДИ 1,30-1,41), так и у больных НЯК (СЗ 1,10; 95% ДИ 1,06-1,13) (табл. 1).
Высокая вероятность развития ОАС зафиксирована у пациентов <35 лет, больных БК (СЗ 1,42; 95% ДИ 1,09-1,75) и НЯК (СЗ 1,65; 95% ДИ 1,20-2,10). На протяжении последующего периода динамического наблюдения госпитализировано 22% больных БК и 13% пациентов с НЯК по причине усиления симптомов заболевания. Сделав поправку на наличие основных кардиоваскулярных факторов риска, ученые установили, что 3-месячный период до и после ВЗК-индуцированной госпитализации ассоциирован с высокой вероятностью развития ОАС у больных БК (отношение рисков (ОР) 1,77; 95% ДИ 1,47-2,12) и НЯК (ОР 1,87; 95% ДИ 1,58-2,22) по сравнению с другими периодами жизни.
На основании полученных данных ученые сделали вывод, что больным ВЗК свойственен высокий риск развития ОАС, при этом молодые пациенты более подвержены данным осложнениям.
Абстракт ОР003, J. Kirchgesner и соавт. (Франция)
Многоцентровое двойное слепое рандомизированное плацебо-контролированное исследование по изучению эффективности ректальной формы такролимуса в лечении резистентного язвенного проктита
 Резистентный язвенный проктит трудно поддается лечению; I. C. Lawrance и соавт. предположили, что для коррекции трудноизлечимых форм проктита можно использовать топический такролимус.
Резистентный язвенный проктит трудно поддается лечению; I. C. Lawrance и соавт. предположили, что для коррекции трудноизлечимых форм проктита можно использовать топический такролимус.
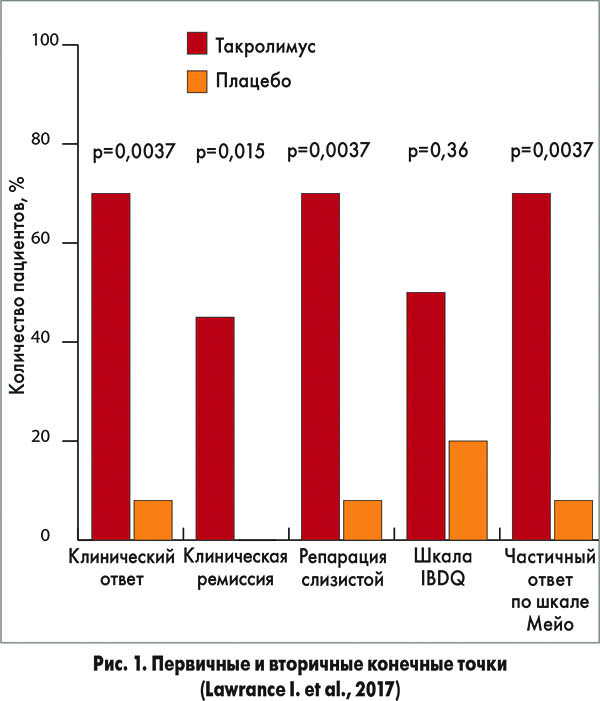
В этом рандомизированном двойном слепом плацебо-контролированном исследовании приняли участие больные с активным язвенным проктитом, которых рандомизировали для ректального введения такролимуса (0,5 мг/мл; n=11) или плацебо (n=10) на протяжении 8 недель. Первичной конечной точкой являлся клинический ответ, который оценивали при помощи шкалы клиники Мейо.
Промежуточный анализ, проведенный после того, как первые 20 пациентов завершили исследование, зафиксировал статистически значимые межгрупповые различия, поэтому исследование было завершено досрочно по этическим соображениям. Анализ данных участников, уже набранных в исследование, позволил получить следующие результаты. Первичной конечной точки достигли 8/11 (73%) пациентов, получавших ректальную форму такролимуса, и 1/10 (10%) больных, принимавших плацебо (р=0,004). Клинической ремиссии достигли 5 (45%) участников основной группы, в группе плацебо таких пациентов не было (р=0,015) (рис. 1).
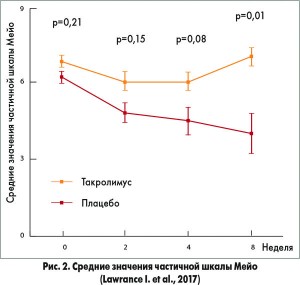 Полная репарация слизистой оболочки прямой кишки к 8-й неделе лечения зафиксирована у 8 (73%) пациентов, получавших ректальную форму такролимуса, и у 1 (10%) больного, принимавшего плацебо (р=0,004). Рост значений шкалы IBDQ на ≥16 баллов по сравнению с исходными показателями отмечен у 5 (45%) участников основной группы и 2 (20%) пациентов контрольной группы (р=0,36). Средние значения шкалы клиники Мейо у пациентов, принимавших такролимус, недостоверно отличались от аналогичного показателя у больных, получавших плацебо, после 2-й (соответственно 4,3±0,74 vs 5,8±0,64; р=0,15) и 4-й недели терапии (соответственно 3,7±0,96 vs 5,8±0,6; р=0,08). Однако после завершения 8-й недели лечения межгрупповые различия становились статистически значимыми (соответственно 3,3±1,2 vs 6,7±0,62; р=0,01) (рис. 2). Исследователи отметили хорошую переносимость ректальной формы такролимуса.
Полная репарация слизистой оболочки прямой кишки к 8-й неделе лечения зафиксирована у 8 (73%) пациентов, получавших ректальную форму такролимуса, и у 1 (10%) больного, принимавшего плацебо (р=0,004). Рост значений шкалы IBDQ на ≥16 баллов по сравнению с исходными показателями отмечен у 5 (45%) участников основной группы и 2 (20%) пациентов контрольной группы (р=0,36). Средние значения шкалы клиники Мейо у пациентов, принимавших такролимус, недостоверно отличались от аналогичного показателя у больных, получавших плацебо, после 2-й (соответственно 4,3±0,74 vs 5,8±0,64; р=0,15) и 4-й недели терапии (соответственно 3,7±0,96 vs 5,8±0,6; р=0,08). Однако после завершения 8-й недели лечения межгрупповые различия становились статистически значимыми (соответственно 3,3±1,2 vs 6,7±0,62; р=0,01) (рис. 2). Исследователи отметили хорошую переносимость ректальной формы такролимуса.
Таким образом, ректальная форма такролимуса превосходит плацебо в достижении клинического ответа, клинической ремиссии и репарации слизистой оболочки прямой кишки у больных резистентным язвенным проктитом.
Абстракт ОР007, I. Lawrance и соавт. (Австралия)
Инновационное лечение рефрактерных перианальных фистул при БК: локальные микроинъекции аутологичной жировой ткани и стромальной сосудистой фракции, полученной из адипоцитарной ткани
Мезенхимальная клеточная терапия является перспективным методом лечения перианальных фистул при БК, рефрактерных к традиционной терапии. Стромальная сосудистая фракция, полученная из аутологической жировой ткани (ССФАЖ), является легкодоступным источником клеток с ангиогенными, противовоспалительными, иммуномодуляторными и регенеративными свойствами. Пилотное исследование ADICROHN основано на инновационной гипотезе, заключающейся в том, что комбинированное действие ССФАЖ, связанное с трофическими характеристиками микроинъекций жировой ткани, может оказать благотворное влияние на состояние пациентов с БК и рефрактерными перианальными фистулами.
В этом проспективном открытом несравнительном одноцентровом клиническом исследовании I-II фазы приняли участие больные в возрасте ≥18 лет со сложными перианальными фистулами, ассоциированными с БК и существующими на протяжении ≥6 мес, а также с контролированным течением внутриполостного заболевания (индекс CDAI <220 баллов). В соответствии с дизайном исследования ученые планировали обследовать 10 пациентов. Первоначально всех больных подвергали клиническому осмотру с использованием анестезиологического пособия: проводили осмотр фистулы, дренирование с проведением лигатуры (при наличии показаний); спустя 7 дней выполняли экстракцию жировой ткани, получали ССФАЖ и вводили микрообразцы адипоцитарной ткани в фистулу. Динамическое наблюдение за состоянием пациентов осуществляли на 1, 2, 6, 12, 16 и 48-й неделе после инъекции с целью изучения безопасности и эффективности проведенного лечения. Безопасность терапии оценивали на каждом визите посредством оценки клинического состояния и обнаружения нежелательных явлений. Анализ эффективности лечения проводили, учитывая степень закрытия фистулы, активность заболевания (соотношение индекса активности перианального заболевания (PDAI) к индексу активности БК – PDAI/CDAI), качество жизни (краткий опросник при ВЗК – SIBDQ). Закрытие фистулы также оценивали при помощи магнитно-резонансной томографии (МРТ, отсутствие скоплений контрастного вещества >2 см в области обработанной перианальной фистулы) на 12-й и 48-й неделе.
С октября 2015 г. 9 пациентам было проведено это инновационное местное лечение (в мягкие ткани вокруг фистулы последовательно введено приблизительно 10 см3 микрожира и около 30 млн жизнеспособных клеток ССФАЖ). Авторы исследования не зафиксировали каких-либо серьезных нежелательных явлений, отметив только одно побочное явление – боль умеренной интенсивности в месте аспирации жировой ткани. Предварительный анализ эффективности 12-недельного лечения (n=7) подтвердил преимущества использованного метода: микроинъекции ССФАЖ способствовали достижению клинического ответа (71%), полной репарации слизистой (28%), значительному уменьшению количества отделяемого (р<0,001), снижению тяжести перианального поражения (р=0,045) и улучшению качества жизни (р=0,039).
В этом исследовании впервые изучалась эффективность местного комбинированного лечения ССФАЖ и трансплантации адипоцитарной ткани; авторы исследования считают данный метод простым, безопасным и эффективным способом хирургической регенеративной терапии перианальных фистул, рефрактерных к традиционному лечению.
Абстракт ОР008, М. Serrero и соавт. (Франция)
Долгосрочная эффективность и безопасность Сх601 (аллогенных мезенхимальных стволовых клеток, полученных из жировой ткани) в лечении сложных перианальных фистул при БК: результаты рандомизированного контролированного 52-недельного исследования III фазы
Существующие методы лечения перианальных фистул при БК часто оказываются недостаточно эффективными; результативность только некоторых из них была оценена в рандомизированных контролированных исследованиях (РКИ) с использованием жестких контрольных точек. Результаты 24-недельного РКИ убедительно доказали, что применение Сх601 в сочетании со стандартной терапией является безопасным и эффективным способом лечения сложных перианальных фистул. В данном исследовании изучалась эффективность и безопасность более длительного применения указанного препарата.
В двойном слепом многоцентровом исследовании III фазы в параллельных группах приняли участие пациенты с неактивным/легким течением полостной БК и сложными перианальными фистулами, рефрактерными к лечению; больных впоследствии рандомизировали в соотношении 1:1 для введения Сх601 (однократной инъекции 120 млн аллогенных мезенхимальных стволовых клеток, полученных из жировой ткани) или плацебо в сочетании со стандартной терапией. Лечебные манипуляции проводил хирург без использования слепого метода, результативность терапии оценивал гастроэнтеролог с использованием слепого метода. Эффективность лечения оценивали через 52 недели в модифицированной ITT-популяции (когорте больных, прошедших рандомизацию, полный курс лечения, как минимум 1 оценку эффективности по сравнению с исходными данными). Конечными точками являлись: комбинированная ремиссия (закрытие всех обработанных наружных отверстий фистул, которые на момент первоначального клинического осмотра содержали отделяемое; при анализе результатов МРТ с использованием слепого метода – отсутствие скоплений контраста >2 см в области пролеченных перианальных фистул) и клиническая ремиссия (закрытие всех обработанных наружных отверстий фистул). Оценивали также достижение устойчивой комбинированной ремиссии к 52-й неделе терапии.
В исследовании приняли участие 212 пациентов, которых рандомизировали для введения Сх601 (n=107) или плацебо (n=105). 61,8% участников завершили 52-недельное исследование (в группе Сх601 – 70 больных; в контрольной группе – 61 пациент). Спустя 24 недели после лечения исследователи зафиксировали выраженную положительную динамику (комбинированной ремиссии в группе Сх601 достигли 51,5% больных, в контрольной группе – 35,6% пациентов; р=0,021), которая сохранялась вплоть до 52-й недели. Введение Сх601 было ассоциировано с большей вероятностью достижения комбинированной (56,3% vs 38,6%; р=0,01) и клинической ремиссии (59,2% vs 41,6%; р=0,013) к 52-й неделе по сравнению с плацебо. Пациенты, достигшие комбинированной ремиссии к 24-й неделе на фоне приема Сх601, реже страдали от рецидивов заболевания к 52-й неделе по сравнению с контролем (75,0% vs 55,9%). Частота возникновения побочных эффектов, ассоциированных с проведенным лечением, была сопоставима в основной (20,4%) и контрольной (26,5%) группах.
Эффективность Сх601 в лечении сложных перианальных фистул при БК сохраняется в течение 1 года после однократного введения препарата; Сх601 имеет хороший профиль переносимости и безопасности.
Абстракт ОР009, J. Panes и соавт. (Испания)
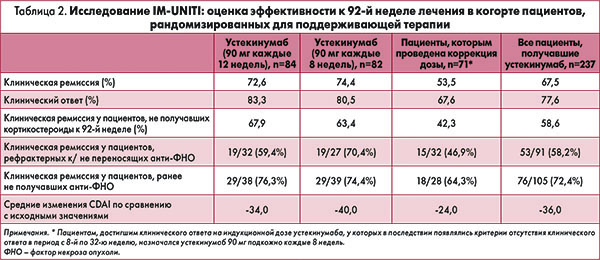
Долгосрочная эффективность и безопасность устекинумаба в лечении БК: результаты дополнительного 2-летнего наблюдения в исследовании IM-UNITI
Устекинумаб является полностью человеческим гуманизированным моноклональным антителом класса IgG1 mAB к человеческому интерлейкину 12/23р40; препарат одобрен FDA для лечения среднетяжелого/тяжелого течения БК. Дополнительное исследование IM-UNITI изучало эффективность и безопасность подкожного введения устекинумаба в качестве поддерживающего лечения.
Количество пациентов, привлеченных в исследование поддерживающей терапии, составило 1281, включая 397 больных, ответивших на индукционную терапию устекинумабом в первичной популяции. Пациентов рандомизировали на три равные группы: в первой устекинумаб назначался в дозе 90 мг подкожно каждые 8 недель (n=132), во второй – 90 мг каждые 12 недель (n=132), в третьей – плацебо (n=133). Если у пациентов появлялись критерии отсутствия клинического ответа в период с 8-й по 32-ю неделю, то производилась коррекция терапевтической схемы (устекинумаб назначался в дозе 90 мг каждые 8 недель). Рандомизации не подлежали: пациенты, ответившие на индукционную терапию плацебо и продолжающие получать плацебо; больные, не ответившие на индукционную терапию плацебо и получившие одну дозу устекинумаба внутривенно (130 мг), а затем подкожно (90 мг каждые 12 недель), если клинический ответ был достигнут к 8-й неделе; участники, не ответившие на индукционную терапию устекинумабом (90 мг подкожно). Все пациенты, которые завершили 44-ю неделю лечения достижением клинического ответа, могли продолжать участвовать в исследовании и получать терапию, аналогичную таковой на 44-й неделе. Таким образом, в исследовании приняли участие 567 пациентов, принимавших устекинумаб, из них 237 участника входили в состав первичной популяции. Пациенты, получавшие плацебо, были выведены из исследования после объявления его результатов, которое имело место на 44-й неделе.
В таблице 2 представлены результаты лечения рандомизированных пациентов.
На основании анализа данных в когорте рандомизированных пациентов, продолжавших получать устекинумаб вплоть до 96-й недели, ученые установили, что ремиссии достигли 79,2% больных, принимавших препарат каждые 12 недель, и 87,1% участников, получавших устекинумаб каждые 8 недель (не нуждавшиеся в коррекции дозы). К 92-й неделе клинического ответа достигли соответственно 90,9% и 94,3% пациентов, принимавших препарат каждые 12 и 8 недель. Среди всех пациентов, получавших устекинумаб, поддерживающая терапия этим иммунодепрессантом вплоть до 96-й недели способствовала достижению клинической ремиссии у 70,7% больных, клинического ответа – у 84,7% пациентов.
Количество побочных эффектов на фоне приема устекинумаба с 44-й по 96-ю неделю не превышало таковое при применении плацебо, включая общие нежелательные явления (82,9 vs 91 соответственно), серьезные нежелательные явления (14,16 vs 18,2), тяжелые инфекции (3,73 vs 4,33). В когорте пациентов, получавших устекинумаб, зафиксировано 2 летальных исхода (внезапная смерть, асфиксия); не зарегистрированы случаи немеланомного рака кожи, семиномы, папиллярного рака щитовидной железы между 44-й и 96-й неделями.
Подкожное введение устекинумаба способствует поддержанию клинического ответа и клинической ремиссии БК на протяжении двух лет; дополнительные сведения о безопасности препарата не получены.
Абстракт ОР010, W. Sandborn и соавт. (США)
Периоперационное применение ведолизумаба не связано с развитием ранних послеоперационных инфекционных осложнений у больных НЯК, перенесших прокто- или колэктомию с наложением илеоанального резервуарного анастомоза
Ведолизумаб широко используется в лечении НЯК. Считается, что введение ведолизумаба непосредственно перед хирургическим вмешательством ассоциировано с высоким риском развития инфекционных осложнений в раннем послеоперационном периоде. Бельгийские ученые опровергли это утверждение в ходе одноцентрового когортного исследования, в котором приняли участие больные НЯК, перенесшие прокто- или колэктомию с наложением илеоанального резервуарного анастомоза (ИРА).
Исследователи изучили данные историй болезней всех пациентов, перенесших прокто- или колэктомию с наложением ИРА за период 2006-2016 гг. В исследование не включали больных, которым была наложена илеостома. Анализировали частоту возникновения инфекционных осложнений в раннем послеоперационном периоде – в течение 30 дней после выполнения прокто- или колэктомии; рассчитывали значения комплексного индекса осложнений, учитывая все осложнения, развившиеся на протяжении 30 дней после хирургического вмешательства.
За указанный период времени прокто- или колэктомия была выполнена 170 пациентам (46% женщин, средний возраст 38 лет, средняя длительность заболевания – 6 лет). Перед проведением оперативного лечения 34 (20%) пациента получали ведолизумаб на протяжении 14 недель, 60 (35%) больных – анти-ФНО терапию в течение 8 недель, 32 (19%) участника – средние/высокие дозы (≥20 мг/сут) преднизолона, 71 (42%) пациент не принимал каких-либо медикаментов.
В ряде случаев проводили двухэтапную операцию, при этом в качестве первого этапа осуществляли формирование стомы (28%), в большинстве случаев этот подход использовали у пациентов с дисплазией/раком (85% vs 13%; р<0,001), гораздо реже – у пациентов, принимавших ведолизумаб (9% vs 32%; р=0,005), анти-ФНО (15% vs 35%; р=0,006), стероиды (0% vs 34%; р<0,001). Формирование стомного мешка на 1-м этапе оперативного вмешательства было признано независимым фактором риска возникновения инфекционных осложнений в раннем послеоперационном периоде (отношение шансов (ОШ) 2,40; 95% ДИ 1,18-4,90), а также развития общих осложнений (ОШ 3,11; 95% ДИ 1,52-6,40; р=0,002).
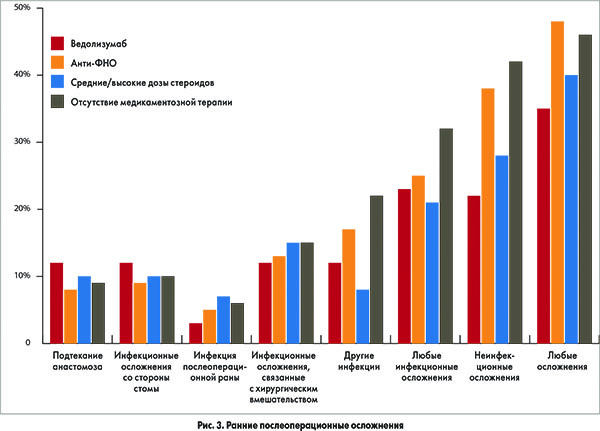 Как демонстрирует рисунок 3, статистически значимые различия между использованными видами лечения и развитием инфекционных осложнений в раннем послеоперационном периоде отсутствовали. Значения комплексного индекса осложнений и продолжительность послеоперационного пребывания в стационаре были сопоставимы между группами. Однако комплексный индекс осложнений был несколько выше у пациентов, перенесших формирование стомы на 1-м этапе операции (ОШ 20,9; 95% ДИ 0,0-30,8) по сравнению с больными, которым наложение стомы было проведено на 2-м этапе (ОШ 0,0; 95% ДИ 0,0-20,9; р=0,001). Аналогичная динамика зафиксирована в отношении продолжительности послеоперационного пребывания в стационаре (соответственно 11 дней; 95% ДИ 9-17 vs 7 дней; 95% ДИ 5-10; р<0,001).
Как демонстрирует рисунок 3, статистически значимые различия между использованными видами лечения и развитием инфекционных осложнений в раннем послеоперационном периоде отсутствовали. Значения комплексного индекса осложнений и продолжительность послеоперационного пребывания в стационаре были сопоставимы между группами. Однако комплексный индекс осложнений был несколько выше у пациентов, перенесших формирование стомы на 1-м этапе операции (ОШ 20,9; 95% ДИ 0,0-30,8) по сравнению с больными, которым наложение стомы было проведено на 2-м этапе (ОШ 0,0; 95% ДИ 0,0-20,9; р=0,001). Аналогичная динамика зафиксирована в отношении продолжительности послеоперационного пребывания в стационаре (соответственно 11 дней; 95% ДИ 9-17 vs 7 дней; 95% ДИ 5-10; р<0,001).
Таким образом, в крупном одноцентровом когортном исследовании доказано, что применение ведолизумаба в периоперационном периоде не ассоциировано с развитием инфекционных осложнений в раннем послеоперационном периоде у больных НЯК. Больным, получающим биологическую терапию или средние/высокие дозы стероидов, авторы рекомендуют проводить формирование стомы на 2-м этапе хирургического вмешательства.
Абстракт ОР012, М. Ferrante и соавт. (Бельгия)
Подготовила Татьяна Можина
Медична газета «Здоров’я України 21 сторіччя» № 7 (404), квітень 2017 р.