4 травня, 2017
Асимптоматическая бактериурия — ключ к врожденному иммунному ответу и иммуномодуляции при инфекции мочевых путей

Инфекции мочевых путей (ИМП) являются одними из самых частых воспалительных заболеваний, с которыми ежедневно сталкиваются врачи различных специальностей. ИМП — термин, охватывающий целый ряд патологических состояний, которые характеризуются микробной колонизацией мочи и микробной инвазией с развитием инфекционного процесса в какой-либо части мочеполового тракта — от наружного отверстия уретры до коркового вещества почек.
Бессимптомная бактериурия (ББУ), или бессимптомная ИМП-состояние, при котором определяется изолированное присутствие бактерий в образце мочи, полученное в условиях, исключающих контаминацию, без клинических проявлений мочевой инфекции; по сути, это микробиологический диагноз.
Многофакторный этиопатогенез и неоднозначность подхода в терапии ББУ до сих пор вызывает больше вопросов, чем ответов у специалистов различного профиля. До настоящего времени исследований, посвященных изучению ББУ, все еще недостаточно, поэтому каждое из них, безусловно, вызывает профессиональный интерес. Так, в рамках XI Научно-практической конференции с международным участием «Рациональная фармакотерапия в урологии — 2017», которая состоялась 9-10 февраля в Москве, был представлен доклад профессора Бьорна Вюльта (Biorn Wult), кафедра микробиологии и иммунологии (MIG) Лундского университета, г. Лунд, Швеция.
— ИМП являются одними из наиболее распространенных в человеческой популяции инфекций и включают в себя признаки общего и местного воспаления, проявления которого довольно вариабельны – от пиелонефрита до цистита и ББУ. С практической точки зрения ИМП также делятся на осложненные, неосложненные и уросепсис.
Главными факторами в развитии ИМП являются вирулентность возбудителя и восприимчивость макроорганизма. Большинство ИМП (в том числе циститов и ББУ) вызываются уропатогенными штаммами E. coli (Uropathogenic E. Coli – UPEC), которая обладает определенным набором биологических свойств, объясняющих уникальный адаптивный механизм и способность быстро реагировать на изменения условий жизни (Ragnarsdottir, Svanborg, 2012):
• острова патогенности (Pathogenicity Island, PAI);
• комплекс факторов вирулентности (фимбрии, токсины, капсула, железосвязывающие белки, иммунные ингибиторы);
• малая экспрессия (или ее отсутствие) генов факторов вирулентности;
• нет четкой разницы между штаммами, вызывающими ББУ и цистит;
• штаммы бессимптомных носителей.
Прикрепление UPEC к уроэпителию обеспечивается адгезинами-фимбриями, закодированными в плазмидах и/или в сегментах хромосомы возбудителя, которые называют островами патогенности (PAI). У данного возбудителя ИМП наличествуют 2 типа фимбрий (Р и тип I), представляющих собой мелкие бактериальные органеллы, напоминающие волоски (пили) и прикрепляющиеся к уроэпителию.
Р-фимбрии экспрессируются большинством штаммов E. coli при пиелонефрите и сепсисе. Что касается фимбрий типа I, то некоторые авторы считают, что они важны для диагностики инфекций нижних мочевых путей (ИНМП). Следует заметить, что данные 2 вида фимбрий хоть и являются основными, однако ассортимент патогенетически значимых адгезинов UPEC гораздо шире.
Иммунологические механизмы защиты мочевых путей осуществляются посредством врожденных и приобретенных факторов.
При острых ИМП иммунный ответ индуцируется неспецифическими факторами защиты, включающими различные сигнальные рецепторы, которые экспрессируются на иммунокомпетентных клетках. Факторы иммунологической защиты обобщенно приведены в таблице 1.
Toll-подобные рецепторы (Toll-like receptor, TLR) входят в систему врожденного (неспецифического) иммунитета, который в процессе эволюции живых организмов сформировался гораздо раньше адаптивного (специфического). Это обширный класс клеточных рецепторов, распознающих паттерны микробных структур и эндогенные сигналы клеток организма. Считается, что каждый из этого класса рецепторов распознает определенный молекулярный паттерн микроорганизмов для быстрой мобилизации более древней (врожденной) иммунной системы и последующей индукции адаптивного (специфического) иммунитета. Поэтому для формирования иммунного ответа при ИМП Toll-подобные рецепторы (в частности, тип TLR4) являются ключевым элементом.
TLR4 экспрессируются на эпителиоцитах мочевыводящих путей и способны как опосредованно, так и напрямую распознавать фимбрии E. coli и некоторых других бактерий.
TLR4-зависимая клеточная активация, опосредованная фимбриями E. coli, является многоступенчатым процессом, при котором происходит каскад иммунологических реакций. TLR4 активирует транскрипцию генов иммунного ответа, в результате чего повышается синтез провоспалительных цитокинов (ИЛ‑6, ИЛ‑8) инфицированными клетками уроэпителия, происходит рекрутирование нейтрофилов, презентация микробного антигена дендритными клетками, активация Т- и В-лимфоцитов с образованием специфических антител (IgA, IgG) и множество других последовательных реакций, приводящих в итоге к формированию специфического (адаптивного) иммунного ответа.
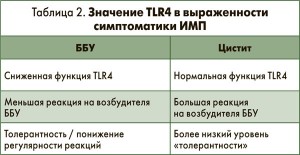
Существует предположение, что при ББУ снижение уровня экспрессии TLR4, обусловленное точечной мутацией генов, носит защитный характер.
Примечательным является то, что можно добиться эффекта нокаута генов (gene knockout), кодирующих предрасположенность к ИМП, без всяких последствий для мочевыводящих путей (аналогично и для дыхательных путей). Учитывая мультифакторное взаимодействие E. coli с эпителием мочевыводящих путей при формировании местного и системного иммунного ответа, а также существование ББУ, ключевым вопросом является то, каким образом осуществляется иммунологический контроль и поддержание толерантности, а также возможность влияния на эти процессы с тем, чтобы уменьшить проявления ИМП. На сегодняшний день проблемы бессимптомного бактерионосительства и формирование толерантности слизистой оболочки мочевых путей к E. coli, а также варианты нокаута генов иммунного ответа, приводящих к вышеозначенным феноменам, изучаются на экспериментальных моделях. Также можно утверждать, что полиморфизм важнейших рецепторов, опосредующих активацию клеток врожденного иммунитета, призван поддерживать баланс между защитой целостности тканей, устранением бактериурии (или понижением регуляции до ББУ-толерантности), с одной стороны, и избыточным реагированием с повреждением тканей, предрасположенности к тяжелым инфекциям – с другой. Более того, генетически детерминированный полиморфизм клеточных рецепторов обусловливает тип и выраженность воспалительных процессов на одни и те же микроорганизмы у различных людей. Соответственно, экспериментальные модели для исследований ББУ используются в качестве ключа для понимания механизма иммунного ответа при ИМП.
Бессимптомная бактериурия:
фокус на исследованиях и терапии
Как упоминалось ранее, варианты иммунного ответа и клинические проявления ИМП при действии одних и тех же уропатогенов индивидуальны. Целью наших исследований является изучение механизмов формирования иммунологической толерантности при контакте E. coli со слизистой оболочкой мочевыводящих путей, проявляющемся ББУ.
В сотрудничестве с группой Jurg Hacker (Вюрцбург) установлено, что у бессимптомных носителей определяются возбудители, развивающиеся из фекальных авирулентных или ослабленных патогенных штаммов, в частности E. coli 83972. Также были получены интересные данные относительно свойств возбудителей ББУ:
• колонизируют мочевыводящие пути в течение нескольких месяцев/лет;
• имеют меньший размер генома;
• размножаются быстрее;
• около 50% относятся к тем же клонам, что и вирулентные штаммы E. coli;
• несут гены вирулентности, но не экспрессируют их;
• характерны делеции и множественные точечные мутации.
Также было установлено, что отсутствие лечения ББУ обусловливает меньшую частоту рецидивов, сопровождающихся клиническими проявлениями (T. Cai et al., 2012). По данным четырехлетних наблюдений выявлено, что искусственная колонизация мочевых путей штаммом E. coli 83972, вызывающим ББУ, защищает мочевыводящие пути от таких возбудителей ИМП, как Proteus, Klebsiella и пр. Соответственно, было выдвинуто предположение, что ББУ является протективным фактором при ИМП, защищая пациентов от возникновения рецидивов.
Для проверки этого предположения в нашем исследовании была проведена инокуляция стандартизированным штаммом E. coli 83972, 30 мл (105 КОЕ/мл) пациентам (n=20), получавшим антибактериальную терапию по поводу ИМП. Перед введением культуры E. coli 83972 была выдержана пауза 2-3 дня (без антибиотиков), а затем проведена трехкратная ежедневная инокуляция (0,1 и 2 дня). Плацебо-контролируемое исследование показателей иммунного ответа проводилось в течение 11 мес.
Результаты исследования реакции пациентов на стандартизованный штамм E. coli 83972 показали слабость иммунного ответа при ББУ, однако при этом наблюдалась внутривариабельная индивидуальность; определялись разные уровни ИЛ‑6 (р=0,1099), ИЛ‑8 (р≤0,0001) и лейкоцитурии (р≤0,0001). Также было установлено, что со слабыми ответами на ББУ ассоциируется генетически детерминированный полиморфизм TLR4 и IRF3. Эти факторы позволили нам прийти к выводу, что иммунный ответ у каждого человека так же индивидуален, как и отпечатки пальцев.
Следующим этапом исследования было изучение механизмов взаимодействия бактерий с организмом хозяина при ББУ. Для этого после первой инокуляции E. coli 83972 выделили изолированные штаммы от четырех разных пациентов, обозначенных как PI2, PII‑4, PIII‑4 и 4,9-контроль, с различной по длительности бактериальной колонизацией мочевыводящих путей: 214, 155, 54 и 68 дней соответственно. В ходе исследования изолятов, полученных от вышеобозначенных пациентов, были выявлены различные точечные мутации (несинонимичная замена, межгенная, инверсия, делеция); при этом наибольшее их количество определялось у PI2, а наименьшее (единичные инверсия, делеция и несинонимичная замена) – у контрольного 4,9. Нами был сделан вывод, что адаптация бактерий к организму-хозяину происходит посредством переформатирования генома (делеция / утрата генов).
Более того, при повторной колонизации мочевыводящих путей вышеобозначенных пациентов контрольными изолятами E. coli был обнаружен интереснейший феномен, при котором наблюдался тот же самый паттерн мутаций.
Ранее было установлено, что иммунная система пациентов «персонализирует» нормальную бактериальную флору (Zdziarski, 2010). Также было доказано, что бактерии, вызывающие ББУ, подавляют транскриптомику генов хозяина, ингибируя фосфорилирование РНК-полимеразы II. Это означает, что они манипулируют хозяином и активно подавляют иммунный ответ (Lutay, Svanborg, 2013). Таким образом, при бактериальной колонизации слизистых оболочек в нашем организме имеет место сложное двухстороннее взаимодействие, которое может приводить как к развитию заболевания, так и к бессимптомному носительству возбудителей.
При эпидемиологическом исследовании изолятов E. coli, выделенных у пациентов ББУ и ИНМП (цистит), был проведен анализ свойств возбудителей в соответствии со следующими критериями:
• образование биопленки, жгутикование;
• индукция иммунного ответа организма in vitro (клеточные линии);
• иммунный ответ организма на мышиной модели ИМП;
• активация бактериальных генов;
• скорость роста бактерий;
• адгезия.
Несмотря на подробнейший анализ, данное исследование не выявило каких-либо особенностей выделенных от пациентов с ББУ изолятов E. coli. Это позволило исследователям сделать вывод о том, что возбудители проявляют свои свойства только при колонизации организма хозяина в течение достаточно длительного времени (Koves et al., 2013).
Исследователями было выдвинуто предположение, что если бактерии не являются главным «игроком», значит, им должен быть организм-хозяин. В частности, установлено, что дисфункция TLR4 ассоциируется с менее выраженной реакцией на E. coli и развитием ББУ (B. Wult, 2016) (табл. 2).
Исходя из всего вышесказанного, можно сделать несколько предварительных выводов:
1. Фокус внимания научных исследований сместился с бактерий на изучение предрасположенности организма-хозяина к тем или иным ИМП, при этом ключевую роль в такой предрасположенности играют TLR4.
2. Изучение генетических факторов, определяющих полиморфизм и функционирование важнейших рецепторов, становится приоритетным.
3. Проявления воспалительных реакций при пиелонефрите зависят от баланса в рамках этих реакций.
4. На сегодняшний день патогенез цистита еще плохо изучен; данное заболевание может развиваться по совершенно иным патогенетическим механизмам, нежели пиелонефрит.
5. ББУ стала моделью для разъяснения понижения регуляции и формирования иммунологической толерантности со стороны организма-хозяина; данная модель может стать фундаментом для разработки будущих методов лечения ИМП.
Альтернативные методы лечения:
механизмы действия
На сегодняшний день одним из альтернативных методов лечения рецидивирующих ИМП является терапия с помощью препарата ОМ‑89. Это пероральный иммуностимулятор, который представляет собой лиофилизированный экстракт из 18 штаммов UPEC (ОМ‑89).
В настоящее время проводится исследование по изучению молекулярных механизмов действия ОМ‑89, в ходе которого был выдвинут ряд гипотез, однако окончательных данных пока нет. Как же все это работает?
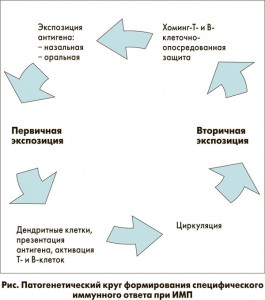
Общеизвестно, что адаптивный (специфический иммунитет) не является определяющим при острых ИМП. Когда речь идет о первичной стимуляции микробными антигенами, важную роль играют факторы врожденного иммунитета: дендритные клетки, презентация антигена, активация Т- и В-клеток, их циркуляция. При вторичной экспозиции антигена (вакцинация) происходит эффект хоминга с формированием Т- и В-клеточно-опосредованного иммунного ответа. Патогенетический круг формирования специфического иммунного ответа при ИМП приведен на рисунке.
Каким же образом можно добиться формирования устойчивого местного иммунного ответа на уровне мочевыводящих путей? При стимуляции иммунной системы у пациентов с ИМП существует ряд проблем:
• уропатогенные штаммы UPEC включают тысячи различных клонов и, соответственно, множество антигенов;
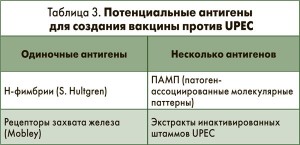
• ограниченный защитный эффект адаптивного (специфического) иммунитета при острых ИМП является существенным препятствием в разработке вакцины (содержит одиночные антигены).
Проблемой также является выбор антигена, который можно использовать для значимой стимуляции иммунной системы против инфекций, вызванных UPEC. Потенциальные антигены, тестируемые сегодня с целью создания вакцины против UPEC, приведены в таблице 3.
В предыдущих экспериментальных (на животных моделях) исследованиях, посвященных изучению иммунного ответа, в том числе при ИМП, были получены следующие результаты:
• врожденный иммунитет стимулируется через макрофаги и дендритные клетки (Schmidhammer, 2002);
• специфический иммунитет стимулируется через макрофаги, дендритные клетки, активацию Т- и В-клеток (Huber, 2000; Schmidhammer, 2002); в ответ на стимуляцию иммунной системы штаммами ОМ‑89 и прочими штаммами UPEC синтезируются специфические антитела (Huber, 2000);
• в рамках экспериментальной модели ЛПС-цистита было доказано уменьшение воспаления в мочевом пузыре (S.J. Lee et al., 2006).
В исследовании S.J. Lee и соавт. (2006) использовались 6-8-недельные самки мышей Balb/C (n=30). Индукция цистита проводилась посредством внутрипузырной инстилляции ЛПС (липополисахарид) E. coli спустя 24 ч после завершения 10-дневного курса иммунотерапии ОМ‑89. Спустя еще 24 ч проводился гистопатологический анализ на предмет наличия признаков воспаления. Также оценивался индекс воспаления мочевого пузыря (ИВМП): отек, лейкоцитарная инфильтрация, кровоизлияния. Результаты гистопатологического анализа продемонстрировали выраженное снижение ИВМП; повышенным оказался только уровень цитокинов ИЛ‑6 и гамма-интерферона.
Таким образом, был сделан вывод, что ОМ‑89 может стимулировать иммунную систему на уровне мочевыводящих путей. Гипотетические механизмы действия ОМ‑89 заключаются в следующем:
• судя по всему, ОМ‑89 модулирует иммунную систему, подавляя воспалительную гиперактивность;
• баланс между «хорошим» и «плохим» воспалением, вероятно, регулируется благоприятным для пациента образом;
• неизвестно, связан ли главный защитный эффект с менее интенсивной воспалительной реакцией (толерантностью), способствующей ББУ, а затем спонтанному излечению;
• также неизвестно, заключается ли главный защитный эффект в создании среды с более высоким порогом для поддержания бактериальной популяции.
Поскольку окончательные результаты исследования по изучению иммуностимуляции на уровне мочевыводящих путей при помощи ОМ‑89 еще не получены, проблема формирования иммунологической толерантности при ББУ, а также механизмы формирования местного иммунного ответа при ИМП вызывают больше вопросов, чем ответов.
На основании уже полученных данных предыдущих исследований можно сделать следующие выводы (B. Wult, 2016):
1. Врожденный иммунитет опосредован активацией ПРР (паттерн-распознающих рецепторов) – сигнальных TRL, которые индуцируют синтез провоспалительных цитокинов, рекрутирование фагоцитов (макрофагов и нейтрофилов), высвобождение и созревание дендритных клеток.
2. Адаптивный (специфический) иммунитет опосредован Т- и В-клетками (клеточный) и синтезом антител (гуморальный).
3. В рамках экспериментальной модели ЛПС-цистита доказано уменьшение воспаления мочевого пузыря посредством реализации функций врожденного и адаптивного иммунитета в ответ на повторную бактериальную стимуляцию иммунной системы организма хозяина (вторичная экспозиция антигена).
Таким образом, на сегодняшний день проблема рецидивирующих ИМП и ББУ нуждается в дальнейшем изучении; фокус исследований при этом закономерно смещается на вопросы генетической детерминированности факторов иммунной защиты макроорганизма и факторов вирулентности микроорганизмов, что сулит немало новых открытий в области молекулярной биологии, иммунологии и генетики.
Альтернативным подходом в терапии ББУ и рецидивирующих ИМП является стимуляция собственных иммунных механизмов пациента с помощью пероральных вакцин. Применение методов иммунотерапии в ежедневной клинической практике, разработка иммунотропных препаратов на основе выделенных от конкретного пациента штаммов возбудителей полностью соответствует принципам персонифицированного подхода в медицине, открывая совершенно новые возможности для эффективного лечения и профилактики как инфекционно-воспалительных заболеваний, так и многих других патологических состояний.
Подготовила Наталия Позднякова