4 лютого, 2017
Хірургічна тактика у хворих на гострокровоточивий колоректальний рак
Гострі кишкові кровотечі є серйозною проблемою в невідкладній хірургії органів черевної порожнини. Розвиток ускладнень злоякісного пухлинного ураження товстої кишки кровотечею, за зведеними статистичними даними вітчизняних та зарубіжних клінік, коливається в межах від 6,2 до 40%, а в структурі кишкових кровотеч колоректальний рак сягає від 9 до 16%. Пацієнти з гострокровоточивим колоректальним раком (ГККР), за даними нашої клініки, становлять 21,6% в структурі кишкових кровотеч та 29,7% – в структурі ускладненого колоректального раку.
На сьогодні аналіз несприятливих наслідків лікування хворих зводиться до критики пізніх операцій за рахунок подовження етапу діагностики та підготовки хворого до оперативного втручання або позиції, що полягає у необхідності проведення екстреного хірургічного лікування при виникненні перших ознак пухлинної кровотечі у необстежених та непідготовлених хворих.
Актуальність проблеми гострокровоточивих злоякісних пухлин колоректальної зони полягає у відсутності чітко визначених алгоритмів хірургічної тактики, що визначається небажано високим рівнем післяопераційної летальності у межах від 20 до 50%, а кількість ускладнень злоякісних пухлин гострою кровотечею не має тенденції до зниження і в останні роки прогресивно зростає. Активна, активно-очікувальна та очікувальна тактики при гострих колоректальних кровотечах пухлинного походження існують давно, тільки число прихильників та суперечників кожної з них періодично змінюється. Предметом дискусій при обговоренні хірургічних аспектів лікування ГККР є визначення показань, термінів проведення та вибір методів оперативних втручань.
Матеріали та методи
В Київському міському центрі надання допомоги хворим з шлунково-кишковими кровотечами, що діє на базі Київської міської клінічної лікарні № 12, за період 2002-2013 рр. лікувалися 1114 хворих з клінікою кишкової кровотечі, що становило 9,5% від загальної кількості пацієнтів, госпіталізованих з приводу шлунково-кишкових кровотеч. Серед них хворих на ГККР – 241 (21,6%), вони посідають 3-тє місце після кровоточивого геморою – 38,1% та дивертикульозу ободової кишки – 23,3%.
З приводу ускладнених форм колоректального раку за цей період госпіталізовано 811 хворих. ГККР посідає 2-ге місце (29,7%) після колоректального раку, ускладненого гострою кишковою непрохідністю (45,1%).
Вік госпіталізованих хворих коливався від 41 до 94 років. Чоловіків – 126 (52,3%), вік у межах від 41 до 94 років, середній вік (66,9±11,8) років. Жінок – 115 (47,7%), вік у межах від 50 до 89 років, середній вік 69,0±8,4 років. Осіб похилого та старечого віку – 81,3%.
У всіх пацієнтів спостерігалися супутні захворювання різних органів та систем, що характерно для цієї вікової категорії хворих (поліморбідність 100%). Індекс поліморбідності становив 4,7 у чоловіків та 5,3 у жінок.
Згідно з Міжнародною класифікацією злоякісних новоутворень TNM 7-го перегляду серед хворих, госпіталізованих з приводу ГКРР, встановлено такі стадії злоякісного процесу: I – 13 (5,4%) хворих, II – 142 (58,9%), III – 41 (17,0%), IV – 45 (18,7%).
Згідно з прийнятою в клініці класифікацією тяжкості шлунково-кишкових кровотеч (В.Д. Братусь, 2001) помірний ступінь тяжкості геморагії був у 99 (41,1%) пацієнтів, середній – у 49 (20,3%), тяжкий – у 93 (38,6%). Співвідношення тяжкості кровотечі: помірна / середня / тяжка – 1,0 / 0,5 / 0,9. Проведено діагностичний комплекс з 356 інструментальних методів дослідження у 206 (85,5%) із 241 госпіталізованого пацієнта, при цьому ректороманоскопію (РРС) проведено у 135 (65,5%) пацієнтів, іригоскопію (ІС) – у 84 (40,8%), фіброколоноскопію (ФКС) – у 91 (44,2%). У 97 (47,1%) хворих було використано поєднання різних методів інструментальної діагностики.
Не проводилось обстеження у 35 (14,5%) хворих:
• 11 пацієнтів (4,6%) обстежені раніше, лікувалися в інших медичних закладах та отримували в клініці лише консервативну гемостатичну терапію і далі продовжили лікування в Київській міській онкологічній лікарні;
• у 10 хворих (4,1%) діагноз встановлений раніше в інших медичних закладах і підтверджений даними аутопсії;
• 8 пацієнтів (3,3%) з раніше встановленим діагнозом без повторного обстеження були оперовані у ранньому відстроченому порядку у зв’язку з розвитком кишкової кровотечі;
• у 4 випадках (1,7%) у зв’язку з вкрай тяжким станом при госпіталізації, у 2 з яких пухлина визначалась при пальпації, діагноз встановлений при аутопсії;
• 2 хворих (0,8%) раніше не обстежувалися, але у зв’язку з розвитком в клініці рецидиву кишкової кровотечі (1 ви падок) та на висоті активної кровотечі (1 випадок) були оперовані, діагноз встановлено інтраопераційно, при цьому в одного з пацієнтів пухлина визначалася при пальпації.
Загалом діагноз було встановлено на підставі отриманих даних при проведенні РРС – у 83 (40,3%) хворих, ІС – у 59 (28,6%), ФКС – у 64 (31,1%).
Діагноз, що обіймав локалізацію та поширеність злоякісного пухлинного ураження, був встановлений протягом 1-ї доби у 95 (46,1%) пацієнтів, 2-ї доби – у 44 (21,4%), 3-ї доби – у 27 (13,1%), 4-ї доби – у 24 (11,7%), пізніше 4-ї доби – у 16 (7,8%).
На підставі даних, отриманих при проведенні інструментальних методів дослідження, виявлено ГКРР наступних локалізацій: сліпа кишка – 21 випадок (10,2%), висхідна ободова кишка – 13 (6,3%), печінковий згин – 7 (3,4%), поперечна ободова кишка – 12 (5,8%) (права половина – 7, ліва – 5), селезінковий згин – 3 (1,5%), низхідна ободова кишка – 8 (3,9%), сигмовидна кишка – 33 (16,0%), ректосигмоїдний відділ – 18 (8,7%), пряма кишка – 86 (41,7%), первинно-множинний рак – 5 (2,4%): висхідна ободова та селезінковий згин – 1, висхідна ободова та сигмовидна кишка – 1, селезінковий згин та сигмовидна кишка – 1, сигмовидна кишка та ректосигмоїдний відділ – 1, сигмовидна кишка та пряма кишка – 1.
Результати дослідження та обговорення
Аналіз результатів лікування хворих на ГККР проведено у двох групах пацієнтів, що перебували на лікуванні протягом двох періодів, які відповідають етапам удосконалення і впровадження у клінічну практику алгоритму вибору хірургічної тактики у хворих на ГКРР в умовах надання екстреної допомоги.
І період – хворі (148), що знаходилися на лікуванні в нашій клініці за період з 2002 по 2009 рр. Цей період характеризувався активною хірургічною тактикою у зв’язку з відсутністю використання ендохірургічних методів гемостазу і, як наслідок цього, високою ймовірністю розвитку рецидивів кровотеч у різні терміни постгеморагічного періоду. Загальний стан хворого вважали нестабільним, а гемостаз нестійким, що спонукало до більш широкого проведення екстрених операцій за відсутності протипоказань.
ІІ період – хворі (93), що знаходилися на лікуванні в нашій клініці в період з 2010 по 2013 рр. Цей період характеризувався впровадженням у клінічну практику розробленої активної діагностично-лікувальної тактики з раннім проведенням ендоскопічної верифікації пухлинного ураження товстої кишки, широким застосуванням ендохірургічних методів гемостазу у хворих з активною кровотечею, ендохірургічної профілактики розвитку рецидиву кровотечі у групі хворих з наявністю стигмат кровотечі та наступним проведенням клініко-ендоскопічного моніторингу з урахуванням прогностичних факторів розвитку рецидиву кровотечі з метою забезпечення надійного гемостазу та гладкого перебігу постгеморагічного періоду на тлі інфузійно-трансфузійної корекції гіповолемії та компенсації крововтрати, що передумовлює можливість виконання за відсутності протипоказань оперативного втручання у ранньому відстроченому періоді згідно з існуючими протоколами онкостандартів.
Хірургічна тактика при ГКРР є глибоко індивідуалізованою і носить активно-очікувальний характер. Труднощі вибору і визначення раціональних термінів проведення оперативних втручань при ракових товстокишкових кровотечах довгий час пояснювали відсутністю об’єктивних критеріїв прогнозування ефективності спонтанної (або в разі проведення консервативної терапії) зупинки кровотечі, надійності гемостазу у кровоточивій пухлині та ризику розвитку рецидиву кровотечі.
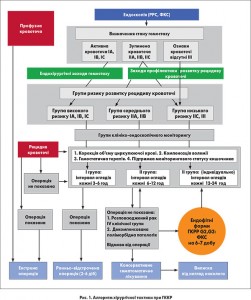
Згідно із розробленим алгоритмом лікувальні та діагностичні заходи розпочинаються одразу після госпіталізації хворого та оцінки його загального статусу та йдуть паралельно з моменту госпіталізації.
У разі профузної кишкової кровотечі, про що свідчить наявність у хворого гемодинамічних порушень та масивного виділення малозміненої крові, що обумовлює неможливість обстеження товстої кишки та застосування заходів ендохірургічного гемостазу, за відсутності протипоказань пацієнти підлягають екстреному оперативному втручанню за життєвими показаннями.
Всі інші хворі підлягають веденню гемостатичної та індивідуально визначеної інфузійно-трансфузійної терапії з одномоментною ранньою підготовкою кишечника до ендоскопічного обстеження.
Серед пацієнтів з ГКРР переважають особи похилого та старечого віку з високим індексом поліморбідності, адаптаційні можливості в цій категорії знижені, тому дуже важливим є негайний початок консервативних лікувальних заходів. Ранній початок терапії зумовлює менший об’єм крововтрати та, відповідно, менший об’єм гемотрансфузій, зупиняє каскад шокогенних реакцій, дозволяє швидше досягти стабілізації показників гомеостазу.
При ургентній госпіталізації хворих на колоректальний рак, що ускладнений гострою кишковою кровотечею, лікувально-діагностичні заходи тривають в умовах дефіциту часу, тому рання верифікація пухлинного ураження товстої кишки, скорочення термінів діагностики та негайний початок лікувальних заходів безпосередньо впливають на остаточний результат лікування.
Діагноз, що обіймав локалізацію та поширеність злоякісного пухлинного ураження, в І періоді спостережень був встановлений протягом 1-ї доби у 42 (33,3%) пацієнтів, 2-ї доби – у 20 (15,9%), 3-ї доби – у 25 (19,8%), 4-ї доби – у 23 (18,3%), пізніше 4-ї доби – у 16 (12,7%). Згідно з розробленим у клініці лікувально-діагностичним алгоритмом в ІІ періоді спостережень діагноз був встановлений протягом 1-ї доби у 53 (66,3%) пацієнтів, 2-ї доби – у 24 (30,0%), 3-ї доби – у 2 (2,5%), 4-ї доби – у 1 (1,2%). Загалом у перші дві доби перебування у стаціонарі в І періоді спостережень діагноз ГККР був встановлений у 49,2% хворих, а в ІІ періоді цей показник зріс майже у 2 рази і становив 96,3%.
Серед інструментальних методів досліджень товстої кишки в ІІ періоді спостережень надано перевагу ендоскопічним методам, а саме – ФКС. Питома вага виконаних ФКС в ІІ періоді спостережень зросла в 4,3 раза, а кількість хворих, у яких діагноз ГКРР був встановлений за даними ФКС, зросла в 6,8 раза (з 9,5 до 65,0%).
Завдання та можливості ендоскопічних методів досліджень у хворих з гострими кишковими кровотечами:
• верифікація джерела кровотечі, його локалізації, розмірів;
• визначення морфологічної форми, поширеності, ступеня деструкції пухлинної тканини, взяття біопсії для гістологічного дослідження;
• оцінка активності кровотечі та ступеня гемостазу;
• застосування мініінвазивних методів ендохірургічного гемостазу в зоні джерела кровотечі та проведення профілактики рецидиву кровотечі;
• контроль ефективності проведених мініінвазивних методів ендохірургічного гемостазу.
З метою оцінки стану гемостазу при ендоскопічному дослідженні користуємося розробленою нами класифікацією активності пухлинних колоректальних кровотеч:
І. Активна кровотеча:
ІА – підтікання незміненої крові з пухлини;
ІВ – кровотеча з-під згустку крові, фіксованого на пухлині;
ІС – пухлина, вкрита пухкими згустками крові, легко контактно кровоточить.
II. Зупинена кровотеча:
ІІА – великі тромбовані судини в кратері ракової виразки;
ІІВ – на пухлині фіксовані щільні згустки крові;
ІІС – пухлина вкрита гематином з дрібними тромбованими судинами.
III. Відсутні ознаки кровотечі – пухлина вкрита фібрином та брудно-сірим нашаруванням.
Для здійснення зупинки активної кровотечі та профілактики розвитку рецидиву кровотечі користуємося мініінвазивними методами ендохірургічного гемостазу в зоні джерела кровотечі, що ґрунтуються на використанні механічних (кліпування, лігування) та теплових (монополярна та біполярна коагуляція, гідроелектрокоагуляція, аргоноплазмова коагуляція) методів, ендоскопічній ін’єкційній терапії (епінефрин, спірт-лідокаїнова суміш), розпиленні гемостатичних засобів (транексамова кислота) та плівкоутворювальних речовин (капрофер).
У І періоді спостережень ендоскопічний моніторинг не проводився, методи ендохірургічного гемостазу використані в 10,9% випадків – при виконанні 6 РРС з 55 застосовано розпилення плівкоутворювальних полімерів, але у зв’язку з низькою ефективністю методу гемостазу він був доповнений тампонадою прямої кишки серветкою з антифібринолітиком. Ще в 11 випадках була застосована тампонада прямої кишки без ендоскопічного використання гемостатичних препаратів.
У ІІ періоді спостережень в клінічну практику запроваджено широке застосування ендоскопічного моніторингу з використанням ендохірургічних методів гемостазу при активних кровотечах та за наявності стигмат недавньої кровотечі. Проведення наступного клінікоендоскопічного моніторингу сприяє виявленню ознак розвитку раннього рецидиву кровотечі на доклінічному етапі його прояву, дозволяє здійснювати контроль ефективності первинного ендоскопічного гемостазу, а в разі необхідності проводити повторні ендоскопічні гемостатичні процедури, спрямовані на забезпечення надійного гемостазу та профілактику розвитку рецидиву пухлинної кровотечі. У деяких випадках повторні ендоскопічні огляди доповнюють первинні дані про поширеність та морфологічні характеристики злоякісного пухлинного ураження, його операбельність, що має важливе значення для визначення показань та вибору способу і об’єму оперативного втручання.
Згідно з розробленою нами класифікацією активності пухлинних колоректальних кровотеч у І періоді спостережень стан гемостазу визначений у 67 (53,2%) хворих при проведенні 55 РРС та 12 ФКС: підтікання незміненої крові з пухлини (ІА) – 6 (9,0%), кровотеча з-під згустку крові, фіксованого на пухлині (ІВ) – 4 (6,0%), пухлина вкрита пухкими згустками крові, легко контактно кровоточить (ІС) – 9 (13,4%), великі тромбовані судини в кратері ракової виразки (ІІА) – 8 (11,9%), на пухлині фіксовані щільні згустки крові (ІІВ) – 7 (10,4%), пухлина вкрита гематином з дрібними тромбованими судинами (ІІС) – 29 (43,3%), пухлина вкрита фібрином та брудно-сірим нашаруванням (ІІІ) – 4 (6,0%). Ще у 59 (46,8%) хворих цієї групи діагноз встановлений за допомогою ІС, джерело кровотечі не візуалізоване, стан гемостазу не визначений.
У ІІ періоді спостережень стан гемостазу визначений у всіх 80 (100%) хворих при проведенні 28 РРС та 52 ФКС: підтікання незміненої крові з пухлини (ІА) – 8 (10,0%), кровотеча з-під згустку крові, фіксованого на пухлині (ІВ) – 11 (13,7,0%), пухлина вкрита пухкими згустками крові, легко контактно кровоточить (ІС) – 5 (6,3%), великі тромбовані судини в кратері ракової виразки (ІІА) – 2 (2,5%), на пухлині фіксовані щільні згустки крові (ІІВ) – 6 (7,5%), пухлина вкрита гематином з дрібними тромбованими судинами (ІІС) – 45 (56,2%), пухлина вкрита фібрином та брудно-сірим нашаруванням (ІІІ) – у 3 (3,8%).
Після проведення первинного ендоскопічного обстеження отримано можливість поділу хворих, з урахуванням прогностичних факторів розвитку рецидиву пухлинної кровотечі, на три групи.
Групи ризику розвитку рецидиву кровотечі: І група (IA, IВ, ІС) – хворі з активною кровотечею, яка зупинена ендохірургічними методами; ризик розвитку рецидиву кровотечі високий.
ІІ група (ІІА, IIB) – пацієнти з ознаками зупиненої кровотечі, яким проведені заходи, спрямовані на профілактику розвитку рецидиву кровотечі; ризик розвитку рецидиву кровотечі середній.
ІІІ група (IIC, ІІІ) – хворі з ознаками зупиненої кровотечі або без ознак кровотечі, в яких необхідність проведення ендохірургічної профілактики розвитку рецидиву кровотечі та наступного клініко-ендоскопічного моніторингу визначається індивідуально; ризик розвитку рецидиву кровотечі низький.
За нашими даними, навіть візуально визначені ознаки зупиненої кровотечі не можуть бути надійною гарантією відсутності розвитку рецидиву кровотечі з ракової пухлини – ракова тканина агресивна, нестабільна та схильна до розпаду з розвитком кровотечі. Тому за наявності кровотечі, зупиненої ендохірургічними методами, та стигмат недавньої кровотечі проводимо ендоскопічний моніторинг з обов’язковим використанням мініінвазивних ендохірургічних втручань, спрямованих на профілактику розвитку рецидиву кровотечі (рис. 1).
Після первинного ендоскопічного дослідження залежно від групи ризику розвитку рецидиву кровотечі визначаємо групу клініко-ендоскопічного моніторингу (КЕМ), з урахуванням визначення показань до хірургічного лікування. Для цього в кожній групі хворих виділяємо 3 підгрупи:
а) відсутні протипоказання до проведення оперативного лікування;
б) визначено протипоказання до проведення оперативного лікування: розповсюджений рак ІV клінічної групи з ознаками ракової інтоксикації та поліорганної недостатності; виражена поліморбідна патологія, що декомпенсує вітальні ресурси;
в) пацієнти, що відмовилися від операції.
Хворі Іа групи з зупиненою ендохірургічними методами активною кровотечею і високим ризиком розвитку рецидиву кровотечі підлягають клініко-ендоскопічному моніторингу з використанням ендоскопічних методів профілактики рецидиву кровотечі. Залежно від їх ефективності та сукупності обтяжуючих факторів у плані прогнозу ризику розвитку рецидиву кровотечі хворі підлягають оперативному лікуванню в екстреному чи ранньо-відстроченому порядку, протягом 2-6 діб, після проведення передопераційної підготовки.
Пацієнти ІІа групи з ознаками зупиненої кровотечі та середнім ризиком розвитку рецидиву кровотечі, яким проведено заходи, спрямовані на профілактику розвитку рецидиву кровотечі, підлягають клініко-ендоскопічному моніторингу з повторним, за необхідності, використанням мініінвазивних ендоскопічних профілактичних заходів та оперативному лікуванню у ранньо-відстроченому періоді, протягом 2-6 діб, після проведення необхідної передопераційної підготовки.
Хворі ІІІа групи з наявністю стигмат зупиненої кровотечі, яким проводимо ендохірургічну профілактику розвитку рецидиву кровотечі, або без ознак кровотечі, яким необхідність ендоскопічного моніторингу визначається індивідуально залежно від наявності клінічних ознак зупинки кровотечі, при низькому ризику розвитку рецидиву кровотечі, підлягають оперативному лікуванню у ранньо-відстроченому періоді, протягом 2-6 діб, після проведення необхідної передопераційної підготовки.
Клінічний моніторинг здійснювався хірургами та реаніматологами, під час нього встановлювався адекватний об’єм лікувальних заходів, спрямованих на компенсацію гіповолемії, дефіциту об’єму циркулюючої крові і корекцію гемодинамічних розладів. У ході клінічного моніторингу визначалися показання і терміни проведення оперативних втручань з урахуванням прогностичних факторів ризику розвитку рецидиву кровотечі.
У разі наявності ознак запущеності та неоперабельності раку товстої кишки, а також вираженої поліморбідної патології в стадії декомпенсації, що визначають вкрай високий анестезіологічний та операційний ризики, або якщо хворі відмовляються від оперативного лікування (групи Іб, Ів, ІІб, ІІв, ІІІб, ІІІв), обирається консервативна тактика лікування з пролонгованим клініко-ендоскопічним моніторингом та використанням ендохірургічних методів гемостазу; після проведення консервативного лікування хворі підлягають симптоматичному лікуванню у онколога за місцем проживання.
Завданнями ендоскопічного моніторингу є:
1. Здійснення контролю стану ефективності первинного ендоскопічного гемостазу з використанням мініінвазивних методів ендохірургічного гемостазу, спрямованих на забезпечення надійного гемостазу та профілактику розвитку рецидиву кровотечі.
2. Виявлення раннього рецидиву кровотечі на доклінічному етапі його прояву з проведенням активного ендоскопічного гемостазу.
3. Неодноразове проведення мініінвазивних методів ендохірургічного гемостазу у хворих з активними та рецидивними пухлинними кровотечами із запущеними формами раку шлунка та наявністю тяжкої супутньої патології, яким оперативне лікування не показане.
4. Доповнення первинних даних про поширеність та морфологічні характеристики пухлинного ураження шлунка, його операбельність, що має важливе значення для визначення показань та вибору способу і об’єму оперативного втручання.
Згідно з визначеними групами у плані прогнозу ризику розвитку рецидиву кровотечі хворі підлягають проведенню пролонгованого клініко-ендоскопічного моніторингу з інтервалами оглядів у Іа, Іб, Ів групах через кожні 3-6 год з кратністю огляду до 4 за добу, у ІІа, ІІб, ІІв – 6-12 год з кратністю огляду до 2 за добу, у ІІІа, ІІІб, ІІІв необхідність ендоскопічного моніторингу визначається індивідуально залежно від наявності клінічних ознак зупинки кровотечі, в разі необхідності – 12-24 год, 1 раз за добу.
До групи моніторингу увійшли 32 (40,0%) пацієнта: із зупиненою ендохірургічними методами активною кровотечею та високим ризиком розвитку рецидиву кровотечі – 24 (75,0%) та з ознаками зупиненої кровотечі та середнім ризиком розвитку рецидиву кровотечі, яким проведено заходи, спрямовані на профілактику розвитку рецидиву кровотечі, – 8 (25,0%). При повторному ендоскопічному дослідженні ендохірургічні заходи гемостазу та профілактики рецидиву кровотечі застосовані ще у 4 (12,5%) пацієнтів з проведенням у них подальшого ендоскопічного моніторингу.
Підготовку кишечника для ендоскопічного моніторингу проводили прийомом половинної дози осмотичних послаблювальних препаратів або за допомогою сифонних та очисних клізм. Рецидиви кишкової кровотечі на тлі повноцінної консервативної гемостатичної терапії діагностовано у 9 (9,7%) пацієнтів. Рецидив кровотечі – це критичний стан, при якому відбувається зрив вже включених компенсаторних механізмів, що призводить до прогресуючого погіршення стану пацієнта та має негативний прогноз перебігу захворювання.
У випадку виникнення рецидиву кровотечі у хворих, які знаходяться на етапі пролонгованого клініко-ендоскопічного моніторингу, показано проведення екстреного оперативного лікування за життєвими показаннями, за виключенням пацієнтів з наявністю супутньої патології в стадії декомпенсації, неоперабельного раку IV клінічної групи та тих, що відмовилися від операції. Ці хворі підлягають подальшому клініко-ендоскопічному моніторингу з інтервалами оглядів через кожні 3-6 год і повторним проведенням методів ендохірургічного гемостазу.
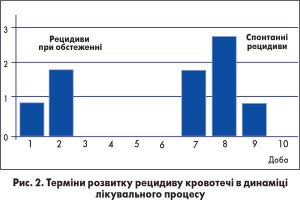
Рецидиви кровотечі виникли під час обстеження хворого чи підготовки до обстеження у 3 (33,3%) та були спонтанні у 6 (66,7%). Рецидиви, що були пов’язані з обстеженням, виникли на 1-шу (1 випадок) та на 2-гу добу (2 випадки). Причиною стало поєднання механічної дії на пухлину сифонними клізмами та нестійкого гемостазу в зоні деструкції ракової тканини.
Спонтанні рецидиви виникли на 7-му добу у 2 (33,3%) пацієнтів, на 8-му – у 3 (50,0%), на 9-ту – у 1 (16,7%). Пояснення лежить в морфологічних особливостях ендофітних форм ГКРР, при яких пухлина росте в глибину з деструкцією стінки кишки, утворюючи масивні некрози, з відторгненням коагуляційного струпа саме на 7-10-ту добу з розвитком спонтанного масивного рецидиву кровотечі (рис. 2).
Аналіз термінів розвитку рецидиву кровотечі представлено на рисунку 2.
Проведено детальний аналіз характеристик злоякісних колоректальних пухлин, які були джерелом профузних кровотеч та рецидивів кровотеч. Більшість з них мали виразково-інфільтративний тип росту зі ступенем диференціювання G3, що пояснюється їх патоморфологічними особливостями.
На підставі отриманих даних нами була виділена група з 16 хворих з ендофітними колоректальними карциномами низького та середнього ступенів диференціювання, яким проведено ендоскопічний моніторинг на 6-7-му добу постгеморагічного періоду. Ознак кровотечі не виявлено у 13 (81,3%) випадках, а у 3 (18,7%) виявлено стигмати спонтанно зупиненої кровотечі у вигляді дрібних тромбованих судин та гематину, причому клінічних ознак рецидиву кровотечі не спостерігалося. Хворим проведено ендохірургічні заходи профілактики розвитку рецидиву кровотечі та подовжений термін консервативної гемостатичної терапії.
Отже, у І періоді лікування мініінвазивні методи ендохірургічного гемостазу були вжиті у 6 (4,1%) із 148 пацієнтів з ГКРР, у всіх випадках кровотечу зупинено. Масивна триваюча кровотеча спостерігалась у 3 (2,0%) хворих, що не дозволило провести обстеження товстої кишки та використати ендохірургічні заходи гемостазу, ці хворі оперовані в екстреному порядку на висоті кровотечі. Рецидив кровотечі виник у 7 (4,7%) хворих, серед яких ендоскопічно верифіковано джерело кровотечі у 5, але ендохірургічні втручання на субстраті кровотечі не проводилися.
Прооперовано 59 (39,9%) пацієнтів із 148. В екстреному порядку оперативне лікування проведено у 8 (13,6%) хворих: на висоті кровотечі у 3 (37,5%) та на висоті рецидиву кровотечі у 5 (62,5%), з летальністю 50,0% (4 хворих). У ранньому відстроченому періоді оперований 51 (86,4%) хворий, летальних випадків не було. Симптоматична терапія проведена у 89 (60,1%) пацієнтів, з яких померло 11 (12,4%). Загальна летальність становила 10,1% (15 хворих), а післяопераційна – 6,8% (4 хворих).
У ІІ періоді лікування хворих мініінвазивні методи ендохірургічного гемостазу було вжито у 80 (86,0%) із 93 хворих на ГКРР. Всього їм було проведено 119 (1,5 на 1 хворого) мініінвазивних методів ендохірургічного гемостазу під час проведення ендоскопічного моніторингу. У всіх 24 пацієнтів з триваючою кровотечею вдалося ендоскопічно зупинити її (ефективність – 100%).
Рецидив кровотечі виник у 2 (2,2%) хворих, що статистично достовірно менше, ніж у І періоді (р<0,05). Поширеність ракового процессу визначила протипоказання до оперативного лікування цих хворих, кровотечу зупинено ендохірургічними заходами гемостазу, помер 1 (50,0%) пацієнт від поліорганної недостатності.
Оперовано 46 (49,5%) хворих з 93. Всі оперативні втручання виконані у ранньому відстроченому періоді.
Летальних випадків не було. Симптоматичну терапію проведено у 47 (50,5%) пацієнтів, з яких померло 5 (10,6%). Загальна летальність становила 5,4% (5 хворих), серед оперованих хворих летальних випадків не було (табл.).
Таким чином, застосування розробленого алгоритму хірургічної тактики у ІІ періоді лікування хворих на ГКРР дозволило знизити кількість екстрених операцій з 13,6 до 0% порівняно з І періодом, тим самим ліквідувати летальність після екстрених операцій, яка досягала 50,0%, у тому числі після оперативних втручань на висоті кровотечі – 66,7% (2 хворих з 3) та на висоті рецидиву кровотечі – 40,0% (2 хворих з 5). Досягнуто зниження післяопераційної летальності з 6,8 до 0% та загальної летальності з 10,1 до 5,4%. Поряд з цим збільшено хірургічну активність з 39,9 до 49,5%, кількість оперативних втручань, що проводились у ранньому відстроченому періоді, – з 86,4 до 100% та питому вагу радикальних оперативних втручань з 79,7 до 89,1%.
Висновки
1. Розробка лікувально-діагностичного алгоритму базується на екстреній та повноцінній діагностиці, ефективному ендохірургічному гемостазі та ендоскопічній профілактиці розвитку рецидиву кровотечі з наступним клініко-ендоскопічним моніторингом, що забезпечує стабільний перебіг постгеморагічного періоду та суттєво впливає на зменшення частоти екстрених операцій, які проводяться з невиправданим ризиком для життя хворого, супроводжуючись високою частотою післяопераційних ускладнень та летальності.
2. Застосування розробленого алгоритму хірургічної тактики у ІІ періоді лікування хворих дозволило знизити кількість екстрених операцій з 13,6 до 0% порівняно з І періодом, збільшити кількість операцій у ранньому відстроченому періоді з 86,4 до 100% і тим самим досягти зменшення загальної летальності з 10,1 до 5,4% та післяопераційної летальності з 6,8 до 0%, у тому числі після екстрених операцій з 50,0 до 0%.
3. Вважаємо операції на висоті кровотечі у хворих на ГКРР надто небезпечними, що пов’язано з високою післяопераційною летальністю; доцільно застосовувати комплекс мініінвазивних методів ендохірургічного гемостазу для здійснення зупинки активної кровотечі та профілактики розвитку її рецидиву і оперувати хворих у ранньому відстроченому періоді.
Дотримання такої тактики є доцільним з точки зору зменшення ризику для життя хворого і можливості виконання радикальних оперативних втручань, за результатами наших досліджень, у 89,1% хворих на ГКРР.
Література
1. Алгоритм лечения осложненных форм колоректального рака / С.В. Антипова, Е.В. Калинин, В.В. Шляхтин, Р.А. Галат // Укр. мед. альманах. – 2009. – № 1. – С. 10-14.
2. Алгоритм лечения осложненных форм рака толстой кишки / А.В. Шелехов, В.В. Дворниченко, Р.И. Расулов, Н.И. Минакин // Бюл. Восточно-Сиб. науч. центра Сиб. отд-ния Рос. акад. мед. наук. – 2005. – № 1. – С. 110-116.
3. Белозьоров І.В. Тактика лікування колоректального раку, що ускладнений кровотечею / І.В. Белозьоров // Харківська хірургічна школа. – 2013. – № 3. – С. 142-143.
4. Кащенко В.А. Вопросы стандартизации хирургического лечения рака ободочной кишки / В.А. Кащенко, В.П. Петров, Е.Л. Васюкова // Колопроктология. – 2014. – № 2. – С. 4-9.
5. Кондратенко П.Г. Хирургическая тактика у больных с острыми кровотечениями из злокачественных опухолей пищеварительного канала / П.Г. Кондратенко, Н.Л. Смирнов // Хірургія України. – 2005. – № 3. – С. 23-25.
6. Лечение больных с осложнениями злокачественных опухолей ободочной кишки / В.В. Дарвин, А.Я. Ильканич, С.В. Онищенко, Н.В. Климова // Хирургия. – 2007. – № 6. – С. 8-12.
7. Нарезкин Д.В. Оказание лечебной помощи больным с осложненным колоректальным раком в общехирургическом стационаре / Д.В. Нарезкин, С.Н. Щаева // Колопроктология. – 2011. – № 4. – С. 38-40.
8. Особенности хирургической тактики у больных осложненным колоректальным раком / А.А. Маслов, И.С. Тищенко, Г.В. Каминский, Л.Х. Чалхахян // Сибирский онкологический журнал. – 2009. – Прил. № 2. – С. 131-132.
9. Острые желудочно-кишечные кровотечения опухолевой этиологии / А.П. Михайлов, А.М. Данилов, А.Н. Напалков [и др.] // Вестник хирургии им. И.И. Грекова. – 2006. – № 1. – С. 79-81.
10. Щаева С.Н. Современные аспекты хирургического лечения больных осложненным колоректальным раком на региональном уровне / С.Н. Щаева, Д.В. Нарезкин // Онкологическая колопроктология. – 2012. – № 4. – С. 36-38.
11. Abdel-Razek A.Н. Challenge in diagnosis and treatment of colonic carcinoma emergencies / A.H. Abdel-Razek // Alexandria J. Med. – 2012. – Vol. 48, N2. – P. 109-113.
12. Complete mesocolic excision with central vascular ligation produces an oncologically superior specimen compared with standard surgery for carcinoma of the colon / N.P. West, W. Hohenberger, K. Weber [et al.] // J. Clin. Oncol. – 2010. – Vol. 28, N2. – P. 272-278.
13. Emergency colonic surgery: analysis of risk factors predicting morbidity and mortality / G. Costa, F. Tomassini, S.M. Tierno [et al.] // Chir. Ital. – 2009. – Vol. 61, N5-6. – P. 565-571.
14. Urgent surgery in colon carcinoma / S. Merkel, C. Meyer, T. Papadopoulos [et al.] // Zentralbl. Chir. – 2007. – Vol. 132, N1. – P. 16-25.