4 лютого, 2017
Особливості формування гепатикоєюноанастомозів методом високочастотного електрозварювання м’яких тканин в клінічній практиці
В поточній хірургічній практиці актуальною залишається проблема накладання біліодигестивних анастомозів з метою відновлення магістрального жовчовідтоку. Формування біліодигестивних анастомозів проводиться при реконструктивних оперативних втручаннях на позапечінкових жовчних протоках – як паліативне симптоматичне втручання чи як радикальна операція у хворих з пухлинною та непухлинною патологією за наявності синдрому обтураційної жовтяниці. Також накладання зазначених анастомозів є основним методом лікування при пошкодженнях жовчовивідних проток. Серед методів відновлення магістрального жовчовідтоку на сьогодні гепатикоєюностомія на Ру петлі займає домінуюче місце і є стандартною операцією [1, 2, 6, 12].
Проте рівень ускладнень після накладання гепатикоєюноанастомозів (ГЄА) залишається досить високим, ранні ускладнення (неспроможність швів, формування абсцесу, жовчотеча з анастомозу, холангіт) виникають приблизно у 20% хворих, віддалені проявляються здебільшого у вигляді стриктур і становлять 10-30% [8, 9, 13]. Також значні труднощі виникають за наявності виражених запальних явищ в зоні операції, а розвиток гнійного холангіту чи жовчного перитоніту часто є протипоказом до виконання реконструктивних втручань через високу загрозу неспроможності шовних анастомозів [9, 10]. На сьогоднішній день триває пошук нових методів формування біліодигестивних анастомозів, як в умовах незапалених, так і в умовах запалених тканин [5, 7, 11].
Метою нашого дослідження було розробити новий спосіб формування біліодигестивних анастомозів, який би дозволив зменшити кількість післяопераційних ускладнень, а також дав би можливість формувати анастомози, як на незапалених, так і на запалених тканинах.
Матеріали і методи. Для досягнення цієї мети було розроблено спосіб формування ГЄА методом високочастотного (ВЧ) електрозварювання м’яких тканин. В основі електрозварювання біологічних тканин лежить метод біполярної діатермокоагуляції. З’єднання живих м’яких тканин при ВЧ-електрозварюванні досягається шляхом теплової денатурації глобулярних білків, процес відбувається у вигляді коагуляції. Коагуляції білків передує пробій (руйнування) мембран клітин і утворення загального для з’єднуваних об’ємів білкового простору, коагуляція якого і приводить до утворення з’єднання.
Для отримання з’єднання проводиться нагрівання тканини струмом високої частоти (66 кГц) з додатковою модуляцією прямокутними імпульсами на частоті 5 кГц. При проходженні електричного струму бранші зварювального інструменту щільно зводяться, в результаті між структурами, що зварюються, утворюється коагуляційна плівка, яка щільно і герметично їх з’єднує. При цьому температура в місці зварювання не перевищує 70-80 °C, що є цілком достатнім для утворення міцного з’єднання та запобігає виникненню коагуляційного некрозу тканин [3].
Розробку та успішну апробацію формування біліодигестивних анастомозів методом ВЧ-електрозварювання було проведено в ході експериментального дослідження на 50 кролях. Тваринам накладали зварювальні холецистоентеро- та ентероентероанастомози, як на незапалених, так і на запалених тканинах в умовах змодельованого жовчного перитоніту [4]. В різні терміни післяопераційного періоду проводили визначення прохідності, герметичності та міцності зварювальних анастомозів, здійснювали макро- і мікроскопічне оцінювання ділянки зварювального шва. Також тваринам накладали традиційні шовні анастомози та порівнювали результати, отримані в обох групах. Отримані в ході експериментального дослідження результати засвідчили надійність та безпечність анастомозів, сформованих методом ВЧ-електрозварювання, що дозволило почати використання цього методу в клінічній практиці.
Методом ВЧ-електрозварювання в клініці було сформовано 14 ГЄА. З приводу злоякісних пухлин періампулярної зони було прооперовано 8 пацієнтів, у 5 з них накладено паліативні ГЄА, у 3 – ГЄА були сформовані при проведенні панкреатодуоденальної резекції. Інші 6 хворих були прооперовані з приводу доброякісних захворювань та пошкоджень позапечінкових жовчних проток. У однієї хворої була рубцева стриктура гепатикохоледоха, яка виникла через 9 міс після холецистектомії, у 2 пацієнтів діагностовано рубцеві стриктури ГЄА, які утворилися через 10 міс та 5 років після накладання цих анастомозів. Ще у 2 пацієнтів зварювальні ГЄА формували на тлі гострого гнійного холангіту та у однієї хворої – на тлі локального жовчного перитоніту на 8-й день після ятрогенного пошкодження гепатикохоледоха ІІ типу за класифікацією Бісмута.
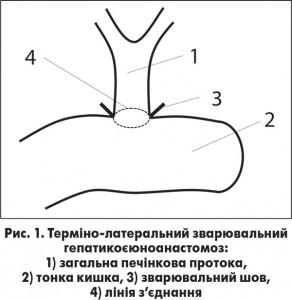
ГЄА формували між загальною печінковою протокою та петлею тонкої кишки, виключеної за Ру. Порожню кишку пересікали на відстані 20-30 см від зв’язки Трейца та формували Ру петлю довжиною 80-100 см, яку проводили позадуободово. Загальну печінкову протоку (ЗПП) циркулярно виділяли та пересікали (виділяли раніше пересічений дистальний кінець) на проміжку від конфлюенса правої і лівої печінкових проток до місця впадіння в неї міхурової протоки. На відстані близько 3 см від заглушеного кінця порожньої кишки вздовж її поздовжньої осі проводили лінійний розріз довжиною відповідно до діаметру ЗПП.
Формування ГЄА починали з накладання 3 евертуючих П-подібних швів-трималок. Шви накладали атравматичною ниткою PDS4/0. Перший П-подібний шов накладали посередині задньої стінки майбутнього анастомозу. Два наступних шви накладали на передню стінку таким чином, щоб після їх розтягнення утворився рівносторонній трикутник. Зазначені шви співставляли з’єднувані органи та виконували функцію трималок, забезпечували фіксацію та полегшували маніпулювання. Крім того, що шви-трималки зводили з’єднувані органи, вони також забезпечували вивертання країв ЗПП та тонкої кишки, чим значно полегшували та пришвидшували процес зварювання. Також за рахунок того, що шви-трималки мають П-подібну форму та зав’язуються ззовні, шовний матеріал не контактує з просвітом анастомозу.
Наступним етапом проводили накладання точкових зварювальних з’єднань (швів) по всьому периметру анастомозу. Зварювальні шви накладали прямим біполярним пінцетом з мідно-молібденовими зварювальними поверхнями шириною 3,5-4 мм. За допомогою пінцета захоплювали стінки ЗПП та тонкої кишки на глибину 3-4 мм і помірно стискували, зварювання проводили за допомогою апарата «Патонмед ЕКВЗ‑300» в режимі «Ручне зварювання», параметри струму та час, необхідний для зварювання, визначалися автоматично. Зварювання проводили в проміжках між швами-трималками, зварювальні шви накладали послідовно один за одним. Всі зварювальні шви були евертуючими – слизова до слизової. Таким чином отримували зварювальний шов по всьому периметру анастомозу. Другий ряд швів не накладали (рис. 1).
Серед особливостей формування зварювальних анастомозів можна виділити те, що найбільш складними для зварювання місцями були точки біля першого шва на задній стінці. Але маніпулюючи швами-трималками, легко вдавалося ротувати задню стінку в зручну для зварювання площину.
Результати та їх обговорення. В результаті проведеного експериментального дослідження встановлено, що всі анастомози, сформовані методом ВЧ-електрозварювання, були прохідні та герметичні, а також мали достатню початкову міцність (40-100 мм рт. ст.), міцність зварювального шва в післяопераційному періоді зростала в лінійній прогресії і через 3 тижні досягала міцності інтактної кишки (240-250 мм рт. ст.).
Впровадження методу в клінічну практику підтвердило достатню міцність та герметичність зварювального шва відразу після його накладання та в подальшому післяопераційному періоді. Ці висновки зроблено як на основі відсутності клінічної симптоматики жовчотечі, так і даних інструментальних методів обстеження, таких як УЗД та магнітно-резонансна панкреатохолангіографія (МРПХГ), проведених в різні терміни післяопераційного періоду.
Для більш інформативного висвітлення результатів представляємо клінічний приклад. Хворий Н., 66 років, поступив 12.04.2016 з діагнозом: Пухлина підшлункової залози. Механічна жовтяниця. Цукровий діабет 2 типу. В анамнезі за місцем проживання дві невдалі спроби ендоскопічного стентування жовчовивідних проток, після чого 18.03.2016 накладено розвантажувальну холецистостому. Результати обстежень при поступленні: загальний білірубін – 145,8 мкмоль/л, прямий білірубін – 97,3 мкмоль/л, аланінамінотрансфераза – 53 Од/л, аспартатамінотрансфераза – 57 Од/л, протромбіновий час – 19 с, протромбіновий індекс – 68%. Індекс MELD (Model For End-Stage Liver Disease), який дозволяє оцінити ступінь ураження печінки, становив 15 балів, що відповідає 6% прогностичного летального наслідку від печінкової недостатності протягом 3 наступних місяців.
18.04.2016 виконано операцію: Холецистектомія. Гепатикоєюностомія на Ру петлі. Біопсія підшлункової залози. Інтраопераційно виявлено, що підшлункова залоза збільшена, на всьому протязі бугриста, щільноеластичної консистенції, малорухома. Печінка значно збільшена, застійна, циротично змінена. Холедох незначно розширений до 1,1 см. Взято біопсію з головки підшлункової залози (аденокарцинома), виконано холецистектомію, сформовано терміно-латеральний ГЄА за запропонованою методикою, ділянку анастомозу дреновано двома трубчатими дренажами.
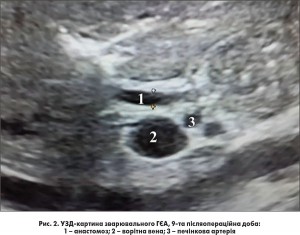
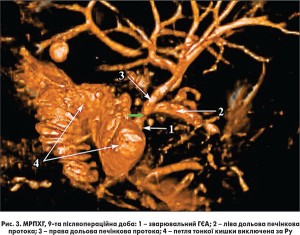
Післяопераційний період перебігав без ускладнень, виділення жовчі по дренажах не спостерігали, загальний білірубін – 60,2 мкмоль/л, прямий білірубін – 41,7 мкмоль/л, аланінамінотрансфераза – 20 Од/л, аспартатамінотрансфераза – 28 Од/л. Через 9 днів після операції проведено УЗД органів черевної порожнини та МРПХГ, даних за неспроможність чи стенозування ГЄА не виявлено (рис. 2, 3). На 10-ту післяопераційну добу в задовільному стані хворого виписано зі стаціонару.
Через 2 місяці після операції після курсу хіміотерапії хворий пройшов планове обстеження: загальний білірубін – 21,5 мкмоль/л, прямий білірубін – 14,7 мкмоль/л, аланінамінотрансфераза – 24 Од/л, аспартатамінотрансфераза – 30 Од/л. За даними УЗД органів черевної порожнини діаметр загальної печінкової протоки – 8 мм, ГЄА прохідний.
Ускладнення відмічені в одному випадку після проведення ПДР, на 6-ту післяопераційну добу у хворого на тлі гіпопротеїнемії (загальний білок – 49,5 г/л) виникла часткова неспроможність панкреатоєюноанастомозу з виділенням по дренажу підшлункового соку. Після чого на 9-ту післяопераційну добу, вірогідно внаслідок літичної дії панкреатичних ферментів, виникла часткова неспроможність ГЄА. Консервативна терапія протягом 12 днів привела до усунення ускладнення. В інших пацієнтів зварювальні анастомози були спроможні. Окремо можна виділити хворого В., 46 років, з множинними метастазами в печінці, в післяопераційному періоді протягом 7 днів відмічалася виражена лімфорея, внаслідок якої виникла гіпопротеїнемія (53,9 г/л) – даних щодо неспроможності зварювального шва не було. Також добру прохідність ГЄА підтверджують лабораторні дані – рівень загального білірубіну, який до операції в середньому становив 134,2±18,8 мкмоль/л, в післяопераційному періоді стрімко знижувався і на момент виписки в середньому сягав 36,0±6,3 мкмоль/л. Максимальний час спостереження за цими хворими становить 9 міс, даних стосовно ускладнень зі сторони гепатобіліарної системи не виявлено.
Висновки
1. Формування ГЄА методом ВЧ-електрозварювання м’яких тканин є надійним та безпечним.
2. ГЄА, сформовані методом ВЧ-електрозварювання, прохідні та герметичні.
3. Зварювані тканини отримують помірну термічну травму і в подальшому в ділянці зварювального шва відбуваються типові регенераторні процеси.
4. При формуванні евертуючих ГЄА досягається чітке співставлення слизових оболонок з’єднуваних органів, за рахунок чого попереджується надмірне розростання рубцевої тканини і, відповідно, зменшується ризик подальшого утворення стриктур та стенозу анастомозів.
5. Метод ВЧ-електрозварювання однаковою мірою дає можливість накладати ГЄА як в умовах незапалених, так і в умовах запалених тканин.
Література
1. Гальперин Э.И. Руководство по хирургии желчных путей / Под ред. Э.И. Гальперина, П.С. Ветшева. – 2-е изд. – М.: Видар, 2009. – 563 с.
2. Ничитайло М.Е. Повреждения желчных протоков при холецистэктомии и их последствия / Ничитайло М.Е., Скумс А.В. – К.: Макком, 2006. – 344 с.
3. Основные биофизические свойства мягких живых тканей при электросварке / А.В. Лебедев, А.Г. Дубко, Е.Г. Лопаткина // Вісник НТУ України «Київський політехнічний інститут». – 2011. – № 61. – С. 130-133.
4. Формування біліодигестивних та міжкишкових анастомозів в умовах жовчного перитоніту з використанням ВЧ-електрозварювання в експерименті / М.Ю. Ничитайло, Ю.О. Фурманов, А.І. Гуцуляк [та ін.] // Клінічна хірургія. – 2016. – № 1. – С. 65-68.
5. An extrahepatic bile duct grafting using a bioabsorbable polymer tube / M. Aikawa, M. Miyazawa, K. Okamoto [et al.] // J Gastrointest Surg. – 2012. – Vol. 16, № 3. – Р. 529-534.
6. Blumgart`s Surgery of the liver, biliary tract and pancreas / L.H. Blumgart, W.R. Jarnagin, J. Belghiti [et al.] – Philadelphia: Elsevier saunders. – 5th edition, 2012. – 2021 p.
7. Healing of stoma after magnetic biliary-enteric anastomosis in canine peritonitis models / J.H. Li, L. Guo, W.J. Yao [et al.] // Chin Med Sci J. – 2014. – Vol. 29, № 2. – Р. 91-97.
8. Long-term outcome after early repair of iatrogenic bile duct injury. A national Danish multicentre study // N.M. Stilling, C. Fristrup, A. Wettergren [et al.] // HPB (Oxford). – 2015. – Vol. 17, № 5. – Р. 394-400.
9. Reconstruction of major bile duct injuries after laparoscopic cholecystectomy / K. Holte, L. Bardram, A. Wettergren, A. Rasmussen // Dan. Med. Bul. – 2010. – Vol. 57, № 2. – Р. 413-415.
10. Referral pattern and timing of repair are risk factors for complications after reconstructive surgery for bile duct injury / P.R. de Reuver, I. Grossmann, O.R. Busch [et al.] // Ann Surg. – 2007. – Vol. 245, № 5. – Р. 763-770.
11. Repair of bile duct defect with degradable stent and autologous tissue in a porcine model / Y.L. Liang, Y.C. Yu, K. Liu [et al.] // World J Gastroenterol. – 2012. – Vol. 18, № 37. – Р. 5205-5210.
12. Techniques of biliary reconstruction following bile duct resection / S. Hirano, E. Tanaka, T. Tsuchikawa // J Hepatobiliary Pancreat Sci. – 2012. – Vol. 19, № 3. – Р. 203-209.
13. Treatment of failed Roux-en-Y hepaticojejunostomy after post-cholecystectomy bile ducts injuries / A. Benkabbou, D. Castaing, C. Salloum [at al.] // Surgery. – 2013. – Vol. 153, № 1. – P. 95-102.