7 лютого, 2017
Открытие аутоантител к антигенам бета-клеток поджелудочной железы у человека – революционный этап в предсказании развития сахарного диабета 1 типа у «здорового» человека

Сахарный диабет (СД) остается в настоящее время бичом человечества, унося из жизни ежегодно миллионы людей во всех странах мира. Особенно большую озабоченность вызывает тот факт, что рост этого заболевания из года в год драматически прогрессирует и носит характер пандемии. По данным международной диабетической ассоциации (IDF), количество больных СД в 2015 году на нашей планете исчисляется 415 млн человек, а по эпидемиологическим прогнозам, в 2040 году оно достигнет 624 млн. Прогрессивно увеличивается и частота СД 1 типа (СД1Т) у детей. Так, с 1960 года число детей, больных СД1Т, возрастает ежегодно на 3-5% (C.C. Patterson et al., 2009). Количество детей и подростков, больных СД1Т, в мире составляет 542 тыс. человек, среди которых впервые выявленных – 86 тыс. В 2015 году в мире умерли 5,1 млн больных СД, то есть каждые 6 с умирал один больной.
Эпидемиологические исследования последних лет также показали динамическое возрастание заболеваемости и в Украине. Так, согласно официальным данным (Довідник ІЕОР, 2016) количество всех зарегистрированных больных СД в Украине в 2015 году составляло 1 233 600, а количество впервые выявленных детей (0-14 лет), больных СД1Т, достигло 87 420, то есть каждый 12-й ребенок из 1 тыс. нормогликемических детей всей Украины.
СД является не только огромной медицинской проблемой, но и социальной. Общество несет колоссальные затраты на лечение СД и его осложнений: сердечно-сосудистых, почечных, офтальмологических и др. Согласно данным IDF в 2015 году только на обеспечение больных инсулином, другими сахароснижающими средствами и уход было потрачено в мире 673 биллиона долларов, а в 2040 году предполагается затратить 800 биллионов долларов.
Согласно современным представлениям СД1Т является хроническим аутоиммунным заболеванием, возникающим в результате комплексного взаимодействия генетической предрасположенности и факторов внешней среды, при котором происходит постепенное селективное органоспецифическое снижение числа и функции инсулин-продуцирующих бета-клеток в поджелудочной железе (M.A. Atkinson, S. Eisenbarth, A.W. Michels, 2014; A.G. Ziegler et al., 2016). Когда масса разрушенных или функционально угнетенных бета-клеток достигает 80-90%, возникает инсулиновая недостаточность, приводящая к нарушению гомеостаза глюкозы в организме и появлению клинических симптомов. СД1Т может возникать в любом возрасте, но в основном в раннем детском и юношеском (ювенильный СД1Т), и, реже, в более поздние годы (взрослый СД1Т) (M.J. Hawa et al., 2013; E. Bonifacio, 2015).
Характерной особенностью этиопатогенеза СД1Т является довольно длительная (длящаяся иногда годами) асимптомная фаза развития, то есть скрытый доклинический период – от начала возникновения аутоиммунного процесса в островках Лангерганса (ОЛ), сопровождаемого деструкцией и дисфункцией бета-клеток, до клинического проявления заболевания.
До недавнего времени отсутствовали достоверные методы выявления наличия аутоиммунного процесса в ОЛ поджелудочной железы человека в доклиническую стадию патогенеза СД1Т. Наши знания об этом вопросе основывались преимущественно на данных, полученных в опытах на моделях СД1Т у лабораторных животных. Вместе с тем исследования, проведенные на экспериментальных животных, при всей их научной ценности не могут быть полностью экстраполированы на заболевания у людей в связи с уникальной видовой специфичностью их иммунной системы, особенностью клинического течения, неодинаковой длительностью жизни и социальными факторами (H.A. Drexhageet al., 2016).
Знаменательным событием в изучении патогенеза СД1Т, особенно асимптомной доклинической стадии его развития, стало открытие в конце прошлого столетия аутоантител к антигенам ОЛ поджелудочной железы – островковых аутоантител (ОАА) у человека. Благодаря этим достижениям появились надежные уникальные иммунологические биомаркеры, дающие возможность прижизненного нетравматического выявления аутоиммунного процесса в ОЛ, которое приводит к гибели бета-клеток у практически здорового человека задолго (от месяцев до многих лет) до появления у него стабильной гипергликемии, то есть развитие клинической манифестации заболевания.
Впервые островковые аутоантитела были обнаружены к антигенам цитоплазмы ОЛ (ICA) в сыворотке периферической крови (ПК) больных СД1Т (G.F. Bottаzo et al., 1974). В настоящее время описаны и успешно используются в клинической практике еще четыре других классических сывороточных аутоантитела против антигенов бета-клеток: IAA, GADA, IA‑2A и ZnT8А.
Появление стандартизированных методов определения различных ОАА (ICA, IAA, GADA, IA‑2A и ZnT8A) и выпуск многими фирмами стандартных наборов реактивов для их определения у человека стимулировали создание ряда многолетних, проспективных международных и национальных Программ по изучению возможности использования ОАА с диагностической целью, а также более глубокого изучения иммунных механизмов, происходящих в организме человека, предшествующих развитию клинически установленного СД1Т. К таким приоритетным международным программам прежде всего следует отнести: BABYDIAB (Baby Diabetes), DAISY (Diabetes Autoimmunity Study in the Young), DIPP (Diabetes Prediction and Prevention Study), TEDDY (The Environmental Determinations in the Young), TRIGR (Trial to Reduce IDDY in Genetically in Risk) и другие подобные программы.
Весьма важным вопросом при исследовании ОАА являются методы их определения. В настоящее время существуют три основных метода определения титра ОАА в сыворотке ПК человека: радиоиммунологический, электрохемилюминесцентный и иммуноферментный (ELISA). Наиболее высокочувствительным и специфическим среди них считается радиоиммунологический, но он наиболее дорогой и для его использования требуются специальные условия (E. Bonnifacio, 2015). Хемилюминесцентный метод также довольно чувствительный, но редко используемый, так как наиболее специфичен только при определении IAA и GADA (L. Yu et al., 2013).
Иммуноферментный метод ELISA является самым распространенным и более дешевым для определения ОАА, но до недавнего времени считающийся менее чувствительным, чем радиоиммунологический. Однако после его модификации и создания нового трехскринингового метода (RSR) было установлено, что модифицированный метод ELISA не уступает радиоиммунологическому, причем его возможно использовать даже при небольшом количестве капиллярной крови (I. Raab et al., 2016).
В клинической практике методы определения ОАА в настоящее время используются в основном в трех целях: 1) диагностики асимптомной доклинической стадии и предсказания возникновения СД1Т; 2) установления наличия сохранившихся функционирующих ОЛ при уже развившемся начальном СД1Т; 3) более точной дифференциации взрослого СД1Т (LADA) от СД2Т.
Как уже указывалось, выдающимся достижением иммунодиабетологии последних десятилетий следует считать открытие аутоантител к ОЛ поджелудочной железы, которые расширили возможности диагностики СД1Т у человека и изучения доклинической стадии его патогенеза. К ним прежде всего следует отнести разработку методов прижизненного нетравматического определения различных ОАА, которые считаются достоверным способом предсказания риска развития СД1Т у «здорового» человека задолго (от месяцев до многих лет) до возникновения клинических симптомов заболевания (A.G. Ziegler et al., 2013; E. Bonifacio, 2015). Однако при этом, естественно, возникает вопрос, какие же из пяти ныне используемых ОАА или их сочетания обладают наиболее высокой диагностической ценностью для предсказания риска развития клинически диагностируемого СД1Т.
Вместе с тем следует отметить, что при исследовании титра сывороточных ОАА у детей начиная с рождения был выявлен чрезвычайно важный факт – очень раннее появление в ПК ОАА (сероконверсия). Пик сероконверсии происходит между 1 и 3 годами. До 6 мес ОАА у младенцев обнаруживаются очень редко.
У многих детей (особенно с генотипом HLA-DR/DQ), у которых развивается СД1Т, он подтверждается определением четырех аутоантител (IAA, GADA, IA‑2A и ZnT8). Причем даже при позитивном титре 2 ОАА риск развития СД1Т >80% (A.G. Ziegler et al., 2013; I.P. Krischer et al., 2015; G. Bonifaccio, 2015).
Следовательно, самое раннее установление риска развития СД2Т необходимо проводить уже на первых годах жизни ребенка (до 5 лет) в виде тестирования на наличие комплекса различных ОАА (I. Raab et al., 2016). К слову, эти данные стимулировали идею создания иммунных препаратов, препятствующих развитию СД1Т в самом раннем возрасте ребенка, то есть наподобие вакцин, которые сейчас успешно применяются для профилактики детских инфекционных заболеваний и туберкулеза (E. Bonifacio et al., 2015; A.G. Zielger et al., 2016).
Для лучшего понимания целесообразности использования того или иного ОАА или их комплекса в клинической практике рассмотрим диагностическую ценность каждого из них в отдельности.
IAA – аутоантитела к инсулину, которые были впервые выделены в 1983 г. Они считаются наиболее специфичными к антигенам бета-клеток, появляются в организме ребенка самыми первыми. По данным некоторых авторов (M. Schlosser et al., 2014), было установлено, что обнаружение одного IAA дает возможность только предсказать развитие СД1Т преимущественно у детей до 5-летнего возраста. Причем величина их титра и частота выявления находится в обратной связи с возрастом. После достижения детьми 12-летнего возраста у большинства из них IAA не обнаруживается. Недавно было показано, что риск возникновения СД1Т у IAA-положительных детей во многом зависит также от степени аффинности IAA – чем она больше, тем значительнее повышен риск развития СД1Т (L. Yu et al., 2013).
GADA – аутоантитела к декарбоксилазе глутаминовой кислоты, открытые в 1982-1990 гг. Антиген GAD является фрагментом глютаминовой кислоты, участвует в регуляции глюкозой секреции инсулина. Он является самым широко используемым биомаркером для выявления аутоиммунной деструкции бета-клеток и прогрессирования СД1Т как в самом раннем детском возрасте, так и в более позднем, то есть при LADA (I. Vermenlen еt al., 2010).
Исследование титра различных ОАА у родственников больных СД1Т (первого, второго и третьего поколения) с нормальной толерантностью к глюкозе показало, что риск развития у них СД1Т (при использовании одного GADA) по происшествии 5 лет составлял 68%, то есть, что наиболее высоким риском предсказания диабета является позитивность к GADA, особенно у лиц молодого возраста и с наличием генотипов HLA II степени. Для более точного предсказания СД1Т кроме GADA требуется дополнительно определение еще одного ОАА (IAA, IA‑2A или ZnT8A) (P.I. Bingley et al., 2016).
IA‑2A – аутоантитела к протеину‑2-тирозин-фосфатазы / антигена‑2 инсулиномы – является фрагментом антигена GAD, состоящего из трех различных молекул: декарбоксилазы глютаминовой кислоты и двух протеинов тирозинфосфатазы: тирозинфосфатазы‑2 (ICA‑512) и фагрина (IA‑2βА). Считается одним из главных маркеров аутоиммунной деструкции бета-клеток, обладает высокой специфичностью при развивающемся диабете. Он часто используется, особенно в комплексе с другими ОАА, как биомаркер выявления ассимптомной фазы СД1Т (E. Bonifacio, 2015).
Значительное повышение достоверности предсказания наблюдается тогда, когда при обнаружении повышенного титра GADA в последующем дополнительно происходит появление в ПК и IA‑2A и, особенно, еще одного ОАА (P.Y. Bingley et al., 2016).
На основании исследований, проведенных на огромном количестве (несколько тысяч) пациентов, P. Xu и соавт. (2016) пришли к заключению, что предсказание развития СД1Т на основании определения GADA у лиц младше 16 лет во многом зависит от величины его титра. Так, при низком титре одних GADA диабет развивается у 11%, а при высоком титре – у 45% обследуемых. Еще больший процент предсказания СД1Т наблюдается при одновременном появлении GADA и IA‑2A (более 70%). IA‑2A, по мнению авторов, является лучшим маркером прогрессии дисгликемии (потеря толерантности к глюкозе, снижение продукции С-пептида, повышение уровня HbA1с). При сочетанном определении GADA и IA‑2A и ряда метаболических маркеров предсказание СД1Т возрастает более чем до 80%.
ZnT8A – аутоантитела к транспортеру ZnT8A, открыты в 2008 году позже всех ОАА, принадлежат к одним из наиболее достоверных и специфических маркеров предсказания возникновения СД1Т, особенно у детей (I.M. Wenzlauet al., 2007). При определении только одного ZnT8A он обнаруживается у 63% детей с впервые выявленным СД1Т. Определение ZnT8A совместно с GADA, IA‑2A и IAA по Программе DASР дает возможность предсказания развития СД1Т свыше 90% (M. Schlossen et al., 2014). Характерной особенностью ZnT8A является также то, что они обнаруживаются преимущественно в ОЛ, в то время как GADA и IA‑2A – во многих тканях (I. Labatschi, H.C. Herved, 2012). Считается, что обнаружение повышенного титра ZnT8A указывает на тенденцию быстрого прогрессирования СД1Т (E. Bonifacio, 2015).
Собственные исследования аутоантител к антигенам бета-клеток ОЛ поджелудочной железы и их использование как маркера аутоимунной деструкции ОЛ и для диагностирования асимптомной фазы развития СД1Т у детей и подростков нашей страны было начато в сентябре 1996 года, то есть двадцать лет тому назад. В октябре 1998 года план этих исследований, проводимых проспективно в ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины», был оформлен в виде первой в Украине Программы «Иммунитет в доклиническую стадию сахарного диабета 1 типа (ИДСД)» (Н.Д. Тронько и др., 2010).
Согласно плану исследований Программы ИДСД решается несколько задач:
1. Освоение и внедрение в клинику впервые в Украине методов определения титров ОАА (IAA, GADA и IA‑2A) в ПК с целью их использования как теста для диагностики асимптомной доклинической фазы развития СД1Т и предсказания риска возникновения клинического СД1Т у нормогликемических детей нашей страны.
Получение такой информации дало возможность: установить количество нормогликемических детей с отягощенной наследственностью, но с нормальной толерантностью к глюкозе, позитивных к ОАА в Украине и, следовательно, выделить группу риска по развитию СД1Т, требующую постоянного медицинского наблюдения. Полученные нами результаты дают возможность сравнить их с аналогичными данными Программ, проводимых в других странах Европы и США, то есть выявить региональные особенности.
2. Изучение ряда показателей функционального состояния естественного (содержание, ультраструктура и функция нейтрофилов, моноцитов и ЕК-клеток) и адаптивного иммунитета, иммунофенотипа лимфоцитов (CD3+T-, CD4+T-, CD8+T- CD20+ и CD56+клеток) и их ультраструктуры, а также содержание различных цитокинов (ИЛ‑1α, ИЛ‑1β, ИЛ‑2, ИЛ‑6, ИЛ‑10, ФНОα и ИФНγ), хемокинов (ИЛ‑8 и ИЛ‑16) и адипокинов (лептина и адипонектина) в ПК нормогликемических здоровых, ОАА-позитивных, ОАА-негативных с уже развившимся СД1Т детей с генетической склонностью к СД1Т. Результаты этой части исследований подробно изложены в недавно опубликованной нашей монографии (К.П. Зак, Н.Д. Тронько, В.В. Попова, А.К. Бутенко, 2015).
К концу 2016 года в реестр Программы ИДСД для клинико-иммунологического обследования внесен 561 ребенок и подросток обоего пола в возрасте от 7 до 15 лет без каких-либо видимых воспалительных, онкологических или аллергических заболеваний. Из них 457 нормогликемических детей, имеющих в семейном анамнезе отягощенную наследственность – родственники первой линии (отцы, матери, сибсы) больные СД1Т были отобраны для дальнейшего обследования (рис. 1). После тестирования на наличие ОАА (IAA, GADA и IA‑2A) они были разделены на две подгруппы: 1) ОАА-позитивные (n=161), то есть с повышенным титром хотя бы двух аутоантител GADA + IA‑2A (у детей до 10 лет определяли и IAA); 2) ОАА-негативные (n=296), у которых все ОАА не определялись даже при повторных измерениях. Контрольная группа (n=104) состояла из здоровых детей с нормогликемией без генетической наследственности и с отрицательными тестами на толерантность к глюкозе и наличие ОАА.
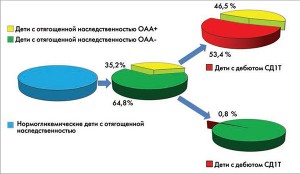 Рис. 1. Частота возникновения СД1Т у ОАА-позитивных и ОАА-негативных детей
Рис. 1. Частота возникновения СД1Т у ОАА-позитивных и ОАА-негативных детейс отягощенной наследственностью
У всех обследуемых детей определение титра ОАА проводили высокочувствительным радиоиммунологическим методом при помощи гамма-счетчика 5500В фирмы «Becton» (США) с использованием стандартизированных наборов реактивов для определения титров аутоантител IAA, GADA и IA‑2A фирмы «Cis Bio International» (Франция), контролируемых DASP и рекомендованных экспертами ВОЗ. Приведенные выше иммунологические исследования проводили одновременно с традиционным клиническим обследованием больных, то есть определением гликемического профиля, уровня HbA1c и др. проспективно в динамике, вплоть до манифестации диабета (у ОАА-позитивных детей).
Многолетние проспективные исследования (В.В. Попова, 2008, 2015; В.В. Попова, К.П. Зак, 2006, 2008; К.П. Зак и др., 2015), как видно из рисунка 1, показали, что при двукратном определении ОАА у 457 нормогликемических детей с отягощенной наследственностью повышенный титр GADA и IAA был обнаружен у 161 ребенка (35,2%), а 295 детей из этой подгруппы (64,8%) оказались отрицательными.
При этом у 76 детей из 161 ОАА-положительного ребенка (53,4%) в среднем через 30,9±3,2 месяца возник клинически диагностируемый СД1Т, в то время как у 75 обследуемых (58,5%) в оставшейся подгруппе ОАА-положительных детей это заболевание не было выявлено. У ОАА-отрицательных детей за этот же период времени СД1Т возник только у одного ребенка, то есть 0,8%. Полученные нами результаты оказались созвучны с данными большинства зарубежных программ по этому вопросу (E. Bonifacio, 2015; A.G. Ziegler, E. Bonifacio, 2012).
На рисунке 2 приводятся сравнительные данные о частоте возникновения СД1Т у различных когорт детей Украины: А – общей популяции – 0,12%; Б – нормогликемических, но с отягощенной наследственностью к СД1Т – 18,81%; В – ОАА-положительные с отягощенной наследственностью – 53,41%.
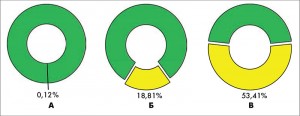 Рис. 2. Частота возникновения СД1Т у детей Украины: А – общей популяции,
Рис. 2. Частота возникновения СД1Т у детей Украины: А – общей популяции,Б – отягощенно наследственных, В – ОАА-положительных
Важно также отметить, что, по нашим данным, среди ОАА-положительных детей, у которых СД1Т страдал отец, диабет развивался значительно чаще (72,1%), чем у детей, у которых страдала диабетом мать (27,9%) (рис. 3). В этом отношении полученные нами результаты близки к данным других авторов (G.S. Eisenbarth, I. Jeffry, 2008). Было также установлено, что у половины (50%) ОАА-положительных детей, у которых возник диабет, родственниками первой линии были братья и сестры (рис. 4). Это должно также учитываться дополнительно при предварительном возможном прогнозе риска развития СД1Т.
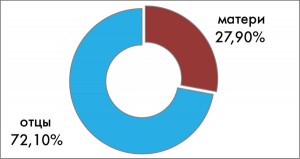 Рис. 3. Процентное соотношение количества
Рис. 3. Процентное соотношение количествадетей, заболевших СД1Т, в зависимости
от пола их родителей, больных диабетом
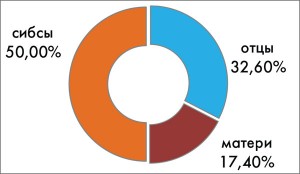 Рис. 4. Процентное соотношение
Рис. 4. Процентное соотношениеродственников первой линии (отцов,
матерей, сибсов), болеющих диабетом,
у ОАА-положительных детей, у которых
возник СД1Т
Проведенные нами исследования также показали, что процент прогнозируемой предсказуемости возникновения СД1Т у детей с отягощенной наследственностью увеличивается со временем, прошедшим после первого обнаружения повышения титра ОАА до клинической манифестации заболевания, то есть, чем более длительный период наблюдения за пациентом после первого установления повышенного титра ОАА, тем выше процент предсказуемости клинического дебюта СД1Т.
Вместе с тем, как показывает наш опыт, принимая во внимание достаточно высокую стоимость наборов для определения ОАА, хорошие прогностические результаты могут быть получены и при сочетанном определении только двух видов ОАА, таких как GADA и IA‑2A (В.В. Попова, 2015; К.П. Зак и др., 2015).
Следовательно, основываясь на работах проведенных многочисленными научными коллективами ученых на огромном клиническом материале, можно с большой долей уверенности утверждать, что повышение титров сывороточных ОАА является наиболее надежным биомаркером предсказания риска возникновения СД1Т у человека с нормогликемией. Процент достоверности предсказания СД1Т пропорционален числу видов ОАА, определяемых тестированием – чем их больше (но не менее двух), тем выше прогноз, так как различные ОАА идентифицируют неодинаковые эпитопы бета-клеточных антигенов. Важное значение имеют также величина титра ОАА, аффинность и длительность времени наблюдения, предшествующего возникновению заболевания после первого посещения врача. К примеру, при исследованиях, проведенных на нормогликемических детях с отягощенной наследственностью при определении только одного вида (IAA, GADA или IA‑2A), развитие клинических признаков СД1Т (по различным источникам) наблюдалось только в 9-22% случаев после десятилетнего наблюдения. По данным P.I. Bingley и соавт. (2016), при высоком титре одного GADA возникновение СД1Т отмечается в 86%, IAA – в 26% случаев, IA‑2A – в 6% случаев. Пятилетние наблюдения у таких однопозитивных детей к ОАА также показали, что СД1Т чаще развивается у них при последующем дополнительном появлении в ПК других видов ОАА (одного или всех четырех). При обнаружении повышенного титра двух ОАА, особенно GADA и IA‑2A, риск развития СД1Т в течение 10 лет приближается к 60% (В.В. Попова, 2008; К.П. Зак и др., 2015). У детей, позитивных к трем ОАА, СД1Т возникал через 7-10 лет более чем в 60% случаев (M. Pietropaolo et al., 2005), а при сочетанном определении четырех аутоантител (IAA, GADA, IA‑2A и ZnT8A) и, особенно, пяти ОАА (ICA, IAA, GADA, IA‑2A и ZnT8A), СД1Т клинически диагностируется свыше чем в 90% случаев при длительном наблюдении (A.G. Ziegler, E. Bonifacio, 2012; M. Schlossen et al., 2014; Е. Bonifacio, 2015). По данным A.G. Ziegler и соавт. (2011), при одновременной позитивности ко многим ОАА развитие заболевания СД1Т неизбежно.
Вместе с тем следует подчеркнуть, что характерной особенностью ОАА является колебания их титра в ПК в течение развития СД1Т, то есть наряду с его повышением может наблюдаться реверсия к норме, особенно отдельных видов ОАА (K. Wehik et al., 2016). На основании проведенных исследований авторы приходят к заключению, что дети, которые ранее были позитивны ко многим ОАА, после произошедшей реверсии одного из них, обладают в дальнейшем очень высоким риском возникновения СД1Т, что позволяет авторам прийти к выводу, что дети, позитивные к одному из ОАА не менее чем через 1 год после сероконверсии, благоприятны к стратификации риска развития СД1Т.
Важное значение имеет также использование определения ОАА для выявления наличия сохранившихся бета-клеток у впервые выявленных больных СД1Т в отдаленные сроки после старта заболевания. Согласно исторической модели патогенеза СД1Т, предложенной еще в 1986 году George Eisenbarth (M.A. Atkinson et al., 2014), клиническое его проявление у человека наступает только после того, когда все инсулинпродуцирующие бета-клетки окончательно потеряны. Однако недавние патолого-цитохимические исследования поколебали эту догму, так как в поджелудочной железе пациента, длительно болеющего СД1Т, были обнаружены отдельные инсулинпродуцирующие клетки. Причем у таких больных определялась небольшая продукция С-пептида и повышение титров некоторых ОАА, особенно у пациентов с дебютом заболевания старше 18 лет с продолжительностью заболевания, достигающей 50 лет (M.A. Atkinson et al., 2015; E. Bonifacio, 2015). Установление того факта, что резидуальные бета-клетки, способные к эндогенной секреции инсулина, сохраняются в течение длительного времени после старта заболевания диабетом имеет весьма важное значение для иммунологической стратегии лечения СД1Т, так как вселяет большую надежду на возможность восстановления функции резидуальных бета-клеток у пациентов с уже развившимся заболеванием (К.П. Зак, В.В. Попова, 2015).
Одной из важных областей применения ОАА в диабетологии стало также их использование и как маркеров для более точной диагностики СД1Т взрослых (LADA) и его дифференциации от СД2Т. Как известно, у взрослых пациентов с СД1Т, особенно у более молодых, часто бывает нелегко отличить его от СД2Т. Подтверждением этого явились многочисленные исследования, показавшие, что более чем у 10% пациентов, которым первоначально был установлен диагноз СД2Т, на самом деле был СД1Т (S. Fourlans et al., 2005).
В 2013 году были опубликованы результаты скрининга ОАА (GADA, IA‑2A ZnT8A) у 6 156 больных с впервые выявленным диабетом в возрасте 30-70 лет, проведенные научными коллективами 7 стран Европы. Они показали, что 541 человек из них (8,8%) были GADA-позитивными и 57 (0,9%) – IA‑2A-позитивными.
На основании полученных данных участники консорциума приходят к заключению, что наряду с клинической картиной главным маркером СД1Т взрослых является наличие у пациентов повышенного титра GADA. Определение GADA стало обязательным в рутинной практике за рубежом в диагностике СД1Т у взрослых.
На основании изложенных выше данных литературы и результатов собственных исследований можно прийти к заключению, что, несмотря на некоторые дискуссионные вопросы, существует единое мнение ученых по поводу того, что определение сывороточного титра аутоанител к ОЛ поджелудочной железы является надежным тестом для предсказания риска возникновения СД1Т и диагностики асимптомной его фазы у «здорового» человека задолго до возникновения у него клинических симптомов заболевания. Чем большее число ОАА (ICA, IAA, GADA, IA‑2A и ZnT8A) включено в скрининг, тем выше процент предсказания риска СД1Т. При позитивности всех пяти ОАА в течение длительного времени процент предсказания превышает 90%. При этом возникновение заболевания СД1Т неизбежно. Важное значение имеет вид ОАА, величина их титров, возраст пациента и генотип HLA-DR-DQ. Так как характерной особенностью ОАА являются лабильность высоты их титра в ПК, то есть их повышение или реверсия возврата к норме в течение развития СД1Т, то для точности предсказания заболевания необходимо повторное многократное их определение.
Таким образом, следует считать необходимым введение в клиническую практику обязательного скрининга выявления ОАА у детей любого возраста (начиная с младенчества) при подозрении на СД1Т, особенно у детей с генетическим отягощением в семейном анамнезе или наличием генотипа HLA-DR-DQ. Следовательно, метод определения ОАА должен стать рутинным в лабораторных медицинских учреждениях нашей страны.
Литература
1. Довідники основних показників діяльності ендокринологічної служби України. – Київ, 2001-2015 рр.
2. Зак К.П., Попова В.В. Имунная интервенция в терапии сахарного диабета (аналитический обзор) // Диабет. Ожирение. Диабетический синдром. – 2015. – № 6 (IV). – C. 31-44.
3. Зак К.П., Тронько Н.Д., Попова В.В., Бутенко А.К. Сахарный диабет. Иммунитет. Цитокины. – К.: Книга плюс, 2015. – 485 с.
4. Попова В.В. Продукція діабетасоційованих аутоантитіл до острівцевих аутоантигенів (IA‑2A, GADA, IAA) у дітей і підлітків на етапах еволюції цукрового діабету 1 типу як основа клініко-імунологічного алгоритму доклінічної діагностики захворювання // Современная педиатрия. – 2015. – Т. 2, № 66. – С. 113-118.
5. Попова В.В. Уміст діабетасоційованих автоантитіл до острівцевих автоантигенів (IA‑2A, GADA, IAA) і рівень різних видів цитокінів у дітей та підлітків на доклінічній і ранній клінічній стадіях розвитку цукрового діабету 1-го типу // Міжнародний ендокринологічний журнал. – 2015. – Т. 2, № 66. – С. 138-146.
6. Попова В.В., Зак К.П. Открытие аутоантител к островкам Лангерганса поджелудочной железы – выдающееся достижение в области предсказания возникновения и диагностики типа сахарного диабета в клинике (Обзор с включением собственных данных) // Лікарська справа. – 2006. – № 7. – С. 3-12.
7. Попова В.В., Зак К.П. Хемокины при сахарном диабете 1-го типа у человека. – Укр. медичний часопис. – 2008. – Т. 67, № 5. – С. 1-14.
8. Тронько Н.Д., Попова В.В., Зак К.П., Маньковский Б.Н. О научно-исследовательской проспективной программе «Иммунитет в доклинический период развития сахарного диабета 1 типа», созданной в ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины» // Ендокринологія. – 2010. – Т. 15, № 2. – C. 180-191.
9. Atkinson M.A., Eisenbarth G.S., Michels A.W. Type 1 diabetes // Lancet. – 2014. – Vol. 38, N9911. – P. 69-82.
10. Atkinson M.A., von Herrath M., Powers A.C., Clare-Salzler M. Current concepts on the pathogenesis of type 1 diabetes – considerations for attempts to prevent and reverse the disease // Diabetes Care. – 2015. – Vol. 38, N6. – P. 979-988.
11. Bingley P.J., Boulware D.C., Krischer J.P.; Type 1 Diabetes TrialNet Study Group. The implications of autoantibodies to a single islet antigen in relatives with normal glucose tolerance: development of other autoantibodies and progression to type 1 diabetes // Diabetologia. – 2016. – Vol. 59, N3. – P. 542-549.
12. Bonifacio E. Predicting type 1 diabetes using biomarkers // Diabetes Care. – 2015. – Vol. 38, N6. – P. 989-996.
13. Bonifacio E., Ziegler A.G., Klingensmith G. et al. Effects of high-dose oral insulin on immune responses in children at high risk for type 1 diabetes: the Pre-POINT randomized clinical trial // JAMA. – 2015. – Vol. 313, N15. – P. 1541-1549.
14. Bottazzo G.F., Florin-Christensen A., Doniach D. Islet cell antibodies in diabetes mellitus with autoimmune polyendocrine deficiencies // Lancet. – 1974. – Vol. 2, N7892. – P. 1279-1283.
15. Eisenbarth G.S., Jeffrey J. The natural history of type 1A diabetes // Arq. Bras. Endocrinol. Metabol. – 2008. – Vol. 52, N2. – P. 146-155.
16. Fourlanos S., Dotta F., Greenbaum C.J. et al. Latent autoimmune diabetes in adults (LADA) should be less latent // Diabetologia. – 2005. – Vol. 48, N11. – P. 2206-2212.
17. Hawa M.I., Kolb H., Schloot N. et al. Adult-onset autoimmune diabetes in Europe is prevalent with a broad clinical phenotype // Diabetes Care. – 2013. – Vol. 36. – P. 908-913.
18. IDF Diabetes Atlas, Seventh edition. – 2016.
19. Insel R.A., Dunne J.L., Atkinson M.A. et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association // Diabetes Care. – 2015. – Vol. 38, N10. – P. 1964-1974.
20. Krischer J.P., Lynch K.F., Schatz D.A. et al. The 6 year incidence of diabetes-associated autoantibodies in genetically at-risk children: the TEDDY study // Diabetologia. – 2015. – Vol. 58, N5. – P. 980-987.
21. Lebastchi J., Herold K.C. Immunologic and metabolic biomarkers of β-cell destruction in the diagnosis of type 1 diabetes // Cold Spring Harb. Perspect. Med. – 2012. – Vol. 2 N6. a007708. doi: 10.1101/cshperspect.a007708.
22. Patterson C.C., Dahlquist G.G., Gyurus E. et al. Incidence trends for childhood type 1 diabetes in Europe during 1989-2003 and predicted new cases 2005-2020: a multicentre prospective registration study // Lancet. – 2009. – Vol. 373, N9680. – P. 2027-2033.
23. Pietropaolo M., Yu S., Libman I.M. et al. Cytoplasmic islet cell antibodies remain valuable in defining risk or progression to type 1 diabetes in subjects with other islet autoantibodies // Pediatr. Diabetes. – 2005. – Vol. 6, N4. – P. 184-192.
24. Raab J., Haupt F., Scholz M. et al. Capillary blood islet autoantibody screening for identifying pre-type 1 diabetes in the general population: design and initial results of the Fr1da study // BMJ Open. – 2016. – Vol. 6, N5: e011144.
25. Schlosser M., Lampasona V., Williams A.J.K. et al. Combined appearance of autoantibodies against GAD, IA‑2, insulin and ZnT8 in the islet autoantibody standardization program 2013 proficiency workshop // Diabetologia. – 2014. – Vol. 57, Suppl. 1. – A‑334.
26. Schlosser M., Mueller P.W., Lampasona V. et al. Combined measurement of autoantibodies against GAD, IA‑2, insulin and ZnT8 in the Diabetes Autoantibody Standardization Program 2009 Workshop // Diabetologia. – 2010. – Vol. 53, Suppl. 1. – P. 178.
27. Torn C., Mueller P.W., Schlosser M. et al. Diabetes antibody standardization program: evaluation of assays for autoantibodies to glutamic acid decarboxylase and islet antigen‑2 // Diabetologia. – 2008. – Vol. 51. – P. 846-852.
28. Vehik K., Lynch K.F., Schatz D.A. et al. Reversion of b-cell autoimmunity changes risk of type 1 diabetes: TEDDY Study // Diabetes Care. – 2016. – Vol. 39, N9. – P. 1535-1542.
29. Wenzlau J.M., Frisch L.M., Gardner T.J. et al. Novel antigens in type 1 diabetes: the importance of ZnT8 // Current Diabetes Reports. – 2009. – Vol. 9. – P. 105-112.
30. Williams A.J., Lampasona V., Schlosser M. et al. Detection of antibodies directed to the N-terminal region of GAD is dependent on assay format and contributes to differences in the specificity of GAD autoantibody assays for type 1 diabetes // Diabetes. – 2015. – Vol. 64, N9. – P. 3239-3246.
31. Williams A.J., Lampasona V., Wyatt R. et al. Reactivity to N-terminally truncated GAD65(96-585) identifies GAD autoantibodies that are more closely associated with diabetes progression in relatives of patients with type 1 diabetes // Diabetes. – 2015. – Vol. 64, N9. – P. 3247-3252.
32. Xu P., Krischer J.P.; Type 1 Diabetes TrialNet Study Group. Prognostic classification factors associated with development of multiple autoantibodies, dysglycemia, and type 1 diabetes – a recursive partitioning analysis // Diabetes Care. – 2016. – Vol. 39, N6. – P. 1036-1044.
33. Yu L., Dong F., Miao D. et al. Proinsulin/insulin autoantibodies measured with electrochimiluminescent assay are the earliest indicator of prediabetic islet autoimmunity // Diabetes Care. – 2013. – Vol. 36. – P. 2266-2270.
34. Ziegler A.G., Bonifacio E., and BABYDIAB–BABYDIET Study Group. Age-related islet autoantibody incidence in offspring of patients with type 1 diabetes // Diabetologia. – 2012. – Vol. 55, N7. – P. 1937-1943.
35. Ziegler A.G., Danne T., Dunger D.B. et al. Primary prevention of beta-cell autoimmunity and type 1 diabetes – The Global Platform for the Prevention of Autoimmune Diabetes (GPPAD) perspectives // Mol. Metab. – 2016. – Vol. 5, N4. – P. 255-262.
36. Ziegler A.-G., Bonifacio E., Powers A. C. et al. Type 1 diabetes prevention: a goal dependent on accepting a diagnosis of an asymptomatic disease // Diabetes. – 2016. – Vol. 65, N11. – P. 3233-3239.
37. Ziegler A.-G., Pflueger M., Winkler C. et al. Accelerated progression from islet autoimmunity to diabetes is causing the escalating incidence of type 1 diabetes in young children // J. Autoimmun. – 2011. – Vol. 37, N1. – P. 3-7.
38. Ziegler A.-G., Rewers M., Simell O. et al. Seroconversion to multiple islet autoantibodies and risk of progression to diabetes in children // JAMA. – 2013. – Vol. 309, N23. – P. 2473-2479.


