25 липня, 2017
Анемия хронического заболевания в клинике экстрагенитальной патологии
Анемия хронического заболевания (АХЗ) по частоте в мире занимает второе место и наблюдается при воспалительных, инфекционных и онкологических заболеваниях. Ключевую роль в развитии АХЗ играет нарушенный гомеостаз железа, характеризующийся уменьшением абсорбции и невозможностью рециркуляции железа из клеток ретикулоэндотелиальной системы, что приводит к гипоферремии (низкий уровень железа, связанного с трансферрином) и нарушению эритропоэза.
АХЗ также рассматривается как анемия воспалительного ответа. Хотя АХЗ может сопровождать опасные для жизни заболевания, анемия воспалительной реакции, возможно, является защитным естественным механизмом, используемым организмом человека для ограничения количества железа при попадании в него потенциально вредных веществ. Эта система (Withholding Defense System – сдерживающая система защиты) была описана Юджином Вайнбергом (Университет штата Индиана) в начале 1980-х гг.: при вторжении патогена в человеческий организм определенная группа клеток направляется к нему, чтобы уничтожить, прежде чем он успеет размножиться. Воспалительная реакция рассматривается как неотъемлемая составляющая этого естественного иммунного ответа. Воспаление вызывает выброс химических веществ, которые сигнализируют о переходе механизма регулирования железа в защитный режим.
Провоспалительные цитокины выполняют роль триггеров в развитии гипоферримии и АХЗ, что реализуется, главным образом, за счет эритрофагоцитоза и повышения экспрессии белка двухвалентного транспортера металлов 1 (DMT 1). В результате этого происходит увеличение поглощения железа в активированные макрофаги и удержание железа в макрофагах путем снижения регуляции экспрессии ферропортина. Следовательно, высвобождение железа из макрофагов блокируется.
При АХЗ нарушается функция ферропортина – трансмембранного экспортера железа – из дуоденоцитов в кровоток. Ключевую роль в патофизиологии АХЗ играет гепсидин – острофазный белок, регулирующий поглощение железа, экспрессия которого индуцируется липополисахаридами (ИЛ-6) и ингибируется фактором некроза опухоли. Гепсидин отвечает за уменьшение абсорбции железа из желудочно-кишечного тракта (ЖКТ), блокируя высвобождение железа из макрофагов. Недавно идентифицированный ген гемоювелин может действовать совместно с гепсидином для индукции данных изменений, конечным результатом которых становится ограниченная доступность железа для прогениторов эритроидных клеток и изменение их пролиферации, что приводит к нарушению биосинтеза гема.
В клинике беременности высокого риска очень важно определить, какой вариант анемии у каждой конкретной пациентки, так как это непосредственно влияет на выбор тактики лечения. У беременной с наличием хронического заболевания возможно сочетание железодефицитной анемии (ЖДА) и анемии хронического воспаления. Такие тесты, как ферритин сыворотки или С-реактивный белок (CRP), могут быть выполнены для того чтобы дифференцировать ЖДА, при которой пероральные формы препаратов железа могут быть полезными, и АХЗ, при наличии которого их назначать не следует.
 Группа пациенток с аутоиммунными заболеваниями характеризуется высоким риском развития анемии во время беременности. Анемия является распространенным клиническим состоянием у пациенток с системной красной волчанкой, при этом наиболее распространена АХЗ, но в данной группе пациенток отмечаются также аутоиммунная гемолитическая анемия, ЖДА, миелотоксичность, вызванная лекарственными средствами, и анемия хронической почечной недостаточности. Подтверждены данные о том, что иммунная система, которая у людей с хроническими заболеваниями постоянно находится в активном состоянии, производит вещества, влияющие на развитие, депонирование и транспорт железа внутри организма. Клетки иммунной системы производят цитокины – специализированные белки, которые стимулируют или ингибируют функцию других клеток иммунной системы.
Группа пациенток с аутоиммунными заболеваниями характеризуется высоким риском развития анемии во время беременности. Анемия является распространенным клиническим состоянием у пациенток с системной красной волчанкой, при этом наиболее распространена АХЗ, но в данной группе пациенток отмечаются также аутоиммунная гемолитическая анемия, ЖДА, миелотоксичность, вызванная лекарственными средствами, и анемия хронической почечной недостаточности. Подтверждены данные о том, что иммунная система, которая у людей с хроническими заболеваниями постоянно находится в активном состоянии, производит вещества, влияющие на развитие, депонирование и транспорт железа внутри организма. Клетки иммунной системы производят цитокины – специализированные белки, которые стимулируют или ингибируют функцию других клеток иммунной системы.
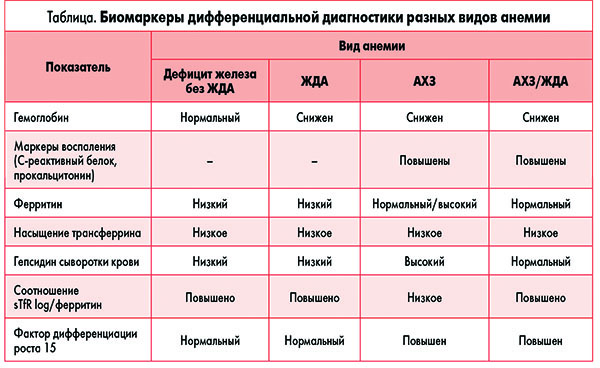
АХЗ – это гиперпролиферативный процесс, который характеризуется снижением активности эритропоэтина за счет снижения его выработки и повышения устойчивости к нему, обусловленной синтезом аутоантител (anti-Epo). Дифференциальная диагностика разных видов анемии представлена в таблице.
Представляется очень важным дифференцировать АХЗ и ЖДА, потому что эти патологические состояния имеют много общего: низкий уровень железа в сыворотке крови, возможное наличие микроцитарных клеток, хотя этот тип клеток указывает на истинный дефицит железа. Уровень трансферрина, белка – транспортера железа, повышен при ЖДА, сигнализируя о повышенной потребности организма в железе. Общая способность связывания железа (TIBC) – определяющаяся посредством косвенного измерения уровня трансферрина – является низкой при АХЗ, поскольку в организме имеется достаточно запасов железа, но доступность его затруднена. Уровень TIBC, как правило, увеличивается, когда запасы железа снижаются, и уменьшается при их повышении. При ЖДА уровень TIBC превышает 400-450 мкг/л из-за низких запасов железа. При АХЗ уровень TIBC, как правило, ниже нормы, потому что запасы железа восполняются.
У почти 2/3 пациентов определение уровня ферритина сыворотки крови является одним из тех тестов, которые позволяют дифференцировать АХЗ и ЖДА. Но значения этого показателя могут достигать нормального уровня даже при наличии дефицита железа.
По этой причине возникают трудности с определением конкретной этиологии дефицита железа у пациента с воспалением или инфекцией. В этом случае необходимо определение гораздо более термостабильного показателя растворимого рецептора трансферрина (sTfR). Наиболее информативным является отношение показателя рецептора трансферрина к логарифму концентрации ферритина в сыворотке крови, что позволяет наиболее точно дифференцировать АХЗ и дефицит железа, что имеет ключевое значение для выбора тактики лечения. При АХЗ не рекомендованы пероральные формы препаратов железа.
Успешное лечение АХЗ связано с эффективностью терапии основного заболевания. Если терапевтического эффекта удалось достичь вне беременности, то коррекция анемии обычно происходит достаточно быстро или она полностью устраняется без прямого лечения. В период гестации контроль над активностью аутоиммунного заболевания, успешное лечение инфекционного процесса, онкологической патологии является абсолютно необходимым условием эффективности лечения, также абсолютно необходима медикаментозная коррекция анемии.
Стандартным подходом в лечении анемии при беременности является назначение пероральных форм препаратов железа, к преимуществам которых относят доступность, дешевизну, простоту в применении. Однако для достижения эффекта при данном подходе требуется достаточно длительный период, кроме того, в ряде случаев возникают побочные явления со стороны ЖКТ, что приводит к отказу от лечения, а также в определенной группе беременных, даже при соблюдении комплаенса, отмечается нулевой результат лечения. В ряде рекомендаций указывается на необходимость смены пероральных форм препаратов железа. К примеру, в протоколы лечения анемии в период гестации ведущих стран ЕС, США, Канады, Австралии после многочисленных исследований эффективности и безопасности были внесены рекомендации относительно применения парентеральных форм железа.
Изменение подходов к лечению анемии обусловлено результатами серьезных фундаментальных и клинических исследований. Известно, что хотя общее количество железа у здорового человека составляет всего около 3 г, данный химический элемент играет важную роль в физиологии беременности. Баланс железа при гестации зависит от гармонизации 3 основных процессов: его потребления, потери и метаболических потребностей. Потребление железа зависит от его содержания в пище, его общего количества в организме и, самое главное, способности абсорбировать железо из пищеварительного тракта. Нарушения всасывания железа могут развиваться при наличии патологии ЖКТ или хронического воспалительного заболевания вследствие экспрессии регуляторного пептида – гепсидина, что обусловлено выбросом провоспалительных цитокинов. Потеря железа происходит в результате острой травмы или хронического воспаления, кровопотери из ЖКТ, мочевыводящих или дыхательных путей, вследствие гемодиализа при хроническом заболевании почек.
Повышенная метаболическая потребность возникает в период эмбриогенеза, развития плода, младенчества, детства, беременности и при использовании эритропоэз-стимулирующего агента (ЭСА). Стимулирование эритропоэза с использованием ЭСА может привести к функциональному дефициту железа, когда потребность в железе увеличивается, но не может быть удовлетворена существующим депо (низкий уровень содержания железа (абсолютная нехватка железа) или ограничение выделения из депо).
Лечение АХЗ при беременности связано с определенными сложностями, так как диагностика дефицита железа достаточно рутинна, а выявление причин, приведших к данному дефициту, и их устранение при АХЗ имеют ряд особенностей.
Исторически сложилось так, что пероральному пути введения железа уделялось много внимания, но эффективность применения пероральных форм скомпрометирована из-за плохого всасывания, необходимости соблюдения режима приема, побочных эффектов (до 56%) и отмены лечения (19%).
Преодоление данных проблем стало возможным с развитием фармакологии и усовершенствованием форм препаратов железа для внутривенного введения, позволяющих избежать токсичного влияния железа в его элементарном состоянии, гармонизировать требуемую дозу с желаемой скоростью повторного использования. К таким формам относятся препараты, содержащие сахарозу соединения железа (сахараты), и модифицированные составы декстрана железа (комплексы железа глюконата в некоторых странах). В этих препаратах значительно улучшен профиль безопасности, что позволило снизить частоту побочных явлений. Дальнейшее их усовершенствование заключалось в том, чтобы устранить необходимость в тестовой дозе. Возможность введения большего количества железа в более короткий промежуток времени значительно повысила удобство лечения.
Во время беременности потребность в железе возрастает от 1,5-2,0 мг/сут до 5-7 мг/сут, поэтому баланс потребления, потери и метаболических потребностей в железе нарушается и сдвигается в сторону ЖДА. Наличие у беременной этого вида анемии, особенно при уровне гемоглобина ниже 85 г/л, увеличивает риск рождения маловесного плода, преждевременных родов, слабости родовой деятельности, повышенной кровопотери, послеродовой депрессии и т.д. Оценить адекватность депо железа возможно по уровню ферритина в сыворотке крови: если он ниже 30 мкг/л, депо железа считается низким. В таком случае истощение запасов железа происходит в период родов, особенно оперативных, что имеет негативные последствия не только для матери, но и для новорожденного, так как в среднесрочной и долгосрочной перспективе ребенок не получит достаточного количества железа [2, 7].
Низкие антенатальные концентрации гемоглобина (и особенно дефицит железа) являются фактором риска послеродового кровотечения и тяжелой кровопотери.
Во многих современных учебниках пишется о том, что именно пероральным формам препаратов железа нужно отдавать предпочтение и только при наличии мальабсорбции, тяжелых осложнений со стороны ЖКТ или в случае непереносимости препарата нужно применять внутривенные формы. Но при этом необходимо учитывать то, что пероральные формы препаратов железа дают медленный и зачастую субоптимальный эффект, а при анемии хронического воспаления их прием вообще не рекомендован.
Поэтому, если дефицит железа и анемия (ЖДА, сочетание ЖДА и АХЗ) выявлены на поздних сроках беременности, в антенатальном периоде для коррекции железодефицитной анемии и уровня гемоглобина до родов выбор должен быть сделан в пользу внутривенных форм препаратов железа, что снижает не только риск кровотечения, но и необходимость переливания крови в перипартальном периоде.
Необходимо пояснить фармакокинетические особенности внутривенных форм препаратов железа. В настоящее время все железоуглеводные комплексы или коллоиды разрабатываются на основе мелких сфероидальных частиц железа-углевода. Каждая частица состоит из сердцевины из оксигидрата железа, окруженного оболочкой из углевода, которая стабилизирует гель, замедляет выделение железа, поддерживает полученные частицы в коллоидной суспензии. После внутривенного введения железоуглеводные комплексы смешиваются с плазмой и фагоцитируются в ретикулоэндотелиальной системе. В фагоцитах железо выделяется из их углеводного комплекса в низкомолекулярный железный бассейн, откуда железо либо включается ферритином в интрацеллюлярные хранилища железа, либо высвобождается и связывается с внеклеточным белком связывания железа – трансферрином, который доставляет железо к рецепторам на поверхности клеток предшественников эритроидов [1, 3, 6].
В отношении безопасности внутривенных форм препаратов железа результаты исследования, полученные Breymann, по лечению сахаратом железа более 500 женщин с диагнозом анемия (в амбулаторных условиях, без какой-либо тестовой дозы) свидетельствуют о достаточно высоком ее уровне. В данном исследовании первая доза была предоставлена в палате, где были доступны средства для оказания неотложной помощи, а все последующие дозы были даны на амбулаторной основе, при этом ни одна пациентка не нуждалась в неотложной помощи.
В исследовании были осуществлены оценка и сопоставление эффективности 2 и 3 доз внутривенного введения сахарата железа с терапией пероральными формами препарата железа. В группе с внутривенным введением препарата железа наблюдалась более высокая частота положительного ответа (Hb>110 г/л) – 75 против 80%. Отмечена значительная разница в запасах железа перед родами (ферритин >50 мг/л) в группе с применением 3 внутривенных доз препарата железа по сравнению с группой пациенток, которые принимали пероральные формы препаратов железа (49 против 14%, р<0,001). Существенной была разница между двумя группами в уровне ферритина после лечения, причем депо железа восстанавливалось только в группе, которая получала лечение сахаратом железа. Такие же результаты получены Bayoumeu и соавт. Увеличение уровня ферритина происходит не из-за прямой внутривенной инъекции комплекса железа, а потому что комплекс сахарата железа быстро выводит железо в эндогенные связывающие белки без депонирования в паренхиматозной ткани.
Кроме того, были изучены различные факторы, которые влияют на достижение ответа в лечении анемии. Отмечено, что процентное увеличение уровня гемоглобина после одного месяца терапии было в значительной мере связано с исходным значением гемоглобина в обеих группах (получавших внутривенную форму сахарата железа и пероральные формы препаратов железа). Carretti и соавт. установили, что рост гемоглобина обратно коррелировал с начальной величиной гемоглобина, а значительно более высокие пропорции высоких ответов гемоглобина наблюдались после 28-й недели беременности по сравнению со II триместром. Это может быть связано с физиологической гемодилюцией и замедленной реакцией эритропоэтина во II триместре. Процентное увеличение гемоглобина было значительно выше в группе пациенток, которым внутривенно вводили сахарат железа, чем в группе тех, кто перорально принимал препараты железа, в III триместре гестации. Таким образом, чем ниже начальное значение гемоглобина на поздних сроках беременности, тем более целесообразно проводить лечение таких пациенток внутривенной формой сахарата железа.
В лечении АХЗ/ЖДА при наличии у беременной аутоиммунных заболеваний следует рассматривать следующие факторы влияния: активацию провоспалительных цитокинов, повышение уровня гепсидина, снижение всасывания железа из ЖКТ, нарушения воздействия эритропоэтина, формирование антител к эритропоэтину, что может препятствовать достижению скорого и оптимального эффекта от стандартной терапии пероральными формами препаратов железа, а при наличии маркеров воспаления они не рекомендованы.
С другой стороны, считается, что ионы железа при внутривенном введении препарата могут связываться непосредственно с трансферрином, минуя блокаду ретикулоэндотелиальной системы. Таким образом, они не поглощаются макрофагами, а значит, становятся доступными для эритрона, не попадая в порочный круг патогенеза АХЗ [1, 3, 5].
АХЗ вносит значительный вклад в повышение заболеваемости беременных с воспалительными, аутоиммунными, инфекционными, злокачественными заболеваниями. Понимание патогенеза АХЗ, ключевой роли гепсидина в регуляции всасывания и высвобождения железа, правильный анализ биомаркеров анемии и воспаления позволяет выбрать правильную тактику лечения. Применение сахарата железа у данной группы пациенток является целесообразным с точки зрения патогенеза и позволяет достичь быстрого эффекта в лечении анемии у беременных при высоком профиле безопасности препарата.
Литература
- Adamson J.W. The anemia of inflammation/malignancy: mechanisms and management. Hematology Am Soc Hematol Educ Program. 2008; 159-165.
- Bayoumeu F., Subiran-Buisset C., Baka N.E., Legagneur H., Monnier-Barbarino P., Laxenaire M.C. Iron therapy in iron deficiency anemia in pregnancy: Intravenous route versus oral route. Am J Obstet Gynecol. 2002; 186: 518-2.
- Bencaiova G., von Mandach U., Zimmermann R. Iron prophylaxis in pregnancy: Intravenous route versus oral route. Eur J Obstet Gynecol Reprod Biol. 2009; 144: 135-9.
- Breymann C. The use of iron sucrose complex for anemia in pregnancy and the postpartum period. Semin Hematol. 2006; 43: S28-S31.
- Cavill I., Auerbach M., Bailie G.R. et al. Iron and the anaemia of chronic disease: A review and strategic recommendations. Curr Med Res Opin 2006; 22: 731-737.
- Chandler G., Harchowal J., Macdougall I.C. Intravenous iron sucrose: Establishing a safe dose. Am J Kidney Dis 2001; 38: 988-991.38.
- Chertow G.M., Mason P.D., Vaage-Nilsen O., Ahlmen J. On the relative safety of parenteral iron formulations. Nephrol Dial Transplant 2004; 19: 1571-1575.
Тематичний номер «Гінекологія, Акушерство, Репродуктологія» № 2 (26), червень-липень 2017 р.



