28 липня, 2017
Неудачи первой линии таргетной терапии метастатического рака почки. Что дальше?
28 апреля в рамках научно-практической конференции «Достижения и перспективы в онкоурологии, пластической и реконструктивной хирургии мочевыводящих путей» старший научный сотрудник отделения пластической и реконструктивной онкоурологии Национального института рака, кандидат медицинских наук Олег Анатольевич Войленко рассказал о возможностях второй линии таргетной терапии пациентов с метастатическим раком почки. В докладе были представлены результаты основных исследований, современные рекомендации по второй линии терапии пациентов с метастатическим почечноклеточным раком (мПКР), а также перспективные направления лечения таких пациентов.
Он отметил, что, согласно данным Globocan за 2012 г., в мире насчитывалось около 337 тыс. больных ПКР, из них умерло 143 тыс., т.е. 40% от всех заболевших. При этом метастатическая форма заболевания диагностировалась в 30% случаев. По данным многих авторов, после проведенной нефрэктомии по поводу неметастатического рака почки в 30% случаев наблюдается прогрессирование заболевания. Из этого следует, что фактически половине пациентов с ПКР в дальнейшем потребуется проведение таргетной терапии. Выживаемость до года при мПКР составляет всего 36%, а 5-летняя выживаемость – 12%, в большинстве случаев прогрессирование заболевания возникает в течение 3 лет после операции. Лечение пациентов с мПКР требует мультидисциплинарного подхода, дальнейшая тактика, в том числе в отношении таргетной терапии, определяется совместно хирургом и химиотерапевтом.
Согласно рекомендациям NCCN 2016, акситиниб – единственный таргетный препарат второй линии терапии пациентов с мПКР, имеющий категорию I рекомендаций для применения как после прогрессирования на ингибиторах тирозинкиназы (ИТК), так и после цитокинов.
В Украине акситиниб зарегистрирован под торговым названием Инлита®. В случае его неэффективности в третьей и последующих линиях терапии применяются эверолимус, сунитиниб, сорафениб.
Акситиниб – пероральный высокоселективный ингибитор рецепторов VEGFR 1, 2 и 3 (D.D. Hu-Lowe et al., 2008). Было установлено, что акситиниб уменьшает кровоток в опухоли. На протяжении 24 ч после приема акситиниба быстро уменьшается проходимость сосудов, количество кровеносных сосудов и ангиогенез в опухоли (T. Inai et al., 2004). Кроме того, рост опухоли замедляется благодаря снижению проницаемости сосудов (L.J. Wilmes et al., 2007). На фоне терапии этим препаратом на протяжении 7 дней уменьшается количество кровеносных сосудов опухоли, в то же время его отмена приводит к возобновлению роста опухоли (M.R. Mancuso et al., 2006).
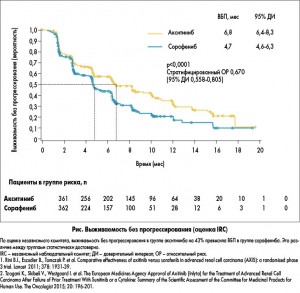
В рандомизированном исследовании AXIS сравнивалась эффективность акситиниба (5 мг 2 р/день) и сорафениба (400 мг 2 раза в день) у пациентов с гистологически подтвержденным мПКР (светлоклеточная форма) при прогрессировании заболевания на фоне первой линии терапии (сунитиниб, бевацизумаб + интерферон-α, темсиролимус, цитокины). Первичной конечной точкой исследования была выживаемость без прогрессирования (ВБП), в исследовании также оценивались общая выживаемость (ОВ), частота общего ответа (ЧОО), длительность ответа (ДО), безопасность и качество жизни. На фоне терапии акситинибом показатель ВБП был выше по сравнению с сорафенибом – 6,8 против 4,7 мес, при более детальном анализе, после стратификации пациентов, практически во всех подгруппах акситиниб также показал свое преимущество (рис.). Согласно данным исследования по критериям RESIST, частичная регрессия наблюдалась в 19 и 9%, стабилизация заболевания – в 49,9 и 54%, прогрессирование – в 21,6 и 21%, промежуточный ответ – в 6,1 и 11,1% случаев в группах акситиниба и сорафениба соответственно. Таким образом, в исследовании AXIS акситиниб показал преимущество над сорафенибом во второй линии терапии пациентов с мПКР в отношении медианы безрецидивной выживаемости (6,8 против 4,7 мес) и частоты объективного ответа (19 против 9%).
Было выявлено, что гипертензия, возникающая на фоне терапии акситинибом, является независимым предиктором увеличения ОВ. В группе пациентов с систолическим артериальным давлением (САД) ≥140 мм рт. ст. ОВ составила 20,7 мес, а с САД <140 мм рт. ст. – 15,7 мес на 8-й неделе после рандомизации и 20,8 против 14,8 мес на 12-й неделе, аналогично при диастолическом артериальном давлении (ДАД) ≥90 мм рт. ст. – 21,3 и 20,7 мес на 8-й и 12-й неделе после рандомизации, по сравнению с 13,9 и 12,9 мес при ДАД <90 мм рт. ст. в группе акситиниба и сорафениба соответственно.
По результатам исследований AXIS и RECORD-1 препараты акситиниб и эверолимус были включены во вторую линию терапии. Поскольку акситиниб продемонстрировал лучшую ВБП (6,8 против 4,9 мес), в дальнейшем все препараты сравнивались с эверолимусом.
В рандомизированном исследовании METEOR кабозантиниб сравнивали с эверолимусом во второй линии терапии у 658 пациентов со светлоклеточным ПКР при прогрессировании заболевания на фоне терапии ингибиторами рецепторов VEGFR. Были получены следующие результаты: ВБП была выше на фоне терапии кабозантинибом после как минимум одного цикла VEGFR-TKІ (9,1 против 3,7 мес), токсичность 3-4 степени наблюдалась как на фоне терапии кабозантинибом (68%), так и на фоне терапии эверолимусом (58%), по результатам исследований кабозантиниб был включен в терапию второй линии пациентов с мПКР (T.K. Choueiri et al., 2015).
Для того чтобы обеспечить максимальный клинический эффект, важно определить необходимую последовательность назначения таргетных препаратов при мПКР. По результатам исследования RECORD‑3, ВБП выше в группе пациентов, принимавших сунитиниб с дальнейшим переходом на эверолимус, по сравнению с пациентами, вначале принимавшими эверолимус (25,8 против 21,1 мес). Таким образом, сунитиниб остался стандартом первой линии терапии (R.J. Motzer et al., 2013).
Одним из перспективных направлений является комбинированная таргетная терапия, в настоящее время проводится ряд исследований по изучению эффективности различных комбинаций таргетных препаратов. Промежуточные результаты исследования JAVELIN 100 показали 100% частичный ответ у пациентов, получающих акситиниб в комбинации с авелумабом в первой линии (Larkin et al., 2016). В исследовании CHEKMATE‑016 комбинированная терапия также демонстрирует высокие показатели ВБП (A. Amin et al., 2014).
Активно изучаются возможности персонализированной терапии. Так, в исследовании IMmotion150 в первой группе пациенты получали атезолизумаб в комбинации с бевацизумабом после терапии атезолизумабом, во второй – после приема сунитиниба, а в третьей изначально пациенты принимали атезолизумаб в комбинации с бевацизумабом. Не было выявлено статистически значимого различия в ВБП между группами в целом, но среди пациентов с экспрессией PD-L1 >1% наблюдалось статистически значимое увеличение медианы ВБП в третьей группе – 5,5, 7,8 и 14,7 мес соответственно (D. McDermont et al., 2017).
Таким образом, эра таргетной терапии позволила достичь новых высот в борьбе с мПКР. В то же время хирургическое лечение продолжает занимать важное место в терапии этого заболевания. На сегодняшний день основной опцией терапии второй линии мПКР в Украине является акситиниб, который демонстрирует высокие показатели ВБП и ОВ.
Дальнейшие разработки, направленные на преодоление механизмов резистентности, позволят улучшить клинические результаты ОВ пациентов. Перспективными направлениями являются комбинированная таргетная терапия и персонализированная терапия. Изучение новых агентов, направленных на звено иммунного ответа, а также их комбинаций, персонализированный подбор препаратов на основании изучения антигенного статуса опухоли позволят улучшить показатели выживаемости пациентов с мПКР.
Подготовила Екатерина Марушко
Напечатано при поддержке Представительства «Пфайзер Эйч.Си.Пи. Корпорейшн» в Украине».
WUKINL0317005