10 липня, 2017
Атезолизумаб одобрен FDA по новому показанию при уротелиальной карциноме
Управление по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) по процедуре приоритетного рассмотрения одобрило препарат атезолизумаб (Тецентрик) к применению в качестве варианта первой линии терапии тех пациентов, которые не могут получать химиотерапию цисплатином.
Ранее FDA приняло дополнительную заявку на получение биологической лицензии и предоставило статус приоритетного рассмотрения для утверждения атезолизумаба в лечении пациентов с местнораспространенной или метастатической уротелиальной карциномой, которые могут получать химиотерапию цисплатином. Атезолизумаб одобрен для применения у пациентов, которые еще не получали лечения (первая линия) либо у которых произошло прогрессирование заболевания по меньшей мере спустя 12 мес после получения химиотерапии до операции (неоадъювант) или после операции (адъювант). Уротелиальная карцинома составляет 90% всех случаев рака мочевого пузыря, а также может быть обнаружена в почечной лоханке, мочеточнике и уретре.
«В мае 2016 г. Тецентрик стал первым препаратом более чем за 30 лет, который одобрен FDA для лечения больных с распространенным раком мочевого пузыря, – отметила доктор Sandra Horning, руководитель отдела разработки продуктов компании «Рош». – В настоящее время атезолизумаб доступен для большего количества пациентов с этим типом рака мочевого пузыря, особенно для тех, кто не может переносить химиотерапию на основе цисплатина в качестве первоначального лечения».
Одобрение FDA основано на результатах исследования II фазы IMvigor210.
Статус приоритетного рассмотрения предоставляется тем лекарственным средствам, использование которых, по мнению FDA, может обеспечить значительное повышение эффективности и безопасности лечения, профилактики или диагностики определенного заболевания.
Атезолизумаб одобрен FDA для лечения пациентов с местнораспространенной или метастатической уротелиальной карциномой, у которых заболевание прогрессировало во время или после химиотерапии препаратами платины или ухудшилось после неоадъювантной или адъювантной химиотерапии препаратами платины, которую они получали в течение 12 мес. Положительное решение FDA относительно атезолизумаба основано на частоте ответа опухоли и длительности последнего.
Это третье одобрение для атезолизумаба в течение года. Данный препарат также одобрен для лечения больных с метастатическим немелкоклеточным раком легкого (НМРЛ), у которых заболевание прогрессировало во время или после платиносодержащей химиотерапии, а также после соответствующей одобренной FDA терапии, если опухоль ассоциируется с аномалиями генов EGFR или ALK.
Об исследовании IMvigor210
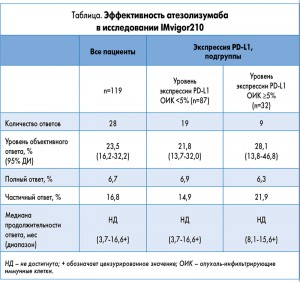
IMvigor210 – это открытое многоцентровое исследование II фазы, предметом которого была оценка эффективности и безопасности использования атезолизумаба в лечении пациентов с локально распространенной или метастатической уротелиальной карциномой независимо от экспрессии PD-L1. Пациенты в этом исследовании были включены в одну из двух когорт. Когорта 1, на результатах изучения которой будет основываться новое показание, состояла из тех пациентов, которые не могли получать химиотерапию на основе цисплатина в первой линии, не получали предшествующего лечения или у которых заболевание прогрессировало минимум через 12 мес после неоадъювантной или адъювантной химиотерапии. Когорта 2, результаты изучения которой послужили основой для ускоренного принятия FDA решения об одобрении атезолизумаба в мае 2016 г., включала тех пациентов, у которых заболевание про- грессировало во время или после предшествующей платиносодержащей химиотерапии или у которых отмечалось прогрессирование заболевания в течение 12 мес после неоадъювантной или адъювантной химиотерапии на основе препаратов платины. Первичной конечной точкой исследования была частота объективного ответа, вторичными конечными точками – продолжительность ответа, общая выживаемость, выживаемость без прогрессирования заболевания и безопасность применения. В таблице приводится краткая информация об эффективности атезолизумаба в исследовании IMvigor210.
Наиболее распространенными побочными реакциями 3-4 степени (≥2%) в этом исследовании были: усталость (8%), инфекция мочевых путей (5%), анемия (7%), диарея (5%), повышение уровня креатинина (5%), кишечная непроходимость (частичная или полная), повышение уровня печеночного фермента аланинтрансаминазы (4%), гипонатриемия (15%), снижение аппетита (3%), сепсис (3%), почечная недостаточность и гипотония.
В настоящее время компания Genentech проводит подтверждающее исследование III фазы (IMvigor211), которое сравнивает атезолизумаб с химиотерапией у больных с определенным типом рака мочевого пузыря в качестве стартовой терапии, а также у пациентов, у которых заболевание прогрессировало на фоне как минимум одного из предшествующих режимов терапии, содержавшего препараты платины.
Сегодня атезолизумаб (Тецентрик) используется для лечения:
• метастатической уротелиальной карциномы, если:
– пациенту не может быть назначена химиотерапия, содержащая цисплатин;
– пациент получал платиносодержащую химиотерапию, которая оказалась неэффективной либо утратила свою эффективность;
• метастатического немелкоклеточного рака легкого, если:
– пациент получал химиотерапию, содержащую платину, которая оказалась неэффективной либо утратила свою эффективность;
– у пациентов опухоль ассоциируется с мутацией EGFR или ALK и они получали одобренную FDA терапию для НМРЛ с этими генетическими аномалиями, которая оказалась неэффективной либо утратила свою эффективность.
О препарате атезолизумаб (Тецентрик)
Атезолизумаб (Тецентрик) – моноклональное антитело, предназначенное для целенаправленного связывания с белком PD-L1 (лиганд запрограммированной клеточной смерти 1), который экспрессируется на опухолевых клетках и иммунных клетках, инфильтрирующих опухоль. Взаимодействие лиганда PD-L1 с PD-1 и B7.1, присутствующими на поверхности Т-лимфоцитов, приводит к подавлению активности Т-лимфоцитов. Блокируя это взаимодействие, атезолизумаб может активировать Т-лимфоциты, восстанавливая их способность эффективно обнаруживать и атаковать опухолевые клетки.
Источник: www.gene.com
Перевела с англ. Катерина Котенко