4 серпня, 2017
Глаукома: от факторов риска к современному медикаментозному лечению
В Стране Слепых и кривой – король.
Герберт Уэллс
Глаукома – это общий термин, объединяющий большую группу заболеваний с различной этиологией, которые приводят к развитию глаукомной оптической нейропатии, ассоциирующейся с характерными структурными изменениями зрительного нерва и завершающейся его атрофией, что приводит к сужению полей зрения и в конечном итоге к слепоте.
По прогнозам экспертов, к 2020 г. около 79,6 млн жителей земного шара будут страдать глаукомой, а более 11 млн человек ослепнут из-за этого заболевания (Gupta D., 2016). В настоящее время примерно у 2 млн американцев в возрасте 40 лет диагностирована глаукома, при этом ученые предполагают, что более половины пациентов с глаукомной оптической нейропатией остались вне поля зрения врачей и не получают должной медицинской помощи. В нашей стране статистика заболеваемости глаукомой также неутешительна: ежегодно в Украине выявляется более 25 тыс. новых случаев заболевания. Именно глаукома – основная причина необратимой утраты зрения: на долю этой патологии приходится 25% случаев слепоты у афро- и латиноамериканцев, что значительно превышает вероятность полной утраты зрения у больных диабетической ретинопатией и возрастной макулярной дегенерацией. Прогрессирующее течение глаукомы опасно не только развитием слепоты на финальной стадии заболевания, но и серьезными функциональными нарушениями, возникающими на ранних этапах: сужение полей зрения ограничивает пациентов в повседневной активности, затрудняет самостоятельное обслуживание, лишает возможности насладиться чтением, заставляет отказаться от управления автомобилем.
Среди разнообразных форм глаукомы наиболее распространенными являются первичная открытоугольная глаукома (ПОУГ) и первичная закрытоугольная глаукома (ПЗУГ); при этом распространенность ПОУГ в странах Европы и США примерно в 7 раз превышает таковую ПЗУГ.
«Тихий вор зрения»
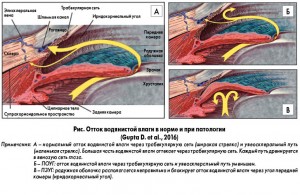 Тихо и незаметно глаукома лишает человека зрения, блокируя отток водянистой влаги из передней камеры глаза. При ПОУГ возникает дисбаланс между продукцией и оттоком водянистой влаги, фильтрующейся через переднюю камеру глаза (рис.). Такая ситуация возникает, если цилиарное тело продуцирует очень большое количество прозрачной жидкости или заблокирована трабекулярная сеть (основной дренажный канал) в передней камере, что вызывает повышение внутриглазного давления (ВГД). В результате повышения ВГД усиливается давление на волокна зрительного нерва, передающие зрительные образы в мозг. Ухудшение кровоснабжения сопровождается развитием кислородного голодания и уменьшением количества питательных веществ, поступающих к зрительному нерву; спустя некоторое время высокое ВГД и другие перечисленные факторы приводят к его необратимым повреждениям и слепоте.
Тихо и незаметно глаукома лишает человека зрения, блокируя отток водянистой влаги из передней камеры глаза. При ПОУГ возникает дисбаланс между продукцией и оттоком водянистой влаги, фильтрующейся через переднюю камеру глаза (рис.). Такая ситуация возникает, если цилиарное тело продуцирует очень большое количество прозрачной жидкости или заблокирована трабекулярная сеть (основной дренажный канал) в передней камере, что вызывает повышение внутриглазного давления (ВГД). В результате повышения ВГД усиливается давление на волокна зрительного нерва, передающие зрительные образы в мозг. Ухудшение кровоснабжения сопровождается развитием кислородного голодания и уменьшением количества питательных веществ, поступающих к зрительному нерву; спустя некоторое время высокое ВГД и другие перечисленные факторы приводят к его необратимым повреждениям и слепоте.
Механизм возникновения другого типа глаукомы – ПЗУГ – несколько иной. В здоровом глазу водянистая влага образуется в передней камере и оттекает из нее, создавая давление, достаточное для поддержания правильной формы глаза, не повреждая его при этом. Количество новой внутриглазной жидкости, постоянно образующейся в глазу, уравновешивается количеством водянистой влаги, постоянно оттекающей через так называемый угол передней камеры. Выполнение дренажной функции возможно, если этот угол составляет не менее 30 градусов. Если угол блокируется, а жидкость продолжает продуцироваться с нормальной скоростью, то она не сможет оттекать из глаза, что приведет к опасному повышению ВГД и повреждению зрительного нерва.
Если ПОУГ и ПЗУГ остаются недиагностированными, то естественное хроническое прогрессирующее течение заболевания приводит к необратимому сужению полей зрения и в конечном итоге к слепоте. Многие больные глаукомой не предъявляют никаких офтальмологических жалоб, поскольку первоначальное нарушение полей зрения, как правило, является периферическим и асимметричным, что позволяет менее пораженному глазу частично компенсировать появляющиеся дефекты. Поэтому в большинстве случаев ПОУГ диагностируют случайно при профилактическом офтальмологическом осмотре. Значительная распространенность, неблагоприятный прогноз, высокий уровень инвалидности, колоссальное социально-экономическое бремя обусловливают необходимость ранней диагностики глаукомы, заподозрить которую можно на основании выявления известных факторов риска.
Факторы риска
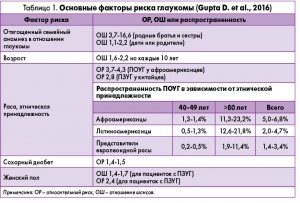 Факторы риска развития глаукомы хорошо известны (табл. 1). Обнаружив их, врач общей практики может определить пациентов из группы риска и посоветовать обратиться за консультацией к офтальмологу.
Факторы риска развития глаукомы хорошо известны (табл. 1). Обнаружив их, врач общей практики может определить пациентов из группы риска и посоветовать обратиться за консультацией к офтальмологу.
Семейный анамнез
Отягощенный семейный анамнез у родственников первой степени родства ассоциирован со значительным увеличением риска развития глаукомы. Например, у лиц, имеющих хотя бы одного родственника, больного глаукомой, вероятность возникновения ПОУГ резко возрастает (ОШ 3,7). Подчеркивая значимость отягощенного семейного анамнеза, С. McMonnies (2017) все же указывает, что на долю специфических генетических мутаций, провоцирующих появление глаукомы, приходится <5% от всех случаев ПОУГ.
Этническая принадлежность
Наиболее высокая распространенность ПОУГ отмечается среди афро- и латиноамериканцев; у представителей этих популяций глаукома протекает более тяжело, часто осложняясь полной потерей зрения. ПЗУГ чаще страдают коренные жители Азиатского региона (китайцы), представители этнической группы коренных народов Северной Америки (инуиты).
Возраст
Распространенность глаукомы резко возрастает с возрастом: минимальные значения этого показателя регистрируются у пациентов 40-49 лет, максимальные – у лиц старше 80 лет.
Сахарный диабет
Болезнь XXI века, пандемичный характер распространения которой приводит в отчаяние многих специалистов, является признанным фактором риска глаукомы. По данным М. Zhou и соавт. (2014), представивших результаты систематического обзора и метаанализа 13 исследований, обобщенный ОР возникновения ПОУГ у больных сахарным диабетом (СД) составляет 1,40 (95% ДИ 1,25-1,57). Сделав поправку на наличие значимой гетерогенности между исследованиями типа «случай – контроль» (р<0,001) и исключив их из дальнейшего анализа, ученые определили более точные значения риска развития ПОУГ у лиц, страдающих СД, – ОР 1,35 (95% ДИ 1,06-1,74).
Эти данные были позднее подтверждены в масштабной работе, выполненной под руководством D. Zhao (2015): тщательный анализ результатов 47 исследований, проведенных в 16 странах с участием огромного количества пациентов (n=2 981 342), показал, что риск возникновения глаукомы у больных СД выше, чем у лиц, не имеющих указанной эндокринной патологии (ОР 1,48; 95% ДИ 1,29-1,71; I2=82,3%; р<0,001). Исследователи подчеркнули, что вероятность развития глаукомы ежегодно возрастает на 5% (95% ДИ 1-9%) с момента подтверждения диагноза СД. Средние значения ВГД у больных СД на 0,18 мм рт. ст. (95% ДИ 0,09-0,27; I2=73,2%) выше аналогичного показателя у лиц без СД. Кроме того, увеличение концентрации глюкозы в сыворотке крови натощак на 10 мг/дл ассоциировано с возрастанием уровня среднего ВГД на 0,09 мм рт. ст. (95% ДИ 0,05-0,12; I2=34,8%). Таким образом, не только сам факт наличия сопутствующего СД, но и длительность заболевания, уровень гликемии натощак связаны со значительным увеличением риска развития глаукомы.
Артериальное давление
Артериальная гипертензия (АГ) может спровоцировать появление глаукомы. К такому неутешительному выводу пришли Н. Вае и соавт. (2014), проанализировав результаты 16 исследований (n=60 084): ОШ развития открытоугольной глаукомы (ОУГ) у больных АГ составляет 1,22 (95% ДИ 1,09-1,36; модель с фиксированными эффектами) или 1,22 (95% ДИ 1,08-1,37; модель со случайными эффектами). При этом у больных АГ чаще возникает глаукома с высоким ВГД, а не нормотензивная форма заболевания (ОШ 1,92 и 0,94 соответственно).
Еще в одной работе (Zhao D. et al., 2014) не только отмечается зависимость между наличием АГ и формированием глаукоматозной оптической нейропатии (ОР 1,16; 95% ДИ 1,05-1,28; I2=34,5%), но и подчеркивается тесная взаимосвязь между уровнем артериального давления (АД) и ВГД. Оказывается, увеличение уровня систолического АД на 10 мм рт. ст. ассоциировано с возрастанием ВГД на 0,26 мм рт. ст. (95% ДИ 0,23-0,28; I2=30,7%); тогда как повышение диастолического АД на 5 мм рт. ст. приводит к росту ВГД на 0,17 мм рт. ст. (95% ДИ 0,11-0,23).
Дислипидемия
Эндотелиальной дисфункции и нарушению сосудистой регуляции отводится важная роль в многофакторном патогенезе глаукоматозной атрофии зрительного нерва. Дислипидемия – признанный фактор риска развития эндотелиальной дисфункции и, по мнению А. Junemann и соавт. (2014), является одной из причин возникновения глаукомы.
Курение
Мнения экспертов относительно роли курения в развитии глаукоматозной оптической нейропатии достаточно противоречивы. Одни, основываясь на метаанализе данных 6 обсервационных исследований, утверждают, что вероятность возникновения ПОУГ у пациентов, курящих в настоящее время (обобщенный ОР 0,97; 95% ДИ 0,81-1,16; р=0,74), а также у бывших курильщиков (ОР 0,97; 95% ДИ 0,83-1,13; р=0,66) не превышает таковой у лиц, никогда не имевших этой пагубной привычки (Zhou Y. et al., 2016). Другие (Jain V. et al., 2017) авторитетно и доказательно заявляют о наличии тесной взаимосвязи между курением и возникновением ПОУГ (данные 6 обсервационных исследований), количеством выкуренных сигарет и появлением ОУГ (данные 2 широкомасштабных испытаний), причем более опасно в этом отношении продолжающееся курение, а не курение в прошлом.
Синдром обструктивного апноэ сна
Распространенное заболевание, при котором происходит спадение дыхательных путей во сне, остановка или резкое ослабление дыхания, может привести к возникновению различных обменных и сосудистых нарушений, в том числе глаукомы. Доказательства данного факта представлены в различных метаанализах.
Например, в работе Y. Shi и соавт. (2015) обнаружено, что скорректированный риск развития глаукомы у пациентов с синдромом обструктивного апноэ сна (СОАС) составляет 1,67 (95% ДИ 1,30-2,17). При использовании модели с фиксированными эффектами значения обобщенного ОР несколько возросли и составили 1,96 (95% ДИ 1,37-2,80; данные 6 исследований типа «случай – контроль»); анализ модели со случайными эффектами продемонстрировал незначительное снижение этого показателя (ОР 1,41; 95% ДИ 1,11-1,79; данные 9 перекрестных исследований).
Подобная зависимость отмечена в метаанализе результатов 6 испытаний (3 когортных, 3 исследования типа «случай – контроль»; n=2 288 701): S. Liu и соавт. (2016) подтвердили высокую вероятность возникновения глаукомы у больных СОАС (скорректированный суммарный эффект для исследований типа «случай – контроль»: ОШ 2,46; 95% ДИ 1,32-4,59; р=0,005; для когортных исследований: ОШ 1,43; 95% ДИ 1,21-1,69; р=0,0001).
X. Wu и коллеги (2015), выполнив метаанализ 12 исследований (n=36 909), не только зафиксировали прямую зависимость между наличием СОАС и развитием глаукомы (ОШ 1,65; 95% ДИ 1,44-1,88; I2=43%), но и установили, что для пациентов с СОАС характерен высокий риск развития ПОУГ (ОШ 1,87; 95% ДИ 1,54-2,33; I2=0%), а не нормотензивной глаукомы. Характер течения СОАС также накладывает свой отпечаток на вероятность появления глаукоматозной оптической нейропатии: риск глаукомы более высок у больных с тяжелой формой СОАС (ОШ 5,49; 95% ДИ 1,04-33,83; I2=0%) в отличие от пациентов с легким/среднетяжелым течением заболевания.
Деменция и болезнь Альцгеймера
Болезнь Альцгеймера (БА) является одной из самых распространенных форм деменции. При этом нейродегенеративном заболевании отмечается появление внутринейрональных нейрофибриллярных отложений, экстрацеллюлярное накопление β-амилоида в виде бляшек, что приводит к появлению церебральной амилоидной ангиопатии, прогрессирующей утрате функционирующих нейронов и синапсов преимущественно в лимбических областях головного мозга. Кроме классических клинических проявлений (изменений личности, прогрессирующей когнитивной дисфункции, невозможности выполнять обычную повседневную деятельность), присоединяется значительное снижение зрения. В настоящее время результаты многих клинических и экспериментальных исследований подтверждают наличие вероятной общей причинно-следственной связи между БА и глаукомой. Эти два хронических нейродегенеративных заболевания имеют несколько схожих признаков: рост распространенности с увеличением возраста, дегенерация ганглиозных клеток сетчатки; экстрацеллюлярные фибриллярные отложения (наблюдающиеся также при эксфолиативной глаукоме), сходные механизмы клеточной гибели, продукция активных форм кислорода, митохондриальная дисфункция (Ghiso J. et al., 2013).
В одном из широкомасштабных исследований, проведенных C. Su и соавт. (2016), изучалась вероятность совместного развития ПОУГ/ПЗУГ и деменции. В этом исследовании приняли участие 6509 больных глаукомой (3304 с ПОУГ и 3205 с ПЗУГ), когорту сравнения составили 26 036 пациентов без глаукомы. Оказалось, что у страдающих глаукомой риск развития деменции выше, чем у лиц, не имеющих этой офтальмологической патологии (ОШ 1,13; 95% ДИ 1,01-1,27). У больных ПОУГ зафиксировано 1,21-кратное увеличение риска развития деменции по сравнению с пациентами без глаукомы (ОШ 1,21; 95% ДИ 1,02-1,43), в то время как для больных ПЗУГ такое утверждение не было правомочным (ОШ 1,09; 95% ДИ 0,95-1,26). Вероятность появления деменции возрастала с увеличением возраста больных ПОУГ (≥65 лет: ОР 1,28; 95% ДИ 1,07-1,54) и зависела от гендерной принадлежности (женский пол: ОР 1,34; 95% ДИ 1,06-1,69).
Helicobacter pylori
Helicobacter pylori (Нр) – это спиралевидная грамотрицательная бактерия, которая инфицирует слизистую оболочку желудка и двенадцатиперстной кишки, вызывает гастрит, гастродуоденальные язвы, рак желудка, MALT-лимфому. Высказывается мнение, что этот микроорганизм может быть причастен к развитию таких нейродегенеративных заболеваний, как БА и глаукома. Эту гипотезу сформулировали F. Tsolaki и соавт. (2015), выполнившие интересное исследование. В соответствии с дизайном данного испытания ученые сформировали 3 группы: в основную вошли 60 больных деменцией (БА, фронтотемпоральная деменция, болезнь Паркинсона) и 35 пациентов с ПОУГ; первую контрольную группу составили участники (n=31), не имевшие клинических проявлений деменции и глаукомы (в этой подгруппе изучалась распространенность Нр); вторая контрольная группа была представлена 30 пациентами, госпитализированными в ургентное офтальмологическое отделение (в данной подгруппе анализировалась взаимосвязь между деменцией и глаукомой).
Оказалось, что 68,33% больных деменцией были инфицированы Нр, в контрольной группе этот показатель составил 45,16% (р<0,05); гистологическое подтверждение инфицированности Нр получено у 68,57% больных глаукомой и 45,16% представителей контрольной группы (р<0,05). В основной группе 16,66% больных деменцией имели сопутствующую офтальмологическую патологию (в контрольной группе не было случаев глаукомы; р<0,01). На основании полученных данных исследователи резюмировали: «По сравнению с общей популяцией инфекция Нр достоверно чаще обнаруживается у больных БА и другими формами деменции, а также у пациентов с ПОУГ». Констатировав указанный факт, ученые пока не смогли объяснить природу этого явления, а также установить возможные благоприятные/неблагоприятные последствия инфицирования Нр в отношении прогрессирования БА и ПОУГ.
Подобные данные были получены в метаанализе (695 больных глаукомой, 1580 участников без глаукомы), выполненном под руководством J. Zeng (2015). Ученые зафиксировали статистически значимую взаимосвязь между инфицированием Нр и развитием ОУГ (ОШ 2,08; 95% ДИ 1,42-3,04), ПОУГ (ОШ 3,06; 95% ДИ 1,27-2,46), нормотензивной глаукомы (ОШ 1,77; 95% ДИ 1,76-5,34), но не с возникновением псевдоэксфолиативной глаукомы (ОШ 1,46; 95% ДИ 0,40-5,30; р=0,05).
Миопия
Наличие такой аномалии рефракции, как близорукость, может предрасполагать к появлению глаукомы. Такой вывод сделали М. Marcus и коллеги (2011), авторы систематического обзора и метаанализа 13 исследований (n=48 161): обобщенное ОШ возникновения глаукомы у лиц, страдающих миопией, составило 1,92 (95% ДИ 1,54-2,38; данные 11 испытаний). Наибольший риск возникновения глаукомы зафиксирован у пациентов с миопией высокой степени (-3 диоптрии и больше; обобщенное ОШ 2,46; 95% ДИ 1,93-3,15), минимальный – у больных миопией слабой степени (до -3,0 диоптрий; обобщенное ОШ 1,65; 95% ДИ 1,26-2,17).
Мигрень
Результаты недавних исследований убедительно доказывают, что мигрень («болезнь великих людей») может не только нарушать привычный ритм жизни приступами интенсивной пульсирующей односторонней головной боли, но и провоцировать появление глаукомы. Среди множества таких исследований следует особо отметить работу G. Gramer и соавт. (2015), в которой при помощи специальной стандартизированной анкеты было опрошено 2027 пациентов с глаукомой и внутриглазной гипертензией. Проанализировав полученные результаты, ученые установили, что многие респонденты страдали ПОУГ (n=1244), ПЗУГ (n=218), нормотензивной глаукомой (n=140), имели внутриглазную гипертензию (n=138), пигментную (n=49) или псевдоэксфолиативную глаукому (n=64). В сформированной когорте 13,7 и 19,0% пациентов сообщили о периодическом появлении симптомов мигрени и вазоспазма соответственно; при этом 30,8% больных имели отягощенный семейный анамнез в отношении мигрени, а 40,3% опрошенных – касательно глаукомы. Респонденты с отягощенным анамнезом в отношении глаукомы чаще страдали мигренозной головной болью по сравнению с лицами без подобной патологии в анамнезе (15,7 vs 12,3% соответственно; р=0,02). Мигрень чаще имела место у больных нормотензивной глаукомой (21,4%), чем у пациентов с ПОУГ (13,1%; р=0,01), псевдоэксфолиативной глаукомой (7,8%; р=0,02), ПЗУГ (10,1%; р=0,004). Наибольшая вероятность развития мигрени (63,5%) зафиксирована у анкетируемых с нормотензивной глаукомой по сравнению с соответствующим показателем у больных ПОУГ (р=0,007).
Международные рекомендации
 В 2015-2016 гг. две авторитетные международные организации – Американская академия офтальмологии (American Academy of Ophthalmology, ААО) и Международный совет по офтальмологии (International Council of Ophthalmology, ICO) – опубликовали руководства по лечению ПОУГ и глаукомы соответственно. В каждом из этих документов рассматриваются патофизиология, диагностика, медикаментозное и оперативное лечение заболевания; помимо этого, уделяется большое внимание факторам риска возникновения данной офтальмологической патологии (табл. 2).
В 2015-2016 гг. две авторитетные международные организации – Американская академия офтальмологии (American Academy of Ophthalmology, ААО) и Международный совет по офтальмологии (International Council of Ophthalmology, ICO) – опубликовали руководства по лечению ПОУГ и глаукомы соответственно. В каждом из этих документов рассматриваются патофизиология, диагностика, медикаментозное и оперативное лечение заболевания; помимо этого, уделяется большое внимание факторам риска возникновения данной офтальмологической патологии (табл. 2).
По мнению американских экспертов, терапия глаукомы должна быть направлена на достижение целевых значений ВГД, стабилизацию состояния зрительного нерва и предупреждение сужения полей зрения.
Положение Руководства ААО «Первичная открытоугольная глаукома» (2015) гласит, что ВГД можно снизить при помощи медикаментов, лазеротерапии или инцизионного хирургического лечения (в виде монотерапии или в сочетании с другими методами). Следует обсуждать с пациентами возможные риски и преимущества любого метода лечения (высокое качество доказательств, сильная рекомендация).
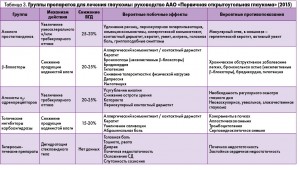 Аналоги простагландинов в виде глазных капель чаще всего используются для инициального снижения ВГД у больных глаукомой, так как они наиболее эффективны, хорошо переносятся, принимаются 1 р/сут, относительно безопасны (I+, высокое качество доказательств, сильная рекомендация).
Аналоги простагландинов в виде глазных капель чаще всего используются для инициального снижения ВГД у больных глаукомой, так как они наиболее эффективны, хорошо переносятся, принимаются 1 р/сут, относительно безопасны (I+, высокое качество доказательств, сильная рекомендация).
Кроме аналогов простагландинов, в руководстве ААО предполагается возможность применения препаратов других групп (табл. 3).
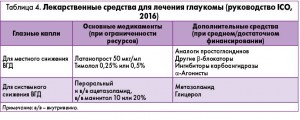
Эксперты ICO полностью согласны со своими американскими коллегами в вопросе медикаментозного лечения, уточняя при этом, что препаратом выбора для снижения ВГД может быть такой аналог простагландина, как латанопрост (табл. 4).
Латанопрост является аналогом простагландина F-2α, селективным агонистом простаноидных рецепторов FP. Латанопрост снижает ВГД путем увеличения преимущественно увеосклерального оттока внутриглазной жидкости из глаза. Снижение ВГД начинается примерно через 3-4 ч после введения препарата, максимальный эффект развивается через 8-12 ч, а действие медикамента сохраняется на протяжении как минимум 24 ч. По данным многоцентровых рандомизированных контролированных исследований (РКИ), у пациентов с исходным ВГД 24-25 мм рт. ст., получавших латанопрост на протяжении 6 мес, было зафиксировано снижение ВГД на 6-8 мм рт. ст. Имеются убедительные доказательства эффективности монотерапии латанопростом. Кроме того, в ряде РКИ доказана результативность длительной комбинированной терапии латанопростом и β-блокатором (тимололом), кратковременной сочетанной терапии с агонистом адренорецепторов (дипивалил эпинефрина), пероральным ингибитором карбоангидразы (ацетазоламид). В ходе этих РКИ отмечены также хорошая переносимость и высокий профиль безопасности латанопроста: препарат не влияет на продуцирование водянистой влаги, не проникает через гематоэнцефалический барьер, в обычных терапевтических дозах не оказывает значимого фармакологического воздействия на активность сердечно-сосудистой и дыхательной систем.
В ряде экспериментальных исследований отмечены антиоксидантные, антиагрегантные, вазодилатирующие свойства этого лекарственного средства; это позволило некоторым ученым предположить наличие у латанопроста нейропротекторного действия, что чрезвычайно важно при таком нейродегенеративном заболевании, как глаукома.
Результаты РКИ, доказавших эффективность латанопроста в лечении ОУГ, ПЗУГ, были подтверждены в целом ряде систематических обзоров и метаанализов. Так, в метаанализе результатов 5 РКИ (n=528; Lou Н. et al., 2014) установлено, что назначение латанопроста способствует более выраженному снижению ВГД у больных ПЗУГ, чем применение тимолола: достоверные различия зафиксированы в динамике суточных изменений (взвешенная разность средних (ВРС) 2,22 мм рт. ст.; 95% ДИ 1,65-2,79; р<0,00001), пикового (ВРС 2,44 мм рт. ст.; 95% ДИ 0,85-4,03; р=0,003) и минимального (ВРС 2,67 мм рт. ст.; 95% ДИ 1,93-4,41; р<0,00001) уровня ВГД.
По данным R. Chen и соавт., у больных закрытоугольной глаукомой латанопрост способствует снижению средних значений ВГД на 7,9 мм рт. ст. (32,4%), пикового и минимального уровня ВГД на 7,4 мм рт. ст. (29,8%) и 7,9 мм рт. ст. (32,5%) соответственно. Доказательства эффективности латанопроста в снижении ВГД у пациентов с ПОУГ приводятся в работе L. Lin и соавт. (2014).
Нейропротекторная терапия
Несмотря на подробное описание нюансов традиционного медикаментозного лечения, ни в одном из упомянутых руководств не рассматриваются вопросы вспомогательной фармакотерапии. Основываясь на особенностях патогенеза глаукомы, многие ученые считают целесообразным использование нейропротекторных препаратов. Особое значение нейропротекторная стратегия будет иметь у больных с сопутствующей деменцией, БА, когнитивной дисфункцией. Необходимо помнить, что одним из главных условий проведения нейропротекторного лечения в офтальмологии является стойкая предварительная нормализация офтальмотонуса.
В обзоре S. Jain и соавт. (2015) рассматривается потенциальная роль нейропротекции в лечении глаукомы и регенерации зрительного нерва. Авторы предлагают несколько вариантов возможных терапевтических действий: блокировать эксайтотоксичность глутамата при помощи мемантина (неконкурентного антагониста NMDA-рецепторов, разрешенного FDA для лечения БА средней/тяжелой степени тяжести), активировать α2-рецепторы посредством бримонидина (селективного α2-адреномиметика, рекомендованного для лечения ОУГ), усилить регенерацию зрительного нерва при помощи нейротрофического препарата – цитидин-5′-дифосфохолина (цитиколина).
Цитиколин, являясь естественным метаболитом физиологических реакций организма, активирует биосинтез структурных фосфолипидов мембран нейронов, увеличивает синтез фосфадилхолина, способствует регенерации нервных волокон зрительного нерва (Roberti G. et al., 2015), стимулирует дофаминергическую систему в головном мозге и сетчатке (Mao J. et al., 2016). Цитиколин широко применяется в лечении цереброваскулярных заболеваний, в том числе деменции и нейродегенеративных заболеваний (БА, болезнь Паркинсона). Доказано, что цитиколин препятствует отложению β-амилоида (нейротоксического белка, играющего центральную роль в патофизиологии БА), улучшает когнитивные способности у пациентов с БА.
На протяжении последних лет поццявились результаты экспериментальных и клинических исследований, доказавших целесообразность применения цитиколина в лечении глаукомы. L. Ottobelli и соавт. (2013) доказали, что пероральный раствор цитиколина замедляет прогрессирование глаукоматозной оптической нейропатии. По данным V. Parisi и коллег (2015), глазные капли цитиколина способствуют увеличению биоэлектрического ответа сетчатки (росту амплитуды электроретинограмм) с последующим повышением биоэлектрической активности зрительной коры (возрастанием латентного периода и амплитуды визуальных индуцированных потенциалов). В работе G. Roberti и соавт. (2014) применение цитиколина у больных ПОУГ способствовало улучшению функции ганглионарных клеток сетчатки: уменьшению амплитуды потенциала Р50 (р=0,04) и увеличению амплитуды Р50, N95 (р<0,0001) электроретинограмм; выявленная особенность сохранялась даже спустя 30 дней отмывочного периода (р=0,01 и р=0,002 соответственно).
Отечественные ученые также высоко оценили эффективность цитиколина в лечении глаукомы. Например, М. Фролов и соавт. (2010), наблюдавшие за состоянием больных ПОУГ, установили, что назначение данного препарата способствует увеличению остроты зрения, улучшению периметрических индексов статической автоматической периметрии, стабилизации показателей ретинотомографии. Исследователи утверждают, что эффективность комбинированной терапии с включением цитиколина превосходит результативность стандартного консервативного лечения глаукомы. Г. Шкребец и соавт. (2012) успешно использовали цитиколин у лиц молодого возраста с первичной ювенильной глаукомой, миопией с нормализованным ВГД: применение препарата сопровождалось улучшением и/или стабилизацией зрительных функций. Выявленные изменения после курсового лечения цитиколином исследователи охарактеризовали как «стабилизацию функционального состояния зрительного нерва и внутренних слоев сетчатки, что косвенно можно расценить как благоприятный признак в прогнозе глаукомной оптической нейропатии».
Профилактика
Еще одним значимым направлением в комплексном лечении глаукомы могут быть различные превентивные мероприятия. Попытка свести к минимуму воздействие внешних неблагоприятных факторов, которые становятся пусковыми механизмами повышения ВГД, способна предотвратить развитие грозного заболевания. Ежедневные умеренные физические нагрузки, сбалансированное питание с достаточным количеством овощей, фруктов, рыбы, профилактические осмотры офтальмолога можно отнести к действенным мерам первичной профилактики. При наличии сопутствующих заболеваний (СД, АГ, БА, деменции) немаловажными будут стабилизация показателей гликемии, уровня АД, прием нейропротекторных препаратов.
Вероятность возникновения глаукомы чрезвычайно высока у лиц, имеющих описанные факторы риска. Своевременная диагностика и современная медикаментозная терапия позволяют нормализовать показатели ВГД, остановить прогрессирующее снижение зрения, предотвратить развитие острых приступов глаукомы и стабилизировать состояние зрительного нерва.
Список литературы находится в редакции.
Подготовила Лада Матвеева
Медична газета «Здоров’я України 21 сторіччя» № 13-14 (410-411), липень 2017 р.