25 вересня, 2017
Інтерпретація змін печінкових проб: практичні рекомендації Американської колегії гастроентерологів

 Сьогодні неможливо уявити роботу лікаря будь-якої спеціальності без використання методів
лабораторної діагностики для встановлення діагнозу та оцінки ефективності проведеного лікування.
Відповідно до вимог доказової медицини будь-яке медичне рішення – від діагностики до вибору
терапії та визначення прогнозу для хворого – має ґрунтуватися на результатах клініко-лабораторних
досліджень. У практичній діяльності лікаря-клініциста дати правильну оцінку результатам аналізів
та ефективно її використовувати – найголовніше завдання. Серед найбільш поширених
лабораторних тестів – печінкові проби. Клініцисти щодня оцінюють аномальні показники печінкового
комплексу – рівень аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), лужної
фосфатази, гамма-глутамілтрансферази (ГГT) та білірубіну в сироватці крові пацієнтів.
Сьогодні неможливо уявити роботу лікаря будь-якої спеціальності без використання методів
лабораторної діагностики для встановлення діагнозу та оцінки ефективності проведеного лікування.
Відповідно до вимог доказової медицини будь-яке медичне рішення – від діагностики до вибору
терапії та визначення прогнозу для хворого – має ґрунтуватися на результатах клініко-лабораторних
досліджень. У практичній діяльності лікаря-клініциста дати правильну оцінку результатам аналізів
та ефективно її використовувати – найголовніше завдання. Серед найбільш поширених
лабораторних тестів – печінкові проби. Клініцисти щодня оцінюють аномальні показники печінкового
комплексу – рівень аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), лужної
фосфатази, гамма-глутамілтрансферази (ГГT) та білірубіну в сироватці крові пацієнтів.
 Наприкінці 2016 р. Американська колегія гастроентерологів (American College of Gastroenterology –
ACG) випустила оновлені рекомендації з біохімічних
аналізів крові, результати яких використовують для
оцінки стану печінки [1]. Нове керівництво орієнтоване як на гепатологів, так і на лікарів первинної ланки. Це перший такий документ, в якому автори наводять специфічні значення для нормального діапазону
рівнів АЛТ та пропонують вживати терміни «печінкові біохімічні аналізи» або «печінкові проби» замість
некоректного терміна «показники функції печінки».
Наприкінці 2016 р. Американська колегія гастроентерологів (American College of Gastroenterology –
ACG) випустила оновлені рекомендації з біохімічних
аналізів крові, результати яких використовують для
оцінки стану печінки [1]. Нове керівництво орієнтоване як на гепатологів, так і на лікарів первинної ланки. Це перший такий документ, в якому автори наводять специфічні значення для нормального діапазону
рівнів АЛТ та пропонують вживати терміни «печінкові біохімічні аналізи» або «печінкові проби» замість
некоректного терміна «показники функції печінки».
Наведемо зведені висновки рекомендацій.
1. Печінкові біохімічні аналізи – АЛТ, AСT, лужна фосфатаза та білірубін – є маркерами пошкодження паренхіми печінки, а не функції печінки.
2. Зміни рівнів альбуміну, білірубіну та протромбінового часу є одними із основних показників стану гепатоцелюлярної функції. Вони також можуть бути зумовлені позапечінковими факторами.
3. Лабораторний аналіз рівнів АЛТ, АСТ і лужної фосфатази – досить простий метод діагностики за виконанням.
4. Збільшення рівнів АЛТ і/або АСТ, лужної фосфатази та білірубіну свідчить про наявність гепатоцелюлярного пошкодження, яке потребує потенційної оцінки.
5. Рівень AЛT – більш специфічний маркер захворювання печінки, ніж рівень АСТ.
6. Підвищений рівень лужної фосфатази печінкового походження супроводжується підвищенням рівня ГГT, тому за його наявності потрібно провести
фракціонування лужної фосфатази.
Таким чином, стандартна комплексна метаболічна
печінкова панель містить: показники рівнів АЛТ, АСТ,
лужної фосфатази, білірубіну та альбуміну. Додатково
можна замовити протромбіновий час. Зміни рівня сироваткового альбуміну або протром бінового часу
пов’язані зі зменшенням маси функ ціонуючої паренхіми печінки, хоча жодний із цих показників не є специфічним для захворювань печінки (табл.) [1].
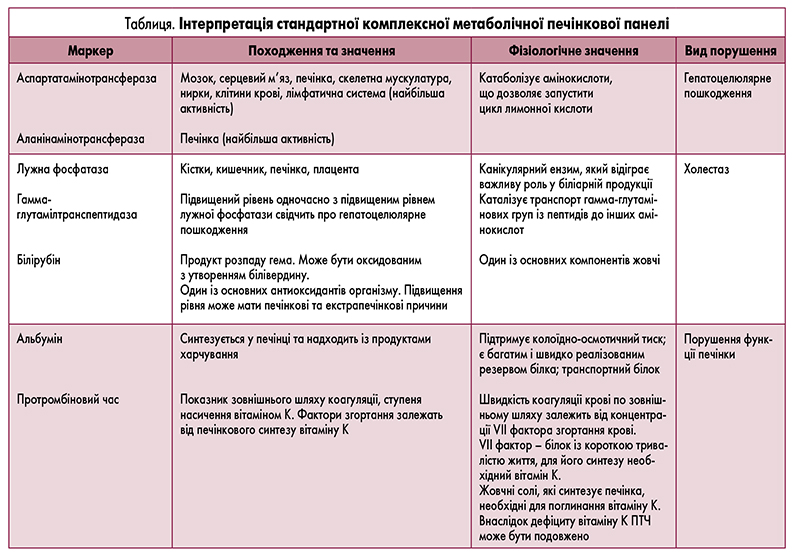
Амінотрансферази – ферменти, що каталізують взаємне перетворення амінокислот і α-кетокислот шляхом перенесення аміногрупи. Їх відкрили А.Е. Браунштейн і М.Г. Крицман у 1937 р. Переамінування відбувається за наявності коферменту – фосфопіридоксалю, який є фосфорильованим похідним вітаміну В6. Амінотранс ферази, у тому числі АЛТ і АСТ, є ферментами, які беруть участь у передаванні аміногруп аспартату та аланіну до кетоглутарової кислоти, і маркерами захворювань печінки [2]. АСТ наявна в печінці та інших органах (серцевий м’яз, скелетний м’яз, нирки, мозок та ін.). Натомість AЛT – переважно в печінці, тому її рівень є більш специфічним маркером пошкодження гепатоциту [3, 4]. Підвищений рівень AСT за відсутності змін рівня AЛT вказує на можливі серцеві чи м’язові захворювання.
Лужна фосфатаза – представник групи металопротеїназ цинку – ферментів, які каталізують гідроліз
фосфатних ефірів при лужному pH [5]. Цей фермент
знаходиться в гепатоцитах на канальній мембрані,
а не у клітинах жовчної протоки. Лужна фосфатаза
також наявна в кістках, плаценті, кишечнику і нирках. Поза печінкою найбільша її концентрація відмічається у кістках. У практиці враховують те, що у пацієнтів із групою крові 0 і B рівень лужної фосфатази
в сироватці може зростати внаслідок вживання жирної їжі через підвищення її рівня в кишечнику [6].
Як правило, рівень лужної фосфатази підвищується
внаслідок обструкції жовчних проток через збільшення її канальцевого синтезу з подальшою транслокацією в синусоїд. Підвищений рівень лужної фосфатази є маркером пошкодження печінки [7]. Це відбувається навіть за наявності незначних уражень і нормального рівня сироваткового білірубіну. Для
підтвердження печінкового походження лужної фосфатази необхідно виміряти рівень канальцевого ферменту – ГГТ, тобто провести фракціонування лужної
фосфатази. Підви щення рівня ферментів, які є більш
специфічні для печінки, а саме 5'-нуклеотидази або
ГГТ, дозволяє визначити печінкове джерело лужної
фосфатази [3]. Ізольоване підвищення рівня ферменту (коли інші результати печінкових тестів – у межах
норми) часто відмічається при вогнищевих ураженнях
печінки (наприклад, абсцесі, пухлині) або при частковій або інтермітуючій обструкції біліарного тракту.
Також ізольовано може бути підвищений рівень лужної фосфатази за відсутності захворювання печінки
або біліарного тракту, наприклад, при малігнізації без
залучення у процес печінки (бронхогенний рак, лімфома Ходжкіна, нирково-клітинний рак), після споживання жирної їжі (фермент утворюється в тонкому
кишечнику), при вагітності (у плаценті), у дітей і підлітків у період росту (через розвиток кісткової тканини) і при хронічній нирковій недостатності (у кишечнику і кістковій тканині). Ізольоване підвищення рівня лужної фосфатази за відсутності симптомів захворювання у літніх людей зазвичай пов’язане
з патологією кісток (наприклад, із хворобою Педжета)
і не вимагає подальшого дослідження.
Білірубін утворюється у результаті розпаду еритроцитів і переважно циркулює в некон’югованій формі. Він тісно пов’язаний з альбуміном. Некон’югований білірубін не виводиться з організму з сечею. Внаслідок кон’югації білірубіну уридин-5-дифосфат глюкуронілтрансферазою утворюється водорозчинна його форма – кон’югований білірубін, що дозволяє виводити білірубін із жовчю. У товстій кишці він перетворюється бактеріями на уробіліноген, який згодом виводиться з організму з сечею та калом. Відсутність уробіліногену в калі надає йому характерного глинистого кольору за наявності перешкод для жовчовиділення. Некон’югований, або вільний, або непрямий, білірубін визначається за реакцією Ван ден Берга і становить ~70% від загального білірубіну в сироватці крові (рис.). Зазвичай загальний білірубін у сироватці крові <1,1 мг/дл і підвищений прямий білірубін (кон’югований білірубін) вказує на гепатоцелюлярну дисфункцію або холестаз.
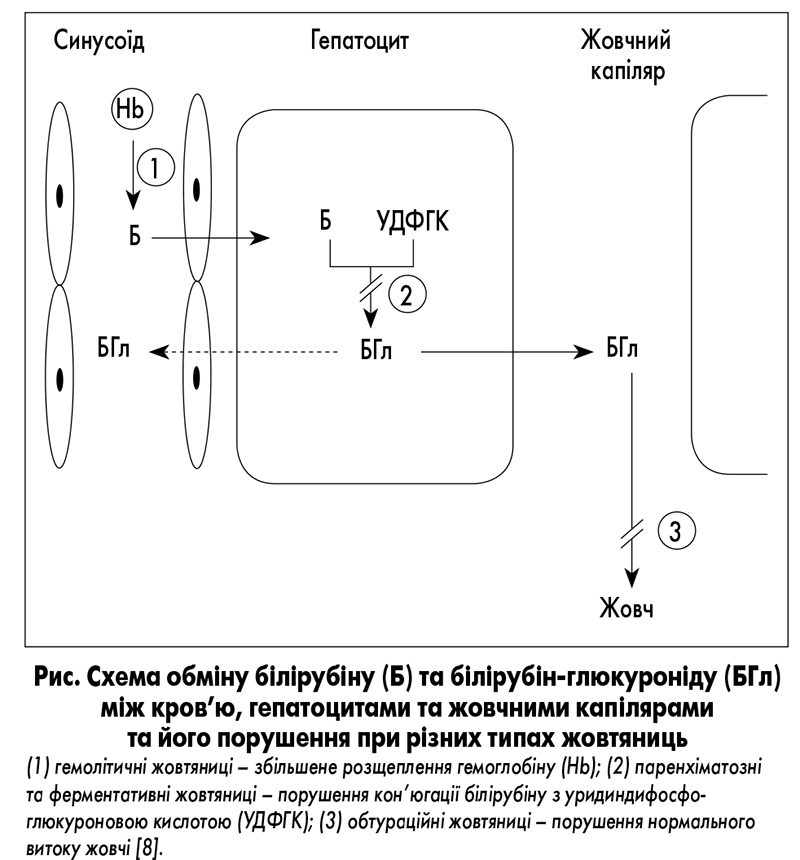
Фракціонування загального білірубіну найбільш доцільно проводити за нормальних або майже нормальних рівнів АЛТ, АСТ і лужної фосфатази. Якщо загальний білірубін підвищений, а фракціонування показує
підвищення некон’югованого білірубіну, гіпер білі рубінемію навряд чи можна пояснити наявністю гепатоцелюлярного захво рювання. Підвищення рівня кон’югованого білірубіну характерно для гепатоцелюлярних, холестатичних розладів з обструкцією на рівні
жовчної протоки. Саме при цих холе статич них станах
прямий білірубін на 60-90% може скла датися з іншої
форми білірубіну – дельта-білірубіну. Дельта-білірубін являє собою сполучення кон’югованого білірубіну та альбуміну і має період напіврозпаду, аналогічний альбуміну [3].
Дельта-білірубін пояснює тривалу жовтяницю у пацієнтів
після перенесених гепатиту або механічної жовтяниці при
відновленні прохідності жовчних шляхів, оскільки його
розпад безпосередньо пов’язаний із періодом напіврозпаду
альбуміну, який становить 14-21 день. Водночас рівень
дельта-білірубіну не підвищується при некон’югованій гіпербілірубінемії.
Маркерами гепатоцелюлярної функції є два показники – альбумін і протромбіновий час. Альбумін – це білок
плазми, який синтезується в печінці, його період напіврозпаду становить 3 тижні [4]. Знижений рівень альбуміну
(нормальний ≥3,5 г/дл) зазвичай вказує на хворобу печінки тривалістю понад 3 тижні, хоча рівень альбуміну може
знизитися при будь-яких серйозних захворюваннях через
ефекти цитокінів. Протромбіновий час – значно більш
чутливий маркер функції печінки, ніж альбумін, тому що
протромбіновий час може бути подовжено у пацієнтів
із тяжким захворюванням печінки тривалістю <24 год.
Протромбіновий час дозволяє визначити порушення
у зовнішньому шляху коагуляції. Це показник тенденції
згортання крові факторів I, II, V, VII, IX і X. Оскільки фактори II, VII, IX і X залежать від вітаміну К, то за наявності
холестазу, коли вітамін К не поглинається, протромбіновий час подовжується. Крім того, значна гепатоцелюлярна
дисфункція може привести до подовження протромбінового часу. Це зазвичай відбувається, доки концентрація
факторів згортання не впаде нижче 10% від норми. Як
правило, за відсутності захворювання печінки подовження протромбінового часу пов’язане з дефіцитом вітаміну К і/або стеатореєю. Слід зазначити, що протромбіновий час також може бути збільшений при прийомі варфарину, гепарину, а також при синдромі дисемінованого
внутрішньосудинного згортання і гіпотермії.
Інтерпретацію печінкового комплексу неможливо здійснити без встановлених діапазонів нормальних значень біохімічних показників. Однак чітких меж для цих значень не існує. Нормою вважають показники, значення яких перебувають в інтервалі між мінімально і максимально допустимою величиною. Крім того, через використання різних реактивів або технологій абсолютні величини для кожного показника печінкового біохімічного аналізу крові можуть варіювати залежно від того, в якій лабораторії виконано дослідження. У зв’язку з цим основну увагу потрібно приділяти, чи перебуває значення показника в діапазоні від мінімальної до максимальної допустимої величини.
Повертаючись до рекомендацій ACG, наведемо зведені висновки стосовно норм печінкового комплексу.
1. Нормальний рівень АЛТ становить: 29-33 МО/л для чоловіків і 19-25 МО/л для жінок, відхилення показника від діапазону цих значень обов’язково слід оцінювати.
2. Підвищений рівень AЛT або AСT, який перевищує верхню межу норми (ВМН) у популяції без ідентифікованих факторів ризику, значно збільшує ризик смерті у зв’язку з захворюваннями печінки.
3. Існує лінійна залежність між рівнем AЛT та індексом маси тіла (ІМТ), що необхідно враховувати.
4. Нормальний рівень АЛТ неможе бути підставою для виключення наявності серйозного захворювання печінки.
5. Рівень АЛТ вищий у чоловіків, ніж у жінок.
6. Діапазони ВМН AЛT і AСT можуть різнитися залежно від того, в якій лабораторії виконано дослідження.
7. Лікарі можуть орієнтуватися на діапазони ВМН для
лужної фосфатази та білірубіну за місцевими лабораторними
даними [1].
Одна з найважливіших змін порівняно з попередніми
редакціями рекомендацій полягає в тому, що новий документ містить визначення нормальних рівнів АЛТ. Попередні
керівництва ґрунтувалися на значеннях ВМН, які залежно
від лабораторії можуть значно варіювати у широкому діапазоні: від 30-40 МО/л в одних установах – до 70-80 МО/л
в інших. Отже, згідно з новими рекомендаціями, нормальний діапазон значень рівня АЛТ – 29-33 МО/л для чоловіків і 19-25 МО/л для жінок.
Автори рекомендацій ACG усвідомлюють, що через зниження межі норми ці значення у багатьох людей потраплять у категорію підвищених. Дійсно, у багатьох журналах опубліковані коментарі з побоюваннями, що тепер лікарям доведеться призначати велику кількість аналізів для встановлення причини підвищення значень печінкових показників і це збільшить витрати на діагностичний пошук. Попри це, автори вважають виправданим використання більш низьких відправних точок та сподіваються, що з часом лікарі-практики звикнуть до нових рівнів. Це допоможе ідентифікувати людей із хронічними захворюваннями печінки на ранніх стадіях.
Вказана ВМН для AЛT була запропонована у масштабному дослідженні за участю 6835 донорів крові з нормальною
вірусною серологією та ІМТ 24,9 кг/м2
: до 30 МО/л для чоловіків і 19 МО/л для жінок [9]. Проведене у Кореї дослідження, в яке було включено 1105 потенційних донорів печінки
з нормальною біопсією печінки, показало, що вік, ІМТ і метаболічні фактори також значимі для рівня AЛT [10]. Автори
дослідження запропонували ВМН для AЛT – 33 МО/л для
чоловіків і 25 МО/л для жінок. На підставі аналізу бази даних
Національного обстеження стану здоров’я і харчування
(NHANES) 1999-2002 рр. та 2005-2008 рр., виключивши випадки вірусних гепатитів, зловживання алкоголем, діабету,
ІМТ >25 або збільшеної окружності талії, за результатами
статистичного аналізу розрахували «найбільш правильне»
значення ВМН для AЛT – 29 МО/л для чоловіків і 22 МО/л
для жінок [11].
У цілій низці досліджень продемонстровано кореляційний зв’язок між рівнями АЛТ, АСТ та захворюваністю і смертні- стю. Німецькі дослідники встановили, що у пацієнтів із рівнем AСT >18 МО/л ризик смертності від усіх причин зріс утричі [12]. У дослідженні, проведеному в Кореї, показано, що порівняно з групою пацієнтів із рівнем АЛТ або АСТ <20 МО/л у групі з показниками 30-39 МО/л відносний ризик (ВР) смертності, пов’язаної з патологією печінки, становив: 9,5 (95% ДІ 7,9-11,5) для AЛT або 8 (95% ДІ 6,6-9,8) – для AСT у пацієнтів чоловічої статі і 6,6 (95% ДІ 1,5-25,6) або 8,2 (95% ДІ 8,1-40,4) відповідно – жіночої [13]. Аналогічні результати отримано в американському дослідженні, зокрема, показано, що підвищені рівні АСТ та AЛT корелюють із більш високою смертністю. Так, стандартизований коефіцієнт смертності (СКС) становив: 1,32 – для пацієнтів із показниками АСТ у 1-2 рази вищими від ВМН (при ВМН: 31 МО/л для чоловіків і жінок), і 1,75 – з показниками АСТ у більше ніж 2 рази вищими від ВМН, та 1,21 – для пацієнтів із показниками АЛТ у 1-2 рази вищими від ВМН (при ВМН: 45 МО/л для чоловіків, 29 МО/л для жінок), і 1,51 – з показниками АСТ у більше ніж 2 рази вищими від ВМН. Для порівняння, СКС при нормальних рівнях АСТ і АЛТ становив 0,95 та 0,61 відповідно [14].
Для оцінки ризику захворюваності та смертності у зв’язку
з аномальними тестами печінкових проб використовували
результати досліджень баз даних NHANES. В одному з досліджень продемонстровано зростання ризику смертності
в 11,2 разу, пов’язаної з захворюваннями печінки, при підвищеному рівні AЛT (при ВМН: 30 МО/л для чоловіків
і 19 МО/л для жінок) [15]. Проведено ще один аналіз, в якому
встановлено зв’язок між ризиком розвитку ішемічної хвороби серця та рівнем AЛT. При цьому показники ризику розвитку цього захворювання були вищими у чоловіків із ВМН
для АЛТ >43 МО/л, ніж у жінок із ВМН для АЛТ >30 МО/л.
Слід зазначити, що у дослідженні узяли участь пацієнти
з підвищеними рівнями АЛТ, не асоційованими із хронічним
вірусним гепатитом чи надмірним вживанням алкоголю [16].
У вказаних дослідженнях продемонстровано клінічне значення зміни ВМН показників рівнів АЛТ та АСТ, тому лікарі-практики повинні враховувати ці рекомендації для діагностики захворювань печінки. Необхідність прийняття нових стандартизованих норм рівнів АЛТ та АСТ підтверджують також дослідження, в яких встановлено наявність патології печінки при нормальних показниках печінкових амінотрансфераз. Так, в одному зі звітів у пацієнтів із гепатитом С із нормальним рівнем АЛТ (ВМН <50 МО/л) або майже нормальним (до 4 разів менше від ВМН) був мостоподібний фіброз – у 9% та цироз – у 11% [17]. У когорті пацієнтів із гемохроматозом, із них 32% – із цирозом, у 40% пацієнтів були нормальні рівні АЛТ та АСТ [18]. В іншому дослідженні показано, що рівень АЛТ, який становив 40 МО/л, пов’язаний із високою поширеністю стеатозу печінки в когорті, у пацієнтів якої використовувалась магнітно-резонансна спектрометрія для визначення рівня печінкових тригліцеридів як маркера печінкового стеатозу. У79% пацієнтів із підвищеним рівнем тригліцеридів у печінці показник АЛТ був <40 МО/л у чоловіків і 31 МО/л у жінок. Додатково зазначимо, що у низці досліджень встановлено лінійний та кореля- ційний зв’язок рівня АЛТ та ІМТ [19].
Встановлення тісного зв’язку неалкогольної жирової хвороби печінки (НАЖХП) із цукровим діабетом 2 типу, ожирінням, метаболічним синдромом та серцево-судинними захворюваннями стимулювало зростання інтересу до НАЖХП як однієї з актуальних проблем охорони здоров’я. Рівень сироваткової AЛT запропоновано як маркер наявності НАЖХП, але значення цього показника перебувають у діапазоні, який зараз вважається «нормою» у значній частині досліджень щодо НАЖХП. Подальше дослідження показало, що рівень AЛT у сироватці є чутливим і точним біомаркером наявності НАЖХП за умови перегляду ВМН для AЛT та її встановлення на нижчому рівні. При пороговому значенні рівня АЛТ 23 МЕ/л було визначено 94% осіб із НАЖХП у цій серії, при використанні магнітно-резонансної спектроскопії 3 Тесла для кількісного аналізу тригліцеридів печінки [20].
Слід зазначити, що автори рекомендацій ACG пропонують змінити позиції стосовно прийняття клінічних рішень
при патології печінки на підставі кратних ВМН для АЛТ
(2X, 3X ВМН і т.д.), які використовують і досі. На їх переконання, такий підхід призводить до недооцінки патологічних змін у паренхімі печінки. Мета даної настанови –
застосовувати саме встановлену ВМН для АЛТ, що підтверджує показаний у дослідженнях зв’язок між рівнем
АЛТ і рівнем смертності від захворювань печінки. Однак
клінічний підхід та судження залишаються пріоритетом.
За наявності у пацієнта ознак й/або симптомів захворювання печінки навіть при нормальних значеннях показників печінкового комплексу необхідно провести діагностичний пошук для виключення цієї патології.
Література
1. Kwo Paul Y. ACG Practice Guideline: Evaluation of Abnormal Liver Chemistries / Paul Y. Kwo, MD, FACG, FAASLD, Stanley M. Cohen, MD, FACG, FAASLD and Joseph K. Lim, MD, FACG, FAASLD // Am. J. Gastroenterol advance online publication. – 2016. – 20 December. – Р. 1-18. – Режим доступу: 10.1038/ajg.2016.517.
2. Karmen A. Transaminase activity in human blood / A. Karmen, F. Wroblewski, J.S. Ladue // J. Clin. Invest. – 1955. – № 34. – P. 126.
3. Dufour D.R. Diagnosis and monitoring of hepatic injury. I. Performance characteristics of laboratory tests / D.R. Dufour, J.A. Lott, F.S. Nolte et al. // Clin. Chem. – 2000. – № 46. – P. 2027-49.
4. Dufour D.R. Diagnosis and monitoring of hepatic injury. IІ. Performance characteristics of laboratory tests / D.R. Dufour, J.A. Lott, F.S. Nolte et al. // Clin. Chem. – 2000. – № 46. – P. 2050-68.
5. Roberts W.M. Variations in the phosphatase activity of the blood in disease / W.M. Roberts // Br. J. Exp. Pathol. 1930; 11: 90-5.
6. Matsushita M. Relationship between the eff ects of a high-fat meal and blood group in determination of alkaline phosphatase activity. / M. Matsushita, T. Komoda // Rinsho Byori. – 2011. – № 59 – P. 923-9.
7. Vroon D.H. Alkaline phosphatase and gamma glutamyltransferase. / M. Matsushita, T. Komoda. In: H.K. Walker, W.D. Hall, J.W. Hurst (eds). // Clinical Methods: The History, Physical, and Laboratory Examinations. Butterworths: Boston, 1990.
8. Губський Ю.І. Біологічна хімія / Ю.І. Губський; Допущено Міністерством охорони здоров’я України як підручник для студентів вищих медичних навчальних закладів освіти III-IV рівнів акредитації. – Тернопіль: Укрмедкнига, 2000. – C. 510.
9. Prati D. Updated defi nitions of healthy ranges forserum alanine aminotransferase levels. / D. Prati, E. Taioli, A. Zanella et al. // Ann. Intern. Med. – 2002. – № 137. – P. 1-10.
10. Lee J.K. Estimation of the healthy upper limits for serum alanine aminotransferase in Asian populations with normal liver histology / J.K. Lee, J.H. Shim, H.C. Lee et al. // Hepatology. – 2010. – № 51. – P. 1577-83.
11. Ruhl C.E. Upper limits of normal for alanine aminotransferase activity in the United States population / C.E. Ruhl, J.E. Everhart // Hepatology. – 2012. – № 55. – P. 447-54.
12. Arndt V. Elevated liver enzyme activity in construction workers: prevalence and impact on early retirement and allcause mortality / V. Arndt, H. Brenner, D. Rothenbacher et al. // Int. Arch. Occup. Environ Health. – 1998. – № 71. – P. 405-12.
13. Kim H.C. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study / H.C. Kim, C.M. Nam, S.H. Jee et al. // Br. Med. J. – 2004. – № 328. – P. 983.
14. Lee T.H. Serum aminotransferase activity and mortality risk in a United States community / T.H. Lee, W.R. Kim, J.T. Benson et al. // Hepatology. – 2008. – № 47. – P. 880-7.
15. Ruhl C.E. Elevated serum alanine aminotransferase and gamma-glutamyltransferase and mortality in the United States population / C.E. Ruhl, J.E. Everhart // Gastroenterology. – 2009. – № 136 – P. 477-85.
16. Ioannou G.N. Elevated serum alanine aminotransferase activity and calculated risk of coronary heart disease in the United States / G.N. Ioannou, N.S. Weiss, E.J. Boyko et al. // Hepatology. – 2006. – № 43. – P. 1145-51.
17. Nutt A.K. Liver biopsy in the evaluation of patients with chronic hepatitis C who have repeatedly normal or near-normal serum alanine aminotransferase levels / A.K. Nutt, H.A. Hassan, J. Lindsey et al. // Am. J. Med. – 2000. – № 109. – P. 62-4.
18. Niederau C. Long-term survival in patients with hereditary hemochromatosis / C. Niederau, R. Fischer, A. Purschel et al. // Gastroenterology. – 1996. – № 110. – P. 1107-19.
19. Clark J.M. The prevalence and etiology of elevated aminotransferase levels in the United States / J.M. Clark, F.L. Brancati, A.M. Diehl // Am. J. Gastroenterol. – 2003. – № 98. – P. 960-7.
20. Martin-Rodriguez J.L. Diagnostic accuracy of serum alanine aminotransferase
as biomarker for nonalcoholic fatty liver disease and insulin resistance in
healthy subjects, using 3T MR spectroscopy / J.L. Martin-Rodriguez,
J. Gonzalez-Cantero, A. Gonzalez-Cantero, J.P. Arrebola, J.L. GonzalezCalvin
// Medicine (Baltimore). – 2017. – № 96(17). – P. 6770.
Тематичний номер "Гастроентерологія, Гепатологія, Колопроктологія" № 3 (45) вересень 2017 р.


