30 вересня, 2017
Європейська протиревматична ліга святкує 70-річчя: основні етапи розвитку

Цьогоріч Європейська протиревматична ліга (EULAR) святкує свій 70-літній ювілей. Від ревматичних та м’язово-скелетних захворювань людство страждає давно. Вони посідають важливе місце у структурі захворюваності й інвалідності, тож у 1947 році європейські ревматологи вирішили об’єднатися в європейську професійну лігу, аби спільно боротися з цією небезпечною недугою. Діяльність EULAR має на меті зменшення тягаря ревматичних захворювань і покращення лікування, профілактики й реабілітації патології опорно-рухового апарату.
EULAR – головна європейська організація, що представляє наукові медичні товариства, медичні асоціації та громадські організації для пацієнтів із ревматичними й м’язово-скелетними захворюваннями. Вітаючи європейську ревматологічну громаду з ювілеєм, президент EULAR Герд Р. Бурместер зазначив, що впродовж останніх 70 років спостерігається значний прогрес у галузі ревматології, що позитивно вплинуло на якість життя пацієнтів із ревматичними захворюваннями. Із 1947 року експерти EULAR докладають значних зусиль для вдосконалення передових технологій у галузі освіти та досліджень у сфері ревматології. Робота EULAR проводилася паралельно дивовижному прогресу в ревматології: перебіг численних смертельних ревматичних хвороб став керованим, що дає змогу пацієнтам вести звичайний спосіб життя. Значного прогресу в галузі ревматології вдалося досягти насамперед завдяки розробленню інноваційних лікарських засобів: протизапальних, імуномоделюючих і модифікуючих перебіг ревматичних хвороб. Важливим кроком на цьому шляху було впровадження в 1948 році глюкокортикоїдів (ГК) у клінічну практику; наступним проривом стало застосування наприкінці 1960-х років метотрексату – препарату, що модифікує перебіг ревматоїдного артриту (РА). Сьогодні ГК і метотрексат залишаються основою лікування хронічних запальних захворювань. Розроблення та впровадження в клінічну практику моноклональних антитіл у 1975 році стали надзвичайно важливою віхою в історії розвитку ревматології й привели до створення специфічних таргетних препаратів, які стали доступними для пацієнтів наприкінці 1990-х – на початку 2000-х років. Проривом у ревматології слід вважати визнання того факту, що рання діагностика й ранній початок лікування, спрямовані на досягнення ремісії в перебігу захворювання (стратегія treat-to-target), дають змогу досягти набагато кращих результатів. Водночас удосконалення методів візуалізації та створення конкретних біомаркерів для ранньої діагностики зробили можливою ранню верифікацію клінічних діагнозів.
На офіційному сайті EULAR представлено відеопрезентацію, яка розповідає про історію організації від початку її заснування й до нашого часу. Ми хочемо ознайомити практичних лікарів з основними подіями в галузі ревматології, що відображені в цій презентації.
Перший Європейський конгрес ревматологів відбувся у вересні 1947 року в містах Копенгагені та Орхусі. Тоді були обрані перші керівники EULAR: президент Меттью-П’єр Вейль (Matthieu-Pierre Weil, Франція), два віце-президенти – Ейнар Ярлов (Einar Jarlov) і президент ILAR (Міжнародна ліга ревматологічних асоціацій) Фортеск’ю Фокс (Fortescue Fox, Велика Британія). До складу EULAR увійшли національні ревматологічні товариства Бельгії, Чехословаччини, Данії, Великої Британії, Фінляндії, Франції, Нідерландів, Угорщини, Ісландії, Італії, Норвегії, Польщі, Румунії, Швейцарії, Іспанії, Швеції, Туреччини та Югославії. Головний офіс організації тоді був розташований у Копенгагені.
У 1948 році відбулася знакова подія: 21 вересня 29-літній жінці з РА було зроблено першу ін’єкцію кортизону в доволі високій дозі (100 мг), що зумовило надзвичайний клінічний ефект. Відтак ревматолог Філіп Хенч і його колеги Чарльз Слокум та Говард Полей започаткували еру сучасної ГК-терапії.
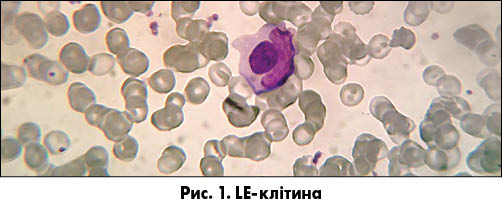
Того самого року M.M. Hargraves і співавт. описали незвичні клітини, що згодом дістали назву «LE-клітини», оскільки їх виявили саме у пацієнтів із системним червоним вовчаком (СЧВ), які перебували під спостереженням лікарів у клініці Мейо (США). LE-клітини – це нейтрофільні лейкоцити, що фагоцитували денатуровані ядра інших лейкоцитів з утворенням великих гомогенних включень, які відтісняють ядро фагоцитуючого нейтрофіла до периферії (рис. 1). Згодом було встановлено, що утворення LE-клітин індукується сироватковим фактором, який виявився імуноглобуліном і дістав назву «вовчаковий фактор». Відкриття LE-клітин і запровадження LE-тесту сприяли формуванню теорії аутоімунітету, яка визначила розвиток учення про системні захворювання сполучної тканини у другій половині ХХ століття.
Наприкінці 1940-х років відбулася ще одна важлива подія для ревматологів: був описаний і застосований тест Ваалера-Роуза для визначення ревматоїдного фактора. Сутність цієї реакції полягає у склеюванні сенсибілізованих баранячих еритроцитів при додаванні до них сироватки хворого на РА. Упровадження цієї методики дало змогу вперше визнати гетерогенність РА й поділити його на сероваріанти.
Наступне десятиріччя ознаменувалося новими видатними подіями та відкриттями в ревматології. Так, у 1950 році за відкриття ГК-гормонів і створення на цій основі ГК-препаратів Філіп Хенч, Тадеуш Рейхтейн і Едвард Кельвін Кендалл були удостоєні Нобелівської премії в галузі медицини та фізіології [5].
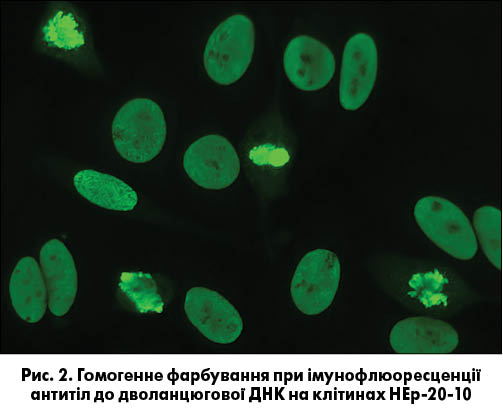
27 вересня 1957 року вчені E.J. Holborow, D.M. Weir, G.D. Johnson уперше продемонстрували ANA (антинуклеарні антитіла) за допомогою непрямої імунофлюоресценції (рис. 2). Це було першим свідченням того, що процеси, які впливають на ядро клітини, є відповідальними за СЧВ. У 1959 році було виявлено, що сироватка від осіб із СЧВ містить антитіла, котрі осаджуються сольовими екстрактами ядер, відомими як ядерні антитіла, що екстрагуються (ENA). Завдяки цьому було охарактеризовано антигени ENA та їх відповідні антитіла. Так, анти-Sm- і анти-RNP-антитіла були відкриті у 1966 та 1971 роках відповідно. У 1970-ті роки також були виявлені антитіла проти Ro/анти-SS-A та анти-La/анти-SS-B. У 1979 році було з’ясовано, що антитіло Scl-70 є специфічним до склеродермії, проте антиген (топоізомераза-I) охарактеризували лише в 1986 році. Антиген і антитіла до Jо-1 були описані в 1980 році.
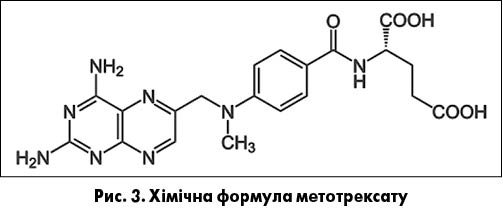
У 1950 році індійський учений Єллапрагада Суббарао, який працював у американській компанії Lederle й вивчав синтез антифолатних з’єднань (рис. 3), уперше синтезував метотрексат (аметоптерин). До складу групи дослідників уходив також американський онколог і педіатр Сідні Фарбер, який уперше застосував метотрексат у дітей із гострим лімфобластним лейкозом, що сприяло розвитку ремісії захворювання. Сьогодні метотрексат розглядають як один із найпотужніших і дієвих протизапальних препаратів для лікування не лише ревматологічних, а й інших імунозапальних захворювань людини.
Упродовж 1950-1959 років відбулося три Європейські конгреси ревматологів: у 1951 році в Барселоні (Іспанія), у 1955-му – у Схевенінгені (Нідерланди) та в 1959-му – у Стамбулі (Туреччина). Водночас у 1955 році секретаріат EULAR переїжджає до Брюсселя. У 1960-1969 роках відбулося два Європейські конгреси: у Стокгольмі в 1963 році та в Лісабоні в 1967 році. У 1965 році секретаріат EULAR розташувався в Базелі, а в 1987-му – переїхав до Цюриха.
Саме в 1960-х роках у рутинній ревматологічній практиці почали активно застосовувати кортизон для лікування РА та СЧВ, а також уперше описано численні побічні ефекти. Тоді кортизон сприймали як панацею в лікуванні РА, що стримувало певним чином застосування хворобомодифікувальних базисних засобів. Надалі погляди на ГК-терапію при РА були критично переглянуті, насамперед з урахуванням їх симптоматично базисного співвідношення та побічних ефектів. Водночас у ті роки метотрексат дістав схвалення для застосування в лікуванні РА.
Як відомо, під час дослідження метотрексату (та першого метаболіту – аметоптерину) було виявлено антипроліферативний ефект, що спонукало групу дослідників під керівництвом R. Gubner уперше випробувати його в 1951 році у пацієнтів із РА [4]. Препарат уводили кільком пацієнтам із РА та псоріатичним артритом із добрим клінічним ефектом, який швидко завершувався після відміни препарату. У 1962 році R.L. Black і співавт. повідомили про позитивні результати застосування метотрексату під час лікування як РА, так і псоріатичного артриту [1]. Фактично це вважається першим клінічним використанням метотрексату при РА.
Однак відкриття ГК та отримання Нобелівської премії Ф. Хенчем зіграли своєрідний злий жарт: спільнота ревматологів не була зацікавлена в тому, щоб розглядати метотрексат як дієвий препарат у лікуванні РА, частково через значний ентузіазм щодо ГК і стурбованість стосовно застосування протиракової терапії (в той час метотрексат активно використовували для лікування різних форм раку) для «доброякісних» захворювань, таких як РА [12]. У 1972 році Рекс Хофмайстер – ревматолог-практик із міста Спокан, США, повідомив про позитивні ефекти при внутрішньом’язовому введенні метотрексату в дозах від 10 до 15 мг на тиждень у 29 пацієнтів із РА. У наступні 5 років іще декілька груп дослідників повідомили про позитивні ефекти метотрексату в лікуванні РА. У 1983 році було проведено перше рандомізоване плацебо-контрольоване 24-тижневе дослідження ефективності метотрексату в 35 пацієнтів із рефрактерним РА.
Утім, саме в 1960-ті роки було подолано негативне ставлення до метотрексату і його почали активно використовувати в клінічній практиці. Вперше метотрексат у педіатрії застосовують у 1986 році – після того, як німецькі вчені H. Truckenbredt і R. Hafner опублікували результати спостережень за 19 пацієнтами з ювенільним ідіопатичним артритом. У 12 пацієнтів (63%) було констатовано значне покращання стану.
У 1964 році R.L. Nienhuis і E. Mandema [7] описали APNF (антиперинуклеарний фактор). Цей антиген представлений у кератогіалінових гранулах, що оточують ядро клітин слизової оболонки порожнини рота людини. Згодом було встановлено, що він належить до цитрулінових білків, а антитіла до циклічного цитрулінованого пептиду з 2010 року входять до класифікаційних критеріїв РА. Відкриття аутоантигенів, що містять цитрулін, властивих РА, стало однією з найважливіших подій у ревматології останнього часу в галузі серологічної діагностики.
У 1970-ті роки відбулося три Європейські конгреси EULAR: у 1971 році – у Брайтоні (Велика Британія), у 1975-му – у Гельсінкі (Фінляндія), у 1979-му – у Вісбадені (Німеччина), на якому вперше президентом EULAR було обрано жінку – професора Валентину Олександрівну Насонову (1979-1981).
1970-1979 роки ознаменувалися визначними відкриттями, що мали значення не лише для ревматології, а й для медицини загалом. Насамперед це відкриття механізму дії аспірину та гальмування синтезу простагландинів, створення моноклональних антитіл, перше використання технології магнітно-резонансної томографії (МРТ) у діагностиці та отримання Нобелівської премії в 1979 році в галузі медицини та фізіології за розроблення технології комп’ютерної томографії.
23 червня 1971 року британський фармаколог Джон (J. Vane) описав свої дослідження механізму дії ацетилсаліцилової кислоти в статті «Гальмування синтезу простагландинів як механізм дії аспіриноподібних ліків». Відтоді аспірин почали застосовувати в усьому світі для профілактики серцево-
судинних захворювань. Джон Вейн виявив, що ацетилсаліцилова кислота сповільнює виробництво в тромбоцитах простагландинів і тромбоксану A2, що зумовлює його антитромботичну й кардіопротективну дію, що було згодом переконливо доведено в багатьох великих дослідженнях і метааналізах [11]. Джон Вейн припустив, що саме антипростагландинова активність нестероїдних протизапальних препаратів (НПЗП) лежить в основі їх протизапального, жарознижувального й аналгетичного ефектів.
Разом із Суне Бергстремом і Бенгтом Самуельсоном Джон Вейн у 1982 році був удостоєний Нобелівської премії з фізіології та медицини. Нобелівський комітет відзначив його за «відкриття простагландинів і аналогічних біологічно активних речовин». У 1984 році за заслуги перед фармацевтичною наукою він був посвячений у лицарі. Джон Вейн казав про себе: «Моє життя та існування пов’язані з ферментами й медіаторами. Це захопливий детектив – знайти раніше невідомі шляхи та взаємодії, щоб прийти до нових важливих концепцій і препаратів».
Слід зауважити, що Нemler і співавт. у 1976 році ідентифікували й виділили фармакологічну ціль дії аспірину – фермент

циклооксигеназу (ЦОГ). ЦОГ-2 відкрив у 1991 році Даніель Л. Сіммонс з Університету Brigham Young.
У 1975 році сталося революційне відкриття для ревматології, гематології, онкології й загалом для клінічної та експериментальної медицини – було запропоновано шлях створення моноклональних антитіл. Георг Келер (George Kohler) і Цезар Мільштейн (Cesar Milstein) розробили методику отримання клітинних гібридів – гібридом [6].
У 1970-х роках молодий німецький імунолог Георг Келер вивчав генетичну мінливість антитіл. Для дослідження треба було
ізолювати клон антитілутворювальних клітин (АУК) – плазматичних клітин (похідних від В-лімфоцитів). Необхідно зазначити, що В-лімфоцити можуть жити тільки в організмі господаря й у штучному живильному середовищі швидко инуть. Їх тривале культивування поза організмом неможливе. І навпаки, клітини пухлини з плазматичних клітин (плазмацитома чи мієлома) добре культивуються й розмножуються in vitro, тому їх називають «безсмертними». Для реалізації проекту

Георг Келер поїхав до Англії, в лабораторію Цезаря Мільштейна, який вивчав клони плазмоцидом, тож разом вони розробили оригінальний підхід до цієї проблеми: вирішили отримати гібрид нормальної АУК і пухлинної клітини. У разі успіху гібрид успадкував би від нормальної клітини здатність до синтезу антитіл, а від пухлинної – безсмертя та здатність до необмеженого й безконтрольного зростання. І їм вдалося це здійснити – створити гібридомну технологію.
Гібридоми революціонізували імунологію й створили в ній абсолютно нові галузі. Завдяки гібридомам виникли нові методи діагностики багатьох захворювань, були відкриті нові шляхи для вивчення злоякісних пухлин і багатьох захворювань. Відтак учені, які відкрили технологію отримання моноклональних антитіл, – Георг Келер і Цезар Мільштейн були відзначені в 1984 році Нобелівською премією.
У 1979 році за розвиток комп’ютерної томографії було присуджено Нобелівську премію Годфрі Хаунсфільду та Аллану Кормаку. Крім того, шкала вимірювання густини середовища для рентгенівських променів, яку використовують у томографії, дістала назву «шкала Хаунсфільда». Спершу час, необхідний для сканування об’єкта, становив 9 днів, що було пов’язано з низькоінтенсивним джерелом гамма-променів, що потребувало тривалих експозицій. Потужна рентгенівська трубка знижувала час дослідження до 9 год. Вдалі зображення були отримані під час обстеження головного мозку людини, головного мозку живого теляти й ділянок нирок свині. Контрастність отриманих знімків була дуже високою й давала змогу оцінити тканини головного мозку та інших органів, проте все одно не було впевненості, що цей метод дасть можливість відрізнити уражені тканини від нормальних, наприклад виявити пухлину. Для досягнення цієї мети в 1971 році в госпіталі Аткінсона Морлі в Уїмблдоні був сконструйований і змонтований швидкий і складний апарат – перший клінічний КАТ-сканер. У 1972 році було зроблено першу сканограму головного мозку жінки з підозрою на його ураження.

Отримані зображення чітко показали наявність темної округлої кісти. Поступово були змонтовані більші й швидші сканери, які зменшили час сканування спочатку до 18 с, а згодом і до 3 с або навіть менше, даючи зображення різних органів із високою роздільною здатністю.
Початком використання методу ультразвукової діагностики в ревматології вважають 1972 рік, коли D.G. McDonald і G.R. Leopold уперше продемонстрували кісту Бейкера за допомогою ультразвуку. Застосування ультразвукового методу для обстеження суглобів дало змогу оцінити не тільки кісткові структури, а й м’які тканини: синовіальну оболонку, м’язи, хрящі. Разом із рентгенологічним дослідженням це дало змогу отримувати точнішу інформацію про стан суглоба.
У 1975 році відбулися зміни й у самій структурі секретаріату EULAR. Уперше були створені вісім постійних комітетів: навчання, епідеміологія, педіатрична ревматологія, соціальне та громадське агентство, міжнародне й національне агентство, агентство клінічних досліджень, агентство публікацій, тренінгів та акредитацій і комітет хірургії ревматичних захворювань.
У 1973 році Національна соціальна ліга презентувала на EULAR свою програму, а в 1975 році був створений постійний комітет PARE (People with Arthritis/Rheumatism in Europe – Люди з артритом/ревматизмом у Європі). Основними завданнями PARE є:
– сприяння розвиткові потужної мережі ефективних користувачів із ревматичними захворюваннями;
– вжиття заходів, аби голос людей із ревматичними захворюваннями був почутий, а також вплив на тих, хто ухвалює рішення в Європі;
– cтворення потужних альянсів, які змінять життя людей із ревматичними захворюваннями.
Відтоді кожна країна – член EULAR представлена одним делегатом у комітеті. Постійний комітет щороку збирається в рамках програми EULAR, щоб ознайомитися з прогресом у галузі ревматології та скласти план подальшої діяльності.
Із 1980 до 1989 року відбулося два конгреси EULAR: у 1983-му – в Москві та у 1987-му – в Афінах.
У 1980-х роках стався прорив у застосуванні метотрексату в лікуванні РА та псоріатичного артриту: цей препарат було визнано ефективним і він увійшов до рекомендацій і списку хворобомодифікувальних базисних препаратів.
У 1982 році D.J. Davies і співавт. [2] уперше описали ANCA (антинейтрофільні цитоплазматичні антитіла) при€сегментарному некротизуючому гломерулонефриті. У 1985 році F.J. van der Woude і співавт. [10] також описали ці антитіла при гранулематозі Вегенера (гранулематоз із поліангіїтом, за сучасною класифікацією). Другий міжнародний практичний семінар з ANCA, який відбувся у травні 1989 року в Нідерландах, зафіксував номенклатуру щодо перинукеарних і цитоплазматичних моделей, а антигени MPO та PR3 були виявлені відповідно у 1988 та 1989 роках. Ці знахідки відкрили новий шлях до лабораторної діагностики системних васкулітів, виділення нових патогенетичних груп – ANCA-асоційованих васкулітів.
У 1984 році було створено перше анти-CD4-моноклональне антитіло для лікування РА. У молекулярній біології CD4 (кластер диференціювання 4) – це глікопротеїн, що розташований на поверхні імунних клітин, таких як Т-хелперні клітини, моноцити, макрофаги та дендритні клітини. Він був виявлений наприкінці 1970-х років і був тоді відомий як leu-3 та T4, а в 1984 році його почали називати CD4.
У 1980-х роках також було присуджено дві Нобелівські премії в галузі медицини, що стосуються ревматології , – відкриття механізмів дії аспірину (1982) та створення моноклональних антитіл (1984).
У 1990-х роках відбулося три Європейські конгреси EULAR: у 1991 році – в Будапешті, у 1995-му – в Амстердамі та в 1999-му – у Глазго. З 1993 року почав діяти післядипломний курс навчання ревматологів, організований EULAR. Спершу він мав очний характер (перший курс відбувся в 1993 році в Левені), а згодом став заочним. За ініціативою EULAR із 1996 року щорічно відзначають Всесвітній день артриту.
У 1990-х роках відбулася ще одна видатна подія – препарати моноклональних антитіл стали доступними для пацієнтів із ревматичними захворюваннями. Моноклональні антитіла, на відміну від традиційних препаратів, високоспецифічні до певних мішеней-антигенів. Тому використання моноклональних антитіл як терапевтичних агентів стало для медицини стратегічним етапом у зміні концепції лікування – від неспецифічної до специфічної (таргетної) терапії.
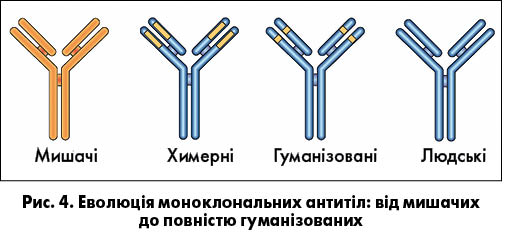
Терапевтичне застосування моноклональних антитіл, які були мишачими антитілами, було обмежено. Їх уведення людині супроводжувалося імунною відповіддю на чужий (гетерогенний) мишачий білок. Це призводило до швидкого усунення бажаного терапевтичного ефекту, ураження нирок і гіперчутливості до чужорідного мишачого білка. Однак невдовзі було розроблено ще один підхід, який значно збільшив терапевтичні можливості моноклональних антитіл. Завдяки техніці рекомбінантних ДНК учені зуміли «примусити» клітини гризунів до вироблення антитіл із людськими Fc-фрагментами (рис. 4).
Виробництво моноклональних антитіл є сегментом фармацевтичної індустрії, що найбільш швидко розвивається. За підсумками 2010 року, два моноклональні антитіла – Rituxan/MabThera та Remicade – увійшли в тoп-5 «блокбастерів» серед біотехнологічних препаратів.
Значному прориву в терапевтичних можливостях сприяли новаторські дослідження професорів Равіндера Маїні та Марка Фельдмана з Інституту ревматології Кеннеді в Лондоні, які представили перші химерні моноклональні антитіла до фактора некрозу пухлин-α (ФНП-α) для лікування пацієнтів із РА [3].

У 2003 році вчені отримали премію Альберта Ласкера за клінічні медичні дослідження, які виявили терапію анти-ФНП як ефективне лікування РА та інших аутоімунних захворювань. Незважаючи на початковий скепсис дослідницького співтовариства стосовно своєї ідеї, Марк Фельдман і Равіндер Маїні перетворили свої винаходи в лабораторії на потужне лікування.
Інгібітори ФНП-α докорінно змінили весь терапевтичний підхід не тільки до РА, а й до анкілозивного спондиліту (АС) і псоріатичного артриту. Насамперед вони поклали початок таргетній терапії, спрямованій на контроль прогресування захворювання, і переконливо довели можливість досягнення ремісії чи низької активності в пацієнтів із РА. Ці препарати дали надію на одужання або принаймні на можливість жорсткого контролю хвороби сотням тисяч пацієнтів, а також надихнули науковців рухатися далі шляхом створення нових лікарських препаратів. Саме впровадження інгібіторів ФНП-α в клінічну практику привело згодом до перегляду стратегії та менеджменту хворих на РА.
У 1996 році Нобелівську премію отримали австралієць Пітер Догерті (Peter C. Doherty) та швейцарець Рольф Цинкернагель (Rolf M. Zinkernagel) за відкриття способу розпізнавання імунною системою чужорідних мікроорганізмів і власних молекул. Це відкриття дало змогу медицині активно розвиватися в напрямі зміцнення імунітету проти широкого спектра захворювань, у тому числі раку, а також зниження ефекту аутоімунних реакцій організму.
Того самого року було запропоновано дві шкали для оцінювання активності й прогресування РА: шкала DAS і радіологічна шкала – модифікована шкала Sharp-van der Heijde.
У 1999 році на фармакологічному ринку з’явився перший представник коксибів – целекоксиб, який вивела на ринок компанія Pfizer-Pharmacia як специфічний інгібітор ЦОГ-2. Водночас на ринку з’являються й інші представники коксибів – рофекоксиб, вальдекоксиб, еторикоксиб, луміракоксиб. Поява препаратів цієї групи супроводжувалася свого роду ейфорією, оскільки до 1999 року було зареєстровано значну кількість ускладнень з боку шлунково-кишкового тракту, нирок, спричинених неселективними препаратами, що блокують фізіологічні ефекти ЦОГ-1. До 1999 року в США було зареєстровано близько 100 тис. госпіталізацій і 16,5 тис. смертей, зумовлених шлунково-кишковими ускладненнями на тлі прийому неселективних НПЗП. Широке впровадження коксибів привело до зменшення частоти ускладнень з боку шлунково-кишкового тракту, однак анонсувало нову проблему – підвищення кардіоваскулярного ризику й частоти серцево-судинних подій.
У 1996 році вперше був сформований перелік базисних засобів для лікування РА. До списку увійшли гідроксихлорохін, сульфасалазин, метотрексат, солі золота та D-пеніциламін. Водночас уперше прозвучала концепція раннього початку терапії РА: оскільки застосування базисних препаратів при ранньому РА дає змогу модифікувати перебіг хвороби, лікування РА (як і багатьох інших хронічних захворювань людини, таких як цукровий діабет, артеріальна гіпертензія, ішемічна хвороба серця тощо) має розпочинатись якомога раніше, бажано протягом перших 3 міс після встановлення достовірного діагнозу РА.
Початок нового століття започаткував щорічне проведення конгресів EULAR. У 2000 році конгрес відбувся в Ніцці, й відтоді провідні ревматологи збираються щороку. Останній конгрес відбувся в Мадриді 13-17 червня 2017-го.
У 2000 році побачив світ перший номер офіційного журналу EULAR – Annals of Rheumatic Diseases (ARD). Першим його головним редактором був Leo van de Putte. У 2008 році журнал стане номером один серед ревматологічних журналів світу з найвищим коефіцієнтом впливу (Impact Factor = 12,4).
У 2000 році EULAR розпочала створення рекомендацій із лікування ревматичних захворювань. Так, першими рекомендаціями EULAR стали рекомендації з лікування остеоартриту колінного суглоба – найпоширенішої патології суглобів у пацієнтів різних вікових груп [8]. Найбільш плідним щодо рекомендацій виявився 2016 рік, коли на конгресі EULAR у Лондоні було представлено 13 новітніх та оновлених рекомендацій із діагностики й лікування ревматичних захворювань.
У 2002 році відбувся перший спільний конгрес EULAR і PReS – Європейського товариства дитячих ревматологів. Відтоді він став традиційним. У 2004 році в рамках конгресу EULAR було проведено перший Європейський конгрес із капіляроскопії, а в 2008 році опубліковано перші спільні рекомендації EULAR та Американської колегії ревматологів (ACR).
У 2006 році відбувся черговий конгрес EULAR в Амстердамі, що вперше зібрав понад 10 тис. учасників – ревматологів з усього світу. Згодом рекорд за кількістю учасників установить конгрес EULAR у Лондоні в 2011 році, на який зібралося 16 102 учасники.
Із 2006 року почав діяти оновлений сайт EULAR.
60-річчя EULAR святкували під час чергового конгресу в 2007 році в парку Гуєль у Барселоні. На цьому ж конгресі був представлений стратегічний план запобігання ревматичним захворюванням та їх лікування у світі, що дістав назву «Мобілізація планети». Відтоді почав активно діяти on-line курс із ревматичних захворювань.
Надзвичайно багато подій і відкриттів відбулося впродовж 2000-2010 років. Чимало подій відбулося вперше в історії ревматології. Так, уперше анти-ФНП-препарати отримали нову специфікацію – застосування не тільки при РА, а й при АС і псоріатичному артриті. Вперше були схвалені для лікування РА препарати з іншим механізмом дії – ритуксимаб і абатацепт. Абатацепт був затверджений у США та Європі в 2005 році для лікування РА в дорослих пацієнтів із неадекватною відповіддю на DMARDs або інгібітори ФНП-α. У січні 2010 року він був затверджений у Європі для ювеніального артриту середнього й тяжкого ступеня у хворих у віці ≥6 років. Саме в цей період з’явився новий термін – стратегія лікування ревматичних захворювань treat-to-target – лікування до досягнення мети, якою стала ремісія захворювання чи низька активність хвороби. Повністю людські моноклональні антитіла були вперше з успіхом апробовані в лікуванні ревматичних захворювань. Біологічні препарати вперше увійшли в рекомендації з лікування РА, АС, псоріатичного артриту.
Із 2010 до 2017 року в арсеналі лікарів з’явилися препарати класу JAK-інгібіторів. У травні 2012 року Управління з контролю якості продуктів харчування та лікарських препаратів США (FDA) дозволило до клінічного застосування новий препарат тофацитиніб (Tofacitinib; CP-690,550; Pfizer), який пригнічує JAK3. Після цього була запропонована нова класифікація базисних хворобомодифікувальних препаратів (табл.). Як зазначають автори нової класифікації, причинами до переосмислення чинної номенклатури стали еволюційний розвиток антиревматичної терапії, значне збільшення кількості нових хворобомодифікувальних препаратів, а також зміна способів їх створення, поява не тільки біологічних агентів, а й біосимілярів. Окрім того, перегляду класифікації DMARDs сприяло розроблення та впровадження в клінічну практику нових синтетичних DMARDs із цільовим механізмом дії – інгібіторів малих молекул або кіназного шляхів, насамперед інгібітора янус-кінази тофацитинібу [9].
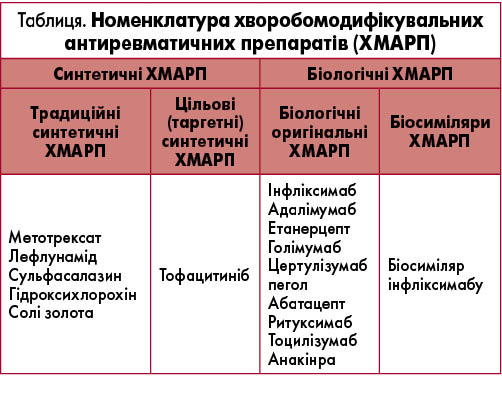
У 2013 році Європейське агентство з лікарських засобів (ЕМА) офіційно схвалило біосиміляр інфліксимабу для лікування РА.
Також було затверджено перший біологічний препарат, створений спеціально для лікування СЧВ, що по праву розглядається як одне з найвидатніших подій ревматології за останні 50 років – блокатор В-клітинного активуючого фактора (B-cell activating factor – BAFF) – белімумаб. Белімумаб – це повністю людські рекомбінантні моноклональні антитіла (IgG1), механізм дії яких пов’язаний із запобіганням взаємодії розчинних BAFF із клітинними рецепторами аутореактивних перехідних і наївних В-клітин, що, у свою чергу, призводить до пригнічення властивої СЧВ В-клітинної гіперреактивності, зокрема синтезу аутоантитіл. Офіційними показаннями до застосування белімумабу при СЧВ є помірна/висока
активність, наявність виражених серологічних порушень (позитивні результати визначення антинуклеарного фактора
та/або антитіл до дволанцюгової ДНК) і недостатня ефективність попередньої стандартної терапії.
Ще однією видатною подією останніх років і новим проривом у лікуванні спондилоартритів стало застосування інгібіторів інтерлейкіну (ІЛ) 17. Відомо, що ентезит як запальна реакція реалізується переважно за рахунок ІЛ-17, що виділяється унікальною популяцією Т-клітин, які розташовуються в синовіально-ентезиальному комплексі. На сьогодні доведено, що імунологічний Th17-опосередкований механізм, у якому беруть участь цитокіни ІЛ-23 та ІЛ-17, є найважливішою ланкою патогенезу псоріазу, псоріатичного артриту, інших спондилоартритів, у тому числі АС. Рекомендації EULAR (2015) пропонують внести цей клас препаратів до алгоритму лікування хворих на псоріатичний артрит.
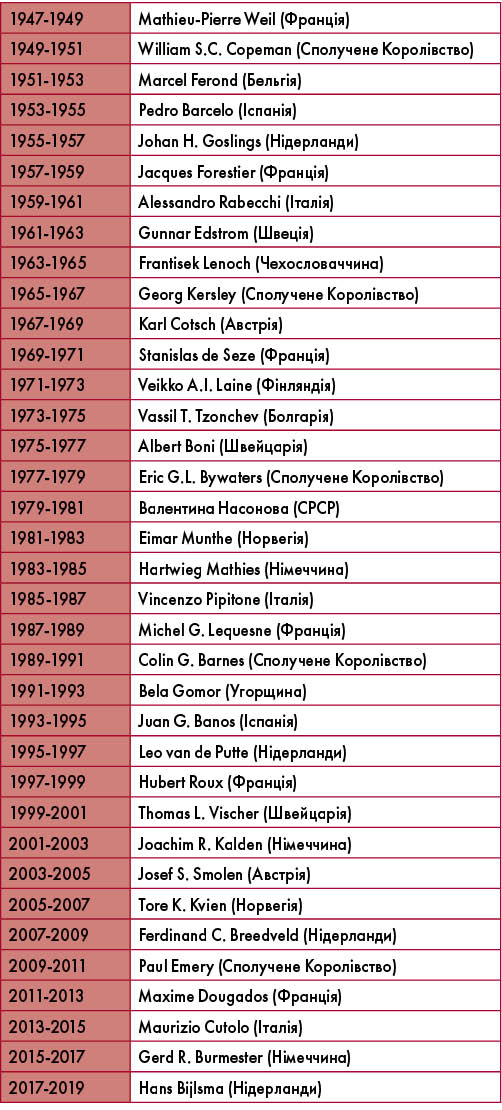
EULAR святкує 70-річчя! Пропонуємо згадати всіх президентів EULAR – відомих ревматологів, які визначали політику та спрямованість ревматології Європи та світу в останні 70 років.
Література
- Black R.L., O’Brien W.M., van Scott E.J., et al. Methotrexate therapy in psoriatic arthritis. Double-blind study on 21 patients. JAMA. 1964; 189: 743-7.
- Davies D.J., Moran J.E., Niall J.F., Ryan G.B. Segmental necrotising glomerulonephritis with antineutrophil antibody: possible arbovirus aetiology? Br. Med. J. 1982; 285 (6342): 606.
- Feldmann M., Maini R.N. Discovery of TNF-α as a therapeutic target in rheumatoid arthritis: preclinical and clinical studies. Joint Bone Spine, 2002; 69: 12-18.
- Gubner R., August S., Ginsberg V. Therapeutic suppression of tissue reactivity. II. Effect of aminopterin in rheumatoid arthritis and psoriasis. Am. J. Med. Sci. 1951; 22: 176-82.
- Hench Ph.S., Kendall E.C., Slocumb C.H., et al. The effect of hormone of the adrenal cortex, cortisone (17-hydroxy-II-dehydrocorticosterone: compound E) and of pituitary adrenocorticotropic hormone on rheumatoid arthritis and acute rheumatic fever. Trans. Assoc. Am. Physicias. 1949; 62: 64-80.
- Kohler G., Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature, 1975; 256: 495-497.
- Nienhuis R.L., Mandema E. A new serum factor in patients with rheumatoid arthritis, the antiperinuclear factor. Ann. Rheum. Dis. 1964, 23: 302-305.
- Pendleton A., Arden N., Dougados M., et al. EULAR recommendations for the management of knee osteoarthritis: report of a task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann. Rheum. Dis. 2000; 59 (12): 936-944.
- Smolen J.S., van der Heijde D., Machold K.P., Aletaha D., Landewe R. Proposal for a new nomenclature of disease-modifying antirheumatic drugs // Ann. Rheum. Dis. 2014; 73: 3-5.
- van der Woude F.J., Rasmussen N., Lobatto S., et al. Autoantibodies against neutrophils and monocytes: tool for diagnosis and marker of disease activity in Wegener’s granulomatosis. Lancet, 1985; 1 (8426): 425-429.
- Vane J.R. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. Nat. New Biol. 1971; 231 (25): 232-235.
- 12. Weinblatt M.E. Methotrexate in Rheumatoid Arthritis: A Quarter Century of Development. Trans. Am. Clin. Assos. 2013; 124: 16-25.


