8 жовтня, 2017
Проблема реактивации вирусного гепатита В при лечении больных ревматологического профиля
 Современная стратегия лечения большинства системных аутоиммунных ревматических заболеваний предполагает применение долговременной иммуносупрессивной терапии. При этом подходы к ее назначению в последние годы становятся все более агрессивными: для ряда заболеваний (ревматоидный артрит, аксиальный и периферический спондилоартрит, псориатический артрит, подагра, системная красная волчанка и др.) разработана и рекомендована для реализации в практической деятельности стратегия treat-to-target (T2T) – лечение до достижения цели (ремиссия или низкая активность заболевания). Такой подход требует пошаговой (с интервалом в 2-3 мес) интенсификации терапии, наращивания доз и количества лекарственных средств с иммуносупрессивными свойствами (за исключением препаратов для лечения подагры).
Современная стратегия лечения большинства системных аутоиммунных ревматических заболеваний предполагает применение долговременной иммуносупрессивной терапии. При этом подходы к ее назначению в последние годы становятся все более агрессивными: для ряда заболеваний (ревматоидный артрит, аксиальный и периферический спондилоартрит, псориатический артрит, подагра, системная красная волчанка и др.) разработана и рекомендована для реализации в практической деятельности стратегия treat-to-target (T2T) – лечение до достижения цели (ремиссия или низкая активность заболевания). Такой подход требует пошаговой (с интервалом в 2-3 мес) интенсификации терапии, наращивания доз и количества лекарственных средств с иммуносупрессивными свойствами (за исключением препаратов для лечения подагры).
С одной стороны, это выглядит вполне оправданным в смысле стремления к желаемой цели: достижения в как можно более короткие сроки клинико-иммунологической ремиссии и поддержания ее в течение длительного времени, что обеспечивает максимально возможный органосохраняющий эффект и предупреждение функциональных нарушений. С другой стороны, длительная активная (селективная или неселективная) иммуносупрессия может сопровождаться активацией хронических очагов инфекции и/или повышением склонности к первичному инфицированию, обусловленному снижением эффективности функционирования защитных клеточно-гуморальных барьеров первого ряда. До недавнего времени предметом внимания были главным образом инфекции верхних дыхательных путей и бронхолегочной системы, почек и мочевыводящих путей, кожи, что отражено в инструкциях по применению иммуносупрессивных лекарственных средств. При применении иммунобиологических препаратов, прежде всего ингибиторов фактора некроза опухолей (ФНО), особое внимание уделяется так называемым оппортунистическим инфекциям. Под ними понимают заболевания, вызываемые условно-патогенными микроорганизмами (бактериями, вирусами, грибами, простейшими), которые могут находиться в организме человека или в окружающей среде и при нормально функционирующей иммунной системе не приводят к болезни. Заболевания возникают только у лиц с иммунодефицитом, обусловленным ВИЧ-инфекцией или иммуносупрессивными препаратами; реже причинами такого значимого ослабления иммунитета бывают недостаточное питание, генетически детерминированные дефекты иммунной системы, бесконтрольное лечение антибиотиками, тропные к иммунной системе вирусы – гепатита С, Эпштейна-Барр, некоторые опухоли. Среди оппортунистических инфекций чаще всего упоминаются туберкулез, другие микобактериальные инфекции, инфекции, вызванные грибами – гистоплазмоз, пневмоцистная пневмония, криптококкоз, кандидоз, аспергиллез, вирусами герпетической группы – Эпштейна-Барр, простого герпеса, Varicella zoster (опоясывающий лишай), цитомегаловирус, а также негерпетическим вирусом папилломы человека, простейшими – токсоплазмоз, криптоспоридиоз (хроническая диарея). Для некоторых оппортунистических инфекций разработаны предупредительные меры. Например, для профилактики активации туберкулеза при лечении анти-ФНО-агентами – прием 0,3 г изониазида 6 мес в году, для профилактики Herpes Zoster – вакцина Zostavax (одобрена Европейским агентством по лекарственным препаратам, ЕМЕА; рекомендована всем ревматологическим пациентам с иммуносупрессией в возрасте старше 50 лет, но не во время активного применения анти-ФНО-препаратов).
В последние годы внимание клиницистов и ученых привлекла проблема реактивации вируса гепатита В (HBV) у ревматологических больных, получающих иммуносупрессивную терапию. Было показано, что ряд противоревматических препаратов с высоким иммуносупрессивным потенциалом, включая ингибиторы ФНО, ритуксимаб, тоцилизумаб, устекинумаб, ингибиторы тирозинкиназы, могут вызывать серьезное обострение хронической HBV-инфекции вплоть до развития молниеносного гепатита, печеночной недостаточности и смерти (L. H. Calabrese et al., 2004; D. Vassilopoulos, G. V. Papatheodoridis, 2012; L. – F. Chen et al., 2017; K. R. Reddy et al., 2015). В то же время имеются убедительные доказательства того, что проведение профилактической противовирусной терапии пациентам высокого риска способно предотвратить реактивацию HBV и, таким образом, расширить возможности и повысить безопасность иммуносупрессивного лечения (K. R. Reddy et al., 2015; D. Vassilopoulos, G. V. Papatheodoridis, 2012; M. Viganо et al., 2012; K. R. Reddy et al., 2015). Новый виток интереса к этой проблеме вызвали ряд публикаций и обнародованное на сайте Управления по контролю за качеством продуктов питания и лекарственных средств США (FDA) 8 октября 2016 года предупреждение о риске реактивации гепатита В у некоторых пациентов, получающих антивирусные препараты, предназначенные для лечения гепатита С, а именно – новые высокоэффективные препараты прямого действия (софосбувир, даклатасвир, симепревир и др.).
Поскольку в нашей стране все более активно имплементируется рекомендуемая международными профессиональными организациями стратегия агрессивного лечения системных аутоиммунных заболеваний типа Т 2Т и уже применяются в лечении гепатита С противовирусные препараты прямого действия, рассмотрение последних научных данных и рекомендаций по профилактике реактивации вируса гепатита В имеет непосредственное прикладное значение.
Под реактивацией HBV понимают клинический синдром, характеризующийся повышением уровня ДНК HBV и АСТ или АЛТ в крови с наличием или отсутствием клинических симптомов или желтухи. Этот синдром может наблюдаться у пациентов с активной инфекцией – имеющих поверхностный антиген вируса гепатита В – HBsAg в крови (HBsAg+), а также у выздоровевших от вирусного гепатита В – при отсутствии в крови HBsAg, но имеющих суммарные антитела к ядерному (HB-core) антигену вируса гепатита В (HBsAg-, anti-HBc+). Напомним, что аnti-HBс появляются при остром гепатите В в крови вскоре после появления HBsAg, персистируют после исчезновения HBsAg перед появлением анти-HBs-антител (anti-HBs) и сохраняются длительное время после выздоровления. Они являются самыми долгоживущими и могут обнаруживаться пожизненно. Наличие anti-HBc позволяет предположить, что человек может быть активно инфицирован или перенес гепатит В в прошлом и имеет иммунитет. Спектр клинических проявлений синдрома реактивации HBV довольно широк и колеблется от бессимптомного течения до печеночной недостаточности. Он может возникать во время лечения многими иммуносупрессивными препаратами, а также вплоть до 12 мес после окончания такого лечения. Принципиально важно, что реактивации HBV может быть предотвращена противовирусной профилактикой (A. M. Di Bisceglie et al., 2015; R. P. Perrillo et al., 2015).
Как было отмечено выше, для определения реактивации HBV необходимы два компонента: вирусологический, свидетельствующий об усилении вирусной репликации, и биохимический, заключающийся в выявлении повышенного уровня АЛТ и/или АСТ в крови. Критериями наличия вирусологического компонента являются хотя бы один из ниже перечисленных: 1) определение как минимум 10-кратного (>1 log10 МЕ/мл) увеличения уровня ДНК HBV в сыворотке крови (самый надежный критерий); 2) обнаружение de novo ДНК HBV или сердцевинного антигена вируса гепатита В – HBeAg (справка: обнаруживается в крови в период вирусемии, параллельно с HBsAg, начиная с конца инкубационного периода; в крови циркулирует недолго, меньше, чем HBsAg, при остром гепатите исчезает к концу желтушного периода); 3) уровень ДНК HBV выше допустимого с биохимическими признаками ухудшения; 4) обратная HBsAg сероконверсия (появление HBsAg в сыворотке крови у лиц с наличием антител к нему – anti-HBs). Критерий наличия биохимического компонента – не менее чем 3-кратное повышение уровня АЛТ в крови выше исходного уровня (J. H. Hoofnagle, 2009; N. A. Terrault et al., 2016; A. Visram et al., 2015; J. P. Hwang et al., 2012). Следует помнить, что повышение количества вируса в крови обычно предшествует повышению активности АЛТ в сыворотке крови за 3-4 нед. Следовательно, при отсутствии биохимического компонента на момент обнаружения вирусологических критериев может понадобиться повторное определение уровня АЛТ/АСТ.
Планируя проведение иммуносупрессивной терапии пациенту с ревматическим заболеванием, врачу необходимо получить ответы на несколько вопросов: 1. Входит ли пациент в группу риска реактивации HBV? Если да, то 2. Насколько высок риск реактивации HBV? 3. Следует ли проводить профилактику реактивации HBV? 4. Чем ее проводить? 5. Нет ли коинфицированности пациента HBV и вирусом гепатита С (HCV)? Если да, то 6. Не проводится ли пациенту лечение гепатита С противовирусными препаратами прямого действия? Если да, то 7. Какие действия следует предпринять совместно с врачом-инфекционистом для предупреждения реактивации HBV у такого пациента и адекватного мониторинга ситуации?
Базируясь на современных данных литературы и международных рекомендациях, попытаемся изложить алгоритм получения ответов на эти вопросы.
1. Для определения, находится ли пациент в группе риска реактивации HBV, до начала иммуносупрессивной терапии следует провести скрининг на HBV-инфекцию. Согласно рекомендациям центров по контролю заболеваний и их предупреждению США (CDC), Европейской ассоциации по изучению печени (EASL) и Азиатской тихоокеанской ассоциации по изучению печени (APASL) HBV-скрининг должен проводиться всем пациентам, у которых планируется проведение иммуносупрессивной терапии (C. M. Weinbaum et al., 2008; EASL, 2012; S. K. Sarin et al., 2016). Рекомендации Американской ассоциации по изучению болезней печени (AASLD), Американской гастроэнтерологической ассоциации (AGA) и Американского общества клинической онкологии (ASCO) несколько менее категоричны: считается целесообразным проводить скрининг на основе оценки риска реактивации HBV, в частности, как будет обсуждаться далее, с учетом иммуносупрессивного потенциала препаратов (A. S. Lok et al., 2009; K. R. Reddy et al., 2015; J. P. Hwang et al., 2015). Тотальный скрининг пациентов – кандидатов на проведение иммуносупрессивной терапии считается более предпочтительным по сравнению с отбором пациентов для скрининга на основе анамнестических данных о перенесенном гепатите В, поскольку 35-65% пациентов с HBV могут не знать об инфицировании (CDC. MMWR Morb Mortal Wkly Rep., 1988; Institute of Medicine, 2010; J. W. Ward et al., 2012; D. J. Hu et al., 2013). По единодушному мнению всех упомянутых профессиональных сообществ, HBV-скрининг должен включать оценку наличия в крови HBsAg и аnti-HBс; некоторые организации (EASL, APASL, AGA, ASCO) считают целесообразным дополнительно сразу определять уровень ДНК HBV.
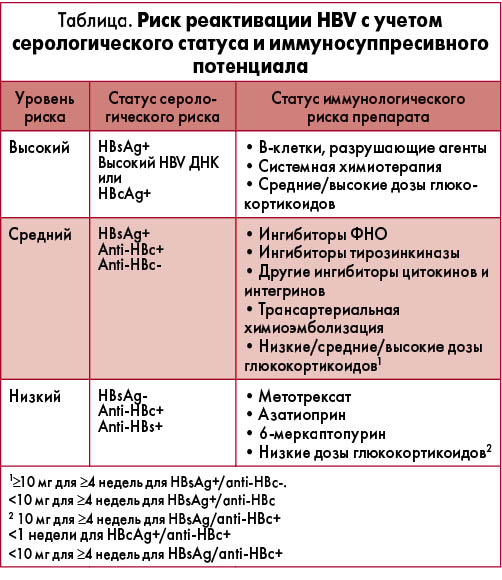
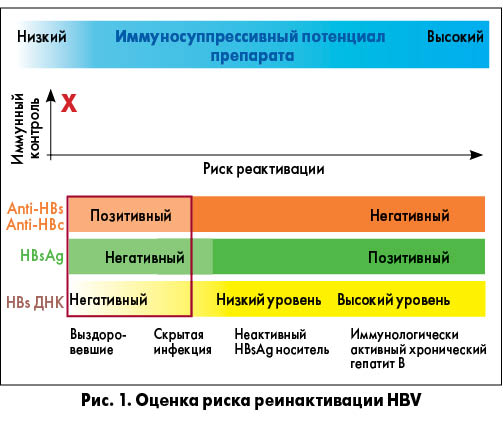
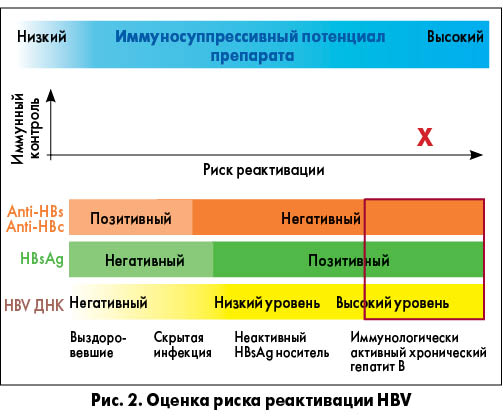
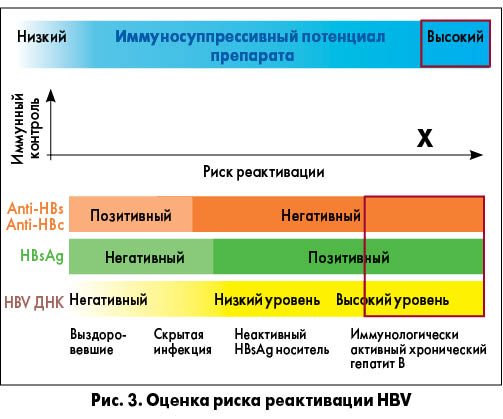
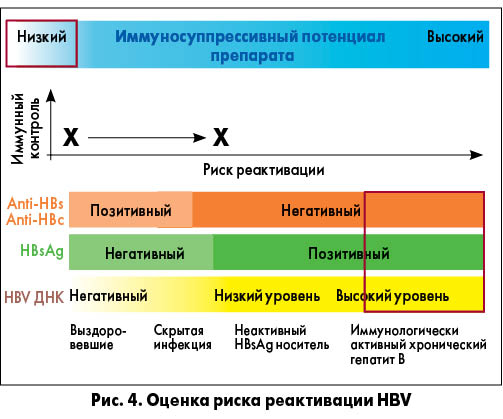
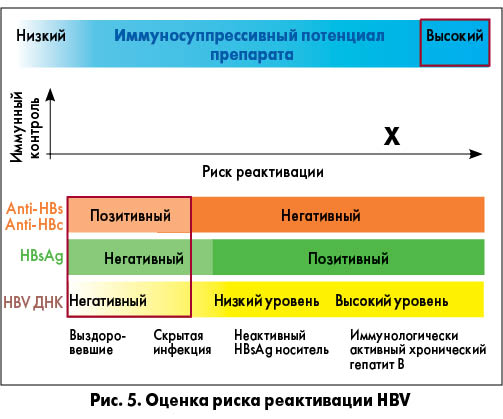
2. Если пациент входит в группу риска – выявляется HBsAg или anti-HBc, степень риска реактивации HBV оценивается с учетом наличия этих маркеров (а также желательно – присутствия anti-HBs и уровня ДНК HBV) и иммуносупрессивного потенциала планирующихся для назначения препаратов. На рисунках 1-5 приведены примеры оценки риска реактивации HBV в зависимости от соотношения названных параметров (R. P. Perrillo et al., 2015; F. Bessone et al., 2016). Как видно из рисунков 1 и 2, независимо от иммуносупрессивного потенциала препарата, низким считается риск у лиц, выздоровевших от гепатита В (anti-HBs+ и/или anti-HBc+ при HBsAg- и HBV ДНК-), высоким – при HBsAg+, высоком уровне HBV ДНК. Максимально высокий риск реактивации HBV имеется при HBsAg+, высоком уровне HBV ДНК и высоком иммуносупрессивном потенциале препарата (рис. 3). При низком иммуносупрессивном потенциале противоревматического лекарственного средства даже при HBsAg+ и высоком уровне HBV ДНК риск реактивации колеблется от низкого до умеренного (рис. 4). В то же время высокий иммуносупрессивный потенциал препарата детерминирует высокий риск реактивации HBV, в том числе у выздоровевших пациентов (anti-HBs+ и/или anti-HBc+ при HBsAg- и HBV ДНК-) (рис. 5). Соответственно степени риска рекомендуется более или менее интенсивный/частый контроль иммунологических и биохимических тестов в процессе лечения. На рисунке 6 приведена градация рисков реактивации HBV (высокий, средний, низкий) с учетом серологического HBV-статуса и иммуносупрессивного потенциала конкретных препаратов, включая разные дозы глюкокортикоидов, ГК (R. P. Perrillo et al., 2015; F. Bessone et al., 2016).
3. Согласно консолидированному мнению CDC, EASL, APASL, AASLD, AGA и ASCO профилактику реактивации HBV следует проводить всем пациентам с HBsAg+, а также лицам с HBsAg-/anti-HBc+, если а) иммуносупрессивное лечение связано с высоким риском реактивации HBV (см. выше оценку риска); б) обнаруживается ДНК HBV. Профилактика реактивации HBV должна быть проведена до начала или во время иммуносупрессивной терапии. Относительно продолжительности проведения профилактики не существует единого мнения из-за отсутствия доказательных данных, однако в любом случае ее нужно продолжать не менее чем в течение 6 мес после завершения иммуносупрессивной терапии. По мнению специалистов AASLD (A. S. Lok et al., 2009), она должна длиться в течение 6 мес после завершения иммуносупрессивной терапии, если HBV ДНК <2000 МЕ или пока цели лечения (переход в статус неактивного носительства с низкой вирусемией или в статус выздоровевшего) не достигнуты, если уровень HBV ДНК >2000 МЕ. В AGA и ASCO считают, что профилактику реактивации HBV целесообразно продолжать 6 мес после иммуносупрессивной терапии или не менее 12 мес, если применялись анти-B-клеточные средства (K. R. Reddy et al., 2015; J. P. Hwang et al., 2015). EASL и APASL рекомендуют проводить профилактику в течение 12 мес после иммуносупрессивной терапии независимо от ее содержания (EASL, 2012; S. K. Sarin et al., 2016).
4. Данные рандомизированных контролируемых исследований по профилактике реактивации HBV при проведении иммуносупрессивной терапии (преимущественно при злокачественных опухолях крови и печени) свидетельствуют об эффективности HBV-противовирусной терапии. При выборе терапии предпочтение отдается препаратам с высоким генетическим барьером развития резистентности (тенофовир, энтекавир) (K. R. Reddy et al., 2015). Показано, что профилактика энтекавиром ассоциируется со значительно более низким уровнем реактивации HBV по сравнению с ламивудином (H. Huang et al., 2014), а адефовир менее мощный, чем тенофавир в лечении HBV (P. Marcellin et al., 2008). Ламивудин рассматривается в качестве возможного варианта терапии только в комбинации с адефовиром (T. G. Vassiliadis et al., 2010).
5. Если пациент не сообщает о наличии у него гепатита С, то для определения – нет ли коинфицированности HBV и HCV на первом этапе достаточно установить суммарные АТ к HCV (CDC’s Testing Recommendations for hepatitis C virus infection 15 Apr 2015; WHO: Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. Updated version, April 2016; УКПМД «Вірусний гепатит С», 2014).
6. Если по результатам определения АТ к HCV у пациента впервые выявлен гепатит С, требуется консультация инфекциониста для дообследования (в частности, для определения РНК HCV, генотипа вируса) и принятия решения о необходимости проведения специфической противовирусной терапии. В случае если врач-инфекционист считает целесообразным проводить лечение гепатита С противовирусными препаратами прямого действия или же известно, что пациент указанную терапию получает, такой HBV/HCV-коинфицированный больной попадает в категорию повышенного риска реактивации HBV. В релизе FDA, посвященном этому вопросу (сайт FDA, 8 октября 2016 года), указывается, что у любого пациента с наличием в настоящее время или в прошлом HBV, получающего по поводу гепатита C некоторые противовирусные препараты прямого действия (DAAs -direct-acting antivirals),
имеется риск реактивации HBV. В определенных случаях такая реактивация сопровождается развитием серьезной патологии печени или смертью пациента. К противовирусным препаратам прямого действия относятся софосбувир, даклатасвир, ледипасвир, симепревир, софосбувир/велпатасвир (последний является первым универсальным препаратом для лечения всех генотипов 1-6 HCV). В связи с этим FDA рекомендует осуществлять мониторинг на HBV во время и после окончания лечения такими препаратами. Ранее об этом не сообщалось, поскольку пациентов с коинфекцией HBV исключали из рандомизированных клинических исследований по изучению противовирусных препаратов прямого действия. Согласно результатам обсервационного исследования пациентов китайской национальности, получавших противовирусные препараты прямого действия (C. Wang et al., 2016), и анализа данных открытой фазы исследования по изучению ледипасвира/софосбувира (M. S. Sulkowski et al., 2016), случаи реактивации HBV наблюдали только у пациентов с наличием HBsAg. У лиц со статусом HBsAg-/anti-HBc+ доказательств реактивации не получено.
7. Исчерпывающих рекомендаций по поводу действий относительно предупреждения реактивации HBV у пациентов, которые получают терапию противовирусными препаратами прямого действия HCV, не существует. С учетом приведенных выше данных у таких пациентов, вероятно, целесообразно по возможности воздерживаться от назначения препаратов с высоким и средним иммуносупрессивным потенциалом, если у них выявляется HBsAg. В рекомендациях AASLD (AASLD/IDSA HCV Guidelines. September 2016) указывается, что стартовая оценка относительно HBV-инфекции у всех пациентов, которые начали лечение гепатита С противовирусными препаратами прямого действия, должна включать определение HBsAg, anti-HBs и anti-HBc. У лиц с HBsAg+ следует проводить оценку ДНК HBV до, во время и сразу же после терапии такими препаратами. При активной HBV-инфекции рекомендуется начать ее лечение до или одновременно с терапией HCV противовирусными препаратами прямого действия. При низком или неопределяемом уровне ДНК HBV достаточно мониторинга реактивации HBV во время терапии HCV. Авторы отмечают, что данных для предоставления рекомендаций для пациентов с HBsAg- и anti-HBc+ или anti-HBs+/anti-HBc+ недостаточно.
Рассмотренный алгоритм действий в отношении предупреждения реактивации HBV-инфекции у пациентов ревматологического профиля, которым планируется проведение иммуносупрессивной терапии, представляет собой обобщенную точку зрения многих профессиональных ассоциаций, прежде всего гепатологических, с формулировкой позиций, касательно которых почти нет разногласий. Вместе с тем авторы всех рекомендаций акцентируют внимание на том, что в ряде случаев необходим индивидуальный подход, важное значение имеет мнение опытного инфекциониста и лабораторный мониторинг, в отношении многих препаратов имеется недостаточно информации или она противоречива. Видимо, именно поэтому в рекомендациях по лечению отдельных ревматических заболеваний эти вопросы либо не рассматриваются вовсе, либо освещаются пунктирно. Например, в последних рекомендациях Американской коллегии ревматологов (ACR) по ведению больных с ревматоидным артритом (J. A. Singh et al., 2016) отсутствуют специфические рекомендации касательно скрининга на HBV, хотя указывается, что при активной HBV-инфекции иммуносупрессивная терапия может назначаться при условии сопутствующего лечения HBV, у пациентов с HBsAg+ следует провести профилактику реактивации HBV до начала иммуносупрессивной терапии, а у лиц с HBsAg-/anti-HBc+ целесообразен мониторинг ДНК HBV.
Среди всех иммуносупрессивных препаратов, применяющихся в ревматологии, самыми небезопасными в плане реактивации HBV являются иммунобиологические агенты. По данным AGA, освещенным в рекомендациях по профилактике реактивации вирусного гепатита В на фоне иммуносупрессивной терапии (K. R. Reddy et al., 2015), наболее высокий риск реактивации HBV (>10%) характерен для анти-В-клеточных препаратов (например, ритуксимаба), а также ГК в дозах 10-20 мг/сут и выше в преднизолоновом эквиваленте в течение ≥4 нед у пациентов с HBsAg+ и anti-HBc+. К препаратам умеренного риска реактивации HBV
(1-10%) относятся ингибиторы ФНО, устекинумаб, ингибиторы тирозинкиназы и ГК в низких дозах (<10 мг/сут по преднизолону) и средних дозах (10-20 мг/сут
по преднизолону) в течение ≥4 нед и более. Группу низкого риска (менее 1%) составляют метотрексат, азатиоприн, ГК, вводимые внутрисуставно или принимаемые орально в любых дозах не более одной недели. Внутри групп умеренного и низкого риска выделяются подгруппы по серологическому статусу с соблюдением общей закономерности: риск выше при HBsAg+/anti-HBc+, ниже при HBsAg-/anti-HBc+. Примечательно, что в недавно опубликованной работе (C. Laohapand et al., 2015) утверждается, что даже долговременное применение метотрексата у больных ревматологического профиля не приводит к реактивации гепатита В. Крупный анализ случаев пациентов с аутоиммунными заболеваниями, имевших HBsAg+ или anti-HBc+ и получавших терапию ингибиторами ФНО (n=257), показал, что среди пациентов с HBsAg+ реактивация HBV наблюдалась в 39% случаев, а среди больных с anti-HBc+ – лишь в 5% (R. Perez-Alvarez et al., 2011). При этом у пациентов, имевших HBsAg, реактивация HBV достоверно чаще регистрировалась у лиц, которые получали предшествующую иммуносупрессивную терапию, по сравнению с теми, кто ее не получал (96 vs 70%), и встречалась в 2,7 раза реже у получавших противовирусную профилактику. У пациентов с anti-HBc+, получавших противовирусную профилактику, случаев реактивации HBV не наблюдали. При применении ритуксимаба реактивация HBV также может быть предотвращена профилактической противовирусной терапией (J. Villadolid et al., 2010). В отношении абатацепта данные противоречивы: если несколько лет назад риск реактивации HBV при его применении приравнивали к таковому для ингибиторов ФНО (P. S. Kim et al., 2012), то в недавней работе (M. Padovan et al., 2016) была продемонстрирована безопасность препарата у больных ревматоидным артритом (РА) с серологическими признаками перенесенной или текущей HBV-инфекции. Даже короткий курс тоцилизумаба (3 дозы) может повышать риск реактивации HBV у больных РА с хронической HBV-инфекцией, хотя пациенты оставались асимптоматичными и имели благоприятные исходы после противовирусной терапии (L. - F. Chen et al., 2017).
В заключение следует отметить, что ситуация с применением иммуносупрессивных агентов у больных ревматическими заболеваниями с сопутствующим хроническим гепатитом С выглядит значительно оптимистичней. В публикациях последних лет констатируется, что профиль безопасности анти-ФНО-препаратов в отношении HCV-инфекции является приемлемым, такая терапия не сопровождается активацией вируса, а даже если это и происходит, то обычно не сопровождается жизнеугрожающим поражением печени, по крайней мере при непродолжительном (1-2 года) лечении (A.M.G. Brunasso et al., 2011; D. Vassilopoulos, G. V. Papatheodoridis, 2012). В связи с этим универсальный скрининг на HCV перед началом анти-ФНО-
терапии считается необязательным, а наличие HCV не является противопоказанием для такого лечения, за исключением пациентов с циррозом, когда соотношение польза/риск должны оцениваться индивидуально (М. Pompili et al., 2013). Более того, полагают, что ингибиторы ФНО, в частности этанерцепт, могут быть даже полезными, поскольку ФНО-зависимые механизмы вовлечены в поддержание воспаления печени и прогрессирование фиброза при HCV-инфекции (Viganо M. et al., 2012). Согласно результатам многоцентрового рандомизированного клинического исследования (F. Iannone et al., 2014), пациентов с РА и хронической HCV-инфекцией c нетяжелым гепатитом можно успешно лечить этанерцептом и метотрексатом без повышения риска гепатотоксичности и репликации HCV. На фоне лечения анти-ФНО-препаратами пациентов с HCV-инфекцией рекомендуется мониторировать функцию печени каждые 3 мес (М. Pompili et al., 2013). При необходимости проведения анти-HCV-противовирусной терапии на фоне применения иммуносупрессивных препаратов она считается эффективной и безопасной (К. Ooka, J. K. Lim, 2016). Вместе с тем остается незыблемым постулат, что при остром или обострениях хронического гепатита С следует избегать назначения как традиционных, так и иммунобиологических иммуносупрессивных препаратов. І