16 жовтня, 2017
Профилактика антибиотикассоциированной диареи, вызванной токсигенным штаммом Clostridium difficile, у детей (обзор)

Наиболее частым побочным эффектом применения антибиотиков у детей является диарея, которая несет не только угрозу развития дегидратации и других осложнений, но и приводит к увеличению затрат на лечение и продолжительности пребывания в медицинских учреждениях. Инфекция Clostridium difficile как одна из причин такой диареи стала главной проблемой во многих странах, что привело к поиску наилучшего способа предотвращения ее возникновения. Профилактика в основном сводится к рациональному использованию антибиотиков, а также выполнению комплексных мероприятий по контролю над распространением инфекции при появлении вспышек заболевания. Широкое внимание уделяется изучению эффективности пробиотических микроорганизмов в лечении и профилактике диареи, связанной с применением антибиотиков. В статье обсуждается эффективность применения пробиотиков в качестве превентивных мероприятий развития антибиотикассоциированной диареи (ААД) у детей, в том числе C. difficile-ассоциированной диареи (CD-АД).
Диарея, возникшая на фоне применения антибактериальных средств и не имеющая других явных причин, определяется как антибиотикассоциированная диарея. По установленным критериям ВОЗ, под термином «диарея» подразумевается появление жидкого, неоформленного стула более 3 раз в сутки на протяжении, как минимум, 2 дней. ААД может развиваться в течение 2 ч после приема антибиотика и практически до 8-й недели после его отмены. Снижение колонизационной резистентности на фоне приема антибиотика приводит к нарушению микробиоценоза кишечника и размножению условно-патогенных микроорганизмов. Появление токсигенного штамма Clostridium difficile – одна из самых серьезных проблем, которая связана с антибиотикотерапией. Токсигенные штаммы C. difficile способны вызывать серьезные клинические проявления в виде псевдомембранозного колита1, заканчивающегося в 30-40% случаев летальным исходом.
Частота развития ААД зависит от вида применяемого антибактериального средства и варьирует в пределах 5-30%. В структуре заболеваемости лидирует идиопатическая форма2, занимающая 80-90%. Остальные 10-20% всех случаев диареи, развившейся вследствие антибиотикотерапии, связаны с C. difficile. ААД чаще всего наблюдается у детей в возрасте менее 2 лет и при применении комбинированного антибиотика, содержащего амоксициллин/клавулановую кислоту.
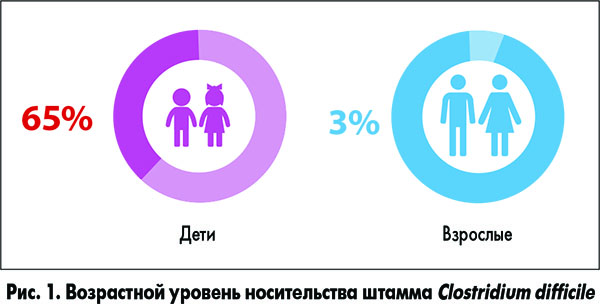
Среди новорожденных частота носительства C. difficile в среднем составляет 50-65% и уменьшается с возрастом, достигая 3% у здоровых взрослых (рис. 1). С. difficile является возбудителем нозокомиальных инфекций3.
Инфицирование С. difficile происходит фекально-оральным путем. Клостридиальные споры выявляют в больничной среде (помещения, оборудование, персонал, пациенты), они сохраняют свою жизнеспособность в течение 40 дней. Показано, что к концу 4-й недели пребывания в стационаре 50% больных инфицируются С. difficile.
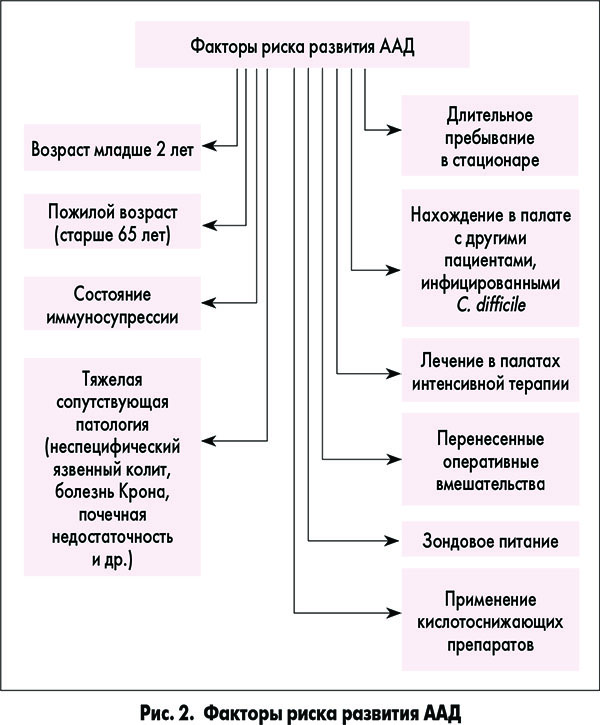
Выделяют следующие факторы риска развития ААД: возраст младше 2 лет; длительное пребывание в стационаре; нахождение в палате с другими пациентами, инфицированными C. difficile; лечение в палатах интенсивной терапии; пожилой возраст (старше 65 лет); перенесенные оперативные вмешательства; зондовое питание; состояние иммуносупрессии; применение кислотоснижающих препаратов; тяжелая сопутствующая патология (неспецифический язвенный колит, болезнь Крона, почечная недостаточность и др.; рис. 2).
Не доказана положительная связь частоты возникновения диареи с путем введения и длительностью лечения антибактериальными препаратами. В ряде исследований показано, что тяжелые формы ААД могут развиться даже после однократного приема антибиотика.
Нарушение состава и функции кишечной микрофлоры, снижение колонизационной резистентности, избыточный рост патогенных микроорганизмов, аллергическое и токсическое действие антибиотиков на слизистую оболочку кишечника, а также изменение моторики желудочно-кишечного тракта в результате прямого воздействия антибактериального препарата на определенные рецепторы являются основными механизмами, которые обуславливают развитие диареи при приеме антибиотиков.
Уменьшение количества анаэробов на фоне антибактериальной терапии приводит к нарушению метаболизма углеводов и клетчатки, которые, накапливаясь в просвете толстой кишки, индуцируют секрецию воды и электролитов, результатом чего является осмотическая диарея4. Кроме того, снижается синтез короткоцепочечных жирных кислот (основных источников энергии колоноцитов), и, как следствие, происходят дистрофические изменения эпителия толстого кишечника, нарушение всасывания воды и электролитов, увеличение проницаемости кишечного барьера по отношению к антигенам.
Некоторые анаэробные бактерии участвуют в метаболизации желчных кислот (ЖК) в просвете кишечника. При подавлении антибиотиками таких бактерий происходит нарушение деконъюгации ЖК. Избыток первичных ЖК, являющихся мощными стимуляторами кишечной секреции, ведет к секреторной диарее5.
Колонизационная резистентность – это свойство кишечного микробиоценоза, позволяющее предотвращать избыточный рост патогенных микроорганизмов в просвете кишечника. Применение антибиотиков снижает колонизационную резистентность, что ослабляет конкуренцию индигенных (постоянно присутствующих в организме хозяина) микроорганизмов с патогенными за рецепторы слизистой оболочки кишечника и, как следствие, прогрессирующее размножение и рост патогенной флоры.
Некоторые антибиотики способны стимулировать мотилиновые рецепторы, ускоряя эвакуацию пищи из желудка и ее пассаж по кишечнику. Клавулановая кислота, применяемая в качестве ингибитора бета-лактамаз, приводит к усилению моторики тонкого кишечника, что в свою очередь сказывается на характере и частоте дефекации.
Необходимым условием для заселения и размножения C. difficile являются нарушения в составе и функции нормальной микрофлоры кишечника. Обычно это происходит при применении антибиотиков широкого спектра действия (пенициллины, цефалоспорины, фторхинолоны). Показано, что риск контаминации кишечника C. difficile выше у тех пациентов, которые получают комбинированную антибиотикотерапию и длительность лечения которых составляет более 3 дней. Clostridium difficile – строго анаэробная, спорообразующая, грамположительная палочка. Споры Clostridium difficile имеют высокую устойчивость к факторам внешней среды и стандартным дезинфицирующим средствам, а также они резистентны к антибиотикам (природные и полусинтетические пенициллины, ингибитор-защищенные пенициллины, цефалоспорины, линкозамиды и др.). Патогенность данного микроорганизма основана на способности продуцировать экзотоксины. Клинические формы ААД вызывают только токсигенные штаммы C. difficile.
Прием антибиотиков создает условия для контаминации C. difficile, ее роста и размножения. Сниженная колонизационная резистентность благоприятствует превращению спор C. difficile в вегетативные формы, после чего происходит прикрепление бактерии к колоноцитам и занятие ею определенной экологической ниши в толстом кишечнике. Организм хозяина реагирует на колонизацию путем образования иммуноглобулинов класса G. Считается, что эти антитела нейтрализуют токсины C. difficile, не давая им возможности связываться с рецепторами колоноцитов. При достаточно полном гуморальном ответе размножение бактерий и образование токсинов сдерживается, пациент при этом становится носителем. При недостаточном иммунном ответе происходит продукция токсинов, и у пациента развиваются клинические формы заболевания.
C. difficile продуцирует два вида токсинов: токсины А и В. Токсин А – энтеротоксин, он активирует макрофаги и моноциты, что приводит к избыточному выделению цитокинов и других медиаторов воспаления. При этом повышается проницаемость слизистой оболочки и увеличивается секреция жидкости. Токсин B – цитотоксин; приводит к дезинтеграции актиновых микрофиламентов в клетках слизистой оболочки кишечника и их гибели.
Оба токсина, как правило, продуцируются одновременно и действуют синергически. Возникающий обширный воспалительный ответ повреждает слизистую оболочку кишечника, вызывая образование язв и появление так называемых псевдомембран.
ААД могут усугублять другие возбудители, такие как Clostridium perfringens типа А, Staphylococcus aureus, Salmonella spp., Klebsiella oxytoca и, возможно, Candida spp. Clostridium perfringens типа А – возбудитель пищевой токсикоинфекции – может вызвать ААД, характеризующуюся доброкачественным течением: заболевание, как правило, заканчивается самопроизвольным выздоровлением в течение 24 ч.
Выявлено, что при развитии ААД в кале содержится увеличенное количество Candida albicans (>105 в 1 г кишечного содержимого), а применение нистатина приводило к уменьшению клинических проявлений. Однако многие исследователи подвергают сомнению достоверность этих доказательств.
Спектр клинических симптомов ААД может варьировать от асимптоматического бактерионосительства (особенно у новорожденных и детей первого года жизни) или легкого течения в виде водянистой диареи до 5-7 раз в сутки, не сопровождающейся системными проявлениями, до тяжелого – диарея до 20 раз в сутки (иногда с примесью крови), сопровождающаяся лихорадкой до 39-40°C, развитием тяжелой дегидратации. Вариантом тяжелого течения является псевдомембранозный колит, который отмечается у 1-2% больных с диареей, вызванной инфекцией С. difficile.
Отсутствие клинически манифестных форм ААД, связанной с Clostridium difficile, у детей объясняется, по-видимому, отсутствием или незрелостью рецепторов клеток слизистой оболочки кишечника к токсинам данного патогена. Считают, что временная резистентность к данной инфекции также может быть связана с наличием у детей первого полугодия жизни материнских антиклостридиальных антител, полученных трансплацентарно.
Терапевтическая тактика различных форм ААД имеет свои особенности, а также зависит от степени тяжести течения и наличия факторов риска со стороны пациента.
При идиопатической форме ААД отмена антибактериальной терапии или замена препарата достаточно быстро (в течение 24 ч) приводит к регрессированию клинических симптомов (прекращению диареи). Иногда применяются препараты, снижающие перистальтику, однако следует быть уверенным, что диарея не связана с С. difficile, так как в этом случае применение таких препаратов усугубляет течение ААД. Также эффективна коррекция диеты. Из рациона следует исключать продукты, содержащие медленно всасывающиеся углеводы. К ним относятся: фруктоза, сорбитол, пищевые волокна (пектины, камеди). У детей, у которых верифицирована лактазная недостаточность, исключают молочные продукты. При развитии дегидратации необходимо восполнение дефицита жидкости и электролитов.
Асимптоматическое бактерионосительство C. difficile у здоровых детей не требует проведения терапевтических мероприятий. При развитии манифестных форм ААД, связанной с С. difficile, используемые антибиотики незамедлительно отменяются.
При проведении специфической терапии противопоказан прием энтеросорбентов (холестирамин, активированный уголь и др.). Это обусловлено связыванием антибиотиков с энтеросорбентами в просвете кишечника и уменьшением их терапевтического эффекта. Противопоказаны также препараты, снижающие перистальтику. Уменьшение моторики кишечника приводит к усилению повреждающего действия токсинов на слизистую оболочку.
К основным мерам профилактики, прежде всего, относится рациональное использование антибиотиков у детей.
Особое место в профилактике ААД у детей занимает применение пробиотиков, которые обладают рядом полезных для организма свойств и все чаще используются для лечения широкого спектра заболеваний желудочно-кишечного тракта. Результаты многочисленных исследований подтверждают эффективность пробиотиков в предотвращении случаев ААД при одновременном использовании с антибиотиком. Сводные данные об относительном риске, полученные в результате метаанализа 63 рандомизированных контролируемых исследований при участии 11 811 пациентов, говорят о статистически значимой взаимосвязи между приемом пробиотиков и уменьшением симптомов ААД (относительный риск 0,58; 95% доверительный интервал 0,50-0,68; р<0,05). При анализе частоты формирования ААД в зависимости от проводимой антибактериальной терапии выявлена меньшая ее частота в основной группе на фоне лечения оральными пенициллинами или цефалоспоринами (12,5%), чем в группе сравнения (33,3%).
Прием этих пробиотиков приводил к значительному уменьшению клинических симптомов и длительности ААД. Применение йогурта, содержащего бактерии рода Bifidobacterium, способствовало снижению частоты дефекации при эритромицин-индуцированной диарее. Эффективность пробиотиков во многом зависит от таких свойств, как выживаемость, способность к размножению и колонизации в толстом кишечнике. Также многочисленные исследования показали отсутствие серьезных побочных эффектов при использовании пробиотиков.
Широко известные в Украине пробиотические препараты Линекс Беби® и Линекс® детские капли, содержащие Bifidobacterium animalis subsp. lactis BB‑12 (ВВ‑12), заслуживают внимания в качестве средства профилактики ААД, в том числе связанной с C. difficile.
Указанный штамм бактерий на сегодняшний день является наиболее изученным пробиотическим микроорганизмом в мире, полное секвенирование генома осуществлено в 2010 г. Более 170 исследований, в которых изучали BB‑12, показали его полезные свойства в отношении поддержания здоровья человека. Выявлено, что штамм BB‑12 синтезирует специфические белки, которые связывают олигосахариды, аминокислоты, ионы магния, некоторые ферменты и белковые молекулы, таким образом реализуя свои защитные свойства слизистой оболочки и регуляцию иммунной системы кишечного тракта. Бифидобактерии BB‑12 показали хорошую устойчивость к кислой среде желудка, а также желчным кислотам и их солям. Важным свойством BB‑12 является его высокая степень адгезии к энтероцитам, что обеспечивает колонизацию толстого кишечника. Исследования показали наличие у ВВ‑12 резистентности к широкому спектру антибиотиков, что определяет возможность его использования совместно с антибактериальной терапией, при этом подтверждено отсутствие переноса генов резистентности патогенным микроорганизмам. Штамм ВВ‑12 соответствует всем характеристикам и требованиям, выдвигаемым сегодня Всемирной организацией здравоохранения к пробиотическому микроорганизму. Штамм Bifidobacterium animalis subsp. lactis имеет статус GRAS, который предоставляется Управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA) США, QPS, а также генетический паспорт; геном Bifidobacterium animalis subsp. lactis полностью расшифрован.
Штамм BB‑12 проявил in vitro антагонистические свойства в отношении группы патогенов, таких как Bacillus cereus, Clostridium difficile, Clostridium perfringens типа A, Escherichia coli ATCC4328, Enterococcus faecalis, Listeria monocytogenes, Pseudomonas aeruginosa, Salmonella enterica subsp. enterica serovar Typhimurium, S. enterica subsp. Enterida serovar Typhi, Shigella flexneri, Shigella sonnei и Candida albicans. Это обусловлено продуцированием ацетата и лактата, особенно в присутствии пребиотических веществ. Также за счет прочной адгезии к слизистой оболочке штамм ВВ‑12 in vitro препятствовал прикреплению к энтероцитам таких патогенов, как S. enterica serovar Typhimurium, C. perfringens, C. difficile и E. coli K2, тем самым предотвращая колонизацию кишечной стенки и проявление патогенных свойств данных бактерий.
Клинические исследования доказали его эффективность в снижении риска развития острой диареи у детей в возрасте до 8 мес, а также частоты респираторных инфекций в раннем возрасте. Рандомизированное двойное слепое плацебо-контролируемое исследование оценило эффективность штаммов BB‑12 и L. acidophilus в профилактике ААД у 343 пациентов во время лечения антибиотиком. Заболеваемость ААД в группе принимавших пробиотики была на 10,8% ниже по сравнению с 15,56% в группе плацебо. Продолжительность диареи также была меньше в основной группе (2,32 дня) по сравнению с группой плацебо (4,58 дня). Эти результаты показывают, что BB‑12 и L. acidophilus могут эффективно уменьшать продолжительность и тяжесть ААД. В другом клиническом исследовании подтверждены превентивная роль ВВ‑12 в возникновении диареи при проведении терапии H. pylori-ассоциированных заболеваний с использованием антибиотиков, а также повышение эффективности ее эрадикации.
Достаточная доказательная база позволяет рекомендовать пробиотики Линекс Беби® и Линекс® детские капли Bifidobacterium animalis subsp. lactis для профилактики антибиотик-ассоциированной диареи у детей, в том числе и CD-ААД.
Список литературы находится в редакции.
УДК 616.34-008.314.4-053.2-02:615.33/579.852.13
Статья печатается в сокращении.
4-07-ЛИН-OTC-0717
Тематичний номер «Педіатрія» №3 (42), вересень 2017 р.