19 жовтня, 2017
Возможность и эффективность применения памидроновой кислоты при анкилозирующем спондилите
 Анкилозирующий спондилит (АС) занимает центральное место среди воспалительных заболеваний позвоночника и является хроническим воспалительным системным заболеванием опорно-двигательного аппарата, преимущественно аксиального скелета, ассоциированным с HLA-B27. АС приводит к прогрессирующему ограничению подвижности позвоночника за счет анкилозирования межпозвонковых суставов и обызвествления спинальных связок. При АС возможны также разнообразные системные проявления, которые в ряде случаев определяют прогноз заболевания и его исходы. Социальное значение АС определяется тем обстоятельством, что эта болезнь начинается в молодом возрасте, а пик ее заболеваемости приходится на возраст 15-30 лет, причем средний возраст начала болезни соответствует 24 годам.
Анкилозирующий спондилит (АС) занимает центральное место среди воспалительных заболеваний позвоночника и является хроническим воспалительным системным заболеванием опорно-двигательного аппарата, преимущественно аксиального скелета, ассоциированным с HLA-B27. АС приводит к прогрессирующему ограничению подвижности позвоночника за счет анкилозирования межпозвонковых суставов и обызвествления спинальных связок. При АС возможны также разнообразные системные проявления, которые в ряде случаев определяют прогноз заболевания и его исходы. Социальное значение АС определяется тем обстоятельством, что эта болезнь начинается в молодом возрасте, а пик ее заболеваемости приходится на возраст 15-30 лет, причем средний возраст начала болезни соответствует 24 годам.
Первая декада XXI века ознаменовалась увеличением числа клинических исследований, посвященных эффективности и безопасности лечения спондилоартритов (СпА). В этот же период произошли серьезные изменения в изучении данного заболевания: изменилась концепция СпА, были внедрены новые классификационные критерии, разработаны ранее не использовавшиеся инструменты для оценки активности СпА и др., а также представлены новые концепции лечения АС, разработанные Американской коллегией ревматологов (ACR), Европейской противоревматической лигой (EULAR), Международным обществом по оценке СпА (ASAS). Основные цели лечения АС и нерентгенологического аксиального СпА заключаются в уменьшении выраженности симптомов, поддержании гибкости позвоночника и нормальной осанки, уменьшении функциональных ограничений и осложнений заболевания.
Прогрессирование АС в первую очередь связано с преобладанием пролиферации костной ткани, что проявляется ростом синдесмофитов (и/или энтезофитов) и процессом анкилозирования позвоночника и суставов. Главная мишень иммунного ответа при АС – граница хрящевой и костной ткани, включая инсерции сухожилий и связок в кости (энтезисы), а также субхондральная кость. Воспалительная энтезопатия (поражение мест прикрепления к костям сухожилий, связок, апоневрозов, фиброзной части межпозвонковых дисков, капсул суставов), остеит (воспаление собственно костной ткани) и вторичный синовит являются патоморфологической основой поражения опорно-двигательного аппарата при АС.
В позвоночнике воспаление и грануляции возникают на границе фиброзного кольца межпозвонкового диска с телом позвонка. Наружные волокна фиброзного кольца эрозируются, склерозируются и постепенно замещаются костной тканью, давая начало костным перемычкам («мостикам») между позвонками – синдесмофитам. Формирование синдесмофитов завершается по мере оссификации межпозвонкового диска. Ремоделирование кости в передних и переднелатеральных отделах, обусловливающее квадратизацию тел позвонков при АС, является результатом острого и хронического спондилита. Воспалительный процесс приводит к разрушению и одновременному восстановлению и компактного, и губчатого вещества тел позвонков. Артриты межпозвонковых суставов сопровождаются эрозированием суставных поверхностей, образованием паннуса и их анкилозированием.
Структурное повреждение при АС главным образом определяется новым образованием кости, которое может привести к полному или неполному анкилозу позвоночника, в том числе фасеточных суставов, крестцово-подвздошных суставов и, реже, других частей скелета. Эрозивные структурные изменения могут и происходят в начале болезни, но не оказывают долговременного влияния на функцию и подвижность позвонков.
Эти патоморфологические данные полностью противоречат ревматоидному артриту (РА), при котором структурное повреждение определяется эрозивным разрушением хряща и кости, а эффективные методы лечения, такие как ингибиторы фактора некроза опухоли-α (ФНО-α), не только улучшают признаки и симптомы болезни, но и почти полностью подавляют рентгенологическую прогрессию. Понимание структурных повреждений при АС еще более усложняется тем, что увеличение локального костного образования в позвоночнике сосуществует с потерей костной массы всего скелета. Так, у пациентов с АС определяется остеопороз (ОП), связанный прежде всего с активностью заболевания, множественные компрессионные повреждения, а также существенно возрастает риск переломов не только позвонков. Иммуногистохимические исследования показали, что в энтезисах больных АС, в отличие от больных РА и здоровых лиц, присутствуют остеокласты. В ходе обследования 44 пациентов в возрасте 40,59±13,2 года рентгенологические изменения позвонков выявили в шейном отделе у 15 (34%) пациентов, в грудном отделе – у 12 (27%), в поясничном – у 10 (23%). У пациентов с наличием рентгенологически подтвержденных компрессионных изменений шейного отдела позвоночника, в сравнении с пациентами без рентгенологических изменений, выявлены достоверные различия индекса BASDAI (4,9±2,3 и 7,0±1,7 соответственно; р=0,04). У лиц мужского пола переломы позвоночника возникают в более молодом возрасте. При АС переломы тел позвонков и их дужек могут возникать при минимальных травмах, спонтанно или при падении с высоты собственного роста, чаще в тех сегментах, которые находятся между анкилозированными позвонками. В отличие от переломов позвоночника, связанных с постменопаузальным ОП, у больных АС после перелома тела или задних структур позвонка нередко встречаются неврологические осложнения.
Таким образом, при АС в позвоночнике одновременно происходит активизация двух противоположных костных ремоделирующих процессов: патологическое формирование новой кости в кортикальной зоне позвонка, фасеточных суставах и связочном аппарате и чрезмерная потеря костной ткани в центральной части тела позвонка, приводящая к ОП. В связи с этим проблему ОП при СпА/АС нельзя рассматривать в отрыве от метаболизма костной ткани в целом.
Патогенез ОП при АС тесно связан с патогенетическими механизмами воспаления. Современные работы свидетельствуют, что в основе диффузной потери костной массы при АС лежит воспаление, а более конкретно – дисбаланс в системе RANKL/RANK/OPG, через которую опосредуется влияние большинства медиаторов воспаления на остеокластогенез. Важную роль в патогенезе ОП при СпА играют провоспалительные цитокины, обладающие способностью стимулировать резорбцию костной ткани. Дифференцировку остеокластов стимулирует один из мощнейших провоспалительных цитокинов – ФНО-α. Как известно, именно он играет центральную роль в патогенезе СпА. Другой провоспалительный цитокин – интерлейкин-6 (ИЛ-6) – поддерживает дифференцировку и стимулирует активацию остеокластов. ИЛ-6 способствует развитию ОП при раннем АС, и его концентрация в плазме коррелирует с маркерами активности заболевания.
С другой стороны, ключевыми факторами, индуцирующими формирование остеофитов/синдесмофитов и остеопролиферативные процессы, являются костные морфогенетические белки (BMP) и Wnt-белки. Wnt-белки способствуют активации, дифференциации и пролиферации остеобластов. В ряде работ показано, что при АС активирован Wnt сигнальный путь. Ингибиторами Wnt сигнального пути являются белки Dickkopf-1 (DKK-1) и склеростин. E. Klingberg и соавт. (2014) при изучении состояния костного метаболизма у 210 пациентов с АС выявили достоверное повышение уровня одного из Wnt-протеинов (Wnt-3a) и снижение уровня склеростина по сравнению со здоровыми донорами. В работе отмечена ассоциация между повышением уровня Wnt-3a и остеопролиферацией (корреляция с показателями BASMI, счета синдесмофитов, mSASSS) вне зависимости от возраста больных. Авторы считают маркером остеопролиферации именно протеин Wnt-3a. Одновременно у пациентов с низкими показателями минеральной плотности шейки бедренной кости был обнаружен низкий уровень сывороточного склеростина. Кроме того, была выявлена положительная корреляция между высоким уровнем С-реактивного белка (СРБ) и низкими значениями DKK-1 и склеростина (антагонистов Wnt).
Учитывая высокий воспалительный потенциал при АС, роль медиаторов воспаления в патогенезе этого заболевания, наиболее эффективными в лечении АС оказались ингибиторы ФНО-α, нестероидные противовоспалительные препараты (НПВП), локальное введение глюкокортикоидов, а также применение бисфосфонатов.
Бисфосфонаты широко применяются в лечении таких заболеваний, как ОП, болезнь Педжета, синдром SAPHO, гиперкальциемия, злокачественные/метастатические поражения костей. Бисфосфонаты являются мощными ингибиторами активности остеокластов и обладают значительным антирезорбтивным потенциалом. Помимо антиостеокластического эффекта, повышения минеральной плотности костной ткани (МПКТ) и предотвращения переломов костей, бисфосфонаты обладают рядом противовоспалительных и иммуномодулирующих свойств. Они ингибируют клетки моноцитарно-макрофагального ряда и подавляют выработку провоспалительных цитокинов, таких как ИЛ-1, ФНО-α и ИЛ-6. Сегодня бисфосфонаты рассматриваются не только как антирезорбтивные лекарственные средства, но и препараты с мощным противовоспалительным потенциалом.
Поскольку в зоне энтезисов при СпА обнаружены активные остеокласты и зоны активного воспаления, течение АС сопровождается остеопоротическими изменениями в костях, а также наблюдается нарушение костного ремоделирования, применение бисфосфонатов может быть эффективным при АС благодаря их влиянию на костную резорбцию и воспалительные процессы в костях (остеит).
В настоящее время в лечении структурно-функциональных нарушений костной системы при АС широко используется памидроновая кислота в виде внутривенных инфузий, что обеспечивает, по сравнению
с другими бисфосфонатами, применяющимися перорально, достаточно высокую концентрацию препарата в плазме и быстрый клинический эффект. Впервые противовоспалительные свойства бисфосфонатов были отмечены при использовании их в качестве адъювантной терапии РА.
В одном из исследований продемонстрирован высокий противовоспалительный эффект бисфосфоната неридроната, назначаемого внутривенно. Эффективность неридроната (100 мг внутривенно 1 раз в месяц) у 60 пациентов с АС оказалась сопоставимой с таковой инфликсимаба. У пациентов наблюдалось снижение показателей активности, улучшение функциональных показателей, а также увеличение МПКТ.
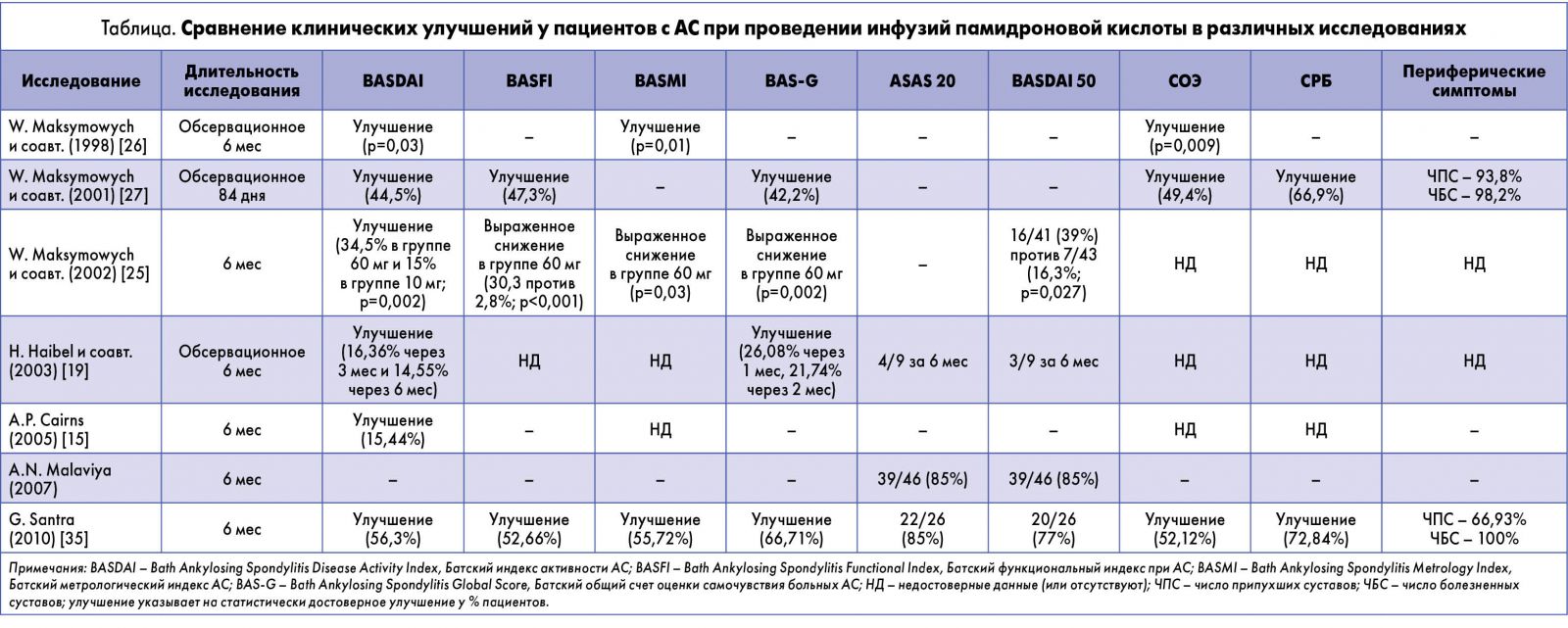
Применению памидроновой кислоты при АС посвящено 6 открытых и 1 рандомизированное контролируемое исследование.
В первом открытом исследовании изучения эффективности и безопасности памидроновой кислоты у больных, страдающих АС, приняли участие 16 пациентов, рефрактерных к НПВП, которые были разделены на 2 группы. Первая группа получала памидроновую кислоту по 30 мг 1 раз в месяц на протяжении 3 мес, а затем по 60 мг в течение последующих 3 мес. Вторая группа получала дозу 60 мг 1 раз в месяц в течение 3 мес. Результаты исследований продемонстрировали достоверное улучшение индексов активности и функциональных возможностей (BASDAI, BASFI) и уменьшение СОЭ при применении памидроновой кислоты. У 44% пациентов отмечены побочные эффекты, чаще всего после первого введения препарата. У пациентов с АС и СпА отмечена только умеренная клиническая эффективность препарата, более выраженная при аксиальной форме заболевания. Результат, как правило, наступал после 3 мес лечения. Эффективность лечения памидроновой кислотой была выше при использовании дозы 60 мг или в случае коротких интервалов между инфузиями. H. Haibel и соавт. (2003) провели небольшое проспективное когортное исследование длительностью 6 мес, в котором пациенты с АС и показателем BASDAI >4 получали Памидронат в дозе 60 мг на 0-й, 2-й, 14-й, 28-й и 56-й нед исследования. Через 3 мес зафиксировано улучшение показателей активности заболевания.
При проведении сравнительной оценки эффективности и безопасности различных доз памидроновой кислоты (10 и 60 мг) у пациентов с АС было показано достоверное улучшение индексов BASDAI, BASFI при использовании дозы 60 мг в сравнении с дозой 10 мг. Бисфосфонат вводили 1 раз в месяц в течение 6 мес. Считается, что 10 мг – это минимальная доза памидроновой кислоты, которая может вызвать постинфузионную реакцию в виде повышения температуры и артралгий. Гриппоподобные симптомы наблюдались в 64% случаев в группе, получавшей 60 мг памидроновой кислоты, и у 45% пациентов в группе приема 10 мг.
По данным Е. Toussirot и соавт. (2006), Памидронат был эффективен у 36 пациентов с АС с вовлечением в патологический процесс передней грудной стенки. Интересно, что у больных с синдромом SAPHO отмечен яркий клинический эффект в отношении грудино-ключичного гиперостоза.
Исследование остеопротекторного эффекта бисфосфонатов при АС проводилось только в двух работах. Н. Haibel и соавт. (2003) при назначении памидроновой кислоты пациентам с АС проводили денситометрию бедренной кости и поясничного отдела позвоночника. Ни у одного пациента с клиническим улучшением через 6 мес (улучшение индекса BASDAI) не было достоверной корреляции с МПКТ.
В одном исследовании проводилась оценка влияния памидроновой кислоты на динамику маркеров резорбции костной ткани при АС. 15 пациентов со средней длительностью АС 14,8 года получали внутривенные инфузии памидроновой кислоты в дозе 30 мг с повышением до 60 мг в течение 6 мес. Было продемонстрировано достоверное уменьшение как маркеров резорбции (С-телопептид; р=0,001), так и маркеров формирования кости (остеокальцин (p=0,02) и костно-специфическая щелочная фосфатаза (р=0,02) через 6 мес терапии. Этот эффект может оказывать благоприятное воздействие на костный метаболизм при АС. Достоверные изменения коснулись также индекса BASDAI, однако не зафиксировано изменений в динамике СРБ и СОЭ.
Еще одно клиническое исследование продемонстрировало хороший эффект внутривенных инфузий памидроновой кислоты при АС. В исследование было включено 35 пациентов с АС с показателем BASDAI >4; инфузии памидроновой кислоты проводились ежемесячно в дозе 60 мг. 26 пациентов получили все 6 инфузий. Из них 22 пациента (85%) достигли ASAS 20 и 20 (77%) получили ответ на уровне 50% BASDAI. В среднем отмечено снижение BASDAI на 56,4%, BASFI – на 52,66%, BASMI – на 55,72%, BAS-G – на 66,71%, СОЭ – на 52,12% и СРБ – на 72,84% после 6 мес терапии. Достоверное уменьшение утренней скованности отмечено у 16 пациентов (62%) в течение 48 ч после первой инфузии. После трех инфузий отмечено достоверное улучшение периферических артритов в виде уменьшения припухлости и числа болезненных суставов. Лихорадка, артралгия и миалгия наблюдались в шести случаях после первого введения и только в одном случае после второй инфузии памидроновой кислоты. Эти симптомы спонтанно разрешились в течение 24 ч и не требовали специфического лечения.
Обобщенная характеристика исследований памидроновой кислоты в лечении АС приведена в таблице. Применение памидроновой кислоты в импульсном режиме (60 мг внутривенно в виде инфузии 1 раз в месяц) приводит к значительному клиническому улучшению у пациентов с АС, о чем свидетельствует позитивная индексная динамика (BASDAI, BASFI, BASMI, BAS-G), а также достоверное снижение лабораторной активности (СОЭ и СРБ). Побочные эффекты обычно не требуют прекращения лечения и наблюдаются после первой инфузии препарата.
Результаты клинических исследований свидетельствуют, что памидроновая кислота обладает противовоспалительными свойствами при АС, ее применение потенциально улучшает индексы активности и функциональные возможности пациента. Положительный клинический эффект памидроновой кислоты более выражен при аксиальной форме заболевания, чем при периферической.
Интересное рандомизированное плацебо-контролируемое исследование по изучению эффективности памидроновой кислоты при боли в нижней части спины проведено в 2014 году. В исследование были включены 11 пациентов с болями в нижней части спины дегенеративного характера. Введение памидроновой кислоты проводилось по эскалационной схеме – 30, 60, 90 и 180 мг Памидроната (последнюю дозу вводили в виде двух инфузий по 90 мг). Отмечено значимое снижение болевого синдрома и улучшение функциональных показателей в течение 6 мес, особенно при введении высоких доз (в виде двух инфузий по 90 мг).
В последние несколько лет бисфосфонаты продемонстрировали специфический противовоспалительный эффект. Индукция апоптоза в синовиальных макрофагах сегодня рассматривается как один из наиболее важных механизмов их противоартритического/противовоспалительного действия. В экспериментальных работах бисфосфонаты индуцировали значительное истощение макрофагов синовиальной оболочки и выборочно синовиоцитов типа А, которые являются одними из наиболее важных источников цитокинов, что приводит к локальному снижению провоспалительных факторов, таких как ИЛ-1, ИЛ-6 и ФНО-α. Бисфосфонаты также продемонстрировали ингибирование миграции и адгезии макрофагов.
Безусловно, для решения вопроса об эффективности памидроновой кислоты при АС нужны рандомизированные контролируемые исследования с более длительным периодом лечения. Однако Памидронат можно уже сегодня рассматривать как препарат выбора у пациентов с АС, рефрактерных к НПВП, и при невозможности использования ингибиторов ФНО-α.
В рекомендациях ACR/ASAS 2015 года впервые рассматривается возможность применения памидроновой кислоты в лечении АС, однако указывается на недостаточное количество исследований, что ограничивает широкое использование и внедрение данного метода. Накопление клинических данных, проведение новых рандомизированных клинических исследований позволят получить достоверные данные об эффективности памидроновой кислоты при АС, которая займет достойное место в менеджменте этого заболевания.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 18 (415), вересень 2017 р.