1 грудня, 2017
Антибактериальная терапия негоспитальной пневмонии на амбулаторном этапе
 Пневмония относится к числу распространенных инфекционных заболеваний и занимает первое место среди причин летальности от инфекционных болезней и шестое место среди всех причин летальности [1].
Пневмония относится к числу распространенных инфекционных заболеваний и занимает первое место среди причин летальности от инфекционных болезней и шестое место среди всех причин летальности [1].
Негоспитальная пневмония (НП) – это острое заболевание, которое возникло во внебольничных условиях (за пределами стационара либо позднее 4 недель после выписки из него) или же диагностировано в первые 48 часов с момента госпитализации. Процесс сопровождается симптомами инфекции нижних дыхательных путей, такими как лихорадка, кашель, выделение мокроты (возможно, гнойного характера), боль в груди и одышка, и рентгенологическими признаками новых очагово-инфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы.
Современные алгоритмы антибактериальной терапии пневмонии изложены в отечественных рекомендациях, которые учитывают опыт европейских государств. Однако до сих пор допускается достаточное количество ошибок в выборе антибиотика для лечения этого заболевания. Неправильное назначение антибактериальных препаратов оказывает решающее влияние на исход заболевания, снижает экономическую эффективность лечения и ведет к селекции резистентных штаммов возбудителей. Адекватная и своевременно начатая антибактериальная терапия является необходимым условием эффективного лечения и, следовательно, благоприятного исхода пневмонии.
Участковый терапевт часто бывает первым медицинским работником, к которому обращается больной. Поэтому для первичного звена медицинской помощи знание современных аспектов антибактериальной терапии необходимо для правильного выбора противомикробного средства.
Принципы лечения НП достаточно хорошо изучены и представлены во многих международных и региональных рекомендациях, однако проблема рациональной антибиотикотерапии больных НП не теряет актуальности. Для адекватного выбора антибактериальной терапии в настоящее время предлагается разделять всех взрослых пациентов на 4 группы [2].
К I группе относят больных НП легкого течения, не нуждающихся в госпитализации, без сопутствующей патологии, и лиц, которые в последние 3 месяца не принимали антибактериальных препаратов. Наиболее часто возбудителями НП у таких пациентов являются S. pneumoniae, M. pneumoniae, C. pneumoniae, H. influenzae (как правило, у курильщиков) и респираторные вирусы. У 30-50% пациентов возбудителя заболевания не определяют вообще, так как проводить рутинную микробиологическую диагностику нецелесообразно. Определенную ценность могут иметь данные эпидемиологических исследований (групповая заболеваемость лиц молодого возраста в организованных коллективах характерна для инфекции, вызванной S. pneumoniae или M. pneumoniae).
Ко II группе относят больных НП легкого течения, не нуждающихся в госпитализации, с наличием сопутствующей патологии (хроническое обструктивное заболевание легких, почечная и сердечная недостаточность, цереброваскулярная патология, опухоли, сахарный диабет, хронические заболевания печени различной этиологии, психические расстройства, алкогольная зависимость) и/или лиц, которые принимали в последние 3 месяца антибактериальные препараты. Возбудителями НП у этих пациентов являются S. pneumoniae (в том числе антибиотикорезистентные штаммы), H. influenzae, S. aureus, респираторные вирусы. Следует учитывать и возможность грамотрицательной инфекции: семейство Enterobacteriaceae (E. coli, Klebsiella spp.), особенно у людей пожилого возраста. Необходимо предвидеть также вероятность анаэробной инфекции при наличии НП у лиц с несанированной полостью рта, клинико-анамнестическими данными относительно наличия неврологических заболеваний и/или нарушением акта глотания. Рутинная микробиологическая диагностика у этих больных также малоинформативна и практически не влияет на выбор антибиотиков. Однако примерно у 20% больных данной группы может возникнуть потребность в госпитализации из-за неэффективного амбулаторного лечения и/или обострения/декомпенсации сопутствующих заболеваний.
К III группе относят больных НП с течением болезни средней степени тяжести, которые нуждаются в госпитализации в терапевтическое (пульмонологическое) отделение по медицинским (наличие неблагоприятных прогностических факторов) показаниям. У пациентов этой группы НП может быть обусловлена S. pneumoniae, H. influenzae, атипичными возбудителями, грамотрицательными энтеробактериями, респираторными вирусами. У 10-40% больных III группы нередко обнаруживают смешанную инфекцию (то есть наличие типичных и атипичных бактериальных возбудителей). Такая разница в частоте выявления возбудителей обусловлена особенностями микробиологических методов диагностики, которые используют разные исследователи.
К IV группе относят больных с тяжелым течением НП, которые нуждаются в госпитализации в отделение реанимации и интенсивной терапии. Спектр микробной флоры у таких пациентов включает S. pneumoniae, Legionella spp., H. influenzae, грамотрицательные энтеробактерии, S. aureus и M. pneumoniae (достаточно редко).
Антибактериальная терапия больному НП назначается в зависимости от группы, к которой он относится (табл.).
Арсенал современных антибактериальных средств велик, поэтому следует придерживаться определенных критериев выбора, которым должен отвечать антибиотик, назначаемый больному НП. При выборе оптимального препарата основными ориентирами для практического врача являются:
- спектр антимикробной активности препарата;
- фармакокинетика/фармакодинамика антибиотика;
- уровень региональной резистентности микроорганизмов;
- учет сопутствующей патологии пациента;
- данные о последнем приеме антибактериальных препаратов (когда, какие);
- данные об эффективности различных антибактериальных препаратов с позиций доказательной медицины и адекватной оценки.
Правильность выбора антибактериального препарата при лечении НП можно продемонстрировать на клиническом примере.
Клинический случай
Больная К., 32 лет, преподаватель, живет в общежитии. Заболела остро с немотивированной слабости, потери аппетита, головной боли, диареи. Через 3 дня появились озноб с повышением температуры тела до 38,2 °С, сухой болезненный кашель, одышка, боли в суставах, мышцах.
При объективном исследовании: частота дыхательных движений – 24/мин, частота сердечных сокращений – 108 уд./мин, артериальное давление (АД) – 130/80 мм рт. ст. Перкуторно над легкими – укорочение легочного звука справа в межлопаточной области, аускультативно – крепитация в этой же области.
Данные общего анализа крови: гемоглобин – 128 г/л; эритроциты – 3,8×1012/л, лейкоциты – 10,7×109/л; палочкоядерные – 2%; сегментоядерные – 39%; эозинофилы – 2%; лимфоциты – 47%; моноциты – 10%; СОЭ – 35 мм/ч.
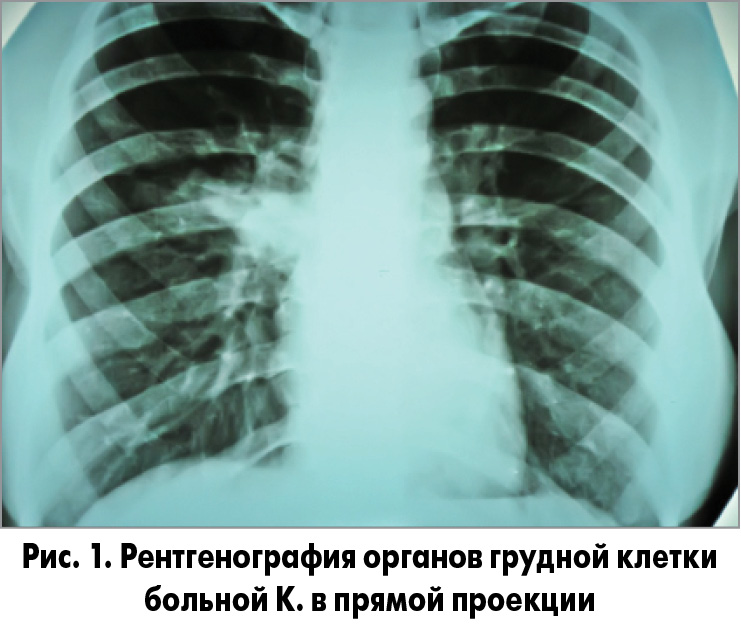
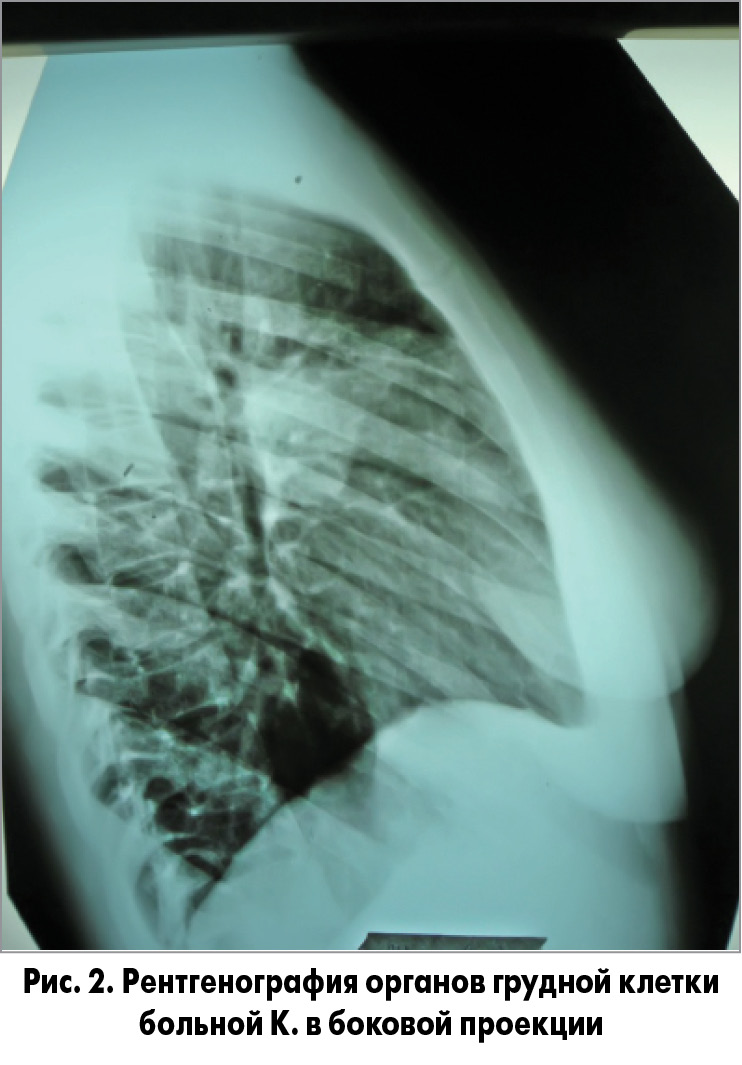
При рентгенографии органов грудной полости диагностирована НП верхней (S3) доли правого легкого (рис. 1, 2).
Участковый врач назначил: цефтриаксон 1000 мг внутримышечно 1 р/день 7 дней, отхаркивающий препарат, витамины, иммуномодуляторы. Поскольку эффекта от проведенного лечения не было, лечащий врач продлил прием цефтриаксона еще на 5 дней, увеличив при этом дозу до 2,0 г/сут. Для усиления терапии добавлены: антимикотический препарат, антигистаминное средство, нимесулид, сульфокамфокаин. Но даже после этого позитивной динамики в состоянии больной К. не наблюдалось.
Хотелось бы прокомментировать назначенную терапию.
Во-первых, выбор препарата. Очевидно, что больная К. может быть отнесена к I группе: у нее отсутствует сопутствующая патология, и в последние 3 месяца пациентка не принимала антибиотиков. Препаратом выбора у таких больных является амоксициллин либо макролид.
Во-вторых, эффективность антибактериального средства мы оцениваем через 48-72 часа, и если эффекта нет, препарат следует заменить. Продолжать прием неэффективного медикамента не имеет смысла, а уж тем более продлевать такое лечение. Применение неэффективного препарата имеет немало негативных последствий. В первую очередь при этом отсрочивается назначение другого, более адекватного антибиотика, что ведет к прогрессированию воспаления (особенно при тяжелых пневмониях, наличии сопутствующей патологии) и развитию осложнений, а также увеличиваются сроки лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов препаратов, а также развития и усиления антибиотикорезистентности. Продолжение лечения, несмотря на его неэффективность, подрывает доверие больного и его родственников к лечащему врачу. Очевидна и неэкономичность такой ошибочной тактики антибактериальной терапии (напрасный расход неэффективного антибиотика, дополнительные затраты на лечение возможных нежелательных явлений и др.).
В-третьих, отсутствует доказательная база, которая показала бы, что назначение так называемой сопутствующей терапии при лечении больных с НП ускоряет выздоровление, поэтому рекомендовать эти препараты не имеет смысла. Академик Ф. Г. Яновский говорил, что необходимо избегать «перекармливания больных лекарствами», ибо «больше» в лечении не всегда означает «лучше».
В-четвертых, для более точного назначения антибактериальной терапии, которое проводится эмпирически, следует обращать внимание на клиническую картину НП. Ряд симптомов может указать на атипичную этиологию заболевания (сухой болезненный кашель, боли в суставах, миалгия, диарея и т. д.). В таком случае есть возможность более точно подобрать антибиотик, а препаратами выбора при подозрении на атипичную этиологию заболевания (C. pneumoniae, M. pneumoniae) являются макролиды.
Одно из главных преимуществ макролидов – активность в отношении атипичных бактерий, что обусловлено их избирательным внутриклеточным накоплением. Наиболее оптимальными свойствами обладают 14- и 15-членные макролиды, в первую очередь представитель новых полусинтетических препаратов кларитромицин. Это 14-членный полусинтетический макролидный антибиотик (по числу атомов углерода в химической структуре), он разработан в результате химического модифицирования эритромицина путем замещения гидроксильной группы в положении С6 на CH3-группу. Это привело к лучшему и более стабильному всасыванию препарата в желудочно-кишечном тракте, повысило его кислотную устойчивость, антибактериальную активность в отношении ряда чувствительных к макролидам микроорганизмов, в том числе за счет стабильности в кислой среде эндосом, что принципиально важно для воздействия на внутриклеточные патогены [3]. В клинической практике препарат применяется с 1991 г.
Кларитромицин хорошо всасывается из желудочно-кишечного тракта. Биодоступность при приеме внутрь достигает 55%, что существенно выше в сравнении с показателями других новых макролидов, в том числе азитромицина (37%). Степень всасывания от приема пищи не зависит, что выгодно отличает кларитромицин от эритромицина и спирамицина. Связь с белками составляет, по разным данным, от 42 до 90%, в среднем 65-75% [4]. Примерно 20% всосавшегося кларитромицина немедленно метаболизируется в печени ферментами цитохрома CYP3A4, CYP3A5 и CYP3A7 с образованием нескольких продуктов, главным образом 14-гидроксикларитромицина. Последний в отношении ряда патогенных бактерий, особенно H. influenzaе, действует в сочетании с кларитромицином синергично [3]. Метаболиты других макролидов подобными свойствами не обладают.
Максимальная плазменная концентрация достигается менее чем через 3 часа после перорального приема. Кларитромицин легко проникает в ткани и жидкости тела, причем особенно активно накапливается в ткани легких, где его концентрация в 5-6, а в эпителиальных клетках – в 20 раз выше, чем в плазме крови [5, 6]. Активный метаболит 14-гидроксикларитромицин также хорошо проникает в жидкости и ткани дыхательной системы, хотя достигаемые при этом концентрации ниже в сравнении с исходным веществом [5]. Степень накопления кларитромицина в различных жидкостях и структурах легочной ткани максимальна по сравнению с другими 14- и 15-членными макролидами, в том числе с азитромицином.
Спектр активности кларитромицина в целом сходен с таковым других макролидных антибиотиков. Вместе с тем данный препарат характеризуется наиболее высокой среди макролидов активностью в отношении стрептококков, в том числе S. pneumoniae и S. pyogenes, метициллинчувствительных штаммов S. aureus, превосходя таковую эритромицина в 2-4 раза. Кларитромицин также высокоактивен против атипичных возбудителей – хламидий, микоплазм, легионелл. Кларитромицин имеет наименьшие минимальные ингибирующие концентрации (МИК50-90) в отношении важнейших грамположительных кокков: пневмококков, в том числе с промежуточной чувствительностью к пенициллину, стафилококков, стрептококков группы А и В. Кларитромицин достаточно эффективно воздействует на большинство штаммов Moraxella (Branhamella) catarrhalis, причем как вырабатывающих, так и не вырабатывающих β-лактамазы [5, 7]. За счет синергизма с метаболитом 14-гидроксикларитромицином отмечается достаточная клиническая активность в отношении наиболее проблемного для макролидов патогена – H. influenzae [4, 5]. Наряду с азитромицином кларитромицин единственный в рассматриваемой группе обладает указанным свойством. При этом подавляющий эффект отмечается и в отношении штаммов указанного возбудителя, продуцирующих β-лактамазы [8]. Чрезвычайно высокой является активность кларитромицина в отношении атипичных бактерий. В частности, его МИК для хламидий в данной группе антибиотиков минимальна. Основное свойство кларитромицина – создание высоких внутриклеточных концентраций и широкий антибактериальный спектр воздействия на типичных и атипичных возбудителей респираторных заболеваний.
Основной эффект кларитромицина – бактериостатический, но при высоких концентрациях и низкой микробной плотности в отношении S. pyogenes и S. pneumoniae препарат оказывает бактерицидное действие. Быстрое создание высоких концентраций препарата в бактериальной клетке приводит к немедленной гибели клетки-мишени. При этом антимикробная активность в отношении данных возбудителей и метициллинчувствительных штаммов Staphylococcus aureus в 2-4 раза выше, чем у эритромицина [9].
У больных с респираторными инфекциями кларитромицин тормозит образование мокроты и улучшает ее реологические свойства. Он ингибирует выработку и высвобождение NО альвеолярными макрофагами, что может иметь значение для купирования воспаления дыхательных путей.
По данным российского многоцентрового исследования ПеГАС-1 – ПеГАС-2 (2004-2005), все макролиды (в том числе кларитромицин) сохраняют высокую активность в отношении S. рneumoniae, поэтому его применение в лечении больных НП оправданно.
Особенность лекарственной формы кларитромицина с замедленным высвобождением (Фромилид Уно) заключается в более медленном достижении пиковой концентрации в крови при более низком ее уровне [10].
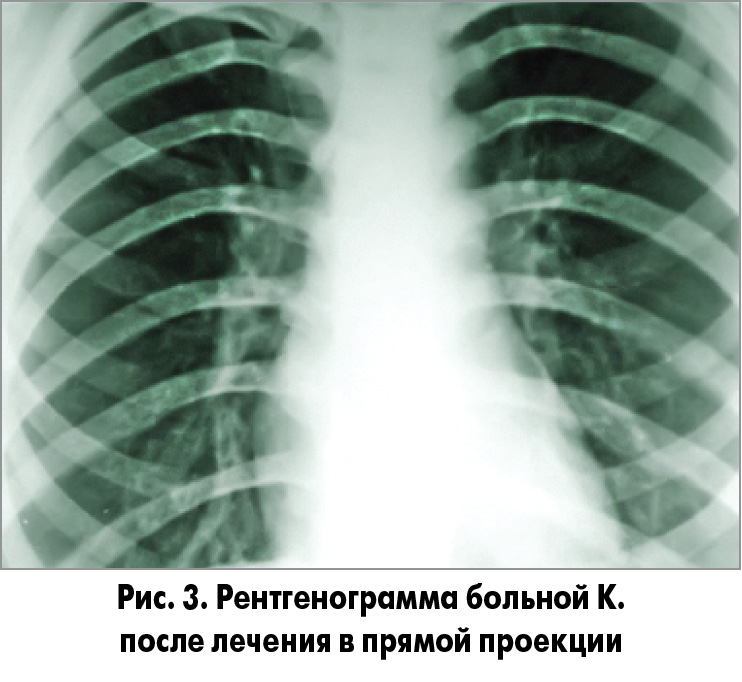
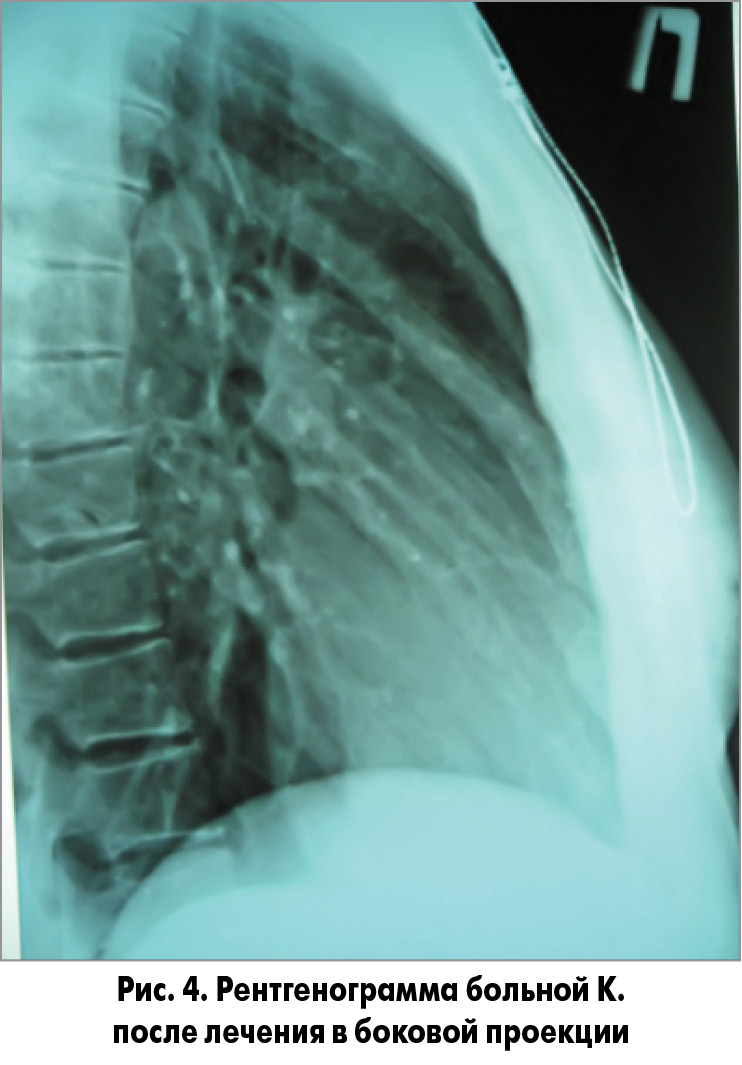
Исходя из вышеперечисленного пациентке К. были рекомендованы следующие препараты: Фромилид Уно 500 мг 1 таблетка в день 7 дней, амброксол 2 мл через небулайзер № 10, фенспирид 80 мг по 1 таблетке 3 р/день. Температура тела нормализовалась на 2-й день. К 5-6-му дню значительно уменьшился кашель, выделение мокроты практически прекратилось. При контрольном рентгенологическом исследовании определялось рассасывание пневмонии (рис. 3, 4).
Остаточные явления в виде кашля, наличие измененных физикальных данных (возможно, сухие хрипы), даже небольшой субфебрилитет не говорят об отсутствии эффекта от назначенного антибиотика и не являются показанием для продолжения антибактериальной терапии. Эти изменения могут быть обусловлены наличием воспаленной легочной ткани, но антибиотики не обладают противовоспалительными свойствами, дальнейшее их применение лишено смысла. Неэффективность антибактериальной терапии – это:
- сохранение или усиление лихорадки и клинической симптоматики спустя 72 часа;
- появление или сохранение нестабильности гемодинамики;
- развитие или усугубление дыхательной недостаточности;
- возникновение необходимости в искусственной вентиляции легких;
- отрицательная рентгенологическая динамика.
Таким образом, лечение больных НП необходимо осуществлять согласно международным и национальным стандартам. Стартовая антибиотикотерапия проводится эмпирически. У пациентов с НП легкого течения, относящихся к I группе и не нуждающихся в стационарном лечении, препаратом первого ряда является амоксициллин или макролид.
При подозрении на атипичную этиологию НП препаратами выбора выступают макролиды. Предпочтение отдается наиболее изученным при НП макролидам с улучшенными фармакокинетическими свойствами (азитромицин, кларитромицин) или благоприятным профилем безопасности и минимальной частотой лекарственных взаимодействий.
Кларитромицин наряду с аминопенициллинами и респираторными фторхинолонами обоснованно занял свою нишу в терапии больных НП. Кларитромицин – высокоэффективное и широко апробированное лекарственное средство. Антимикробный спектр этого макролида, включающий атипичную флору, S. pneumonia, H. influenzae, а также наличие новых пролонгированных форм определяют его востребованность в терапии данной категории пациентов. Кларитромицин является препаратом выбора при этиотропной терапии НП, вызванной С. рneumoniae, L. pneumophila и M. pneumoniae, а также в случае неэффективности стартовой терапии β-лактамами.
Наличие у кларитромицина дополнительных свойств (противовоспалительных, иммуномодулирующих, мукорегуляторных) на фоне его высокой антибактериальной активности обеспечивает быстрый регресс симптомов и улучшение состояния пациентов с НП при терапии данным препаратом.
Литература
- Ewig S. Community-acquired pneumonia. Epidemiology, risk, and prognosis // EurRespir Mon. 1997; 3: 13-35.
- Пневмонії у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія (Навчальний посібник). За ред. Ю. І. Фещенка. – 2013.
- Дейкс М., Перри К. // Рус. мед. журнал. – 2006. – Т. 14, № 17 (269). – С. 1264-1279.
- Козлов С.Н., Страчунский Л. С. Современная антимикробная химиотерапия. – М., 2009. – С. 106-119.
- Peters H.D., Clissold S. P. // Drugs. – 1992. – Vol. 44, № 1. – P. 117-164.
- Fraschini F., Scaglione F., Pintucci G. et al. // Journal of Antimicrob. Chemotherapy. – 1991. – Vol. 27, suppl. A. – P. 61-65.
- Arguedas A., Loaiza C., Rodriguez F. et al. // J. Chemother. – 1997. – Vol. 9, № 1. – P. 44-50.
- Langtry H.D., Brogden N. R. // Drugs. – 1997. – Vol. 53, № 6. – P. 973-1004.
- Sivapalasingam S., Steigbigel N. H. Macrolides, clindamycin, and ketolides. Pronciples & Practice of Infectious Diseases // Churchill Livingstone, 6th edition. 2004: 396-417.
- Guay D.R., Gustavson L. E., Devcich K. J. et al. Pharmacokinetics and tolerability of extended-release clarithromycin. Clin Ther 2001; 23: 566-577.
Медична газета «Здоров’я України 21 сторіччя» № 21 (418), листопад 2017 р.