1 грудня, 2017
Механизм действия гемостатических лекарственных препаратов
Продолжение. Начало в № 20.
Коагулянты
А. Коагулянты прямого действия
Фибриноген
Его применяют при гипо- и афибриногенемии, кровотечениях, возникших во время оперативных вмешательств, массивных кровотечениях в акушерстве и гинекологии. При воздействии тромбина на фибриноген происходит образование фибрина (конечного продукта процесса свертывания крови).
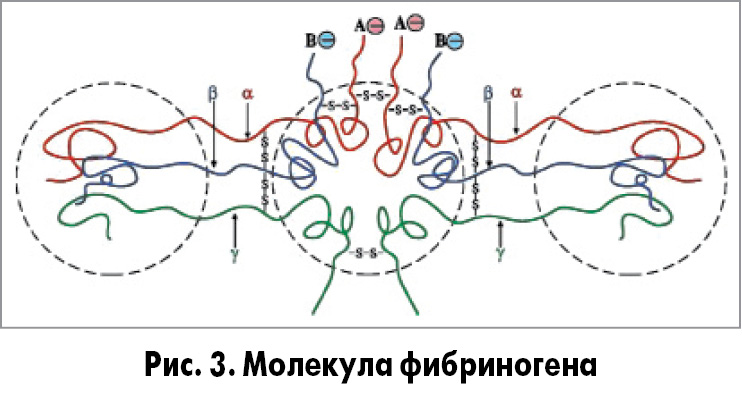
Механизм действия. Фибриноген (фактор I) состоит из трех пар неидентичных полипептидных цепей: Аα, Вβ и γ. Они соединены дисульфидными связями и образуют 3 домена, переплетенные между собой (рис. 3).
Тромбин (сериновая протеаза) отщепляет от фибриногена А- и В-пептиды, в результате чего образуется фибрин-мономер. Фибрин-мономер имеет участки, комплементарные другим молекулам фибрина, – центры связывания, между которыми образуются нековалентные связи. Это приводит к полимеризации молекул фибрина и формированию нерастворимого геля фибрина. Он непрочен из-за слабых нековалентных связей. Стабилизацию геля фибрина осуществляет фермент трансглутамидаза (фактор XIIIa).
Тромбин
Раствор тромбина применяется только местно для остановки кровотечений из мелких капилляров и паренхиматозных органов, из костной полости, десен, особенно при болезни Верльгофа, апластической и гипопластической анемии. При кровотечениях из крупных сосудов тромбин не применяется.
Механизм действия. Тромбин (фактор IIа) образуется в организме из протромбина (фактор II) при ферментативной активации тромбопластином (фактор III, протромбиназа). Лекарственный препарат тромбин, связываясь с фибриногеном, переводит его в нерастворимый фибрин.
Тромбин – гетеродимер, состоящий из А-цепи (36 аминокислот) и В-цепи (259 аминокислот), соединенных дисульфидной связью. Этот белок имеет важные структурные особенности: активная область расщепления (60- и γ-петли), центр, связывающий натрий, экзосайт I и экзосайт II. Экзосайт I расположен на В-цепи и участвует в связывании фибриногена [15].
Концентрат протромбинового комплекса
Концентрат протромбинового комплекса (КПК) используется для быстрой инактивации антагонистов витамина К. В практике используются 3 различных типа КПК: 4-факторный (4F), 3-факторный (3F) и активированный КПК. Функциональными прокоагулянтными компонентами в 4F-КПК являются витамин К-зависимые коагуляционные факторы II, VII, IX и X.
3F-КПК, в отличие от 4F-КПК, не содержит фактор VII.
Активированный КПК содержит протромбин (фактор II), факторы IX и Х (как 3F-КПК, 4F-КПК), но дополнительно в его состав входит фактор VII в активированной форме (VIIa).
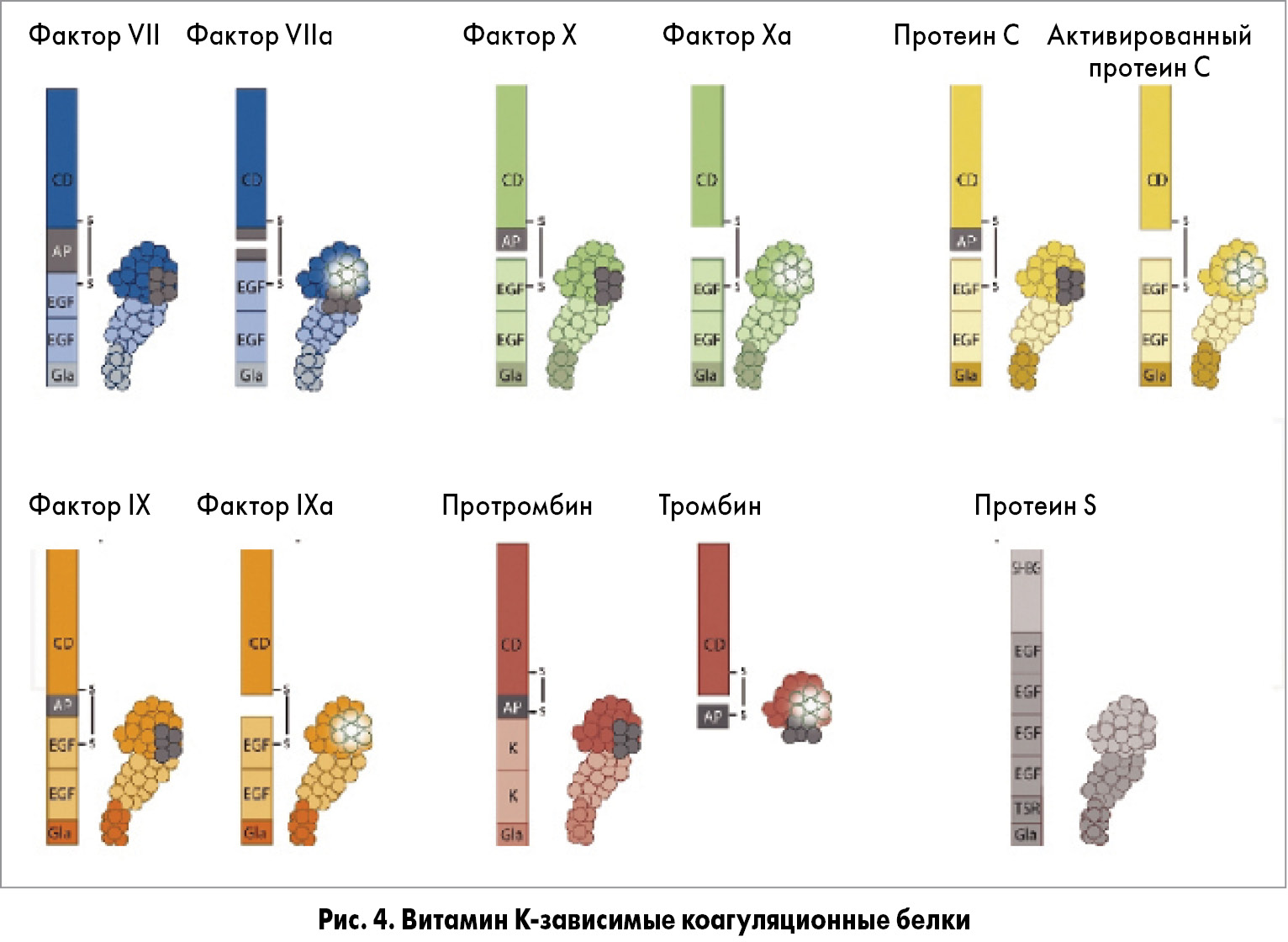
Витамин К-зависимые факторы прокоагуляции (VII, IX, X, протромбин) и витамин К-зависимые антикоагулянтные белки (C и S) изображены как полосы, которые иллюстрируют их различные домены и глобулярные структуры, основанные на современных знаниях их трехмерной конфигурации [16,17] (рис. 4).
4F-КПК применяется при острых кровотечениях и в терапии у пациентов с врожденным или приобретенным дефицитом факторов свертывания [18]. 3F-КПК одобрен для применения во многих странах для лечения гемофилии В. Клинические исследования показывают, что 3F-КПК может также применяться у пациентов с приобретенной недостаточностью факторов протромбинового комплекса, вызванного приемом антагонистов витамина К, хотя и с менее благоприятным результатом, чем 4F-КПК [19-22]. Эффективность активированного КПК была продемонстрирована в нескольких клинических исследованиях [23].
В данном контексте следует отметить концентрат рекомбинантного активированного фактора VII (VIIa). Первоначально он был разработан для лечения кровотечения у пациентов с гемофилией, у которых продуцировались антитела к фактору VIII. В дальнейшем препарат использовали для предотвращения кровотечений, связанных с кардиоваскулярными хирургическими вмешательствами, травмами и внутричерепными кровоизлияниями [24]. В некоторых исследованиях подтвержден положительный эффект концентрата фактора VIIа при лечении витамин К-зависимых кровотечений [25-28]. В одной из недавних публикаций представлены данные об успешном использовании рекомбинантного фактора VIIa и 3F-КПК в лечении внутричерепного кровоизлияния [29]. Оно заключается в доставке необходимого количества уже активированного фактора VIIa к месту повреждения сосуда.
КПК представляют собой смесь частично очищенных витамин К-зависимых коагуляционных факторов. Их получают из плазмы крови человека и затем лиофилизируют. Содержание КПК, указанное на упаковке лекарственных препаратов 3F-КПК и 4F-КПК, определяется содержанием фактора IX в международных единицах активности (IU) на 1 мг белка согласно рекомендациям Европейской фармакопеи.
Активность активированного КПК выражается в произвольных единицах. Прием некоторых КПК, доступных до середины 90-х годов прошлого века, был ассоциирован с повышенным риском тромбоза [30]. Данные, опубликованные C. Grundman и соавт. [31], подтверждают, что перегрузка протромбином вызывает дисбаланс факторов свертывания и является основным тромбогенным триггером при терапии КПК. В соотвествии с этим баланс уровней коагуляционных факторов может оказывать существенное влияние на безопасность терапии КПК [32]. Относительное количество всех прокоагулянтных витамин К-зависимых факторов свертывания в КПК и плазме практически идентично. Это относится и к протеину С. Однако для белка S их уровни значительно ниже, чем в плазме. Протромбин является наиболее распространенным К-зависимым коагуляционным фактором, в то время как фактор VII присутствует только в следовых количествах как в плазме, так и в 4F-КПК.
Согласно рекомендациям Европейского общества анестезиологов (ESA, 2013) для быстрого ингибирования эффекта пероральных антикоагулянтов перед операцией предлагается использовать КПК (уровень доказательства А) (табл.).
Было показано, что 3F- и 4F-КПК более эффективно, чем рекомбинантный фактор VIIa и свежезамороженная плазма, воздействуют на образование тромбина и уменьшение кровопотери при хирургических вмешательствах и травме независимо от того, применялся ли перед этим варфарин [33, 34].
Б. Коагулянты непрямого действия
Викасол. Фитоменадион
Их применяют при геморрагическом синдроме, связанном с гипопротромбинемией, кровотечениях после ранений, травм и хирургических вмешательств, в составе комплексной терапии дисфункциональных маточных кровотечений, меноррагий.
Механизм действия. Эти лекарственные препараты представляют собой синтетические аналоги витамина К, а их фармакологическое действие обусловлено характерными для него свойствами.
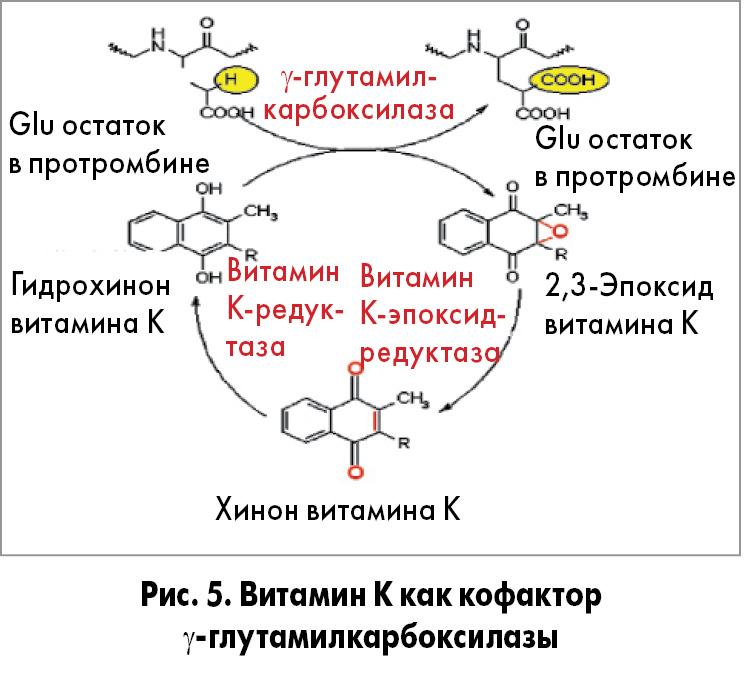
Витамин К присутствует в организме в виде гидрохинона, эпоксида и хинона, постоянно преобразующихся друг в друга. Метаболическая роль витамина К заключается в том, что он является кофактором γ-глутамилкарбоксилазы. Этот фермент осуществляет посттрансляционную модификацию белка, катализируя карбоксилирование глутаминовых остатков (Glu) в белках в γ-карбоксиглутаминовые (Gla) в присутствии О2 и НСО3/СО2. Активным кофактором для γ-глутамилкарбоксилазы является восстановленная форма витамина К – гидрохинон. В процессе карбоксилирования витамин К-зависимых белков гидрохинон преобразуется в эпоксид [35,36] (рис. 5).
При карбоксилировании остатка глутаминовой кислоты в различных белках последние приобретают способность связывать ионы кальция. Так происходит активирование протромбина, факторов свертывания VII, IX и X.
Протамина сульфат
Протамина сульфат применяют для нейтрализации действия избыточного экзогенного гепарина, кровотечениях вследствие передозировки гепарина, перед операцией у больных, принимающих гепарин с лечебной целью, после операций на сердце и кровеносных сосудах с экстракорпоральным кровообращением.
Механизм действия. Протамина сульфат – специфический антагонист гепарина (1 мг протамина сульфата нейтрализует 80-120 ЕД гепарина в крови). Протамина сульфат (основание), связываясь с гепарином (кислотой), образует стабильное соединение и вызывает разрушение комплекса гепарина с антитромбином III, что приводит к снижению антикоагулянтной активности гепарина. Эффект протамина сульфата наблюдается уже через несколько минут после введения. Комплексообразование обусловлено обилием катионных групп (за счет аргинина), которые связываются с анионными центрами гепарина.
Гемостатические средства на основе желатина, коллагена, целлюлозы
Желатиновая губка
Первый желатиновый гемостатик был использован в 1945 г. С 1999 г. используются гемостатики в виде пасты из матричных желатиновых компонентов, полученных из говяжьего или свиного сырья с добавлением CaCl2 и человеческого или животного тромбина. Локальный гемостатический эффект основан на активации тромбоцитов, попадающих в поры губки, формировании на ее поверхности тромбоцитарного агрегата и образовании фибринового сгустка. Данные средства применяют при капиллярных, паренхиматозных и венозных кровотечениях в стоматологии, малой проктологии, абдоминальной хирургии, отоларингологии и гинекологии. Желатиновые гемостатики подтвердили свою эффективность при сложных кровотечениях, возникающих при резекциях почек, селезенки, печени [38]. Они обеспечивают немедленный и продолжительный гемостаз без необходимости лигирования [39], существенно усиливают гемостаз в паренхиме и уменьшают вероятность возникновения послеоперационных геморрагических осложнений.
Коллагеновая губка
В 1970 г. М. Hait [40] впервые применила коллаген в качестве гемостатического агента. Коллаген является структурным белком. При кровотечении он быстро вступает во взаимодействие с тромбоцитами в субэндотелии, что приводит к активации их адгезивно-агрегационных свойств [41]. Данный механизм используется при применении коллагена в качестве местного гемостатика. Кроме того, при использовании коллагеновой губки гемостаз происходит еще и за счет гигроскопического эффекта. Коллагеновые губки применяют с целью достижения гемостаза при кровотечении из паренхиматозных органов (печени, селезенки, поджелудочной и щитовидной желез, почек, легких). Могут рекомендаваться как профилактическая мера в случае образования лимфатических, желчных и жидкостных фистул.
Окисленная целлюлоза
Впервые окисленная целлюлоза в качестве гемостатического агента была использована в 1942 г. V. Frantz [42]. Ее активное применение в клинической практике началось с 60-х гг. прошлого столетия [43]. Материал из окисленной регенерированной целлюлозы при контакте с кровью создает кислую среду (рН=2,5-3,0), усиливающую гемостаз благодаря впитывающей способности оксицеллюлозы. В кислой среде собственные тромбоциты и разрушившиеся эритроциты, выделившие кислый гематин, служат каркасом для образования тромбоцитарного сгустка.
Ингибиторы фибринолиза
Ингибиторы протеиназ плазмы
Апротинин
Апротинин – природный ингибитор протеолитических ферментов, получаемый из легких крупного рогатого скота, тучные клетки которых содержат повышенное его количество. Активность белка измеряется в антитрипсиновых (АтЕ) или калликреиновых ингибирующих единицах (КИЕ, 1 АтЕ соответствует 1,33 КИЕ). Апротинин обратимо взаимодействует с разнообразными протеазами плазмы крови и тканей, формируя стехиометрические комплексы.
Апротинин был открыт в 1930 г. исследовательской группой Мюнхенского университета, выделившей ингибитор калликреина из бычьей ткани и поджелудочной железы коровы. В 1936 г. Куниц и Нортрап выделили ингибитор трипсина из бычьей поджелудочной железы. В 1959 г. ингибитор бычьего трипсина начал применяться в Германии в терапии больных панкреатитом. В конце 1960-х гг. было установлено, что ингибитор калликреина и ингибитор трипсина (апротинин) – идентичны. Учитывая тот факт, что калликреин является воспалительным медиатором, были разработаны протоколы для оценки способности апротинина уменьшать воспаление легких, спровоцированного сердечно-легочным шунтированием.
Результаты исследования, опубликованного в 1987 г., продемонстрировали очевидное снижение риска геморрагий у пациентов, перенесших повторную операцию на открытом сердце, которым был назначен апротинин в высокой дозировке [44].
Дальнейшее изучение показало, что апротинин ингибирует плазмин и поддерживает гомеостаз гликопротеинов тромбоцитов. Апротинин назначался прежде всего пациентам с наиболее высоким риском периоперационного кровотечения вследствие повторного шунта коронарной артерии, больным, по разным причинам не прошедшим процедуру переливания крови, и адептам религиозной организации «Свидетели Иеговы».
Механизм действия. Апротинин – полипептид, состоящий из 58 аминокислот и имеющий молекулярную массу 6512 дальтон.
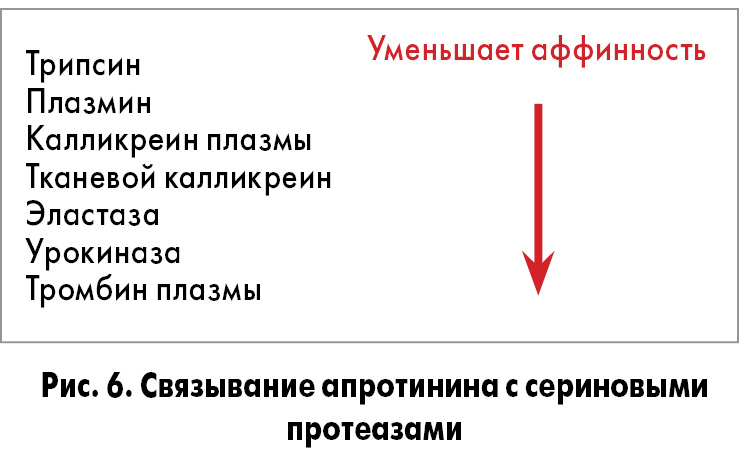
Апротинин ингибирует сериновые протеиназы человека в широком диапазоне концентраций (рис. 6).
Апротинин связывается с трипсином, плазмином и калликреином легче и в гораздо более низких концентрациях, чем с урокиназой или тромбином. Константа ингибирования (Ki) приблизительно в 500 млн раз выше для тромбина [45]. При этом апротинин снижает фибринолитическую активность крови, тормозит фибринолиз и оказывает гемостатическое действие при коагулопатиях.
Ингибиторы плазмина
ε-Аминокапроновая кислота
Аминокапроновую кислоту применяют для остановки и профилактики кровотечений, обусловленных повышенной фибринолитической активностью крови, гипо- и афибриногенемиями. Ее назначают при оперативных вмешательствах на органах, богатых активаторами фибринолиза (легкие, мозг, матка, предстательная, щитовидная и поджелудочная железы, надпочечники), после операций на сердце и сосудах, при экстракорпоральном кровообращении, ожоговой болезни, преждевременной отслойке плаценты, осложненном аборте, маточных кровотечениях, операциях в области уха, горла, носа, носовых кровотечениях, заболеваниях внутренних органов с геморрагическим синдромом (желудочно-кишечные кровотечения, кровотечения из мочевого пузыря и др.). Аминокапроновую кислоту применяют также для предупреждения вторичной гипофибриногенемии при массивных переливаниях консервированной крови.
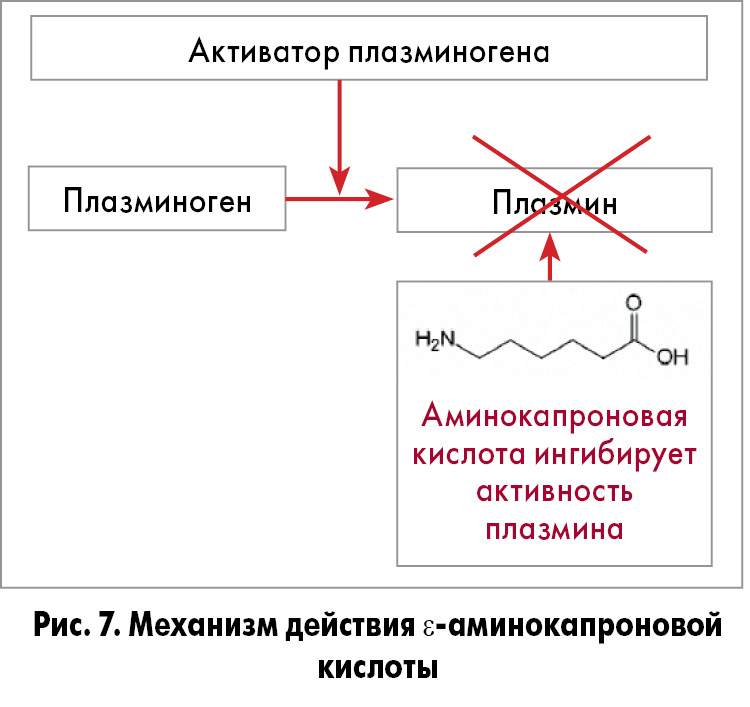
Механизм действия. ε-Аминокапроновая кислота – синтетическое производное лизина. С 60-х гг. XX века исследователи сфокусировали свое внимание на ее терапевтических свойствах как кровоостанавливающего средства [46, 47]. ε-Аминокапроновая кислота – один из антифибринолитических агентов, она ингибирует протеолитическую активность плазмина и превращение плазминогена в плазмин [48] (рис. 7).
Кроме того, ε-аминокапроновая кислота:
- тормозит активирующее действие стрептокиназы, урокиназы и тканевых киназ на фибринолиз;
- нейтрализует эффекты калликреина, трипсина и гиалуронидазы;
- уменьшает проницаемость капилляров;
- стимулирует образование тромбоцитов;
- сенсибилизирует тромбоцитарные рецепторы к тромбину, тромбоксану А2 и другим эндогенным агрегантам.
Транексамовая кислота
Транексамовая кислота – гемостатический препарат, ингибитор фибринолиза. Специфически подавляет активацию плазминогена и его превращение в плазмин. Обладает местным и системным гемостатическим эффектом при кровотечениях, вызванных повышенной активностью фибринолиза.
Показания к применению транексамовой кислоты – профилактика и лечение кровотечений вследствие повышения общего (злокачественные новообразования поджелудочной или предстательной железы, операции на органах грудной клетки, послеродовые кровотечения, ручное отделение плаценты, лейкоз, заболевания печени) и местного (маточные, носовые, желудочно-кишечные кровотечения, гематурия, кровотечения после простатэктомии) фибринолиза.
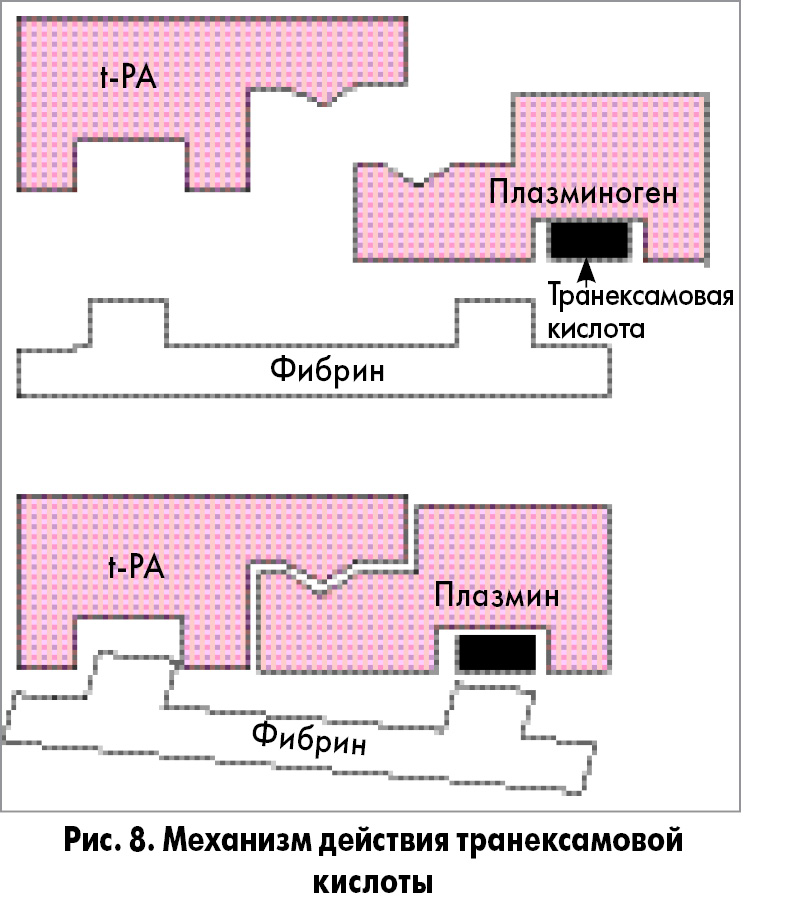
Механизм действия. Транексамовая кислота – синтетическое производное лизина. Ее антифибринолитическое действие заключается в обратимом блокировании участков связывания лизина на молекуле плазминогена, что приводит к предотвращению деградации фибрина. Транексамовая кислота блокирует тканевой активатор плазминогена (t-PA) и его превращение в фибринолизин (плазмин), а также препятствует соединению плазмина и t-PA с фибрином. Вследствие этого происходит подавление деградации фибрина плазмином (рис. 8).
Помимо антифибринолитического действия транексамовая кислота нормализует функцию тромбоцитов и проницаемость капилляров.
В результате кровотечения нарушаются метаболические процессы, работа сердца и функционирование жизненно важных органов (мозг, печень, почки), а состояние пострадавшего стремительно ухудшается. В этой связи использование доступных средств для остановки кровотечения и информация о появлении новых перспективных гемостатиков позволят врачам различных специальностей эффективно бороться с таким жизнеугрожающим состоянием, как кровопотеря.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 21 (418), листопад 2017 р.