16 грудня, 2017
Світова гастроентерологія: що нового у 2017 році?

За матеріалами 25-го Об’єднаного європейського гастроентерологічного тижня
З 28 жовтня по 1 листопада 2017 р. в м. Барселона (Королівство Іспанія) на базі виставкового центру Fira Gran Via проходив 25-й Об’єднаний європейський гастроентерологічний тиждень (UEGW-2017), який вже чверть століття щороку проводить Об’єднана європейська гастроентерологічна асоціація (United European Gastroenterology, UEG). Участь у цій знаковій для всіх гастроентерологів події беруть науковці та лікарі не тільки з Європи, а майже з усіх країн світу. З кожним роком кількість учасників цього масштабного науково-практичного форуму лише збільшується, адже він є унікальною платформою для обміну досвідом та отримання новітньої інформації про останні досягнення сучасної гастроентерології.
Під час численних паралельних сесій, пленарних засідань і симпозіумів провідні вчені Європи та світу висвітлили підходи до вирішення нагальних клінічних проблем, що стосуються профілактики, діагностики та лікування патології усіх відділів травної системи, а також ознайомили учасників форуму з досягненнями експериментальної гастроентерології. Пропонуємо увазі читачів короткий огляд деяких цікавих симпозіумів з найбільш актуальних питань сучасної клінічної гастроентерології.
Захворювання, асоційовані з Нelicobacter pylori: нове у діагностиці та лікуванні
Результати експериментальних і клінічних досліджень, присвячених інфекції Helicobacter pylori (Hp), а також практичні рекомендації щодо обстеження та лікування хворих з Нр-асоційованою патологією, як завжди, становили вагому частину наукової програми Об’єднаного європейського гастроентерологічного тижня. Зокрема, професор Тамара Матсяк-Будник з університетського госпіталю м. Нант (Франція) у доповіді «Helicobacter pylori: кому і як проводити тестування?» розповіла про оновлені показання до ерадикації Нр, а також про переваги та недоліки наявних тестів для виявлення хелікобактерної інфекції. Останні традиційно поділяються на інвазивні (гістологічне та бактеріологічне дослідження, швидкий уреазний тест, полімеразна ланцюгова реакція – ПЛР) та неінвазивні тести (13С-сечовинний дихальний тест, серологічні тести та визначення фекального антигену Нр).
Професор Т. Матсяк-Будник наголосила на доцільності такого порядку пріоритетного використання різних методів діагностики Нр-інфекції:
- для первинної діагностики: гістологічне дослідження, бактеріологічне дослідження, швидкий уреазний тест, ПЛР, серологічне дослідження;
- для контролю ерадикації: 13С-сечовинний дихальний тест або (якщо немає можливості його виконання) визначення фекального антигену Нр;
- для масового скринінгу: серологічне дослідження.
У доповіді аргументовано пріоритетне застосування ПЛР для первинної інвазивної діагностики, зважаючи на можливість одночасного виявлення резистентності Нр до макролідів.
Серологічне дослідження є єдиним тестом, на результати якого не впливають локальні зміни у шлунку (прийом антибіотиків та інгібіторів протонної помпи (ІПП), атрофія слизової оболонки, кровотеча, наявність MALT-лімфоми тощо); частина наявних діагностичних наборів має надзвичайно високу точність, яка наближається до 100%. Недоліком серологічних тестів є неможливість їх застосування для контролю ерадикації Нр. Пріоритетним методом контролю ефективності антихелікобактерної терапії залишається 13С-сечовинний дихальний тест. Припинення прийому антибіотиків за 4 тижні та антисекреторних препаратів за 2 тижні до його виконання є обов’язковими умовами для забезпечення належної точності дослідження.
Відомий фахівець у галузі гастроентерології, постійний експерт робочих груп з Нр-асоційованих захворювань, професор Францис Мегро (Francis Megraud), який очолює французький експертний центр з вивчення Нр у м. Бордо (Франція), у повідомленні «Оптимальне лікування при Helicobacter pylori у 2017 році» представив нові тенденції в антихелікобактерній терапії. Найскладнішими проблемами, які значно впливають на ефективність ерадикації, професор Мегро назвав резистентність Нр до макролідів і фторхінолонів, високу кислотність шлункового вмісту, високий рівень колонізації слизової оболонки Нр, інфікування cagA-негативними штамами, внутрішньоклітинну бактеріальну інвазію та порушення з боку імунної системи. Доповідач також докладно розповів про вплив антихелікобактерної терапії на мікробіом різних відділів травної системи залежно від класу використовуваних антибактеріальних препаратів. Найчастіше зміни мікробіому є нестійкими; відновлення його початкової композиції спостерігається протягом 4-5 тижнів після припинення застосування протимікробних засобів.
На думку професора Мегро, найкращі терапевтичні підходи, спрямовані на ерадикацію Нр, мають враховувати місце та час їх застосування, поширення інфекції та резистентність Нр до протимікробних препаратів, а також індивідуальні особливості пацієнта. Для оптимізації потрійної терапії рекомендується переважне використання подвійних доз ІПП, які не залежать від генетичного поліморфізму CYP2C19 (рабепразолу та езомепразолу), а також застосування амоксициліну по 1 г тричі на добу. Доповідач підкреслив, що потрійну терапію можна призначати лише при поширеності резистентності до кларитроміцину нижче 15% або за результатами індивідуального тесту із підтвердженням чутливості Нр до цього антибіотика. Він також зазначив, що Нр внесений Всесвітньою організацією охорони здоров’я до списку пріоритетних патогенів, щодо яких існує висока потреба у розробленні нових антибактеріальних препаратів.
Дієта у комплексному лікуванні синдрому подразненого кишечника
Цьому важливому з практичної точки зору питанню була присвячена доповідь доктора Івонне Маккензі (Ivonne McKenzie; Королівський госпіталь, Лондон, Великобританія). Вона підкреслила, що синдром подразненого кишечника (СПК) є дуже поширеною функціональною патологією, яка спостерігається у кожного п’ятого дорослого мешканця Великобританії. При цьому саме дотримання дієтичних рекомендацій належить до першої лінії лікування СПК. Водночас для забезпечення високої ефективності бажаним є надання таких рекомендацій досвідченим фахівцем.
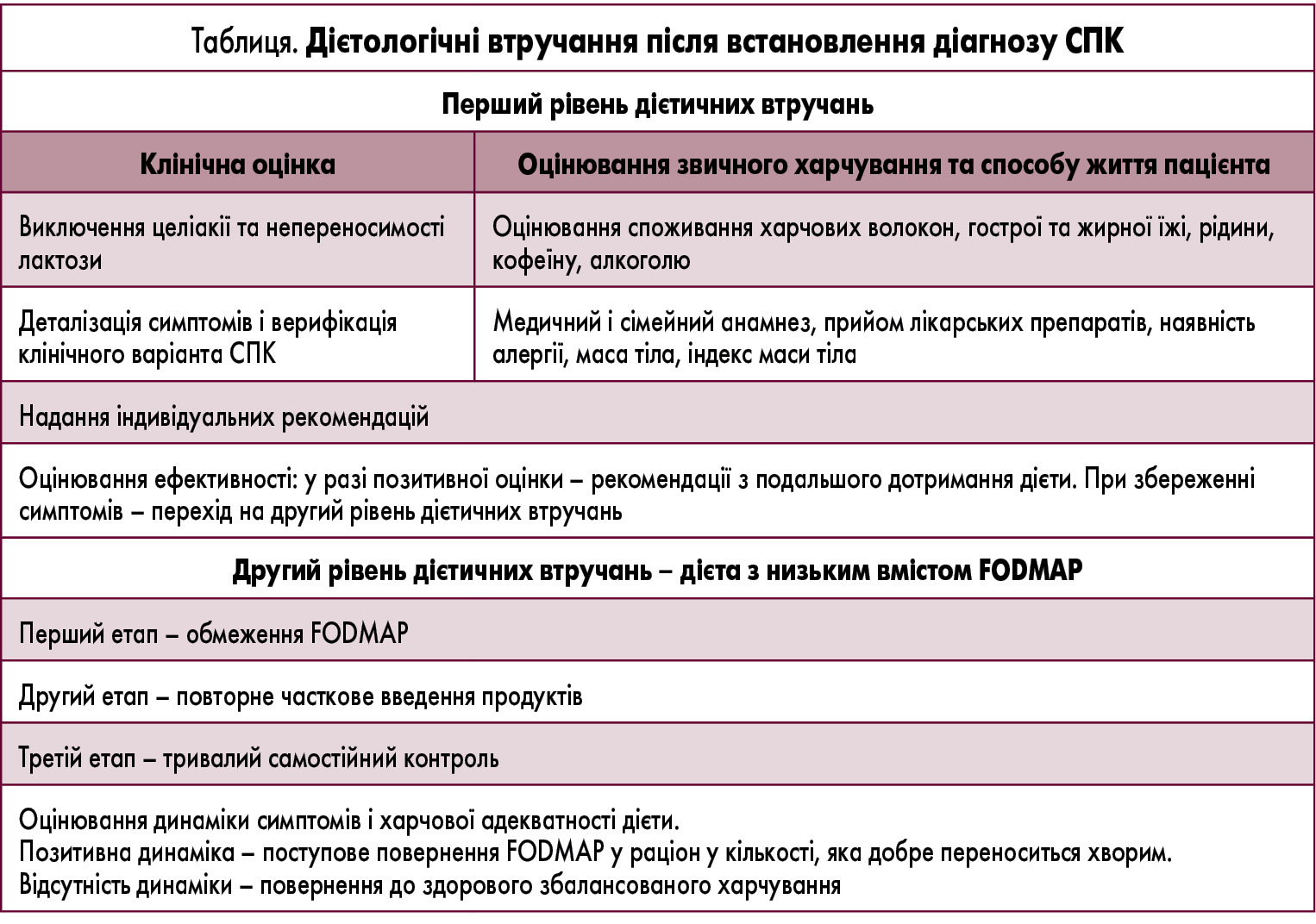
В основу клінічних рекомендацій з цього питання, затверджених у 2015 р. Національним інститутом охорони здоров’я та вдосконалення медичної допомоги (National Institute of Clinical Excellence, NICE) Великобританії, були покладені результати досліджень з оцінювання впливу на перебіг СПК великої кількості аліментарних факторів, зокрема таких, як споживання алкоголю та кофеїну, жирної та гострої їжі, харчові звички й особливості вживання рідини, споживання молочних продуктів і глютену, ферментованих вуглеводів, пробіотиків, дотримання елімінаційних дієт і наявність харчової непереносимості. На підставі цих клінічних рекомендацій NICE Британська дієтологічна асоціація розробила алгоритм дієтологічного ведення пацієнта з СПК, який включає два рівні втручань після встановлення діагнозу СПК (табл.).
На другому рівні дієтичних вручань пацієнту рекомендують дотримуватися дієти із низьким вмістом фруктантів, оліго-, ди- та моносахаридів і поліолів, що ферментуються (fermentable oligosaccharides, disaccharides, monosaccharides and polyols – FODMAP), та пояснюють її принципи.
У контексті корекції збалансованої дієти у хворих із СПК доктор Маккензі навела докази ефективності обмеження алкоголю, гострої їжі та неефективності елімінаційних дієт. Щодо споживання пацієнтами з СПК молочних продуктів, то є можливість отримати потенційну користь від дотримання низьколактозної дієти. Не рекомендується додаткове вживання пшеничних висівок, у той час як споживання двох столових ложок насіння льону, навпаки, покращує консистенцію фекалій у пацієнтів із СПК з переважанням закрепів.
Харчова непереносимість: як діагностувати й обрати тактику ведення?
Цьому вкрай актуальному питанню сучасної гастроентерології було присвячене окреме секційне засідання. Темою першої доповіді, яку представив Александр Р. Москен (Alexander R. Moscen) з Австрії, стала проблема харчової алергії (ХА), розповсюдженість якої зростає в усьому світі. Зокрема розповсюдженість імуноглобулін (Ig) E-асоційованих алергічних реакцій у дітей становить 3-8%, а у дорослих – 1-3%; при цьому 1/3 дорослої популяції США вважає, що має ХА, а 40-60% батьків впевнені в тому, що ХА мають їх діти. Встановлено, що більше ніж 170 харчових продуктів можуть викликати розвиток IgE-асоційованої алергії; при цьому найчастіше алергенами є молоко, яйця, пшениця, арахіс, горіхи, кунжут, риба, фрукти й овочі. До індукованих харчовими продуктами алергічних захворювань належать IgE-залежні порушення (кропив’янка/ангіоневротичний набряк, синдром оральної алергії/гастроінтестинальна гіперчутливість негайного типу, риніт/астма, анафілаксія), клітинно-опосередковані реакції (алергічний контактний дерматит), поєднання IgE-залежних порушень і клітинно-опосередкованих реакцій (атопічний дерматит, еозинофільна гастроентеропатія), не-IgE-опосередковані порушення (ентероколіт і проктоколіт, індукований харчовими білками, целіакія, синдром Хейнера). Всі небажані реакції на харчові продукти розподіляються на токсичні та нетоксичні. Нетоксичні реакції можуть бути неімунно-опосередкованими (ферментативними (наприклад, непереносимість лактози) та фармакологічними (наприклад, зумовленими вазоактивними амінами, метилксантином, капсаїцином, етанолом)) та імунно-опосередкованими.
Слід розрізняти поняття «харчова алергія» та «харчова непереносимість». Під ХА розуміють несприятливий для здоров’я ефект, що виникає в результаті специфічної імунної відповіді та відтворюється при вживанні певної їжі. Харчова непереносимість – це неімунні реакції, що включають метаболічні, токсичні, фармакологічні та невизначені механізми. Перед початком лікування слід обов’язково з’ясувати, що саме має місце у пацієнта – ХА чи харчова непереносимість. Встановлення діагнозу ХА у пацієнтів гастроентерологічного профілю може бути утруднене в тих випадках, коли симптоми обмежені тільки шлунково-кишковим трактом (ШКТ). Харчова непереносимість у пацієнтів гастроентерологічного профілю потребує диференційної діагностики з великою кількістю захворювань. При встановленні цього діагнозу велику увагу слід приділяти збору анамнезу для виділення харчових алергенів із багатьох інших несприятливих харчових реакцій. Для діагностики використовуються шкірні тести (прик-тести), дослідження in vitro й інші тести (визначення загального IgE, «клітинні» тести: тест активації базофілів, пряма активація базофілів, пасивна активація базофілів), ендоскопічні провокаційні тести (інтрагастральна провокація під ендоскопічним контролем, колоноскопічний провокаційний алергенний тест).
А. Москен детально висвітлив недоліки та переваги використання цих методів діагностики. Він, зокрема, навів результати дослідження B. Lobo та співавт. (2017), присвяченого ролі тучних клітин у несприятливих харчових реакціях. На сьогодні роль тучних клітин при функціональних гастроінтестинальних розладах залишається неясною. У деяких роботах було показано, що тучні клітини здатні зменшувати вираженість симптомів СПК. Метою зазначеного дослідження було оцінювання ефективності прийому стабілізатора тучних клітин – динатрію кромоглікату (DSCG) на активацію тучних клітин у порожній кишці та вроджені імунні сигнали у пацієнтів із СПК. Виконували біопсію порожньої кишки та оцінювали клінічні параметри (абдомінальний біль, частота дефекації та консистенція калу). Пацієнти були розподілені на три групи: 1-а група – 16 здорових осіб, 2-а група – 18 пацієнтів із СПК з переважанням діареї, які приймали DSCG у дозі 600 мг/добу протягом 6 міс, 3-я група – контрольна – 25 пацієнтів з СПК із переважанням діареї. У пацієнтів 2-ї групи відзначалося зменшення тяжкості абдомінального болю на >50% порівняно з таким у контрольній групі (р=0,002) та зменшення частоти дефекацій на >50% порівняно з контрольною групою (р<0,001). Консистенція калу нормалізувалася у 70% пацієнтів 2-ї та у 20% – контрольної групи (р<0,001).
Завершуючи виступ, доповідач підкреслив, що харчова непереносимість зустрічається набагато частіше, ніж ХА. У нещодавніх дослідження висунуто припущення щодо причетності до виникнення цих захворювань вроджених імунних механізмів, а подальші дослідження покликані поліпшити розуміння механізмів, що лежать в їх основі. Також необхідно розробити біомаркери, які можна використовувати в рутинній практиці. Це може призвести до створення нових методів лікування.
Друга доповідь, представлена Пітером Р. Гібсоном (Peter R. Gibson) з Австралії, була присвячена непереносимості вуглеводів. Розповсюдженість непереносимості вуглеводів у популяції сягає більше 10%; найчастіше вона проявляється непереносимістю коротколанцюгових вуглеводів (FODMAP), але не обмежується нею. Доповідач нагадав про методи діагностики непереносимості вуглеводів, приділивши увагу недолікам і перевагам дихальних тестів. Лікування пацієнтів з такою патологією полягає в обмеженні вуглеводів у харчуванні – рекомендуються специфічні обмеження (при лактазній недостатності – дієта з низьким умістом лактози) та дієта з низьким вмістом FODMAP, яку призначають у 3 фази. У 1-й фазі слід уникати вживання всіх продуктів із високим вмістом FODMAP, замінюючи їх продуктами з низьким умістом FODMAP. Ефективність оцінюється через 4-6 тижнів. За відсутності ефекту або незадовільної прихильності до такої терапії рекомендується припинити дієту. У 2-й фазі у разі наявності позитивного ефекту застосовується стратегія step down відповідно до переносимості, у 3-й фазі – підтримання модифікованої дієти.
Проводились рандомізовані клінічні дослідження (РКД), у яких порівнювали ефективність дієти із низьким умістом FODMAP та інших дієт: «типової австралійської FODMAP-дієти» (Австралія), дієти з високим умістом FODMAP (Канада), «плацебо-дієти» (Великобританія), звичного харчування (Великобританія), модифікованої NICE-дієти (США). Ефективність дієти з низьким умістом FODMAP була вищою за результатами всіх проведених РКД. Оцінювання довгострокової ефективності дієти з низьким умістом FODMAP проводиться за таким алгоритмом: елімінаційна фаза – фаза повторного введення з оглядом на переносимість – дотримання адаптованої або модифікованої FODMAP-дієти (Tuck, Barrett, 2017).
До ризиків дієти з низьким умістом FODMAP належать: поява харчових розладів (наприклад, нав’язлива ідея здорового харчування – нервова орторексія), неадекватне надходження нутрієнтів – кальцію та волокон (найбільший ризик), дія на мікробіом кишечника (відносне зменшення кількості Bifidobacteria, що корегується за допомогою пробіотиків; Staudacher et al., 2017), втрата пребіотичних ефектів FODMAP (але не на етапі підтримуючої фази; Harvie et al., 2017), підсилення ферментації білка (не тоді, коли підтримується вживання волокон). Необхідно враховувати ці ризики при лікуванні пацієнтів.
Третю доповідь секції на тему «Чутливість до пшениці без целіакії» представив професор Умберто Вольта (Umberto Volta) з Італії. Він зазначив, що вживання 15-30 г на добу пшениці з середнім вмістом клейковини зумовило значне збільшення випадків порушень, пов’язаних із непереносимістю глютену й інших компонентів пшениці. Споживання продуктів з нових сортів пшениці, що вирощуються з використанням пестицидів і добрив у промислових масштабах, відіграє провідну роль у появі несприятливих імунологічних реакцій на глютен та пшеницю. Додавання клейковини до тіста прискорює процес виготовлення хліба та водночас призводить до підвищення вмісту токсичних пептидів глютену в продуктах.
До глютенасоційованих порушень сьогодні належать целіакія, герпетиформний дерматит, глютенова атаксія; IgE- та не-IgE-залежна алергія на пшеницю; чутливість до пшениці без целіакії (глютенова чутливість без целіакції), для якої характерні несприятливі реакції на глютен та інші компоненти пшениці, негативні результати серологічних і гістологічних досліджень на целіакію, негативний прик-тест і наявність специфічного IgE до глютену, гастроінтестинальні (СПК-подібні) й екстраінтестинальні симптоми, поліпшення стану на фоні дотримання безглютенової/безпшеничної дієти та повторна поява симптомів при відновленні вживання продуктів, що містять глютен (4-а Консенсусна конференція із глютенасоційованих захворювань, Мерано, 2016). Потенційними тригерами чутливості до глютену/пшениці без целіакії є глютен (міститься в ендоспермі зерна), лектини пшениці (містяться в ендоспермі та зародку зерна), фруктанти (FODMAP – містяться в оболонці зерна; Volta, De Giorgio, 2017). Вроджені імунні механізми відіграють важливішу роль у підвищеній чутливості до глютену/пшениці без целіакії, ніж адаптивні механізми. При чутливості до глютену/пшениці без целіакії відбувається підвищення тонкокишкової проникності. Глютен-індуковані симптоми при СПК з діареєю асоційовані з підвищенням активності кінази легких ланцюгів міозину й експресією клаудину-15. Епідеміологія чутливості до глютену/пшениці без целіакії на сьогодні залишається невизначеною, дані про її розповсюдженість досить варіабельні (0,6-6%). Перехресний синдром між глютеновою чутливістю/чутливістю до пшениці без целіакії та СПК є досить поширеним явищем: за даними Volta та співавт. (2017), 85% пацієнтів з чутливістю до глютену/пшениці без целіакії мають СПК-подібні симптоми і лише у 15% пацієнтів СПК-подібні симптоми відсутні. За даними Сarroccio та співавт. (2012), у 71% пацієнтів з СПК не було чутливості до глютену/пшениці без целіакції, у 29% цю патологію виявлено. У цих дослідженнях порушення діагностували на підставі клінічних даних без визначення біомаркерів.
При аналізі результатів 10 подвійних сліпих плацебо-контрольованих РКД діагноз чутливості до глютену/пшениці було підтверджено у 16% пацієнтів, у 84% виявлено інші причини появи симптомів (плацебо/ноцебо ефект, інша харчова гіперчутливість, рання стадія целіакії; Molina-Infante, 2017).
У пацієнтів з індивідуальною реакцією на пшеницю та глютенасоційованими симптомами необхідно виключити наявність целіакії та алергії на пшеницю, призначити безглютенову дієту та дієту з виключенням пшениці на 6 тижнів. За наявності відповіді, яку оцінюють за модифікованою шкалою GSRS (зменшення ≥30% симптомів), рекомендується продовжити дієту, за відсутності відповіді (зменшення <30% симптомів) – розглянути призначення традиційної дієти з обмеженням FODMAP, що застосовується при СПК.
Таким чином, чутливість до глютену/пшениці без целіакії – це синдром, що характеризується гастроінтестинальними (СПК-подібними) й екстраінтестинальними симптомами, які спричиняє вживання глютену/пшениці. При підозрі на цю патологію необхідно в першу чергу виключити наявність целіакії та алергії на пшеницю. Хоча за існуючими на сьогодні даними кількість пацієнтів із підозрою на чутливість до глютену/пшениці без целіакії становить більше 6% загальної популяції, тільки у 16% із них дійсно підтверджується підвищена чутливість до глютену/пшениці в подвійних сліпих плацебо-контрольованих перехресних дослідженнях. Сьогодні біомаркери для діагностики чутливості до глютену/пшениці без целіакії не встановлені.
Алкогольна хвороба печінки: що нового
Доповідь доктора Крістофа Морено (Christophe Moreno) з Бельгії була присвячена труднощам у діагностиці алкогольної хвороби печінки (АХП). Універсальний скринінг на зловживання алкоголем при ургентній госпіталізації дає змогу виділити пацієнтів групи високого ризику розвитку цього захворювання печінки. Нині завершено скринінг із використанням модифікованої електронної версії тесту Паддінгтона на вживання алкоголю (Paddington alcohol test) у >48 000 (90,7%) із >53 000 пацієнтів, які були невідкладно госпіталізовані. Підвищений ризик виявлено у 2,3% пацієнтів, високий – у 4% (G. Westwood et al., 2017). Для діагностики АХП використовуються біохімічні тести, тести для неінвазивної діагностики АХП за даними аналізу крові, інструментальні дослідження (УЗД, КТ, еластографія тощо), біопсія печінки. Доповідач проаналізував переваги та недоліки цих методів обстеження у встановленні діагнозу АХП. Він навів результати багатоцентрового проспективного дослідження за участю пацієнтів із групи підвищеного ризику розвитку АСТ, що зловживають алкоголем (Voican et al., 2017). Всім пацієнтам виконувалась біопсія печінки, еластографія та спеціальні біохімічні дослідження (Fibrotest®). Було отримано такі результати:
- група зі стадією фіброзу печінки F<4 vs F=4, загальна діагностична цінність (чутливість і специфічність): еластографія – 0,93 (0,88-0,97), Fibrotest® – 0,88 (0,79-0,93), еластографія + Fibrotest® – 0,94 (0,87-0,96);
- група F<3 vs F≥3: еластографія – 0,90 (0,83-0,93); Fibrotest® – 0,85 (0,79-0,90); еластографія + Fibrotest® – 0,91 (0,86-0,95).
АХП – одне з найпоширеніших хронічних захворювань печінки, яке часто діагностується вже в стадії декомпенсації. Важливою проблемою майбутнього є скринінг пацієнтів на зловживання алкоголем і виділення пацієнтів із серйозними захворюваннями печінки. Сироваткові печінкові тести, що виконуються в рутинній практиці, не дають змоги диференціювати ранні форми АХП від більш тяжких стадій. Неінвазивні методи підходять для діагностики АХП та є простими у виконанні. Еластографія, імовірно, є більш точним інструментом для діагностики прогресування АХП. Біопсію печінки слід вважати методом вибору для підтвердження цирозу печінки та діагностики алкогольного гепатиту.
Доктор Хелена Кортес-Піно (Helena Cortez-Pino) з Португалії присвятила свій виступ природному перебігу АХП. Вживання алкогольних напоїв на сьогодні є головною причиною розвитку цирозу печінки (ЦП) в усьому світі. Смертність від ЦП алкогольного генезу становить 47,9% у структурі всіх випадків смерті від ЦП. Незважаючи на це, зараз спостерігається певне ігнорування вивчення АХП з боку науковців – цій проблемі присвячується мало досліджень і публікацій порівняно з такими захворюваннями, як вірусні гепатити В і С, а також неалкогольна жирова хвороба печінки (НАЖХП). Встановлено, що у носіїв мутації rs738409 в PNPLA3 відзначається підвищений ризик розвитку алкогольного ЦП і гепатоцелюлярної карциноми (ГЦК), а також для них характерний розвиток ЦП після короткого анамнезу зловживання алкоголем, ранній розвиток декомпенсації ЦП і висока смертність від нього (Sctickel et al., 2017). У когортному дослідженні за участю 230 пацієнтів із алкогольним ЦП виявлено низький рівень М30 – маркера апоптозу, асоційованого зі зниженням виживаності, у 94 пацієнтів і високий – у 84 пацієнтів. Рівень М65 – маркера загибелі клітин, асоційованого зі зниженням виживаності, був низьким у 95 пацієнтів, високим – у 80 (Mueller et al., 2017). За результатами обсерваційного дослідження при АХП прогноз гірший, ніж при НСV-інфекції та НАЖХП у пацієнтів із ЦП. Період спостереження становив 21 рік. Пацієнти з АХП мають вищий ризик смерті (відносний ризик 1,53; 95% довірчий інтервал 1,2-1,95; р<0,001) та частіше помирають саме від декомпенсації ЦП (Marotet et al., 2017). Вживання алкоголю є головною причиною розвитку раку печінки в Центральній і Східній Європі та причиною 1/3 випадків раку печінки в усьому світі.
Доповідь Александра Луве (Alexandre Louvet) з Франції стосувалася використання кортикостероїдів при АХП. Так, преднізолон поліпшує короткострокову виживаність при тяжкому алкогольному гепатиті, але він не є «ідеальним» препаратом. Ефективність лікування необхідно оцінювати на ранніх стадіях (7 днів використання), а за відсутності відповіді кортикостероїди потрібно відміняти. При застосуванні кортикостероїдів часто виникають інфекції, тому перед початком їх використання необхідно провести відповідний скринінг.
Тема доцільності застосування кортикостероїдів при гострому алкогольному гепатиті, асоційованому з високою смертністю хворих, була продовжена у доповіді Патріції Бурра (Patrizia Burra) з Італії. Вона зазначила, що у деяких пацієнтів як альтернативу препаратам цієї групи можна використовувати пентоксифілін. Перспективним варіантом також є застосування комбінованої терапії N-ацетилцистеїном та кортикостероїдами. Пацієнтам, у яких не досягнута відповідь на терапію кортикостероїдами, можна рекомендувати ранню трансплантацію печінки.
Виразковий коліт: останні дані щодо оптимізації лікування
Професор Гірт Д’Хаєнс (Geert d’Haens; Нідерланди) висвітлив у своєму виступі принципи ведення хворих із гострим тяжким виразковим колітом (ВК) – захворюванням, що загрожує життю пацієнта і потребує швидкого активного лікування в стаціонарних умовах. Тяжким вважається ВК, при якому частота дефекацій із виділенням кривавого калу становить більше 6 р/добу в поєднанні з будь-якою ознакою системної інтоксикації, зокрема частотою серцевих скорочень більше 90/хв, температурою тіла вище 37,8 °C, рівнем гемоглобіну <105 г/л, ШОЕ >30 мм/год, рівнем С-реактивного білка >30 мг/л. Золотим стандартом ініціального лікування пацієнтів з тяжким ВК вважається внутрішньовенне введення кортикостероїдів. Пацієнти також мають отримувати достатній об’єм внутрішньовенних інфузій рідини, низькомолекулярний гепарин з метою профілактики тромбоутворення, а також корекцію електролітних порушень і анемії. Ефективність лікувальних заходів оцінюють на 3-ю добу лікування. У випадку неефективності або недостатньої ефективності терапії слід застосовувати циклоспорин у дозі 2-4 мг/кг на добу або інфліксимаб. Після курсу лікування циклоспорином можна переходити на введення тіопуринів або ведолізумабу. Інфліксимаб можна застосовувати як терапію, спрямовану на підтримання ремісії. Оптимальною тактикою є спільне ведення таких пацієнтів гастроентерологом і хірургом-колопроктологом.
Питання оптимізації застосування біологічних препаратів при ВК докладно розглянув професор Вальтер Райніш (Walter Reinisch; Австрія). Він навів статистичні результати останніх РКД з оцінювання застосування біологічної терапії у хворих на ВК. Згідно з ними ремісія протягом року спостерігається у 16 і 35% пацієнтів, які отримували адалімумаб та інфліксимаб відповідно та у 23 і 42% пацієнтів, у яких застосовували голімумаб і ведолізумаб відповідно. Проте рівень досягнення ремісії у пацієнтів, у яких раніше уже застосовували біологічну терапію, при повторному призначенні біологічних препаратів є нижчим. Досягнення гістологічної ремісії є ще більш складним завданням. У середньому при ініціальному лікуванні блокаторами фактора некрозу пухлин приблизно у 40-50% хворих відповідь на терапію не досягається, а у 50% з тих пацієнтів, що початково відповіли на лікування, згодом спостерігається втрата ефекту від лікування. З метою оптимізації біологічної терапії при ВК доповідач рекомендував вжити таких заходів:
- оптимізувати дозу з урахуванням клінічного перебігу хвороби і даних про концентрацію препарату в крові пацієнта;
- ретельно відстежувати результати лікування згідно з повідомленнями пацієнтів;
- ретельно моніторувати біомаркери запалення (С-реактивний протеїн, фекальний кальпротектин);
- здійснювати моніторинг супутнього терапевтичного лікування;
- використовувати можливості телемедицини, яка передбачає спілкування пацієнта з лікарем не тільки під час амбулаторного чи стаціонарного візиту, а й регулярний телефонний або електронний зв’язок з метою оцінювання клінічних симптомів і лабораторних показників для вчасного запобігання виникненню загострень ВК;
- призначати комбіновану терапію біологічними препаратами;
- використовувати персоналізовану медицину, яка ґрунтується на сучасних відомостях про ефективність лікування тими чи іншими біологічними препаратами з урахуванням поліморфізму генів та індивідуального метаболізму лікарських засобів.
Останнє особливо важливо для пацієнтів, які отримують біологічну терапію, оскільки у відповідь на прийом цих препаратів в організмі людини можуть утворюватись антитіла, що зменшує або навіть нівелює ефект лікування. Розглядається можливість застосування як комбінованої біологічної терапії біологічних препаратів з різними механізмами впливу на патогенез запалення при ВК, наприклад, інфліксимабу й азатіоприну, інфліксимабу та інгібіторів кальциневрину (такролімусу), ведолізумабу та цертолізумабу пегол та ін.
Професор Субрата Гош (Subrata Ghosh; Канада) детально ознайомив присутніх з результатами міжнародних багатоцентрових РКД, присвячених застосуванню у лікуванні пацієнтів з ВК низькомолекулярних хімічно синтезованих речовин – так званих «малих молекул» (small molecules therapy): тофацитинібу, фінголімоду, озанімоду та ін. Він зазначив, що таргетна терапія препаратами на основі малих молекул має низку переваг, зокрема: можливість самостійного перорального прийому в домашніх умовах, доступна вартість порівняно з біологічними препаратами, можливість застосування в режимі монотерапії, запобігання повторному прийому кортикостероїдів і можливість комбінації з біологічними препаратами. На сьогодні завершені дослідження II фази та продовжується низка досліджень III фази, у яких такі препарати застосовувалися у пацієнтів з ВК, котрі ще ніколи не отримували біологічну терапію або вже мали досвід її використання.
Від клінічних керівництв – до клінічної практики: колоректальний рак
Професор Роб Глін-Джоунс (Rob Glynne-Jones; Великобританія) ознайомив учасників UEGW-2017 з основними положеннями нового керівництва Європейського товариства медичної онкології (ESMO) «Рак прямої кишки», яке нещодавно було опубліковано в часописі Annals of Oncology (2017). Він також навів дані про те, що захворюваність на рак прямої кишки в ЄС становить 125 тис. випадків на рік, а розповсюдженість – 15-25 на 100 тис. населення, це становить 35% від загальної кількості діагностованих випадків колоректального раку. Смертність від раку прямої кишки становить 4-10 на 100 тис.; середній вік, у якому діагностується це захворювання, – 70 років. Важливою відмінністю представленого керівництва від попереднього (2013) є визначення позиції для встановлення діагнозу «дуже ранній рак прямої кишки» додатково до позицій «ранній», «проміжний» і «запущений рак прямої кишки». Встановлення діагнозу на дуже ранній стадії (Тd1sm1N0) забезпечує найкращі результати з точки зору як вартості лікування, так і виживаності пацієнтів. Одним з кращих методів верифікації раку на такій стадії, окрім звичайної ректоскопії з морфологічним дослідженням, є ендоскопічна ультразвукова діагностика за допомогою ректального датчика. Спосіб лікування на дуже ранній стадії передбачає локальне висічення пухлини – застосовується трансанальна ендоскопічна мікрохірургія як альтернативний метод проведенню хіміорадіотерапії або поєднання обох методів.
Підходи до ведення пацієнтів з ахалазією кардії з позицій доказової медицини
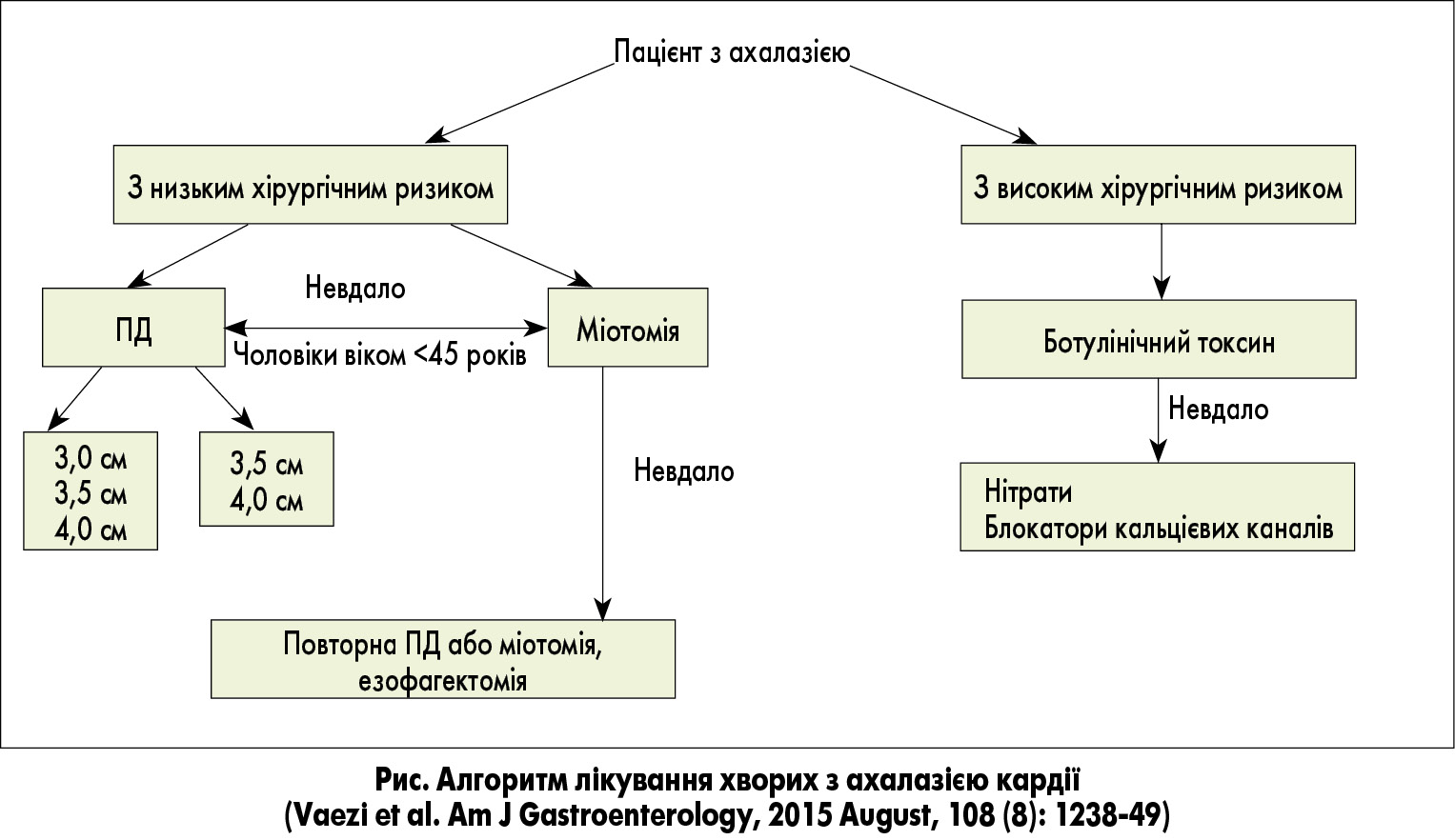
Профессор Гай Боекстаєнс (Нідерланди) представив доповідь про сучасні стандарти діагностики та лікування хворих з ахалазією кардії. Ця патологія частіше зустрічається в осіб чоловічої статі, хворих на ЦД 1 і 2 типу, пацієнтів із синдромом Шегрена. Причиною первинної, ідіопатичної ахалазії стравоходу може бути аутоімунний гангліоніт, зумовлений нейротропним вірусом, або спадкові фактори. Діагноз ахалазії кардії слід запідозрити у пацієнтів, які скаржаться на дисфагію при вживанні як твердої, так і рідкої їжі, а також регургітацію, що не припиняється на фоні курсового лікування ІПП. Золотим стандартом діагностики ахалазії кардії є стравохідна манометрія високої роздільної здатності, за результатами якої визначається тип ахалазії за Чиказькою класифікацією: 1 тип – класичний, 2 тип – класичний з компресією, 3 тип – спастичний. Для первинного лікування ахалазії оптимальним є введення в слизову оболонку кардіального відділу стравоходу ботулінічного токсину (80-100 од.), тривалість ефекту від такого лікування може становити від 6 до 12 міс. При неефективності ботулінотерапії застосовують пневматозну дилатацію (ПД) стравоходу або пероральну ендоскопічну міотомію. Медикаментозну терапію при ахалазії стравоходу призначають хворим, у яких не отримана позитивна відповідь на ботулінотерапію і які мають протипоказання до проведення ПД та пероральної ендоскопічної міотомії (рис.).
Від рекомендацій до клінічної практики: кровотеча з верхніх відділів ШКТ
Професор Ян Гральнек (Jan Gralnek; Ізраїль) представив основні положення останнього керівництва Європейського товариства гастроінтестинальної ендоскопії (ESGE, 2015) щодо ведення пацієнтів з «неварикозною» кровотечею з верхніх відділів ШКТ. Першою рекомендацією ESGE є якнайшвидше оцінювання стану гемодинаміки з метою початку відновлення об’єму циркулюючої крові (ОЦК) за допомогою введення кристалоїдних розчинів. Для оцінювання преендоскопічного рівня ризику при вирішенні питання терміновості проведення ендоскопічного обстеження та необхідності екстреної госпіталізації рекомендовано застосовувати шкалу Глазго–Блетчфорд (GBS), яка включає визначення таких показників: рівень сечовини, гемоглобіну, систолічний артеріальний тиск, пульс, наявність мелени, наявність захворювань печінки та серцево-судинної системи. ESGE не рекомендує встановлення назо- чи орогастрального зонда для аспірації шлункового вмісту. Рекомендовано якнайшвидше внутрішньовенне введення ІПП у високих дозах. Перед виконанням діагностично-лікувальної ендоскопії рекомендується одноразове внутрішньовенне введення протягом 30-120 хв еритроміцину в дозі 250 мг. Така премедикація поліпшує ендоскопічну візуалізацію і зменшує необхідність проведення повторного ендоскопічного дослідження.
У фокусі уваги – неалкогольна жирова хвороба печінки
НАЖХП визначається як накопичення жиру в клітинах печінки за відсутності надмірного споживання алкоголю. Ступінь тяжкості НАЖХП варіює від простого стеатозу до неалкогольного стеатогепатиту (НАСГ), фіброзу та цирозу печінки з ризиком розвитку ГЦК. Сьогодні саме НАЖХП є однією з головних причин виконання трансплантації печінки в усьому світі. НАЖХП діагностується у 70% осіб з ожирінням і тісно пов’язана з метаболічним синдромом. Ведення пацієнтів з НАЖХП вимагає міждисциплінарного підходу, його метою є зниження ризику прогресування захворювання, а також ризику ускладнень з боку печінки та серцево-судинної системи. У реальній клінічній практиці при веденні пацієнтів з НАЖХП лікарі й досі припускаються помилок. Зокрема існує хибний стереотип про те, що нормальний рівень аланінамінотрансферази (АЛТ) означає відсутність серйозного захворювання печінки. Однак результати декількох клінічних досліджень продемонстрували, що приблизно у 30% пацієнтів з НАЖХП відзначаються нормальні показники печінкових проб: в осіб із рівнем АЛТ <30 МО/л можна спостерігати повний спектр стадій захворювання, у тому числі фіброз і цироз печінки. Саме тому наявність стеатозу печінки за даними УЗД потребує подальшого обстеження пацієнта навіть за умови нормального рівня АЛТ. Важливо також пам’ятати про те, що у пацієнтів зі стеатозом печінки й усіма іншими ознаками метаболічного синдрому слід активно виявляти й інші можливі причини ураження печінки, зокрема зловживання алкоголем та інфікування гепатотропними вірусами. Золотим стандартом верифікації фіброзу та цирозу печінки у пацієнтів з НАЖХП залишається біопсія печінки. Останнім часом для оцінювання фіброзу все ширше використовуються неінвазивні методи, такі як еластографія печінки та визначення біохімічних маркерів, однак результати цих досліджень мають корелювати з клінічною картиною (в іншому випадку показана біопсія печінки).
Основою лікування НАЖХП є модифікація способу життя, зокрема виконання дієтичних рекомендацій і регулярні фізичні навантаження. Доведено, що зменшення маси тіла корелює зі зниженням темпів прогресування фіброзу печінки у пацієнтів з НАЖХП. У пацієнтів з НАЖХП і цукровим діабетом 2 типу слід надавати перевагу тим пероральним цукрознижуючим препаратам, які не чинять впливу на масу тіла або сприяють її зниженню. Перспективним напрямом лікування хворих цієї категорії є застосування аналогів глюкагоноподібного пептиду-1 (ГПП-1), які стимулюють секрецію інсуліну, пригнічують апетит і затримують спорожнення шлунка. Продемонстровано, що окрім покращення глікемічного контролю та індукування зниження маси тіла аналог ГПП-1 ліраглутид сприяє розрішенню НАСГ. У ході клінічних досліджень II фази вивчають вплив на перебіг НАСГ і прогресування фіброзу печінки аналога ГПП-1 пролонгованої дії – семаглутиду.
Окремою групою пацієнтів, що мають особливо високий ризик розвитку та прогресування НАЖХП, є ВІЛ-інфіковані, які отримують антиретровірусну терапію. Що ж стосується результатів трансплантації печінки у пацієнтів з термінальними стадіями НАЖХП, то вони аналогічні таким у хворих, яким це втручання виконувалось за іншими показаннями. Тому вік чи наявність ожиріння не можуть розглядатися як причини відмови від виконання трансплантації. Однак ризик смерті від серцево-судинних ускладнень у популяції пацієнтів з НАЖХП, які перенесли трансплантацію печінки, залишається високим, що слід обов’язково враховувати при лікуванні. Крім того, у значної кількості пацієнтів спостерігаються рецидиви НАСГ та фіброзу у трансплантованій печінці.
***
Записи усіх 550 доповідей, що прозвучали під час UEGW-2017, можна отримати на сайті UEG: https://www.ueg.eu/education/ueg-week-24-7/ueg-week-247.
Наступний Об’єднаний європейський гастроентерологічний тиждень (UEGW-2018) планується провести у Відні (Австрія) з 20 по 24 жовтня 2018 р. Детальну інформацію про цю подію можна знайти на сайті:
https://www.ueg.eu/week/past-future/ueg-week-2018/.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 4 (46), листопад 2017 р.