24 грудня, 2017
Влияние предшествующей терапии на активность эверолимуса: предварительный анализ данных исследования RADIANT‑4
Нейроэндокринные опухоли (НЭО) относятся к числу редко встречающихся заболеваний, представляют собой гетерогенную группу новообразований различной локализации, возникающих из нейроэндокринных клеток; наиболее частой локализацией являются гастроэнтеропанкреатическая (ГЭП) эндокринная система (около 57%) и легкие (около 27%). За последние четыре десятилетия отмечено увеличение заболеваемости с 1,09 на 100 тыс. в 1973 г. до 6,98 на 100 тыс. в 2012 г.
В зависимости от гормональной активности различают функционирующие НЭО, которым присущи классические клинические симптомы (например, карциноидный синдром) вследствие повышенной гормональной секреции, и нефункционирующие НЭО. К нефункционирующим относятся большинство НЭО желудочно-кишечного тракта (ЖКТ) и легких. Согласно данным программы «Наблюдение, эпидемиология и окончательные результаты», примерно у половины пациентов при первичном выявлении диагностируют метастатическую форму заболевания, 65% пациентов умирают в течение 5 лет от момента постановки диагноза. Клиническое течение, тактика лечения и прогноз могут широко варьироваться в зависимости от нескольких факторов. К таковым относятся факторы, связанные с заболеванием, например первичная локализация, гистологическая классификация, резектабельность опухоли, наличие метастатических очагов и клинических симптомов, а также факторы, связанные с самим пациентом, такие как цели лечения, сопутствующие заболевания и доступность лечения.
Лечение неоперабельных НЭО и НЭО поздних стадий затруднено ввиду ограниченных терапевтических возможностей. Хотя в международных руководствах и предложены возможные алгоритмы, лечение метастатической НЭО может широко варьироваться в связи с отсутствием консенсуса в отношении единого подхода к терапии. Несмотря на ограниченные данные контролируемых рандомизированных клинических исследований, доступные методы лечения для пациентов с прогрессирующей НЭО легких или ЖКТ традиционно включают применение аналогов соматостатина (АСС), а также проведение химиотерапии (ХТ) и лучевой терапии (ЛТ). У пациентов с функционирующими НЭО стандартом лечения, направленного на ликвидацию симптомов, являются АСС, такие как октреотид и ланреотид. В более поздних проспективных исследованиях III фазы у пациентов с хорошо дифференцированными ГЭП НЭО также были подтверждены антипролиферативные эффекты АСС. До появления новых таргетных агентов ХТ оставалась единственной рекомендуемой терапевтической опцией при панкреатической НЭО поздних стадий. В различных ретроспективных исследованиях частота ответа на ХТ варьировалась от 25 до 42%. Увеличение частоты ответа на фоне ХТ при сравнении с группой исторического контроля не приводило к увеличению выживаемости без прогрессирования (ВБП), хотя проведение такого сравнения затруднено из-за неоднородности данных в исследованиях и группах пациентов. Кроме того, значительная кумулятивная токсичность, связанная с системной ХТ, ограничивает возможность ее долгосрочного применения. Пептидная рецепторная радионуклидная терапия (ПРРТ) представляет собой новую методику, которая может стать многообещающим вариантом лечения прогрессирующих соматостатин-рецептор-положительных НЭО поздних стадий с происхождением из средней кишки.
За последние 6 лет эверолимус (Афинитор) как в качестве единственного агента, так и в сочетании с октреотидом длительного действия продемонстрировал активность в отношении широкого спектра подтипов НЭО в различных исследованиях II и III фазы. В ходе исследовании III фазы RADIANT-4 терапия эверолимусом позволила продлить медиану ВБП на 7,1 мес по сравнению с плацебо. Применение эверолимуса способствовало 52-процентному снижению риска прогрессирования заболевания или летального исхода (отношение рисков – ОР – 0,48; 95% доверительный интервал 0,35-0,67; p=0,00001) у пациентов с прогрессирующей нефункционирующей НЭО легкого или ЖКТ поздних стадий.
Эверолимус показал преимущество во всех подгруппах, проанализированных в исследовании RADIANT-4, однако влияние предшествующей терапии на активность эверолимуса оставалось неизвестным. Этот ретроспективный исследовательский анализ был направлен на изучение влияния предшествующей терапии (АСС, ЛТ и ХТ) на ВБП у пациентов, включенных в исследование RADIANT-4, а также какого-либо воздействия конкретных последовательностей лечения на результаты терапии эверолимусом у отдельных больных с НЭО поздних стадий.
Методы
Участники исследования III фазы RADIANT-4 были рандомизированы в соотношении 2:1. В основной группе эверолимус назначался в дозе 10 мг/сут, больные контрольной группы получали плацебо в сочетании с лучшей поддерживающей терапией. Лечение продолжалось до возникновения признаков радиологической прогрессии, развития неприемлемых побочных эффектов (ПЭ), начала новой терапии или до отказа пациента от дальнейшей терапии.
Пациенты были стратифицированы в соответствии с предшествующей терапией АСС (непрерывный прием АСС ≥12 недель), по происхождению опухоли. На основе прогностического уровня выделено 2 группы:
- группа A (лучший прогноз): апендикс, слепая кишка, тощая кишка, подвздошная кишка, двенадцатиперстная кишка или НЭО неизвестной первичной локализации;
- группа В (худший прогноз): легкие, желудок, ободочная кишка (кроме слепой) или прямая кишка и исходное состояние больного по классификации Всемирной организации здравоохранения (0 против 1). Переход в группу открытого изучения эверолимуса до первичного анализа ВБП не проводился, если у пациентов в группе плацебо заболевание прогрессировало.
В текущем анализе исследования RADIANT-4 пациенты были выделены в подгруппы в зависимости от проводимой ранее терапии – АСС, ХТ или ЛТ (в том числе ПРРТ) – в любой период до включения в исследование:
- ранее получавшие / не получавшие АСС;
- ранее проводилась / не проводилась ЛТ;
- ранее проводилась / не проводилась ХТ.
Эффективность и безопасность эверолимуса по сравнению с плацебо оценивали в каждой из этих подгрупп. Дополнительно пациенты были выделены в следующее подгруппы:
- эверолимус в первой линии терапии у пациентов с предшествующим хирургическим лечением или без него, исключая другие локальные оперативные вмешательства (биопсию, радиочастотную абляцию, трансартериальную эмболизацию, селективную внутреннюю лучевую терапию, чрескожную инъекцию этанола и криоаблацию);
- эверолимус во второй линии, после терапии АСС, включая пациентов с одной лишь проведенной терапией АСС, АСС в комбинации с иными терапевтическими опциями (например, ХТ, гормональной терапией, ЛТ, таргетной терапией), с предшествующим хирургическим лечением или без него, исключая другие локальные оперативные вмешательства.
Результаты
Обе группы были сопоставимы по какой-либо проводимой ранее терапии АСС (53% пациентов, получавших эверолимус, против 56% – получавших плацебо), ХТ (26 против 24%) и ЛТ (21 против 20%). Подгруппа предшествующей ЛТ также включала проведение ПРРТ (n=15). Продолжали прием АСС на момент проведения исследования 5 пациентов (4 – в группе эверолимуса и 1 – в группе плацебо). Изменение функционального статуса отмечено у 17 пациентов (10 – в группе эверолимуса и 7 – в группе плацебо).
В общей сложности 163 пациента получили предварительно АСС. Средняя продолжительность предшествующей терапии АСС составляла 15 мес и была сопоставима в обеих группах лечения. В подгруппе пациентов, получавших ранее АСС, у 105 человек опухоль первично локализировалась в ЖКТ. Средняя продолжительность терапии АСС у пациентов с НЭО ЖКТ составила 16,7 мес и была дольше в группе эверолимуса (21,2 против 14,1 мес). Только 25 пациентам (21 – из группы эверолимуса и 4 –из группы плацебо) в подгруппе получавших ранее АСС не назначалось никаких других противоопухолевых препаратов, кроме АСС.
Из 157 пациентов, получавших ранее АСС непрерывно в течение по меньшей мере 12 недель, у 96 пациентов первичная опухоль локализировалась в ЖКТ, у 67 – в средней кишке и у 29 пациентов – иной локализации. В первой линии терапии эверолимус получали 85 пациентов. Число пациентов, получавших эверолимус во второй линии терапии линии, составляло 78.
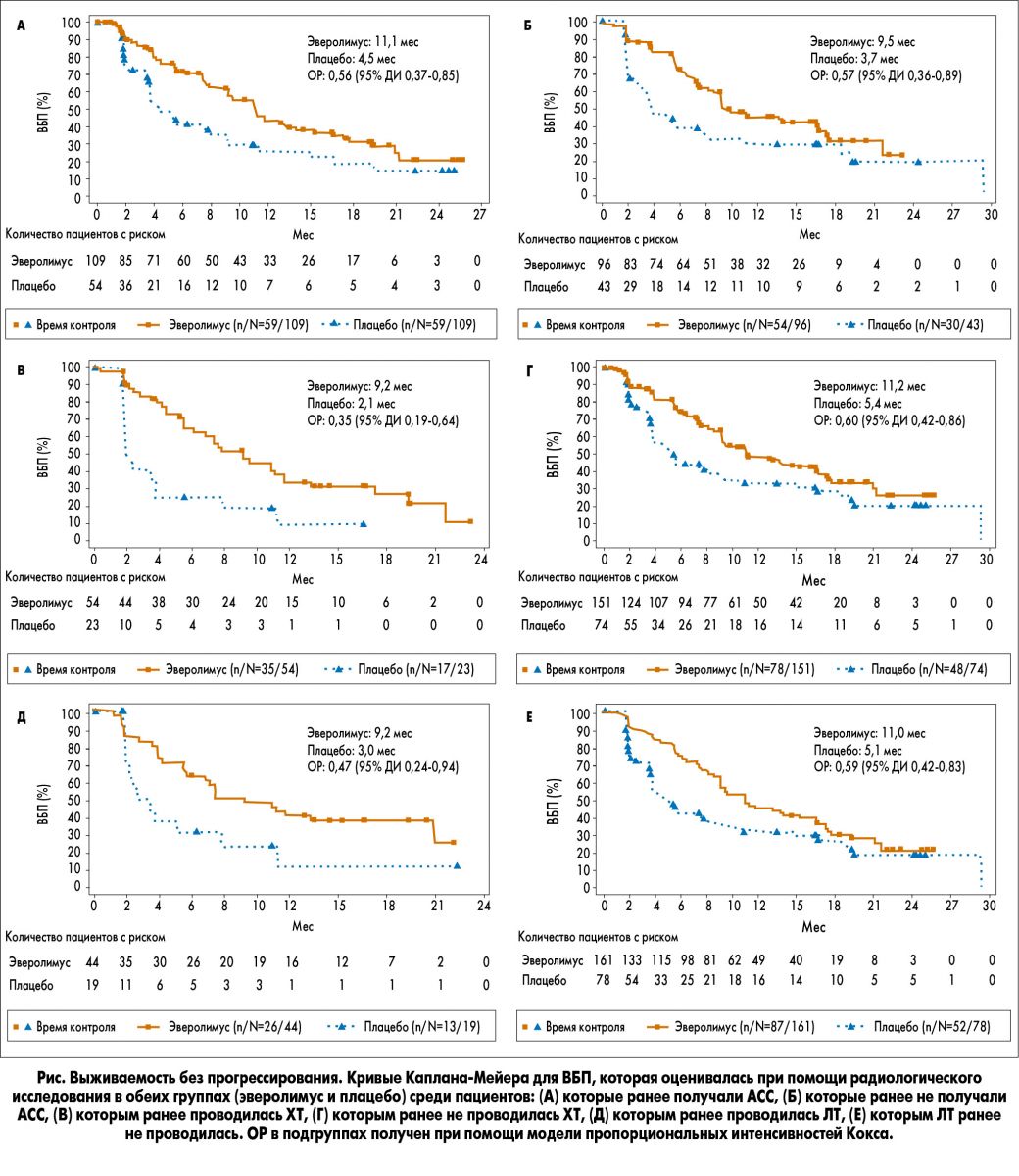
Как показано на рисунке, медиана ВБП в группе эверолимуса превосходила таковую в группе плацебо во всех подгруппах.
Метод предшествующей терапии существенно не влиял на частоту возникновения ПЭ, за исключением астении и одышки, более выраженных у пациентов, которым ранее проводилась ХТ и ЛТ. Профиль безопасности эверолимуса был сопоставимым с таковым у пациентов, ранее получавших ПРРТ (n=15), и у пациентов, которым не проводилась ПРРТ, однако в группе эверолимуса отмечалась более высокая частота нейтропении 3-4 степени (13 против 1%), неинфекционного пневмонита (7 против 1%), отека (7 против 2%) и тромбоцитопении (7 против 1%). Большинство ПЭ относились к 1 или 2 степени тяжести.
Обсуждение
Первичные результаты исследования RADIANT-4 показали статистически значимое увеличение медианы ВБП на 7,1 мес на фоне терапии эверолимусом и 52-процентное снижение риска прогрессирования у пациентов с высоко дифференцированными, прогрессирующими нефункционирующими НЭО ЖКТ или легкого поздних стадий. В ретроспективном исследовательском анализе RADIANT-4 наблюдалось преимущество в ВБП среди пациентов, получавших эверолимус, независимо от предшествующей терапии. В подгруппах ранее леченных пациентов эверолимус увеличил медиану ВБП на 5,8 мес и способствовал 40-65% снижению относительного риска прогрессирования заболевания или смерти по сравнению с группой плацебо. Во второй линии терапии в группе пациентов, которые ранее получали одни лишь АСС, эверолимус значительно увеличил медиану ВБП – до 9,4 мес.
Научные достижения и результаты нескольких ключевых клинических исследований привели к лучшему пониманию патогенеза НЭО и смене парадигмы лечения. У больных с НЭО поздних стадий количество доступных терапевтических опций увеличивается. Поскольку у большинства пациентов в какой-то момент заболевание будет прогрессировать, для них остается важным выбор оптимальной последовательности лечения, которая в настоящее время не известна.
Доступные методы лечения НЭО включают АСС, ингибитор mTOR – эверолимус, ингибитор тирозинкиназ (ИТК) – сунитиниб и ПРРТ с использованием 177Lu-Dotatate. С 1980 г. стандартом лечения карциноидного синдрома при функционирующей НЭО являются АСС. В двух недавно проведенных плацебо-контролируемых исследованиях III фазы АСС также продемонстрировали антипролиферативную активность у пациентов с НЭО средней кишки низкой степени злокачественности (grade 1) и у пациентов с энтеропанкреатической НЭО низкой и средней степени злокачественности (Ki-67 10%). Несмотря на то что изучение АСС при НЭО желудка или легкого не проводилось, их применение в отсутствие иных одобренных препаратов может быть оправдано, если опухоль имеет низкую степень злокачественности и экспрессирует рецепторы соматостатина. Кроме того, АСС также продемонстрировали благоприятный профиль долгосрочной безопасности и, следовательно, могут быть квалифицированы как терапия первой линии при различных типах НЭО. До появления в 2011 году новых таргетных агентов ХТ на основе стрептозотоцина в сочетании с 5-фторурацилом или доксорубицином была признанной терапевтической опцией панкреатических НЭО поздних стадий. В различных исследованиях сообщалось о частоте ответа в пределах 25-42%, что подтвердило активность ХТ на основе стрептозотоцина в эпоху новых таргетных препаратов, особенно при прогрессирующих панкреатических НЭО второй степени злокачественности (G2) с более высокой опухолевой нагрузкой. ХТ на основе темозоломида как в качестве единственного агента, так и в сочетании с капецитабином или бевацизумабом является альтернативным режимом терапии панкреатической НЭО на основе данных ограниченного числа ретроспективных исследований; частота ответа 30-70%. Существует мало доказательств, подтверждающих использование ХТ при внепанкреатической локализации НЭО в случае непанкреатических НЭО.
В течение 15 лет ПРРТ с использованием различных радионуклидов, таких как Indium-111, Yttrium-90 и Lutetium-177, изучается во многих в основном одноцентровых неконтролируемых исследованиях при различных типах НЭО, однако в первом исследовании III фазы NETTER-1 177Lu-Dotatate в сочетании с октреотидом длительного действия продемонстрировано значительное увеличение ВБП по сравнению с одним лишь высокодозным октреотидом (60 мг/мес) у пациентов с распространенной НЭО средней кишки. Экспрессия соматостатиновых рецепторов является важным критерием для проведения ПРРТ, следовательно, ее выполнение ограничено данной подгруппой пациентов. Кроме того, существует повышенный риск долговременной токсичности в отношении почек и костного мозга, а также определенный риск возникновения миелоидных новообразований.
В настоящее время для таргетной терапии при НЭО одобрены сунитиниб и эверолимус. Эверолимус был более широко изучен при НЭО и продемонстрировал активность в широком диапазоне подтипов НЭО с локализацией от легких до прямой кишки, тогда как сунитиниб одобрен при прогрессирующей панкреатической НЭО. Несмотря на некоторую эффективность новых ИТК (пазопаниб, акситиниб, кабозантиниб), о которых сообщалось в исследованиях II фазы, нет конкретных доказательств эффективности ИТК при НЭО непанкреатического происхождения.
Оценка безопасности и переносимости эверолимуса в настоящем подгрупповом анализе согласуется с данными общего популяционного исследования RADIANT-4. Чаще наблюдались ПЭ 1-2 степени тяжести, включая стоматит, диарею, усталость, инфекции, сыпь и периферический отек. Большинство ПЭ, связанных с приемом эверолимуса, можно было контролировать посредством модификации дозы или перерыва в лечении без изменения продолжительности лечения. Как было указано Berardi и соавт. в небольшом ретроспективном исследовании с включением 116 пациентов, кумулятивная доза и интенсивность дозы эверолимуса являются прогностическими факторами, следовательно, при наличии ответа на препарат прием эверолимуса следует продолжить, несмотря на задержку или перерыв в лечении. Ретроспективное популяционное исследование показало, что использование эверолимуса после ПРРТ и/или цитотоксической ХТ может увеличить общую токсичность эверолимуса. В данном анализе более высокая частота возникновения нейтропении 3-4 степени, неинфекционного пневмонита, отека и тромбоцитопении может быть также связана с проведением ПРРТ. В целом профиль безопасности эверолимуса в этом анализе был сопоставим с таковым в общей популяции исследования RADIANT-4 независимо от ранее проводимого лечения, в том числе ПРРТ.
Учитывая растущее число доступных терапевтических опций, выбор терапии должен основываться на индивидуализированных целях лечения. Как показал анализ, эверолимус улучшает исходы у пациентов с прогрессирующими нефункционирующими НЭО ЖКТ или легкого поздних стадий независимо от ранее проводимой терапии, что делает применение эверолимуса возможным как у ранее леченных, так и нелеченных пациентов. Предшествующая терапия не влияла на профиль безопасности эверолимуса, данные сходны с теми, которые сообщались для общей анализируемой популяции в исследовании RADIANT-4.
Статья печатается в сокращении.
Buzzoni R. et al. Impact of prior therapies on everolimus activity:
an exploratory analysis of RADIANT-4. OncoTargets and Therapy. 2017.
Перевела с англ. Екатерина Марушко
Тематичний номер «Онкологія» № 5 (51), грудень 2017 р.