25 грудня, 2017
Роль пробіотиків у лікуванні та профілактиці атопічного дерматиту в дітей
 Атопічний дерматит (АД) – генетично зумовлене хронічне алергічне запалення шкіри з рецидивуючим перебігом, яке має вікові особливості клінічної картини, супроводжується свербінням, часто поєднується з респіраторними проявами алергії негайного типу (алергічним ринокон’юнктивітом, атопічною бронхіальною астмою) та характеризується підвищенням загального рівня IgE і специфічних IgE в сироватці крові.
Атопічний дерматит (АД) – генетично зумовлене хронічне алергічне запалення шкіри з рецидивуючим перебігом, яке має вікові особливості клінічної картини, супроводжується свербінням, часто поєднується з респіраторними проявами алергії негайного типу (алергічним ринокон’юнктивітом, атопічною бронхіальною астмою) та характеризується підвищенням загального рівня IgE і специфічних IgE в сироватці крові.
З огляду на те що у визначенні використовується поняття атопії (АД) та алергії, варто наголосити на останніх номенклатурних і класифікаційних змінах в алергології. Сучасна класифікація та номенклатура була розроблена групою вчених за завданням Європейської академії алергії та клінічної імунології (EAACI) і пізніше допрацьована за участю Всесвітньої організації алергії (World Allergy Organisation, WAO).
Важливим у номенклатурі алергії є визначення гіперчутливості, під якою розуміють об’єктивні прояви та симптоми, що розвиваються внаслідок впливу певних стимулів у дозах, що не викликають цих проявів у несенсибілізованих індивідуумів. Вказане поняття об’єднує всі види гіперчутливості: неалергічну та алергічну, у тому числі опосередковану імунологічними механізмами. Із його введенням зникає потреба в таких термінах, як «ідіосинкразія» та «псевдоалергія».
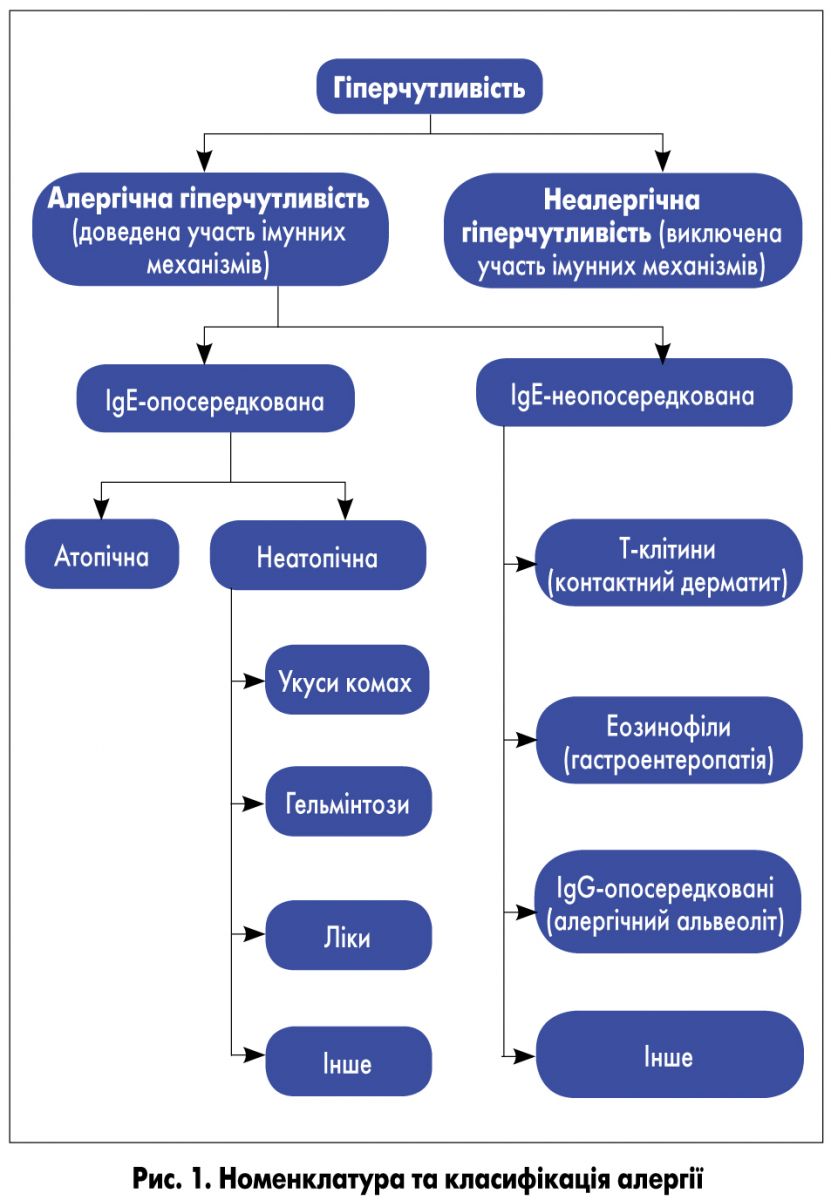 Алергія – це реакції гіперчутливості, опосередковані імунологічними механізмами. У більшості хворих алергічні прояви асоційовані з антитілами IgE-класу, у зв’язку з чим вони віднесені до IgE-опосередкованої алергії. Ця група включає також захворювання за участю атопічних механізмів.
Алергія – це реакції гіперчутливості, опосередковані імунологічними механізмами. У більшості хворих алергічні прояви асоційовані з антитілами IgE-класу, у зв’язку з чим вони віднесені до IgE-опосередкованої алергії. Ця група включає також захворювання за участю атопічних механізмів.
! Під атопією розуміють індивідуальну або спадкову схильність, зазвичай у дитячому або підлітковому віці, до сенсибілізації та продукування IgE-антитіл при звичайному контакті з алергенами, як правило, білкової природи, з появою типових симптомів, таких як астма, ринокон’юнктивіт або екзема.
Однак далеко не всі IgE-опосередковані реакції розвиваються за атопічним механізмом. Термін «атопія» стосується лише генетичної схильності розвивати IgE-опосередковану сенсибілізацію до звичайних білкових речовин навколишнього середовища, при контакті з якими у більшості представників популяції сенсибілізація не розвивається – наприклад, пилком рослин, виділеннями домашніх тварин, кліщів домашнього пилу.
Алергічні захворювання в осіб з атопічною конституцією1 можуть називатися атопічними, наприклад, атопічний риніт або атопічна бронхіальна астма, АД/екзема.
Таким чином, у сучасній класифікації розділені атопічні та неатопічні IgE-опосередковані захворювання, і цей поділ має доведену патогенетичну основу.
Їх розмежування необхідне для реальної клінічної практики, оскільки передбачає розроблення комплексу профілактичних заходів, насамперед первинної профілактики атопічних захворювань серед дітей зі спадковою схильністю. Класифікацію окремих нозологій уніфіковано відповідно до класифікації алергічних реакцій.
Ще 2001 року під час розгляду номенклатури для міжнародного використання було вилучено з наукового обігу такі терміни, як «нейродерміт», «ендогенна екзема», «ексудативний екзематоїд», «почесуха». Запропонований раніше термін «атопічний дерматит» був замінений тимчасово на «синдром атопічного дерматиту / екземи (AEDS)», який у 2008 році запропоновано замінити на термін «екзема».
У дітей і молодих людей з атопічною конституцією, в яких найчастіше запалення спричиняють IgE-антитіла, захворювання визначають як атопічну екзему. При цьому підкреслюється, що діагноз атопічної екземи можна встановлювати лише у випадках IgE-опосередкованої сенсибілізації, підтвердженої шкірними пробами або визначенням IgE-антитіл до алергенів. У решті випадків встановлюють діагноз неатопічної екземи. Диференційна діагностика цих двох різновидів екземи має також важливе прогностичне значення: у дітей з атопічною екземою ризик розвитку бронхіальної астми в підлітковому віці істотно вищий, ніж у хворих на неатопічну екзему.
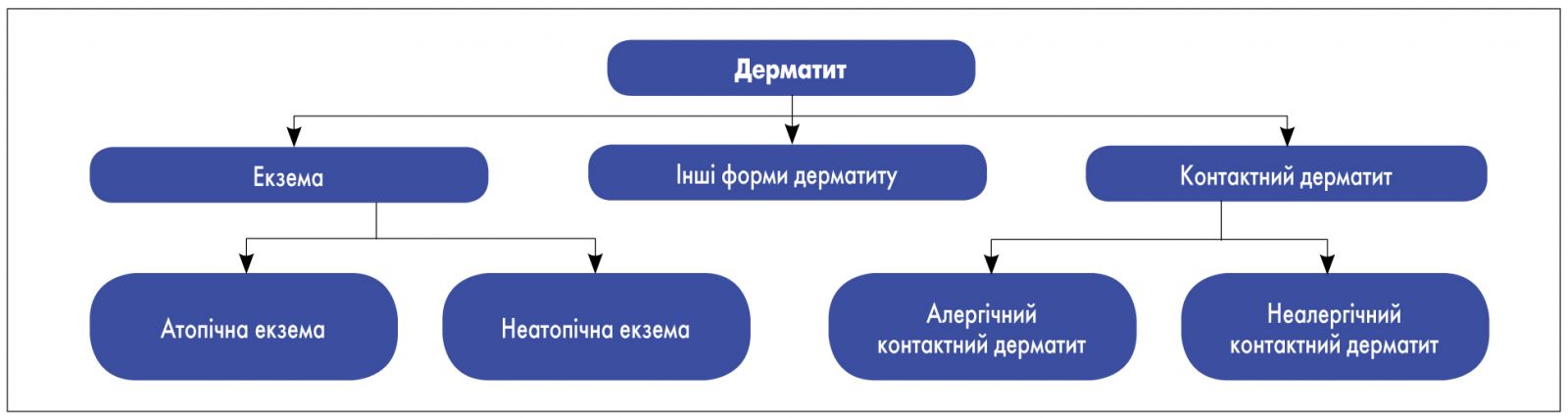
Вплив низькомолекулярних хімічних речовин або подразників, які викликають місцевий запальний процес у шкірі, призводить до розвитку контактного дерматиту.
Рис. 2. Номенклатура та класифікація дерматиту
У тих випадках, коли запалення спричинене сенсибілізованими Тh1-лімфоцитами, захворювання називають алергічним контактним дерматитом. Розуміння цих термінів дозволить більш якісно проводити диференційну діагностику атопічної екземи з іншими захворюваннями.
Сьогодні всі лікарі використовують у своїй роботі перелік захворювань відповідно до МКХ‑10. МКХ‑11 зараз розробляють, у 2018 році заплановано її представити для подальшого використання. У ній будуть враховані результати роботи щодо оновлення класифікацій і номенклатури. Згідно з сучасною термінологією, АД й екзема розглядаються як синоніми.
Відповідно до МКХ‑10:
L20 – L20.9 Атопічний дерматит
L 20 Атопічний дерматит
L 20.8 Інші атопічні дерматити
L 20.9 Атопічний дерматит неуточнений
Причини, патофізіологія та патогенез АД мають багатофакторну природу.
! АД є результатом складної взаємодії між генетичними, екологічними, соціальними факторами.
Доведено зв’язок АД з аномаліями шкіри (дефіцитом філагрину, що призводить до трансепідермальної втрати води, порушення епідермального бар’єру шкіри) та імунорегуляторними порушеннями з переважанням активації Th2, збільшення IgE і підвищення рівня циркулюючих еозинофілів. Сприятливим тлом для розвитку АД є ендогенні фактори, зокрема порушення центральної нервової регуляції, вегетативної нервової системи та шлунково-кишкового тракту.
Сьогодні АД розглядають як міжгалузеву проблему, тому над вирішенням питань профілактики, своєчасної діагностики, адекватного лікування та забезпечення соціальної адаптації дитини, хворої на АД, працюють лікарі алергологи, дерматологи, гастроентерологи та педіатри. Відповідно до наказу Міністерства охорони здоров’я України від 04.07.2016 № 670 діагноз АД встановлює лікар-дерматовенеролог / дерматовенеролог дитячий, лікар-алерголог / дитячий алерголог на підставі діагностичних критеріїв. Ступінь тяжкості АД визначає лікар-дерматовенеролог / дитячий дерматовенеролог за допомогою бальної оцінки ступеня тяжкості АД за індексом 10 SCORAD (шкала оцінки ступеня тяжкості АД).
Підтвердження діагнозу АД здійснює лікар-алерголог / алерголог дитячий за допомогою спеціальних алергологічних методів обстеження, компонентної алергодіагностики тощо. Лікарі загальної практики – сімейні лікарі та дільничний педіатр відіграють ключову роль в організації раннього (своєчасного) виявлення АД, сприянні виконанню рекомендацій спеціалістів і забезпеченні належної медичної реабілітації.
Діагностичні критерії АД (за Hanifin&Rajka)
Основні:
- свербіння шкіри;
- типова морфологія і локалізація уражень: згинальні поверхні кінцівок, посилення шкірного малюнка та ліхенізація шкіри на згинальних поверхнях кінцівок;
- хронічний рецидивуючий перебіг;
- атопія в індивідуальному та сімейному анамнезі.
Додаткові:
- сухість шкіри;
- іхтіоз, посилення шкірного малюнка долонь, фолікулярний кератоз;
- позитивна шкірна реакція гіперчутливості негайного типу з харчовими та іншими алергенами;
- підвищений рівень загального сироваткового IgE;
- виникнення захворювання в ранньому віці (до 2 років);
- схильність до інфекції шкіри переважно стафілококової та герпетичної етіології;
- неспецифічний дерматит кистей і стоп;
- екзема сосків;
- хейліт;
- рецидивуючий кон’юнктивіт;
- лінії Дені (складка Дені-Моргана на нижніх повіках);
- білий дермографізм;
- темні кола навколо очей;
- блідість або еритема обличчя;
- складка на передній поверхні шиї;
- свербіння при інтенсивному потовиділенні;
- алергія до вовни і розчинних жирів;
- залежність клінічного перебігу від факторів зовнішнього середовища та емоцій.
Для встановлення діагнозу необхідна наявність 3 основних і 3 додаткових критеріїв
Лабораторні тести:
- позитивні шкірні тести з харчовими, побутовими або грибковими алергенами;
- окрім загального сироваткового IgE, підвищення рівнів специфічних IgE-антитіл;
- клітинні реакції гіперчутливості уповільненого типу in vitro;
- еозинофілія;
- відхилення показників функціонального стану шлунково-кишкового тракту;
- дисбіоз.
Типова локалізація шкірних уражень залежно від віку:
- ранній дитячий вік – обличчя, волосиста частина голови, шия;
- дитячий вік старше 4 років – згинальні поверхні кінцівок (ліктьові, підколінні ямки), кисті, щиколотки, зменшення уражень обличчя;
- дорослий вік – обличчя (на періоральній та періорбітальній ділянках), шия.
Ступінь тяжкості АД визначається поширеністю процесу на шкірі, інтенсивністю запальних змін на шкірі, наявністю вторинної шкірної інфекції та суб’єктивних проявів (свербіння, безсоння).
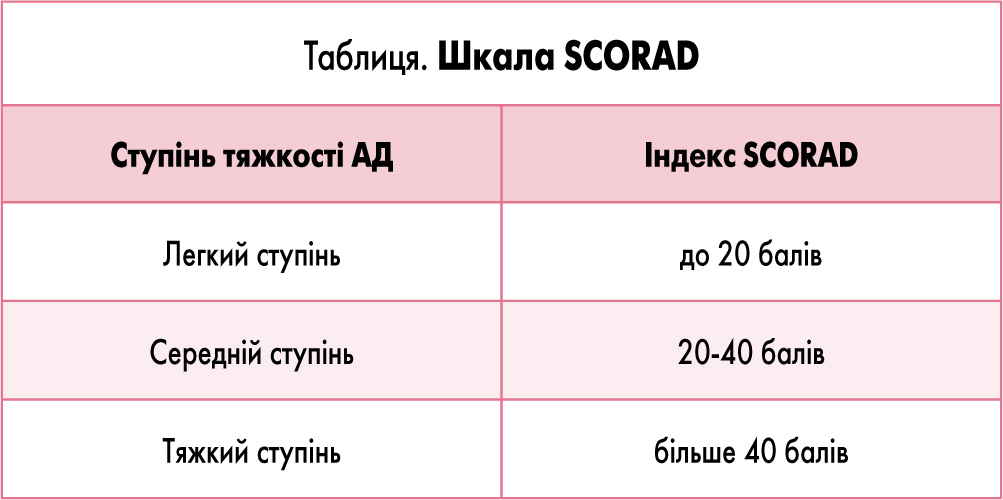 Для діагностики, оцінки ступеня тяжкості, а також ефективності проведеної терапії необхідно використовувати напівкількісний метод – шкалу SСORAD (Scoring of Atopic Dermatitis), який передбачає бальну систему оцінки 6 об’єктивних і суб’єктивних симптомів, які заносяться в оціночний лист. Кожний симптом оцінюється від 0 до 3 балів (0 – відсутність, 1 – легкий, 2 – середній, 3 – тяжкий). Оцінки виставляються у спеціальній таблиці, на їх підставі розраховується загальний індекс SСORAD.
Для діагностики, оцінки ступеня тяжкості, а також ефективності проведеної терапії необхідно використовувати напівкількісний метод – шкалу SСORAD (Scoring of Atopic Dermatitis), який передбачає бальну систему оцінки 6 об’єктивних і суб’єктивних симптомів, які заносяться в оціночний лист. Кожний симптом оцінюється від 0 до 3 балів (0 – відсутність, 1 – легкий, 2 – середній, 3 – тяжкий). Оцінки виставляються у спеціальній таблиці, на їх підставі розраховується загальний індекс SСORAD.
Легкий ступінь – при індексі до 20 балів, середній ступінь – 20-40 балів, тяжкий – більше 40 балів.
Ускладнення виникають переважно унаслідок вторинного інфікування шкіри. Для АД характерні високий ступінь колонізації Staphylococcus aureus; вірусні інфекції, зумовлені Herpes simplex, Varicella, вірусом папіломи та контагіозного молюска, а також грибкові інфекції (дерматомікози, зумовлені Trichophyton, високий відсоток колонізації умовно-патогенними грибами роду Candida albicans, Candida parapsilosis, Rhizopus spp., Spegazziniates sarthra, Pityrosporum ovale).
Із супутніх захворювань найчастіше зустрічається патологія кишково-шлункового тракту: гастрити, виразкова хвороба шлунка і 12-палої кишки, порушення мікрофлори кишкового тракту, паразитарна інвазія, а також вогнища хронічної інфекції, захворювання ЛОР-органів, порушення психіки, катаракта.
Основні завдання лікування та профілактики АД:
- усунення або зменшення запальних змін на шкірі і свербіння;
- запобігання розвитку тяжких форм АД, що призводять до зниження якості життя й інвалідизації, відновлення структури та функцій шкіри;
- лікування супутніх захворювань, що обтяжують перебіг АД і збільшують частоту рецидивів.
Сучасний стан проблеми. Зростання захворюваності на АД у всьому світі пов’язане з несприятливим впливом багатьох факторів сучасної цивілізації та урбанізації. Поширеність патології в розвинених країнах Західної Європи серед дітей віком до 14 років становить 10-20%.
В Україні впродовж 2009-2014 рр. спостерігається поступове зростання захворюваності на АД, його поширеність серед дітей віком від 0 до 18 років складає 7,6%. Статистика свідчить про недостатньо ретельний облік пацієнтів з АД і часто неправильну інтерпретацію діагнозів АД й алергічного контактного дерматиту або нейродерміту.
Деякі дослідники запропонували «гігієнічну гіпотезу», згідно з якою феномен зростання захворюваності на цю патологію пояснюється переважанням активації Th2-лімфоцитів (що було необхідно плоду під час внутрішньоутробного розвитку), але протягом першого року життя імунні механізми змінюють свою спрямованість на переважання Th1, що пов’язано з впливом на дитину ззовні різних інфекційних агентів та сприяє формуванню оральної толерантності. «Гігієнічна гіпотеза» ґрунтується на констатації факту, що поширеність АД обернено пропорційна високим стандартам санітарно-гігієнічних умов проживання людей. Малодітні сім’ї, відмова від щеплень і широке застосування антибіотиків – усе це сприяло скороченню контакту дітей із патогенами, здатними стимулювати саме Th1, тому активною залишається лише ланка активації Th2-лімфоцитів, що може сприяти розвитку алергічних захворювань.
Нещодавно було запропоновано іншу гіпотезу – про вплив первинної мікробної стимуляції організму-хазяїна. У дітей вона відбувається під час становлення кишкової мікрофлори під впливом коменсальної мікрофлори матері й навколишнього середовища. Ці бактеріальні штами можуть можуть бути основними модуляторами імунної системи та запобігати або стимулювати розвиток атопічних захворювань. Мікробіота в кишечнику новонародженої дитини в ранньому післяпологовому періоді пов’язана з активацією вродженого та адаптивного імунітету й необхідна для успішного дозрівання імунної системи слизової кишечника і формування нормальної активності діаміноксидази2, що бере участь у процесах детоксикації та розщеплення гістаміну.
Як наслідок, відсутність або недостатній вплив мікробного стимулу коменсальної мікрофлори на слизову кишечника призводить до зменшення активно працюючої поверхні кишечника (біоплівки), ушкодження його слизової, порушення слизового бар’єру та продукції секреторного IgA, що негативно впливає на формування оральної толерантності. Оральна толерантність – це здатність терпимо сприймати непатогенні антигени, що контактують зі слизовою кишечника. Визнано, що тип антигена, шлях його потрапляння в організм, розпізнавання його рецепторами та його кількість мають вирішальне значення при встановленні оральної толерантності.
! У низці досліджень було встановлено, що кишкова мікрофлора дітей з атопією характеризується порушенням співвідношення клостридій і біфідобактерій убік зниження кількості останніх. Якщо незбалансований склад кишкової мікрофлори може сприяти розвитку атопічних захворювань, то пробіотики можуть бути корисними завдяки їхній здатності поліпшувати імунологічні функції кишечника шляхом зменшення вироблення прозапальних цитокінів і відновлення нормальної проникності кишечника.
Крім того, було висловлене припущення, що позитивні ефекти пробіотиків у запобіганні запуску атопічних захворювань пов’язані зі стимуляцією ними Toll-подібних рецепторів3 (TLRs).
У відповідь на стимуляцію цих рецепторів кишкові епітеліальні клітини виробляють різні рецептори розпізнавання структур, і вони є клітиноспецифічними, які, у свою чергу, розпізнають певні мікробні антигени (патоген-асоційовані молекулярні структури – PAMPs).
Стимуляція TLRs різними PAMPs індукує диференціювання Т-клітин в клітини Th1, що опосередковують клітинні та запальні реакції, і Th2-клітини, які опосередковують гуморальну відповідь, антипаразитарний захист і алергічні реакції. Взаємодія мікрофлори дитини з TLRs може відігравати певну роль в реалізації схильності до харчової алергії.
Систематичний огляд рандомізованих контрольованих досліджень (РКД), проведених за період 1997-2012 рр., щодо ефективності пробіотиків у профілактиці та лікуванні АД у дітей (PAD) опублікований у Pub-Med.
Пробіотики у профілактиці АД
У рандомiзованому клiнiчному дослiдженнi була проведена оцінка ефективності добавки, яка містить комбінацію 4 різних пробіотичних штамів. У результатi автори дійшли висновку, що пробіотичні бактеріальні штами, які отримувала велика група новонароджених дітей із високим ризиком розвитку атопії, запобігають виникненню клінічних проявів екземи й атопічної екземи; відношення шансів (OR) 0,74 (95% довірчий інтервал – ДІ – 0,55-0,98); р=0,035 для екземи; 0,66 (95% ДІ 0,46-0,95); р=0,025 для атопічної екземи. Dotterud і співавт. провели дослідження, метою якого була оцінка ефективності пробіотика, який містить комбінацію бактерій Lactobacillus rhamnosus GG, L. acidophilus, Bifidobacterium animalis, при застосуванні його у вагітних із 36 тижня вагітності та всім новонародженим з обтяженим анамнезом атопії до 3 міс, які були винятково на грудному вигодовуванні.
Хоча інші дослідники дійшли висновку, що використання багатокомпонентних пробіотиків пов’язане з ризиком сенсибілізації.
У публікаціях 2010-2012 рр. наведено переконливі докази доцільності використання пробіотиків у профілактиці АД у дітей.
Пробіотики в лікуванні АД
Група Kirjavainen провела два випробування в 2002 і 2003 роках, в якому порівнювали ефективність пробіотику, який містив біфідобактерії Lactis BB‑12, з плацебо у дітей з раннім початком атопічної екземи. Їх результати показали, що пробіотична добавка модулює склад мікрофлори кишечника таким чином, що може полегшити прояви алергічного запалення, і тільки життєздатні пробіотичні штами є безпечними і потенційно корисними в лікуванні АД.
Доведено позитивні ефекти при використанні пробіотиків у комплексному лікуванні бронхіальної астми, а також для полегшення перебігу АД.
Одним із найбільш вивчених у клінічних дослідженнях є штам біфідобактерій (особливо BB‑12). Проте незалежно від конкретного штаму доза пробіотику, що застосовується для досягнення терапевтичного ефекту, має становити не менше 109 КУО/день.
Незважаючи на те що протягом останніх 4 років опубліковано значну кількість оглядів, мета-аналіз і Cochrane Collaboration огляд, для остаточного встановлення ролі пробіотиків у лікуванні атопічних захворювань необхідні подальші дослідження.
Michail та співавт. представили дані мета-аналізу на підтвердження припущення, що пробіотики відіграють певну роль у лікуванні помірно тяжкого AД у дітей.
Висновки
Атопічний дерматит часто супроводжується патологією збоку шлунково-кишкового тракту, а саме значними дисбіотичними порушеннями у складі мікрофлори кишечника. Відомі та ретельно вивчені ефекти пробіотиків у складі біоплівки щодо можливої імунологічної дії, поліпшення функціонування активної поверхні кишечника шляхом її захисту та активації проліферації ентероцитів, зменшення проникності слизової кишечника. Пробіотики мають здатність активувати та виробляти низку ферментів (дисахаридази, казеїн-фосфатази) та сприяти утворенню в слизовій нормальної кількості діаміноксидази, що нейтралізує гістамін. Ґрунтуючись на результатах досліджень, які доводять ефективність пробіотиків як для запобігання, так і в комплексному лікуванні АД у дітей (їх слід вводити у кількості не менше ніж 109 КУО), можна зробити висновок про доцільність використання пробіотиків для полегшення перебігу АД і формування задовільної оральної толерантності, що знижує ризик реалізації атопії у клінічні прояви АД.
Зауважимо, що пробіотики, які використовують для досягнення вказаних ефектів, мають цілковито відповідати вимогам FAO/WHO: бути непатогенними та нетоксичними, виживати в кишечнику, зберігати стабільність складу протягом усього терміну зберігання; містити живі клітини, які виявляють високий антагонізм до патогенної та умовно-патогенної мікрофлори, мати генетичний паспорт та бути безпечними, не повинні пригнічувати нормальну мікрофлору.
! Сприятлива дія пробіотику є штам-специфічною та не може автоматично переноситися на інші штами. У разі використання комбінації пробіотичних штамів необхідно проводити дослідження ефективності саме цієї комбінації, оскільки взаємодія декількох штамів може змінити їх ефективність або сприяти додатковій сенсибілізації у дітей з атопією.
При призначенні пробіотиків у педіатрії слід також ураховувати фізіологічні особливості складу мікрофлори у віковому аспекті. У разі призначення пробіотиків новонародженому слід звертати особливу увагу на всі речовини, які містить у своєму складі препарат. Важливо, щоб пробіотичний штам був добре вивченим, а його безпечність при застосуванні доведеною.
На фармацевтичному ринку України з’явилися нові пробіотики, розроблені спеціально для наймолодших пацієнтів, – Лінекс Бебі® та Лінекс® Дитячі краплі, до складу яких входять виключно Bifidobacterium animalis subsp. lactis (109 КУО), в одному пакеті/6 краплях.
Bifidobacterium animalis subsp. lactis є одним із найбільш вивчених пробіотичних штамів у світі. Його ефективність і безпечність підтверджують результати понад 300 досліджень, із них 130 – клінічні випробування, у тому числі за участю недоношених дітей.
Препарати, створені на основі цього штаму, використовуються у клінічній практиці понад 30 років. У дослідженнях in vitro штам продемонстрував відмінну кислотостійкість, толерантність до жовчі, здатність пригнічувати ріст патогенів, позитивний вплив на стан бар’єрної функції кишечника, посилення імунної відповіді.
In vivo підтверджено здатність штаму залишатися живим у шлунково-кишковому тракті, підтримувати здорову мікробіоту кишечника, коригувати моторику кишечника при закрепах і виявляти позитивну дію при діареї, знижувати частоту побічних ефектів антибіотикотерапії, підвищувати резистентність до респіраторних інфекцій, зменшувати частоту алергічних реакцій тощо. Механізми позитивного впливу Bifidobacterium animalis subsp. lactis достатньо добре вивчені. Вплив на патогенні бактерії здійснюється шляхом зниження рівня рН у кишковому тракті; вироблення метаболітів, токсичних для патогенних бактерій; вироблення антибактеріальних речовин; конкуренції з патогенами за поживні речовини; блокування адгезивних рецепторів тощо. В експериментах in vitro доведено здатність пробіотичного штаму Bifidobacterium animalis subsp. lactis синтезувати антагоністичні субстанції відносно Bacilluscereus, Clostridium difficile, Clostridium perfringens Type A, Escherichiacoli ATCC4328, Enterococcus faecalis, Listeria monocytogenes, Pseudomonas aeruginosa, Salmonella enterica subsp. enterica serovar Typhi murium, S. Enterica subsp. Enterica serovar Typhi, Shigella sonnei та Сandida albicans. Здатність конкурентно інгібувати локуси адгезії на слизовій оболонці кишечника була продемонстрована відносно Bacteroides vulgatus, Clostridium histolyticum, C. difficile, Enterobacter aerogenes, L. monocytogenes, S. Enterica serovar Typhi murium та Staphylococcus aureus.
Bifidobacterium animalis subsp. lactis є природним компонентом грудного молока та виділяється з калових мас дитини з перших днів її життя. Бактерія, що входить до складу Лінекс Бебі® та Лінекс® Дитячі краплі, має статус GRAS (generally recognized as safe) – загальновизнана як безпечна для застосування. Із 1993 року ця бактерія використовується в усьому світі як компонент дитячих сумішей для вигодовування новонароджених (схвалено Управлінням з контролю якості харчових продуктів і лікарських препаратів (FDA) США), про побічні ефекти при її використанні не повідомлялося. Препарати застосовують у вигляді суспензії або крапель для дітей з народження до 12 років при діареї різного ґенезу (вірусній, бактеріальній, спричиненій прийомом антибіотиків). Крім того, Лінекс Бебі® та Лінекс® Дитячі краплі – оптимальні пробіотики для стабілізації та підтримання функції мікрофлори кишечника, особливо у дітей раннього віку з малюковими та кишковими коліками, регургітацією, функціональними запорами та проносами, які мають прояви мальабсорбції та мальдигестії, ознаки дисбіозу кишечника. Ці пробіотики не містять барвників, ароматизаторів, вітамінів, лактози, що знижує ризик непереносимості та алергії, забезпечує високий профіль безпеки при використанні у найменших пацієнтів.
Здорова мікрофлора при первинній колонізації кишечника дитини сприяє формуванню імунної системи та морфофункціональному дозріванню шлунково-кишкового тракту, що має важливе значення для профілактики багатьох захворювань.
3Toll-подібні рецептори (TLRs) – сімейство мембранних глікопротеїнів, наявних на макрофагах, нейтрофілах і дендритних клітинах. Налічується 10 типів TLR. Структура TLR досить проста: існує цитоплазматичний домен і домен, який знаходиться на зовнішній мембрані клітини і безпосередньо взаємодіє з антигенами.
Література
1. Johansson S.G.O., Hourihane J.O’B., Busquet J. et al. A revised nomenclature for allergy. An EAACI position statement from EAACI nomenclature task force. Allergy. 2001; 56: 813-824.
2. Johansson S.G.O., Bieber N., Dahl R. et al. Revised nomenclature for allergy for global use: Report of the nomenclature review committee of the World Allergy Organisation, October 2003. Journal of Allergy and Clinical Immunology. 2004; 113: 832-836.
3. Engelman P., Herz U., Holt P. et al. New vision for basic research and primary prevention of pediatric allergy: an iPAC summary and future trends. Pediatric Allergy and Immunology. 2008; 19: 4-16.
4. Bershad S.V. In the clinic. Atopic dermatitis (eczema). Ann. Intern. Med. 2011; 155: 51-15.
5. Діагностика та терапія атопічного дерматиту (Стандарти діагностики та терапії) / Укладачі: Л.Д. Калюжна, Я.Ф. Кутасевич, Е.М. Солошенко, Т.В. Проценко, В.Г. Радіонов та ін. – К., 2002.
6. Нові підходи до терапії та контролю атопічного дерматиту: методичні рекомендації / Укладачі: Л.Д. Калюжна, Я.Ф. Кутасевич, Т.В. Проценко, І.О. Олійник. – К., 2005.
7. Патогенез, клиника, диагностика и лечение атопического дерматита: информационно-методическое пособие для практикующего врача / Составители: В.Г. Радионов, О.С. Гусак, В.Н. Любимцева, Л.М. Белецкая и др. – Изд-е 2-е. – Луганск. – 2003.
8. Адаптовані клінічні настанови з діагностики, профілактики та лікування атопічного дерматиту / Ред. Ю. Андрашко. – К., 2012.
9. Протокол діагностики та лікування дітей з атопічним дерматитом: Додаток до наказу МОЗ від 27.12.2005 № 767.
10. Carroll C.L., Balkrishnan R., Feldman S.R. et al. The burden of atopic dermatitis: impact on the patient, family, and society. Pediatr Dermatol. 2005; 22: 192-9.
11. Barnetson R., Rogers M. Childhood atopic eczema. BMJ. 2002; 324: 1376-9.
12. Strachan D.P. Family size, infection and atopy: The first decade of the «hygiene hypothesis». Thorax. 2000; 55: 2-1010.
13. Schmidt W.P. Model of the epidemic of childhood atopy. Med. Sci. Monit. 2004; 10: 5-9.
14. Strachan D.P. Family size, infection and atopy: The first decade of the «hygiene hypothesis». Thorax. 2000; 55: 2-1012.
15. Berg R.D. The indigenous gastrointestinal microflora. Trends Microbiol. 1996; 4: 430-435.
16. Mackie R.I., Sghir A., Gaskins H.R. Developmental microbial ecology of the neonatal. J. Clin. Nutr. 1999; May; 69 (5): 1035-1045.
17. Björksten B. The intrauterine and postnatal environments. J. Allergy Clin. Immunol. 1999; 104: 1119-1127.
18. Berg R.D. The indigenous gastrointestinal microflora. Trends Microbiol. 1996; 4: 430-435.
19. Gaskins H.R. Immunological aspects of host/microbiota interactions at the intestinal epithelium. In: Gastrointestinal Microbes and Host Interactions; Eds. Mackie R.I., White B.A., Isaacson R.E., International Thomson Publishing. 1997; p. 537-587.
20. Cebra J.J. Influences of microbiota on intestinal immune system development. Am. J. Clin. Nutr. 1999; 69: 1046-1051.
21. Sudo N., Sawamura S., Tanaka K., Aiba Y., Kubo C., Koga Y. The requirement of intestinal bacterial flora for the development of an IgE production system fully susceptible to oral tolerance induction. J. Immunol. 1997; 159: 1739-1745.
22. Mossman T.R., Cherwinski H., Bond M.W., Gielin M.A., Coffman R.L. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J. Immunol. 1986; 136: 2348-57.
23. Kalliomki M., Kirjavainen P., Eerola E., Kero P., Salminen S., Isolauri E. Distinct patterns of neonatal gut microflora in infants in whom atopy was and was not developing. J. Allergy Clin. Immunol. 2001; 107: 129-134.
24. Bjrksten B., Sepp E., Julge K., Voor T., Mikelsaar M. Allergy development and the intestinal microflora during the first year of life. J. Allergy Clin. Immunol. 2001; 108: 516-520.
25. Kalliomki M., Salminen S., Poussa T., Arvilommi H., Isolauri E. Probiotics and prevention of atopic disease: 4-year followup of a randomised placebo-controlled trial. Lancet. 2003; 361:1869-1871.
26. Kalliomki M., Salminen S., Poussa T., Isolauri E. Probiotics during the first 7 years of life: A cumulative risk reduction of eczema in a randomized, placebo-controlled trial. J. Allergy Clin. Immunol. 2007; 119: 1019-1021.
27. Winkler P., Ghadimi D., Schrezenmeir J., Kraehenbuhl J.P. Molecular and cellular basis of microflora-host interactions. J. Nutr. 2007; 137: 756-772.
28. Meneghin F., Fabiano V., Mameli C., Zuccotti G.V. Probiotics and Atopic Dermatitis in Children. Pharmaceuticals. 2012; Jul; 5 (7): 727-744.
29. Kukkonen K., Savilahti E., Haahtela T., Juntunen-Backman K., Korpela R., Poussa T., Kuitunen M. Probiotics and prebiotic galacto-oligosaccharides in the prevention of allergic diseases: A randomized, doubleblind, placebo-controlled trial. J. Allergy Clin. Immunol. 2007; 119: 192-198.
30. Dotterud C.K., Storro O., Johnsen R., Oien T. Probiotics in pregnant women to prevent allergic disease: A randomized, double-blind trial. Br. J. Dermatol. 2010; 163: 616-623.
31. Kim J.Y., Kwon J.H., Ahn S.H., Lee S.I., Han Y.S., Choi Y.O., Lee S.Y., Ahn K.M., Ji G.E. Effect of probiotic mix (Bifidobacterium bifidum, Bifidobacterium lactis, Lactobacillus acidophilus) in the primary prevention of eczema: A double-blind, randomized, placebo-controlled trial. Pediatr. Allergy Immunol. 2010; 21: e386-e393.
32. Huurre A., Laitinen K., Rautava S., Korkeamki M., Isolauri E. Impact of maternal atopy and probiotic supplementation during pregnancy on infant sensitization: A double-blind placebo-controlled study. Clin. Exp. Allergy. 2008; 38: 1342-1348.
33. Lee J., Seto D., Bielory L. Meta-analysis of clinical trials of probiotics for prevention and treatment of pediatric atopic dermatitis. J. Allergy Clin. Immunol. 2008; 121: 116-121.
34. Kalliomki M., Antoine J.M., Herz U., Rijkers G.T., Wells J.M., Mercenier A. Guidance for substantiating the evidence for beneficial effects of probiotics: Prevention and management of allergic diseases by probiotics. J. Nutr. 2010; 140: 713-721.
35. Doege K., Grajecki D., Zyriax B.C., Detinkina E., Zu Eulenburg C., Buhling K.J. Impact of maternal supplementation with probiotics during pregnancy on atopic eczema in childhood: A meta-analysis. Br. J. Nutr. 2012; 107: 1-6.
36. Pelucchi C., Chatenoud L., Turati F., Galeone C., Moja L., Bach J.F., La Vecchia. Probiotics supplementation during pregnancy or infancy for the prevention of atopic dermatitis: A meta-analysis. Epidemiology. 2012; 23: 402-414.
37. Kirjavainen P., Arvola T., Salminen S., Isolauri E. Aberrant composition of gut microbiota of allergic infants: A target of bifidobacterial therapy at weaning? Gut. 2002; 51: 51-55.
38. Kirjavainen P., Salminen S., Isolauri E. Probiotic Bacteria in the management of atopic disease: Underscoring the importance of viability. J. Pediatr. Gastr. Nutr. 2003; 36: 223-227.
39. Weston S., Halbert A., Richmond P., Prescott S.L. Effects of probiotics on atopic dermatitis: A randomized controlled trial. Arch. Dis. Child. 2005; 90: 892-897.
40. Pediatric atopic dermatitis: A meta-analysis of randomized controlled trials. Ann. Allergy Asthma Immunol. 2008; 101: 508-516.
41. Урсова Н.И. Пробиотики в комплексной коррекции дисбактериоза кишечника у детей / Н.И. Урсова // Лечащий врач. – 2008. – № 1. – С. 12-14.
42. Роль пробиотиков в питании детей грудного возраста: Заключение экспертов по итогам круглого стола (9 декабря 2008 г., Киев) // Здоровье ребенка. – 2009. – № 3 (18).
43. Хавкин А.И. Пробиотические продукты питания и естественная защитная система организма / А.И. Хавкин // Русский медицинский журнал. – 2009. – Т. 17. – № 4. – С. 241-245.
44. Jungersen M. The Science behind the Probiotic Strain Bifidobacterium animalis subsp. Lactis BB‑12® / M. Jungersen, A. Wind, E. Johansen et al. // Microorganisms. – 2014. – № 2. – p. 92-110.
45. Майданник В.Г. Клинические рекомендации по применению пробиотиков в педиатрической практике / В.Г. Майданник. – К., 2013. – 30 с.
4-05-ЛИН-ОТС‑0617
Тематичний номер «Педіатрія» №4 (43), грудень 2017 р.