26 грудня, 2017
Міокардит у дітей
 Міокардит – це запальне захворювання міокарда, яке виникає внаслідок впливу різноманітних факторів та супроводжується інфільтрацією імунними клітинами та некрозом кардіоміоцитів [2].
Міокардит – це запальне захворювання міокарда, яке виникає внаслідок впливу різноманітних факторів та супроводжується інфільтрацією імунними клітинами та некрозом кардіоміоцитів [2].
У МКХ‑10 виділяють:
I40 – гострий міокардит;
I40.0 – інфекційний міокардит;
I40.1 – ізольований міокардит;
I40.8 – інші види гострого міокардиту;
I40.9 – гострий міокардит неуточнений;
I41 – міокардит при хворобах, класифікованих в інших рубриках;
I41.0 – міокардит при бактеріальних хворобах, класифікованих в інших рубриках;
I41.1 – міокардит при вірусних хворобах, класифікованих в інших рубриках;
I41.2 – міокардит при інших інфекційних та паразитарних хворобах, класифікованих в інших рубриках;
I41.8 – міокардит при інших хворобах, класифікованих в інших рубриках;
I51.4 – міокардит неуточнений.
Епідеміологія
Показники поширеності міокардиту серед дитячого населення визначити вкрай складно через брак достатньо чутливих та специфічних діагностичних критеріїв із застосуванням неінвазивних методів дослідження. За даними M.C. Levine, D. Klugman, S.J. Teach (2010), частота гострого міокардиту становить приблизно 1 випадок на 100 тис. [24]. За наявними клінічними даними, міокардит виявляють у 0,6-1,7% госпіталізованих хворих, здебільшого при аутопсії (0,4-12,8%). Зараз спостерігається як абсолютне, так і відносне збільшення числа дітей з неревматичними кардитами, а гістологічні ознаки міокардиту при аутопсії виявляють у 1/8 дітей у випадках їх раптової смерті [31].
Етіологія
 Основні причини розвитку міокардиту можна поділити на: інфекційні, аутоімунні/аутозапальні та реакції гіперчутливості (токсикоалергічні міокардити). У таблиці 1 подано етіологічні фактори міокардиту в дітей. Теоретично будь-який інфекційний збудник може спричинити міокардит [9]. Проте переважає вірусне ураження міокарда – у понад 50% випадків захворювання [3].
Основні причини розвитку міокардиту можна поділити на: інфекційні, аутоімунні/аутозапальні та реакції гіперчутливості (токсикоалергічні міокардити). У таблиці 1 подано етіологічні фактори міокардиту в дітей. Теоретично будь-який інфекційний збудник може спричинити міокардит [9]. Проте переважає вірусне ураження міокарда – у понад 50% випадків захворювання [3].
Патогенез
У розвитку вірусного міокардиту виділяють 3 фази: гостру, підгостру та хронічну. Гостра фаза захворювання, яка зазвичай триває від кількох днів до 3 тижнів, включає процес рецептор-опосередкованого ендоцитозу вірусу в кардіоміоцит (для вірусу Коксакі В та аденовірусу це спільний ядерний рецептор – конститутивний андростанпрегнановий рецептор – без якого не відбувається інвазії віріонів), реплікацію його всередині клітин, його вихід та інфікування інших міоцитів.
У цей період головну роль відіграє пряма вражаюча дія вірусу на серцевий м’яз, оскільки реплікація та вихід вірусу з клітини може супроводжуватися лізисом кардіоміоцитів. Іншим, не менш важливим, патогенним фактором є дія вірусних протеаз всередині клітин міокарда.
Розщеплення ними білка дистрофіну призводить до дезінтеграції кардіоміоцитів та систолічної дисфункції шлуночків серця [31]. Потім починається ініціація імунної відповіді на реплікацію вірусу, яка проявляється інфільтрацією міокарда спочатку натуральними кілерами та макрофагами, згодом – Т-лімфоцитами [21]. Слід зазначити, що некроз міоцитів також призводить до вивільнення внутрішньоклітинних білків (наприклад, міозину), які в нормі є «прихованими» та не потрапляють у поле зору імунної системи.
Підгостра фаза вірусного міокардиту, що триває від кількох тижнів до кількох місяців, характеризується імунними та аутоімунними реакціями. Вірус-специфічні Т-кілери та вірус-нейтралізуючі антитіла у більшості випадків протягом цього періоду очищують міокард від вірусу. Проте вказані ланки імунітету перехресно уражають міокард за рахунок феномена молекулярної мімікрії. Крім того, в гостру фазу вивільнення «внутрішніх» протеїнів кардіоміоцитів під час їх лізису може призвести до аутоімунізації та синтезу аутоантитіл проти запального міокарда. Внаслідок вказаних процесів збільшується ураження серцевого м’яза та погіршуються клінічні прояви перебігу захворювання [37]. Важливе значення в підгостру та хронічну фази має гіперпродукція фактора некрозу пухлини, інтерлейкіну‑1 та -6 в міокарді, яка підтримує запальний процес та індукує апоптоз кардіоміоцитів.
У більшості випадків міокардит закінчується одужанням та не переходить у хронічну фазу (фаза постміокардитичної дилатаційної кардіоміопатії – ДКМП), оскільки внаслідок очищення серцевого м’яза від вірусу, як правило, відбувається супресія імунних та аутоімунних процесів. Проте в окремих випадках міокард повністю не очищується від вірусної інфекції, спостерігаються її хронічне персистування та аутоімунна відповідь із синтезом антитіл до запального міокарда із переходом захворювання у хронічну форму [21, 37].
Патогенез, в якому важливу роль відіграє як ураження міокарда збудником, так й імунна відповідь, наявний при бактеріальних, грибкових та паразитарних міокардитах. При дифтерійному міокардиті має значення також токсичний вплив на міокард екзотоксину Corynebacterium diphtheriae.
При еозинофільному (токсикоалергічному) міокардиті, який може розвинутися внаслідок алергії, паразитарних інвазій, реакції гіперчутливості до ліків, відбувається еозинофільна інфільтрація міокарда з токсичним впливом еозинофілів на серцевий м’яз [17].
Класифікація
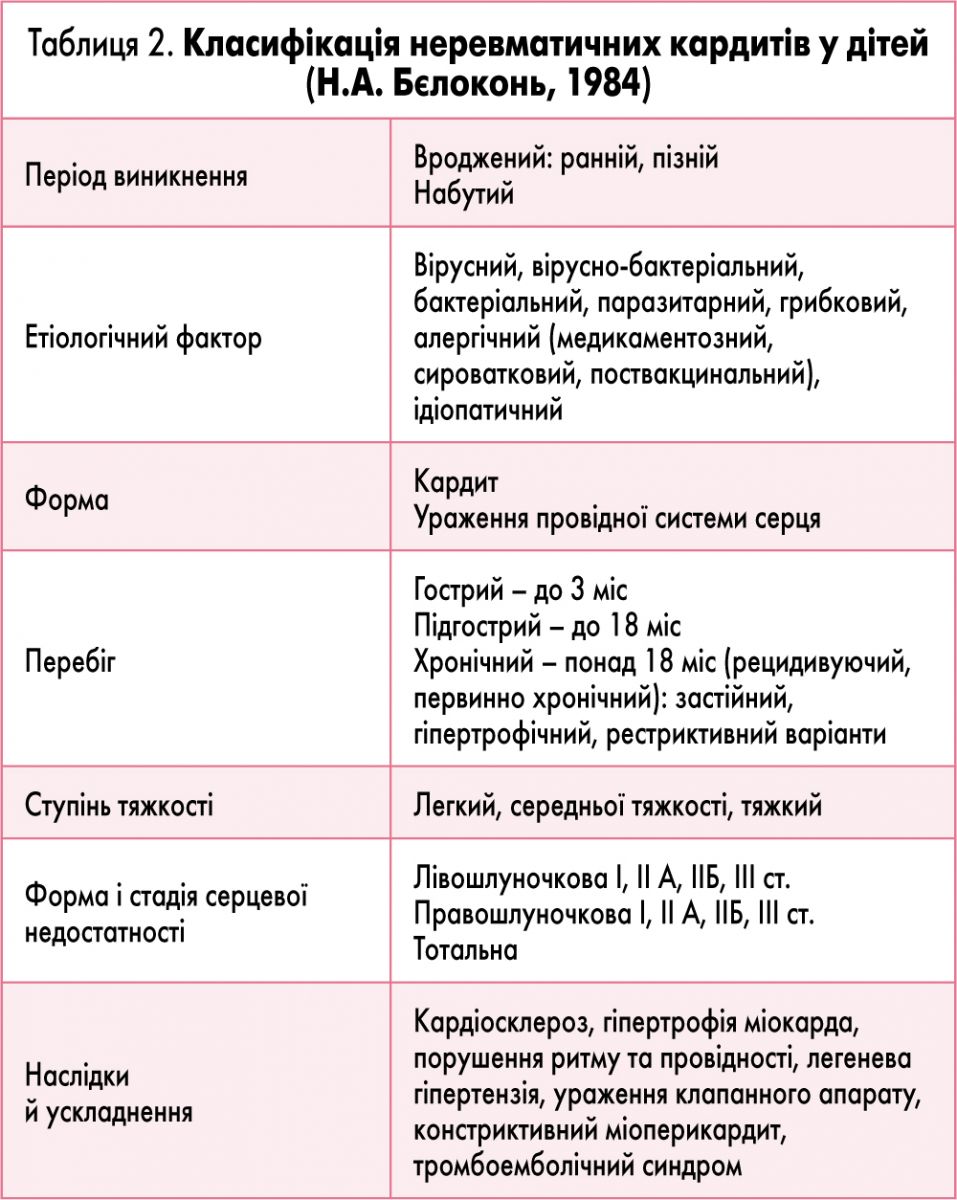 Найбільш зручною для практичного використання є класифікація неревматичних міокардитів у дітей професора Н.А. Бєлоконь. У ній враховано етіологічний фактор, форму, перебіг, тяжкість захворювання, ступінь серцевої недостатності (СН), наслідки та ускладнення (табл. 2).
Найбільш зручною для практичного використання є класифікація неревматичних міокардитів у дітей професора Н.А. Бєлоконь. У ній враховано етіологічний фактор, форму, перебіг, тяжкість захворювання, ступінь серцевої недостатності (СН), наслідки та ускладнення (табл. 2).
Згідно з клінічною класифікацією міокардитів, прийнятою на VI Конгресі кардіологів України (2000), виділяють:
I. Гострий міокардит:
1) з установленою етіологією (інфекційний, бактеріальний, вірусний, паразитарний, при інших захворюваннях);
2) неуточнений.
II. Хронічний, неуточнений міокардит.
III. Міокардіофіброз.
IV. Поширеність:
1) ізольований (вогнищевий);
2) дифузний.
V. Перебіг захворювання:
1) легкий (за відсутності збільшення серця і застійної СН);
2) середньої тяжкості (збільшення розмірів серця без СН);
3) тяжкий (кардіомегалія з ознаками СН, кардіогенним шоком, тяжким порушенням ритму).
VI. Клінічні варіанти: аритмія, порушення реполяризації, кардіалгія та ін.
VII. Серцева недостатність (0-III стадії).
Клінічна картина
Ранній вроджений кардит виникає внаслідок дії етіологічних агентів на серце плода в ранній фетальний період (4-7 міс. вагітності), коли тканини серця плода ще не можуть відповісти адекватною запальною реакцією, а відповідають реакцією проліферації сполучної тканини, із формуванням фіброзної та еластичної тканин. Процес починається з ендокарда, потім у нього залучається міокард. Залежно від того, волокна яких тканин переважають, розвивається або фіброеластоз, або еластофіброз міокарда. Дитина зазвичай народжується з порушенням скоротливої функції міокарда, з дилатацією його порожнин. Ранній вроджений кардит клінічно маніфестує в перші 1-6 міс життя дитини. Діти народжуються з нормальною або помірно зниженою масою тіла, з подальшим прогресивним відставанням у масі тіла та фізичному розвитку через прогресування СН. На електрокардіографії (ЕКГ) реєструються ознаки гіпертрофії лівого передсердя і лівого шлуночка (ЛШ), часто – з глибокими зубцями Q у відведеннях II, III, AVF, V5-6. Характерні зміни реполяризації у вигляді інверсії сегмента ST у «лівих» відведеннях, що, ймовірно, пов’язано з ішемією субендокардіальних шарів міокарда. Можливі порушення внутрішньошлуночкової провідності, блокада лівої ніжки пучка Гіса.
При рентгенографії грудної клітки виявляється посилення легеневого малюнка за рахунок венозного застою. Серце, як правило, значно збільшене (кардіоторакальний індекс – більше 60%), переважно за рахунок ЛШ.
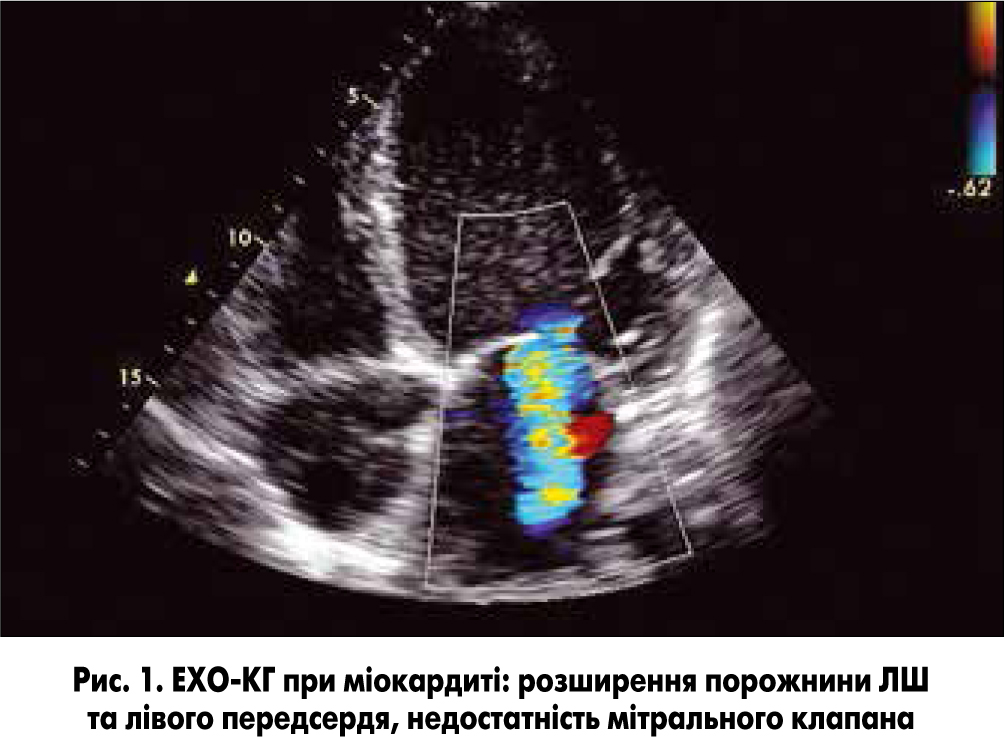 При проведенні ехокардіографії (ЕХО-КГ) визначаються ущільнення ехосигналу від ендокарда, значна дилатація ЛШ і лівого передсердя, гіпокінезія міжшлуночкової перетинки (рис. 1). Відзначається різке зменшення фракції викиду (ФВ) нижче 45-50%.
При проведенні ехокардіографії (ЕХО-КГ) визначаються ущільнення ехосигналу від ендокарда, значна дилатація ЛШ і лівого передсердя, гіпокінезія міжшлуночкової перетинки (рис. 1). Відзначається різке зменшення фракції викиду (ФВ) нижче 45-50%.
Пізній вроджений кардит виникає в останньому триместрі вагітності (після 7 міс внутрішньоутробного розвитку), коли організм плода вже здатний відповідати запальною реакцією на пошкоджуючий агент. У таких випадках запалення в міокарді перебігає так само, як і в дітей з набутим міокардитом. Дитина може народитися як із наслідками перенесеного кардиту, так і з активним запальним процесом у міокарді.
Наслідки пізнього вродженого кардиту – це стійкі порушення ритму або провідності (екстрасистолія, тріпотіння передсердь, пароксизмальна або непароксізмальна тахікардія, АВ-блокади, блокади ніжок пучка Гіса), стійкі порушення процесів реполяризації, збільшення електричної активності ЛШ, які можна виявити у новонародженого вже в період від 0 до 28 днів. При проведенні ЕХО-КГ може бути виявлено незначне розширення ЛШ. Лабораторні показники крові – в межах норми.
Скарги. У дітей молодшого віку можуть бути: блювання (48%) та зниження апетиту (40%), підвищене потовиділення при напрузі, порушення сну, збудливість; у старших дітей – млявість, швидка втомлюваність. У деяких випадках спостерігається лихоманка або субфебрильна температура тіла. Можливі скарги на відчуття серцебиття, перебоїв у роботі серця, може виникати пресинкопе або синкопе внаслідок порушень ритму.
Анамнестичні дані щодо перенесеного вірусного захворювання (катаральних явищ збоку верхніх дихальних шляхів чи гастроінтестинальних проявів) протягом останніх 10-14 днів мають майже 90% дітей з вірусним міокардитом [31, 37]. При еозинофільному міокардиті у третини пацієнтів наявний анамнез алергічних захворювань (бронхіальна астма, алергічний риніт, атопічний дерматит) [17].
При зборі анамнезу в дітей з Лайм-кардитом виявляється укус кліща та поява мігруючої еритеми в місці укусу, а ураження серця виникає через кілька тижнів після появи місцевих проявів захворювання. Якщо міокардит розвивається на тлі інших патологічних станів (скарлатини, дифтерії, системних запальних захворювань сполучної тканини, системних васкулітів тощо), то ураження міокарда клінічно проявляються на тлі симптоматики основного захворювання.
Клінічна картина гострого міокардиту характеризується синдромом малого серцевого викиду, застійними явищами у великому та малому колах кровообігу, порушенням ритму та тромбоемболіями, загальними проявами. Спостерігаються симптоми застійної СН за лівошлуночковим типом, задишка, порушення фізичного розвитку. Синдром малого серцевого викиду ЛШ проявляється тахікардією та ниткоподібним пульсом, болем у животі та диспепсією (мезентеріальна ішемія), позитивним симптомом блідої плями. Симптомами застійної СН за правошлуночковим типом є периферичні набряки, асцит, гепатомегалія (у 50% хворих), набухання шийних вен [31]. Іноді першим проявом міокардиту у дітей є синдром раптової серцевої смерті. У дітей з гострим міокардитом при аускультації виявляються: послаблення тонів серця, порушення ритму, тахікардія, ритм галопу, систолічний шум на верхівці серця з іррадіацією в ліву пахвову ділянку (відносна мітральна недостатність), симетричні вологі дрібноміхурчасті хрипи в базальних відділах легень (застій крові в малому колі кровообігу). Артеріальний тиск, як правило, перебуває в межах норми, але може знижуватися при фульмінантному перебігу міокардиту.
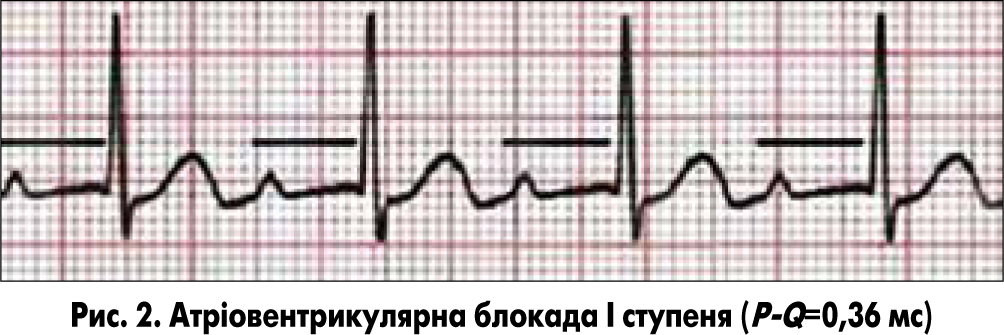 Інструментальні методи обстеження. ЕКГ, холтерівське моніторування (ХМ) ЕКГ. Найчастіше під час ЕКГ при міокардиті виявляють: синусову тахікардію, відхилення електричної осі серця вліво, ознаки гіпертрофії ЛШ або обох шлуночків, порушення процесів реполяризації (елевація чи депресія сегмента ST, неспецифічні зміни зубця T, подовження інтервалу QT), порушення провідності (атріовентрикулярна блокада І-ІІІ ступеня (рис. 2), порушення внутрішньошлуночкової провідності), надшлуночкову або шлуночкову екстрасистолію [12, 31]. При екстрасистолії показане ХМ ЕКГ для визначення кількості екстрасистол за добу та вирішення питання про необхідність антиаритмічної терапії.
Інструментальні методи обстеження. ЕКГ, холтерівське моніторування (ХМ) ЕКГ. Найчастіше під час ЕКГ при міокардиті виявляють: синусову тахікардію, відхилення електричної осі серця вліво, ознаки гіпертрофії ЛШ або обох шлуночків, порушення процесів реполяризації (елевація чи депресія сегмента ST, неспецифічні зміни зубця T, подовження інтервалу QT), порушення провідності (атріовентрикулярна блокада І-ІІІ ступеня (рис. 2), порушення внутрішньошлуночкової провідності), надшлуночкову або шлуночкову екстрасистолію [12, 31]. При екстрасистолії показане ХМ ЕКГ для визначення кількості екстрасистол за добу та вирішення питання про необхідність антиаритмічної терапії.
Рентгенографія органів грудної клітки. Наявність рентгенологічних змін залежить від тяжкості перебігу міокардиту. Найчастіше виявляють кардіомегалію, дилатацію ЛШ (форма качки), лівого передсердя (згладження талії серця), при застійній СН за лівошлуночковим типом – ознаки застою крові в базальних відділах легень, інфільтрати в легенях (при еозинофільному міокардиті).
Трансторакальна доплерехокардіографія є інформативною для констатації ураження міокарда, особливо при дифузному його залученні. У такому випадку виявляють: зниження скоротливості ЛШ, дилатацію порожнини, відносну недостатність мітрального, трикуспідального клапанів через розширення атріовентрикулярних отворів, відносне вкорочення хорд при дилатації порожнини шлуночків та/або дисфункції папілярних м’язів за умови залучення їх у запальний процес. При фульмінантному міокардиті порожнини шлуночків мають нормальні розміри на тлі значно потовщеної через набряк міокарда міжшлуночкової перетинки [21].
У випадках локального залучення міокарда шлуночків можливості ЕХО-КГ значно обмежені. Дослідження Goitein та співавт. (2009) показало, що лише 8 (35%) із 23 дорослих хворих на гострий міокардит із ознаками регіонарного ураження міокарда, за даними магнітно-резонансної томографії (МРТ) серця з контрастуванням, мали ознаки гіпокінезії або дискінезії його стінки за результатами ЕХО-КГ [15].
МРТ серця (МРТс) є перспективним методом неінвазивної діагностики міокардиту. Чутливість та специфічність МРТс для виявлення цієї патології у дорослих становить 86 та 95%, тоді як для ендоміокардіальної біопсії (ЕМБ) за так званими Далласькими критеріями – 35-50% та 78-89% відповідно. Таким чином, МРТс не поступається ЕМБ за інформативністю стосовно виявлення запального процесу в міокарді і при цьому є неінвазивною процедурою (хоча проведення МРТс у маленьких дітей потребує загальної анестезії). Недоліками цього методу є визначення непрямих ознак запалення міокарда замість виявлення запальної інфільтрації «під мікроскопом», а також неможливість визначити наявність вірусного геному в міокарді.
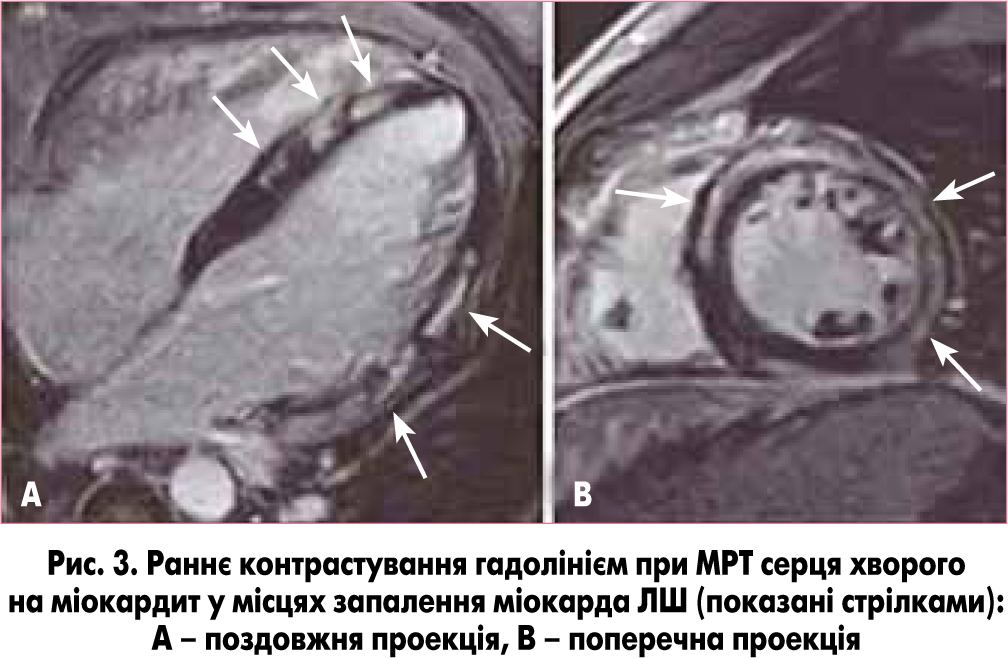 Для діагностики міокардиту за даними МРТ використовують погоджені критерії консенсусу Лейк-Луїз (Lake Louisе Consensus Criteria). Відповідно до цього консенсусу, максимальна діагностична точність може бути досягнута за наявності ≥2 з перелічених критеріїв: регіонарне або дифузне посилення сигналу від міокарда в Т2-зваженому режимі (відображає набряк), підвищення співвідношення загальної інтенсивності сигналу від міокарда та інтенсивності сигналу від скелетних м’язів (рис. 3) при ранньому контрастуванні гадолінієм у T1-зваженому режимі (відображає гіперемію та підвищення проникності капілярів) або наявність принаймні одного локусу ураження з нехарактерним для ішемічного розташуванням при відстроченому контрастуванні гадолінієм (відображає некроз міокарда) [13].
Для діагностики міокардиту за даними МРТ використовують погоджені критерії консенсусу Лейк-Луїз (Lake Louisе Consensus Criteria). Відповідно до цього консенсусу, максимальна діагностична точність може бути досягнута за наявності ≥2 з перелічених критеріїв: регіонарне або дифузне посилення сигналу від міокарда в Т2-зваженому режимі (відображає набряк), підвищення співвідношення загальної інтенсивності сигналу від міокарда та інтенсивності сигналу від скелетних м’язів (рис. 3) при ранньому контрастуванні гадолінієм у T1-зваженому режимі (відображає гіперемію та підвищення проникності капілярів) або наявність принаймні одного локусу ураження з нехарактерним для ішемічного розташуванням при відстроченому контрастуванні гадолінієм (відображає некроз міокарда) [13].
Міокардит у дітей характеризується переважно субепікардіальним і трансмуральним ураженням латеральної стінки ЛШ [39]. Натомість ішемічне ураження міокарда характеризується здебільшого ендокардіальною або трансмуральною локалізацією.
Згідно з результатами дослідження Mahrholdt та співавт. (2006), патерн залучення міокарда при вірусному міокардиті на МРТ серця відрізняється залежно від типу вірусу та може визначати прогноз перебігу захворювання. Наприклад, пацієнти з міокардитом, спричиненим парвовірусом В19, мали субепікардіальне ураження вільної стінки ЛШ при відстроченому контрастуванні гадолінієм, вони одужували протягом декількох місяців. Натомість у тих хворих, міокард яких був уражений вірусом герпесу 6 типу, у процес залучено міжшлуночкову перетинку, а міокардит часто прогресував до хронічної СН [26].
Сцинтиграфія з міченими індієм‑111 антиміозиновими антитілами. Діагностичне значення цього методу для виявлення міокардиту у дітей є сумнівним. Негативні результати тесту практично завжди збігаються з негативними результатами ЕМБ (92-98%), тому це дослідження доцільно проводити для виключення діагнозу. Водночас високий відсоток хибнопозитивних результатів ставить під сумнів його діагностичну цінність для підтвердження наявності міокардиту.
ЕМБ – золотий стандарт діагностики міокардиту в європейській та американській кардіології [37]. Класичними гістологічними критеріями наявності міокардиту є так звані Даллаські критерії, за якими міокардит поділяють на активний та межовий [5]:
- активний міокардит – наявність запального інфільтрату міокарда з некрозом та/або дегенерацією суміжно розташованих кардіоміоцитів, нетипових для коронарогенного ішемічного ураження;
- межовий міокардит – наявність запального інфільтрату міокарда без некрозу або дегенерації суміжно розташованих кардіоміоцитів.
Проте широка варіабельність трактовки результатів біопсії за Далласькими критеріями зумовила сумнівність відтворюваності цього методу. Саме тому Всесвітня організація охорони здоров’я (ВООЗ) розробила так звану Магбурзьку класифікацію результатів ЕМБ (1995) [33].
Сильними сторонами цієї класифікації є точні критерії запальної інфільтрації міокарда та характеристика динаміки перебігу міокардиту за даними повторних біопсій.
Початкова ЕМБ
- Гострий (активний) міокардит: чітко окреслена інфільтрація (дифузна, вогнищева або зливна), більше 14 лейкоцитів/мм2 поля зору (переважно активовані Т-клітини або макрофаги). Концентрацію імунних клітин слід виміряти кількісно за допомогою імуногістохімічного методу. Наявність некрозу або дегенерації кардіоміоцитів є обов’язковою; фіброз може бути відсутнім або наявним, його ступінь також має бути класифікований.
- Хронічний міокардит: інфільтрація >14 лейкоцитів/мм2 (дифузна, фокальна або зливна, переважно активовані Т-клітини або макрофаги). Концентрацію імунних клітин слід виміряти кількісно за допомогою імуногістохімічного методу. Некроз або дегенерація кардіоміоцитів не спостерігається; фіброз може бути відсутнім або наявним, його ступінь також має бути класифікований.
- Міокардит відсутній: немає інфільтрації лейкоцитами або їх кількість менше 14 лейкоцитів/мм2.
Проведення подальших біопсій дає можливість визначити:
- персистуючий міокардит: відповідає критеріям гострого або хронічного міокардиту за результатами початкової біопсії;
- міокардит у стадії розрішення: відповідає критеріям гострого або хронічного міокардиту за результатами початкової біопсії, але запальний процес менш виражений, ніж при першій біопсії;
- при одужанні інфільтрації лейкоцитами немає або їх кількість менше 14 лейкоцитів/мм2.
Обсяг фіброзу визначають як: відсутній (ступінь 0), незначний (ступінь І), помірний (ступінь ІІ) або тяжкий (ступінь ІІІ). За локалізацією та характером формування виокремлюють ендокардіальний, із заміщенням кардіоміоцитів, або інтерстиціальний фіброз.
ЕМБ дає можливість безпосередньо визначити наявність вірусного геному в біоптаті міокарда методом полімеразної ланцюгової реакції (ПЛР) або гібридизації in situ, що:
- є ключовим фактором вибору тактики противірусної чи імуносупресивної терапії вірусного міокардиту;
- дозволяє визначити тип міокардиту: гігантоклітинний (інфільтрація багатоядерними гігантськими клітинами), саркоїдозний (виявлення гранульом), еозинофільний (наявність інфільтрації міокарда еозинофілами);
- диференціювати хронічний міокардит та ДКМП (за відсутності запальної інфільтрації);
- визначити інфільтративне ураження міокарда при хворобах накопичення;
- виявити непрямі ознаки мітохондріальних захворювань.
Лабораторне дослідження. За даними літератури, у дітей із міокардитом збільшується швидкість осідання еритроцитів (ШОЕ) та підвищується рівень С-реактивного протеїну у 1/3-1/2 випадків у гостру фазу, а отже, їх нормальні показники не можуть бути підставою для виключення діагнозу запального ураження міокарда. Рівень аспартатамінотрансферази (АСТ) у сироватці крові підвищений у 85% дітей у гостру фазу міокардиту [12]. Рівень загальної креатинфосфокінази у крові підвищується тільки при масивному лізисі кардіоміоцитів.
Біологічними маркерами міокардиту є специфічні для міокарда молекули, які в нормі знаходяться всередині клітин та виділяються у кров при деструкції кардіоміоцитів (креатинкіназа МВ, тропонін Т та І).
Підвищення рівня тропоніну І у сироватці крові дорослих пацієнтів із гострим міокардитом має високу специфічність (89%), проте низьку чутливість (34%). Рівень креатинкінази МВ підвищується в сироватці крові лише у 5,7% дорослих пацієнтів із гістологічно підтвердженим міокардитом [8]. Водночас у дітей з гострим міокардитом підвищення сироваткової концентрації тропоніну Т має чутливість 71% та специфічність 86% [35]. Молекули тропоніну Т з’являються у крові у підвищеній концентрації вже протягом декількох годин після запального ураження міокарда. Після зупинення прогресування некрозу кардіоміоцитів підвищення концентрації тропоніну Т у крові зберігається протягом більше тижня [37]. Таким чином, креатинкіназа МВ як маркер має вкрай низьку чутливість при міокардиті, а тест для визначення рівня тропоніну І в сироватці крові раціонально проводити для підтвердження діагнозу, проте не для його виключення.
У дітей для встановлення діагнозу міокардиту найбільшу діагностичну цінність має такий біомаркер, як сироватковий рівень тропоніну Т.
Важливу роль у діагностиці вірусного міокардиту відіграє виявлення ознак інфікування кардіотропним вірусом. Рекомендовано визначати наявність геному вірусу методом ПЛР у крові, калі та/чи назофарингеальних змивах. Перелік типових збудників включає: ентеровірус, аденовірус, парвовірус В19, вірус гепатиту С та віруси групи герпесу (Епштейна-Барр, цитомегаловірус, вірус простого герпесу 1 типу, вірус герпесу 6 типу та вірус вітряної віспи) [32].
Зауважимо, що міокардит, спричинений Mycoplasma pneumoniae, зустрічається рідко, проте він є потенційно тяжким ускладненням респіраторних захворювань. Виявлення наявності IgM збудника або чотирикратного підвищення рівня IgG методом парних сироваток має діагностичне значення, проте є неспецифічним для захворювання вказаної етіології.
Встановлення діагнозу
На сьогодні не існує достовірних діагностичних критеріїв міокардиту у дітей, тому встановлення клінічного діагнозу вимагає від лікаря відповідного досвіду та проведення ретельної диференційної діагностики. Про ураження міокарда свідчать порушення його функцій: скоротливості, автоматизму, збудливості та провідності. При порушенні скоротливої функції міокарда, що характерно для масивного або тотального залучення міокарда ЛШ, необхідність включення міокардиту до списку захворювань для диференційної діагностики не викликає сумнівів [31].
Однак виникають питання щодо порушення тільки електричної функції міокарда, яке в більшості випадків у дітей має функціональний характер [2]. Зважаючи на можливість локального ураження міокарда, раціонально використовувати цей діагноз для диференційної діагностики кожного вперше виявленого випадку порушення ритму чи провідності, особливо за наявності в анамнезі нещодавно перенесеного вірусного захворювання.
Ведення пацієнтів
Стратегія лікування міокардиту включає:
- етіотропну терапію (вплив на збудника міокардиту);
- усунення запального процесу;
- нормалізацію імунологічної реактивності пацієнта;
- ліквідацію або компенсацію серцево-судинної недостатності;
- усунення метаболічних змін у міокарді.
Режим. Навіть за відсутності ознак серцевої недостатності в гостру фазу захворювання необхідно призначити постільний режим, у подальшому – на 6 міс заборонити аеробні навантаження [21, 30]. Спортсмени можуть поновити заняття спортом, тільки якщо функція ЛШ, його розміри та кінетика стінок повернулися до норми, маркери запального процесу є негативними, за даними ЕКГ у 12 відведеннях не виявлено відхилень, а за даними ХМ ЕКГ або тредміл-тесту/велоергометрії – клінічно значущих порушень ритму та провідності при фізичному навантаженні [27].
Противірусна терапія. Якщо персистування вірусу в міокарді доведено (виявлено геном вірусу методом ПЛР), обґрунтованим є призначення противірусних препаратів. При інфікуванні міокарда вірусами групи герпесу призначають ганцикловір. Рибавірин у комбінації з альфа-інтерфероном у дорослих пацієнтів із вірусним міокардитом продемонстрував ефективність проти вірусу Коксакі (Okada et al., 1992; Matsumori, 2007). Добре зарекомендували себе препарати β-інтерферону. Так, за даними Khl та співавт. (2003), у результаті введення β-інтерферону підшкірно в дозі 6 млн ОД тричі на тиждень протягом 6 міс у дорослих пацієнтів із підтвердженим ентеровірусним та аденовірусним міокардитом серцевий м’яз очистився від вірусу у всіх 22 хворих, а також покращилась функція ЛШ в 15 із 22 випадків [23]. У подальшому в подвійному сліпому рандомізованому плацебо-контрольованому багатоцентровому дослідженні BICC (Бетаферон у терапії хворих із хронічною вірусною кардіоміопатією), що включало 143 осіб, було здійснено оцінку ефективності інтерферону β‑1b (IFN β‑1b) при вірусному міокардиті порівняно з плацебо [34]. Терапія IFN β‑1b забезпечила значне зниження вірусного навантаження в міокарді, однак повної елімінації вірусу досягнуто не у всіх хворих. При цьому функціональний клас (ФК) за класифікацією Нью-Йоркської асоціації серця (NYHA) достовірно поліпшувався.
Якщо міокардит має вірусну етіологію, в перші 2-3 тижні протипоказане призначення неспецифічних протизапальних препаратів, тому що в гострій фазі внаслідок дії протизапальних препаратів може значно прискоритися реплікація вірусів, збільшитися ураження міокарда, а також зменшитися вироблення інтерферону.
Зараз для лікування гострого вірусного міокардиту доцільно застосовувати гамма-глобулін (внутрішньовенно у дозі 2г/кг/ добу).
Якщо ідентифіковано віруси простого герпесу, Епштейна-Барр, цитомегаловірус, призначають ацикловір (дітям до 2 років – у дозі 100 мг 5 р/добу протягом 5 днів, старше 2 років – 200 мг 5 р/добу протягом 5 днів) або рибавірін.
При бактеріальній етіології міокардиту призначають антибактеріальні препарати широкого спектра дії протягом 2-3 тижнів, враховуючи чутливість збудника до препарату.
Глюкокортикоїдні препарати є важливими у лікуванні пацієнтів із міокардитом, оскільки мають імуносупресивний і протизапальний ефект. Показання до призначення кортикостероїдів – тяжкий перебіг міокардиту із клінічними симптомами СН, порушення ритму та провідності.
Преднізолон призначають перорально з розрахунку 1 мг/кг протягом 10-12 днів із подальшим поступовим зниженням дози.
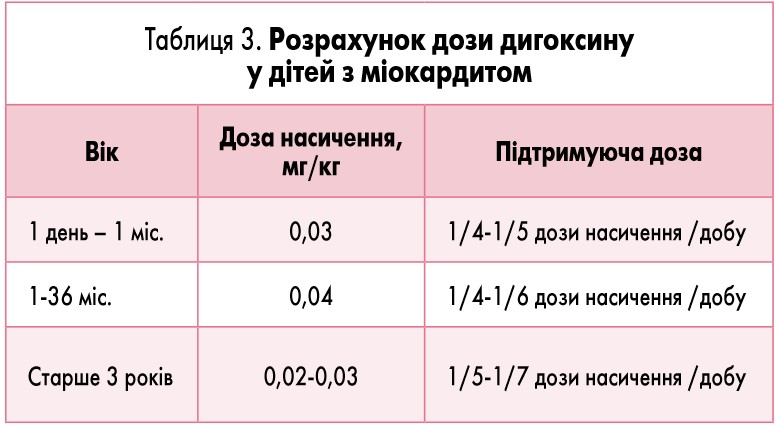 Терапія серцевої недостатності. Терапію гострої та хронічної СН проводять відповідно до загальних положень, із таким уточненням, що при міокардиті чутливість кардіоміоцитів до дигоксину є підвищеною, а це створює умови для зниженого порогу його кардіотоксичності та потребує призначення нижчих доз препарату [31]. Розрахувати дозу дигоксину у дітей з міокардитом допоможе таблиця 3.
Терапія серцевої недостатності. Терапію гострої та хронічної СН проводять відповідно до загальних положень, із таким уточненням, що при міокардиті чутливість кардіоміоцитів до дигоксину є підвищеною, а це створює умови для зниженого порогу його кардіотоксичності та потребує призначення нижчих доз препарату [31]. Розрахувати дозу дигоксину у дітей з міокардитом допоможе таблиця 3.
У дітей раннього віку при тяжкому перебігу набутого міокардиту з розвитком гострої СН інотропну підтримку починають з інфузії допаміну (5-8 мкг/кг/хв) або добутаміну (5-10 мкг/кг/хв), і тільки після стабілізації гемодинаміки через 2-3 дні переходять до дигіталізації.
Діуретики. При СН-ІІА препаратом вибору є верошпірон (2 мг/кг), при СН-IIБ та СН-III доцільно використовувати комбінацію верошпірону з фуросемідом (1 мг/кг).
Терапія порушення ритму. Проводиться за стандартними схемами, з таким уточненням, що при міокардиті, зважаючи на велику частоту зниження скоротливості ЛШ, як антиаритмічній терапії слід надавати перевагу препаратам, які не порушують систолічної функції серця (аміодарон) або позитивно на неї впливають (β-блокатори, окрім випадків гострої СН).
Інгібітори ангіотензинперетворюючого ферменту (АПФ) – обов’язкова складова терапії гострого міокардиту. Препарати цієї групи знижують пост- і переднавантаження, зменшують застій в малому колі кровообігу і збільшують серцевий викид (каптоприл – 0,5-1-2 мг/кг 3 р/добу).
Кардіометаболічна терапія. Проводиться з метою поліпшення метаболізму кардіоміоцитів, підвищення їх стійкості до оксидантного стресу, компенсування збільшеної потреби в кисні та є патогенетично обґрунтованою при міокардиті. Фосфокреатин – енергетичний субстрат, який має кардіопротекторний ефект, зумовлений стабілізацією сарколеми кардіоміоциту, збереженням клітинного пулу аденінових нуклеотидів за рахунок інгібування ферментів, що беруть участь у контролі їх катаболізму. Препарат фосфокреатину випускається у флаконах по 1 г у вигляді порошку для приготування розчину для інфузій. Підліткам та дорослим препарат призначають у дозі 1-2 г/добу загальною курсовою дозою 5-8 г. Неотон вводиться внутрішньовенно краплинно 1-2 р/добу після розчинення в 200 мл фізіологічного розчину або 5% глюкози [1]. Згідно з даними рандомізованого дослідження Jun та співавт. (2010), у дітей з гострим міокардитом, викликаним вірусом Коксакі В, призначення фосфокреатину мало кардіопротекторний ефект за рахунок інгібування синтезу уражаючих міокард вільних радикалів та апоптозу кардіоміоцитів [20]. Крім того, за даними Tao та співавт. (2007), використання фосфокреатину в комплексній терапії дорослих хворих на міокардит із тяжкою СН призводило до достовірного поліпшення систолічної функції ЛШ та зменшення симптомів СН [36].
Інші кардіометаболічні препарати, які мають доказову базу при систолічній дисфункції ЛШ, – це левокарнітин і триметазидин. Так, згідно з даними Azevedo та співавт. (2005), застосування левокарнітину в дозі 100 мг/кг/день при ідіопатичній ДКМП у дітей достовірно покращує ехокардіографічні параметри скоротливості ЛШ [6]. Зазвичай тривалість курсу лікування левокарнітином становить 1-3 міс.
У дослідженні Tuunanen та співавт. (2008) та Zhao та співавт. (2013) показано, що триметазидин поліпшує сиcтолічну функцію ЛШ та переносимість фізичних навантажень при ДКМП у дорослих [38, 42]. Дітям триметазидин призначають у таблетованій формі (20 мг) залежно від віку у дозі 1/3-1 таблетка 3 р/добу курсом тривалістю як мінімум 3 міс.
Імуносупресивна терапія. У хворих на вірусний міокардит при переході захворювання у хронічну фазу, коли головну роль в ураженні міокарда відіграє аутоімунна відповідь, патогенетично обґрунтованою є імуносупресивна терапія. Проте якщо таке лікування призначити на тлі персистування вірусу в кардіоміоцитах, зниження імунної відповіді призведе до агравації вірусного ураження серцевого м’яза.
У випадку наявності персистуючого запалення за результатами ЕМБ та після очищення серцевого м’яза від вірусу можна призначити глюкокортикоїди та/або азатіоприн. У рандомізованому плацебо-контрольованому дослідженні Frustaci та співавт. (2009), в якому таке лікування (глюкокортикоїди в дозі 1 мг/кг/добу з преднізолоном протягом 4 тижнів із наступним переходом на дозу 0,33 мг/кг/день протягом ще 5 міс + азатіоприн 2 мг/кг/добу протягом 6 міс) було призначено хворим на міокардит із хронічною СН та ПЛР-негативним результатом дослідження біоптату міокарда на: аденовірус, вірус Епштейна-Барр, простого герпесу 1 та 2 типів, герпесу 6 типу, парвовісус В19, цитомегаловірус, ентеровірус, вірус грипу А/В, гепатиту С – досягнуто достовірне підвищення ФВ та зменшення кінцевого діастолічного розміру ЛШ через півроку терапії [14].
Методики лікування на стадії дослідження. Зважаючи на аутоімунний компонент ураження серця при вірусному міокардиті/постміокардитичній ДКМП, використання методів екстракорпорального очищення крові хворого від антитіл, у тому числі від антитіл до запального міокарда (імуносорбція/плазмаферез), можуть полегшити перебіг захворювання. На сьогодні існують дані, що імуносорбція при ДКМП поліпшує скоротливість ЛШ та зменшує його кінцевий діастолічний розмір [21], проте поки що при цих захворюваннях у дітей вказані методики широко не використовуються.
Тривають дослідження, які мають на меті оцінити ефективність мофетилу мікофенолату як імуносупресанту аутоімунного компонента при постміокардитичній ДКМП, вакцини від ентеровірусів та аденовірусу, специфічних імуноглобулінів проти цих збудників як імунопрофілактичної та противірусної терапії.
 Імплантація штучного водія ритму. Вона, як правило, показана при міокардиті з ураженням провідної системи серця у вигляді симптоматичної атріовентрикулярної блокади ІІ-ІІІ ступенів.
Імплантація штучного водія ритму. Вона, як правило, показана при міокардиті з ураженням провідної системи серця у вигляді симптоматичної атріовентрикулярної блокади ІІ-ІІІ ступенів.
Радіочастотна абляція аритмогенного субстрату. Слід підкреслити, що аритмогенним субстратом при міокардиті є уражений запальним процесом міокард, який є менш стійким до ятрогенних втручань.
Це означає вищу ймовірність розвитку ускладнень, наприклад розриву стінки серця, під час цієї процедури.
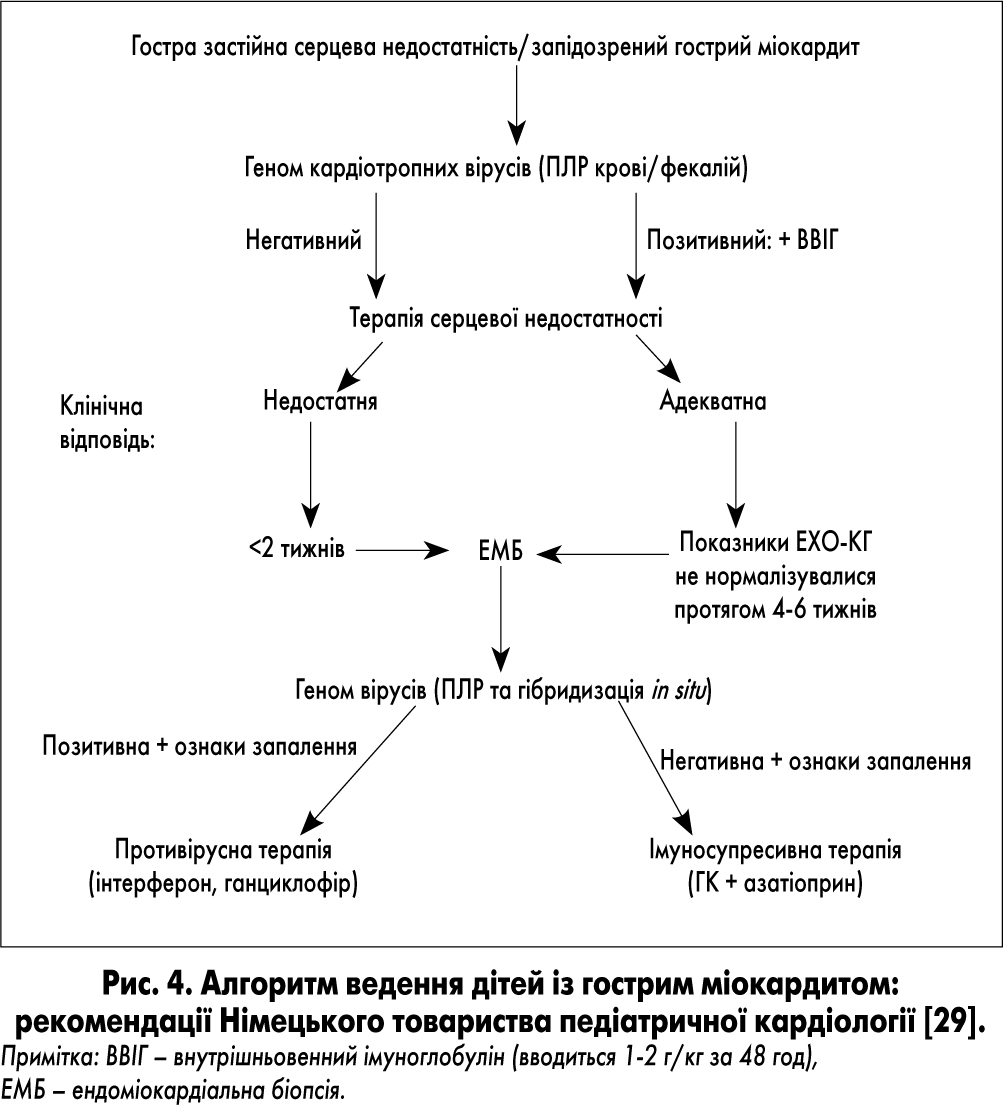
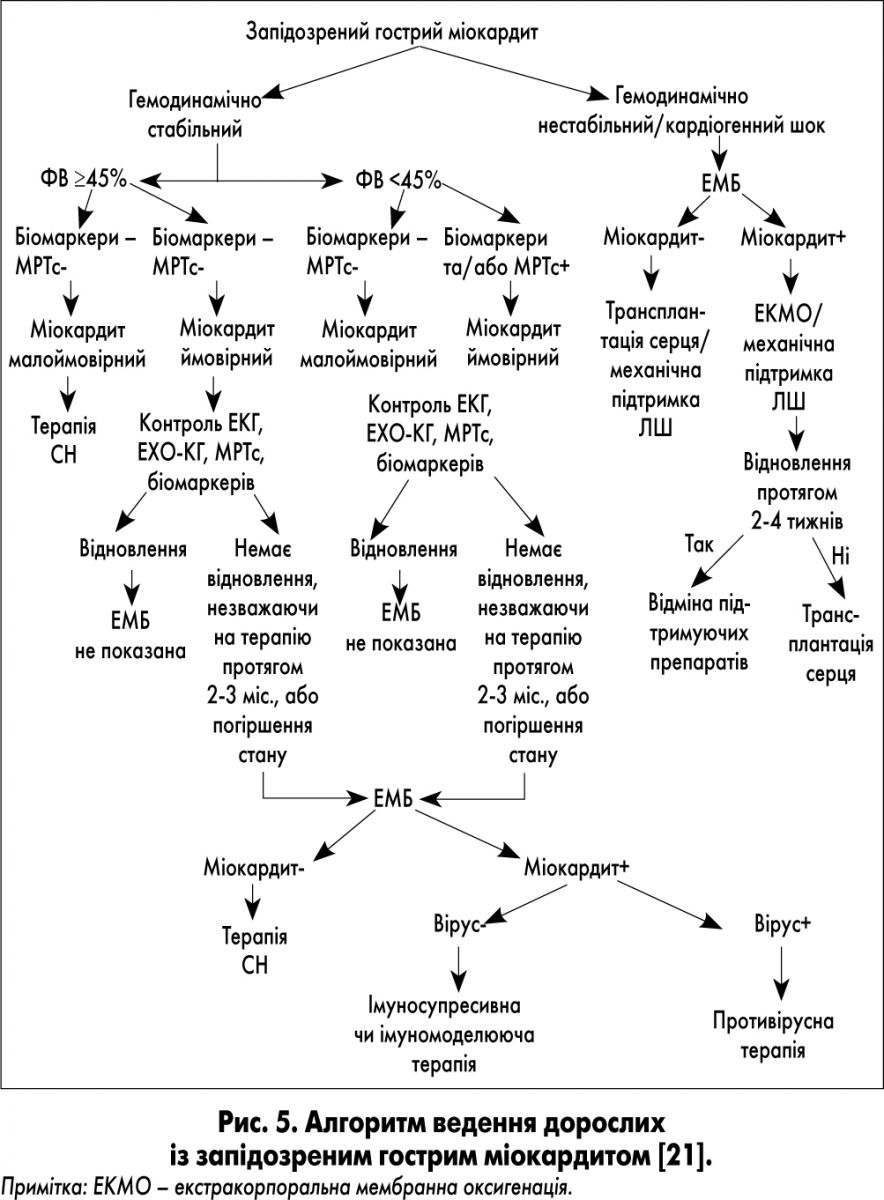
Нижче наведено два алгоритми ведення пацієнтів із міокардитом – Німецького товариства педіатричної кардіології (GSPK) та алгоритм для дорослих (рис. 4 та 5). На нашу думку, кожний із них має свої переваги.
Так, 1-й алгоритм був розроблений спеціально для дітей, 2-й – враховує останні досягнення у розвитку неінвазивних методик для встановлення діагнозу міокардиту (наприклад, МРТс з контрастуванням).
 Специфічні типи міокардитів. Наявність еозинофільного міокардиту, як правило, не вимагає специфічної терапії, лікування є симптоматичним, у більшості випадків хворі одужують самостійно. Проте патогенетично обґрунтованим є призначення середніх доз глюкокортикоїдів коротким курсом [17].
Специфічні типи міокардитів. Наявність еозинофільного міокардиту, як правило, не вимагає специфічної терапії, лікування є симптоматичним, у більшості випадків хворі одужують самостійно. Проте патогенетично обґрунтованим є призначення середніх доз глюкокортикоїдів коротким курсом [17].
Що стосується гігантоклітинного міокардиту, то дотепер не існує доведеного ефективного лікування. Вважається, що патогенетично обґрунтованим є застосування глюкокортикоїдів та імуносупресивної терапії, проте навіть у такому разі цей тип міокардиту має несприятливий прогноз [17]. Призначення циклоспорину або глюкокортикоїдів ± азатіоприну збільшує середню тривалість життя пацієнтів до 12 міс порівняно з показником за відсутності лікування, який становить 3 міс [21]. При цьому відміна імуносупресивної терапії часто призводить до фатального рецидиву захворювання.
Саркоїдозний міокардит вимагає раннього призначення високих доз (зазвичай 2 мг/кг/добу) глюкокортикоїдів, що поліпшує насосну функцію серця. Виживаність пацієнтів із саркоїдозним міокардитом протягом 5 років варіює від 60 до 90% [21].
При міокардиті на тлі аутоімунних/аутозапальних хвороб проводять специфічне лікування основного захворювання, у результаті якого зазвичай поліпшується і стан серця, за необхідності – терапію серцевої недостатності та антиаритмічну терапію.
Диспансеризація
Після перенесеного міокардиту дитина перебуває під наглядом педіатра та дитячого кардіоревматолога: протягом 4 міс після виписки зі стаціонару огляд проводять 1 раз на місяць, потім протягом року – 1 раз на квартал, після цього – 1 раз на 6 міс (за показаннями – частіше). При кожному огляді обов’язковою є ЕКГ. ЕХО-КГ проводять 1 раз на рік (за показаннями – частіше). Важливе значення мають санація хронічних вогнищ інфекції, дотримання режиму дня і відпочинку, раціональне харчування [2].
Питання про заняття фізкультурою дітей шкільного віку вирішують в індивідуальному порядку. Як правило, дитину звільняють від занять в основній групі на 1 рік та призначають ЛФК. Через рік за відсутності ознак запалення їй дозволяють відвідувати підготовчу (6 міс), а згодом – основну групу.
Література
1. Аритмии сердца у детей и подростков (клиника, диагностика и лечение). – СПб.: Невский Диалект, 2003. – 244 с.
2. Кривопустов С.П. Миокардит у детей: современный взгляд на проблему // Здоровье Украины. – 2008. – № 10/1. – С. 32-33.
3. Руководство по кардиологии / под ред. В.Н. Коваленко. – К.: МОРИОН, 2008. – 1424 с.
4. Amabile N., Fraisse A., Bouvenot J. et al. Outcome of acute fulminant myocarditis in children // Heart (British Cardiac Society). – 2006. – Vol. 92. –
p. 1269-1273.
5. Aretz H.T., Billingham M.E., Edwards W.D., Factor S.M., Fallon J.T., Fenoglio J.J., Olsen E.G., Schoen F.J. Myocarditis. A histopathologic definition and classification // American Journal of Cardiovascular Pathology. – 1987. – Vol. 1 (1). – p. 3-14.
6. Azevedo V.M. et al. The role of L-carnitine in nutritional status and echocardiographic parameters in idiopathic dilated cardiomyopathy in children // J Pediatr (Rio J). – 2005. – Vol. 81 (5). – p. 368-372.
7. Bratincsak A., El-Said H.G., Bradley J.S., Shayan K., Grossfeld P.D., Cannavino C.R. Fulminant myocarditis associated with pandemic H1N1 influenza a virus in children // J Am Coll Cardiol. – 2010. – Vol. 55. – p. 928-929.
8. Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine, Single Volume: Expert Consult Premium Edition – Enhanced Online Features and Print, 9e.
9. Brodison A., Swann J.W. Myocarditis: a review // The Journal of infection. – 1998. – Vol. 37 (2). – p. 99-103.
10. Dickstein K., Cohen-Solal A., Filippatos G. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology // Eur Heart J. – 2008. – Vol. 29. – p. 2388-2442.
11. Drucker N.A., Colan S.D., Lewis A.B. et al. Gamma-globulin treatment of acute myocarditis in the pediatric population // Circulation. – 1994. – Vol. 89. – p. 252-257.
12. Freedman S.B., Haladyn J.K., Floh A. et al. Pediatric myocarditis: emergency department clinical findings and diagnostic evaluation // Pediatrics. – 2007. – Vol. 120. – p. 1278-1285.
13. Friedrich M.G., Sechtem U., Schulz-Menger J. et al: Cardiovascular magnetic resonance in myocarditis: A JACC White Paper // Journal of American College of Cardiology. – 2009. – Vol. 53. – p. 1475-1487.
14. Frustaci A. et al. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy the TIMIC study // European Heart Journal. – 2009. – Vol. 30. – p. 1995-2002.
15. Goitein O. et al. Acute myocarditis: noninvasive evaluation with cardiac MRI and transthoracic echocardiography // Am J Roentgenol. – 2009. – Vol. 192 (1). –
p. 254-258.
16. Godsel L.M., Leon J.S., Engman D.M. Angiotensin converting enzyme inhibitors and angiotensin II receptor antagonists in experimental myocarditis // Curr Pharm Des. – 2003. – Vol. 9. – p. 723-735.
17. Guidelines for Diagnosis and Treatment of Myocarditis (JCS2009) // Circulation Journal. – 2009. –Vol. 75.
18. Hia C.P., Yip W.C., Tai B.C. et al. Immunosuppressive therapy in acute myocarditis: an 18 year systematic review // Archive of Diseases in Childhood. – 2004. – Vol. 89. – p. 580-584.
19. Jun et al. Protective effect of creatine phosphate for coxsachievirus myocarditis in children // Journal of Applied Clinical Pediatrics. – 2010.
20. Kindermann et al. Update on Myocarditis // Journal of the American College of Cardiology. – 2012. – Vol. 59. – № 9. – p. 779-792.
21. Kindermann I., Kindermann M., Kandolf R. et al. Predictors of outcome in patients with suspected myocarditis // Circulation. – 2008. – Vol. 118. – p. 639-648.
22. Khl U. et al. Interferon-β treatment eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction // Circulation. – 2003. – Vol. 107. – p. 2793-2798.
23. Levine M.C., Klugman D., Teach S.J. Update on myocarditis in children // Curr Opin Pediatr. – 2010. – Vol. 22 (3). – p. 278.
24. Mahfoud F., Gartner B., Kindermann M. et al. Virus serology in patients with suspected myocarditis: utility or futility? // Eur Heart J. – 2011. – Vol. 32. – p. 897-903.
25. Mahrholdt et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis // Circulation. – 2006. – Vol. 114. – p. 1581-1590.
26. Maron B.J., Ackerman M.J., Nishimura R.A. et al: Task Force 4: HCM and other cardiomyopathies, mitral valve prolapse, myocarditis, and Marfan syndrome // J Am Coll Cardiol. – 2005. – Vol. 45. – p. 1340-1345.
27. Matsumori A., Igata H., Ono K. et al. High doses of digitalis increase the myocardial production of proinflammatory cytokines and worsen myocardial injury in viral myocarditis: a possible mechanism of digitalis toxicity // Jpn Circ J. – 1999. – Vol. 63. – p. 934-940.
28. P. Thomas, T. Carsten, K. Reinhard. Myocarditis in Infants and Children: Guideline of the German Society of Pediatric Cardiology. – 2012.
29. Park: Pediatric Cardiology for Practitioners, 5th ed.
30. Pediatric cardiology / R.H. Anderson et al. – 3rd ed.
31. Presentation, diagnosis, and medical management of heart failure in children: Canadian Cardiovascular Society Guidelines // Canadian Journal of Cardiology. – 2013. – Vol. 29. – p. 1535-1552.
32. Richardson P., McKenna W., Bristow M., Maisch B., Mautner B., O’Connell J., Olsen E., Thiene G., Goodwin J., Gyarfas I., Martin I., Nordet P. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the definition and classification of cardiomyopathies // Circulation. – 1996. – Vol. 93 (5). – p. 841-842.
33. Schultheiss H.P., Piper C., Sowade K. et al. The effect of subcutaneous treatment with interferon-beta‑1b over 24 weeks on safety, virus elimination and clinical outcome in patients with chronic viral cardiomyopathy (abstr) // Circulation. – 2008. – Vol. 118. – p. 3322.
34. Soongswang J., Durongpisitkul K., Nana A., Laohaprasittiporn D., Kangkagate C., Punlee K., Limpimwong N. Cardiac troponin T: a marker in the diagnosis of acute myocarditis in children // Pediatr Cardiol. – 2005. – Vol. 26. – p. 45-49.
35. Tao et al. Therapeutic effect of creatine phosphate on serious viral myocarditis with heart failure // Medical Journal of West China. – 2007.
36. Tavli V., Guven B. Myocarditis in childhood: an update on etiology, diagnosis and management. – p. 39-68.
37. Tuunanen H. et al. Trimetazidine, a metabolic modulator, has cardiac and extracardiac benefits in idiopathic dilated cardiomyopathy // Circulation. – 2008. – Vol. 118 (12). – p. 1250-1258.
38. Vashist S., Woodard P.K., Grady M., Singh G. MRI characteristics of acute myocarditis in pediatric patients: patterns and predictors of outcomes // St Louis Washington University School of Medicine, 2009.
39. Veeraveedu P.T., Watanabe K., Ma M. et al. Torasemide, a longacting loop diuretic, reduces the progression of myocarditis to dilated cardiomyopathy // Eur J Pharmacol. – 2008. – Vol. 581. – p. 121-131.
40. Xiao J., Shimada M., Liu W., Hu D., Matsumori A. Antiinflammatory effects of eplerenone on viral myocarditis // Eur J Heart Fail. – 2009. – Vol. 11. –
p. 349-353.
41. Zhao P. The effect of trimetazidine on cardiac function in diabetic patients with idiopathic dilated cardiomyopathy // Life Sci. – 2013. – Vol. 92 (11). – p. 633-638.
42. Красновский А.Л., Григорьев С.П., Алехина Р.М., Короткова Е.С. Неревматические миокардиты // Острые и неотложные состояния в практике врача. – 2010. – № 3. – С. 25-41.
43. Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей: Руководство для врачей. В 2 т. – Т. 1. – М.: Медицина. – 1987. – 443 с.
44. Неревматические кардиты у детей: учеб.-метод. пособие для студентов медицинских вузов, врачей-интернов, врачей-педиатров, детских кардиологов / С.С. Ивкина, А.И. Зарянкина. – Гомель: учреждение образования «Гомельский государственный медицинский университет», 2012. – 24 с.
Тематичний номер «Педіатрія» №4 (43), грудень 2017 р.


