27 грудня, 2017
Бронхообструктивные заболевания: персонифицированный подход и повышение приверженности пациентов к лечению
19 октября в Киеве состоялся ХІ Национальный астма-конгресс (далее – Конгресс), который традиционно проводился под эгидой Национального института фтизиатрии и пульмонологии им. Ф.Г. Яновского НАМН Украины (г. Киев).
Открытие Конгресса, объединившего участников форума вокруг наиболее актуальных проблем терапии бронхообструктивных заболеваний, прошло в теплой и приподнятой атмосфере. Выступления пользующихся авторитетом представителей отечественной пульмонологии, корифеев профессионального сообщества обеспечили мероприятию высокий научный уровень. С приветственным словом к участникам и гостям обратился председатель Конгресса, академик НАМН Украины, директор ГУ «Национальный институт фтизиатрии и пульмонологии им. Ф.Г. Яновского НАМН Украины», доктор медицинских наук, профессор Юрий Иванович Фещенко.
Перейдя после этого к докладу «Современные возможности диагностики и лечения в эффективном ведении бронхообструктивных заболеваний в общей и специализированной медицинской практике», Ю.И. Фещенко подчеркнул важность фенотипирования и необходимость персонифицированного подхода к пациенту в рутинной клинической практике. Такой подход оправдан в силу того, что он связан не с какой-либо нозологией (бронхиальная астма, БА, или хронические обструктивные заболевания легких, ХОЗЛ), а с определенными молекулярными механизмами, которые лежат, например, в основе воспаления и могут служить биологическими маркерами или индикаторами патологических процессов в организме, что позволяет подобрать наиболее оптимальный вариант терапии для конкретного пациента.
В заключительной части своего выступления докладчик отметил, что широкое применение современных высокотехнологических методов диагностики, использование междисциплинарного подхода позволяют обеспечить персонифицированный подход к пациентам с бронхообструктивными заболеваниями, повысить эффективность терапии, уменьшить инвалидизацию и смертность.
Доклад профессора кафедры фтизиатрии и пульмонологии Национальной медицинской академии последипломного образования им. П. Л. Шупика (г. Киев), доктора медицинских наук Людмилы Александровны Яшиной был посвящен вопросам определения сочетания БА и ХОЗЛ, их фенотипов и эндотипов. Л.А. Яшина отметила, что синдром перекреста БА и ХОЗЛ (overlap-синдром) в силу своей гетерогенности и влияния коморбидности у разных пациентов не укладывается в определенную нозологию, что затрудняет оценку его распространения, диагностику и выбор метода терапии. Поэтому в настоящее время промежуточный подход к ведению пациента с предполагаемым перекрестным синдромом состоит в том, что в клинической практике следует учитывать симптоматику, а ставить диагноз – с помощью как рутинных, так и специализированных методов. При этом в диагностическом поиске необходимо опираться на имеющиеся нарушения у конкретного больного, а не на определенную нозологическую форму, что соответствует персонифицированному подходу, принятому в современной клинической практике.
Обширной программой Конгресса был предусмотрен целый ряд событий, в том числе сателлитный симпозиум при поддержке компании «ГлаксоСмитКляйн» (Великобритания) (?) (ООО «ГлаксоСмитКляйн Фармасьютикалс Украина»). В прозвучавших здесь докладах были затронуты актуальные темы, вызвавшие оживленную дискуссию, в ходе которой обсуждались вопросы современной терапии бронхообструктивных заболеваний, а также возможности повышения комплайенса пациентов.
Новые данные о влиянии на пациент-ориентированные результаты использования современной комбинации бронходилататоров, основанные на принципах доказательной медицины, представил кандидат медицинских наук М.М. Гвоздик (г. Киев).
– Каковы ожидания от бронходилатационной терапии у пациентов с ХОЗЛ? Результаты Continuing to Confront COPD International Patient Survey по исследованию влияния ХОЗЛ на пациентов из 12 стран (n=4343) показали, что 8% пациентов надеются на снижение числа обострений, 18% – улучшение активности, однако подавляющее большинство больных (74%) ожидают от лечения уменьшения симптомов в целом (F. Jason et al., 2016).
Известно, что симптомы ХОЗЛ сложно поддаются лечению. Ранее было доказано, что в рутинной клинической практике более 50% пациентов с ХОЗЛ продолжают страдать одышкой на фоне монотерапии бронходилататорами длительного действия. Результаты американского исследования показали, что 59% пациентов на фоне постоянной бронходилатационной терапии (76% из них принимали тиотропий) имели одышку, оцененную по шкале mMRC в ≥2 баллов (М.Т. Dransfield et al., 2011).
Согласно изменениям, внесенным в Рекомендации GOLD‑2017, пациентам группы В в качестве стартовой терапии предлагается один из бронходилататоров: β2-агонисты длительного действия (БАДД) или М-холинолитики длительного действия (МХДД). Но у пациентов с персистирующей одышкой на фоне монотерапии применяют двойную бронходилатацию (МХДД/БАДД). У больных с тяжелой одышкой назначение двух бронходилататоров рекомендуется в качестве стартовой терапии. Если добавление второго бронходилататора не улучшает симптомы, можно вернуться к монотерапии в качестве «шага вниз». Таким образом, в отличие от GOLD‑2016 в обновленных рекомендациях двойная бронходилатация в качестве стартовой терапии предлагается всем пациентам с ХОЗЛ начиная с группы B.
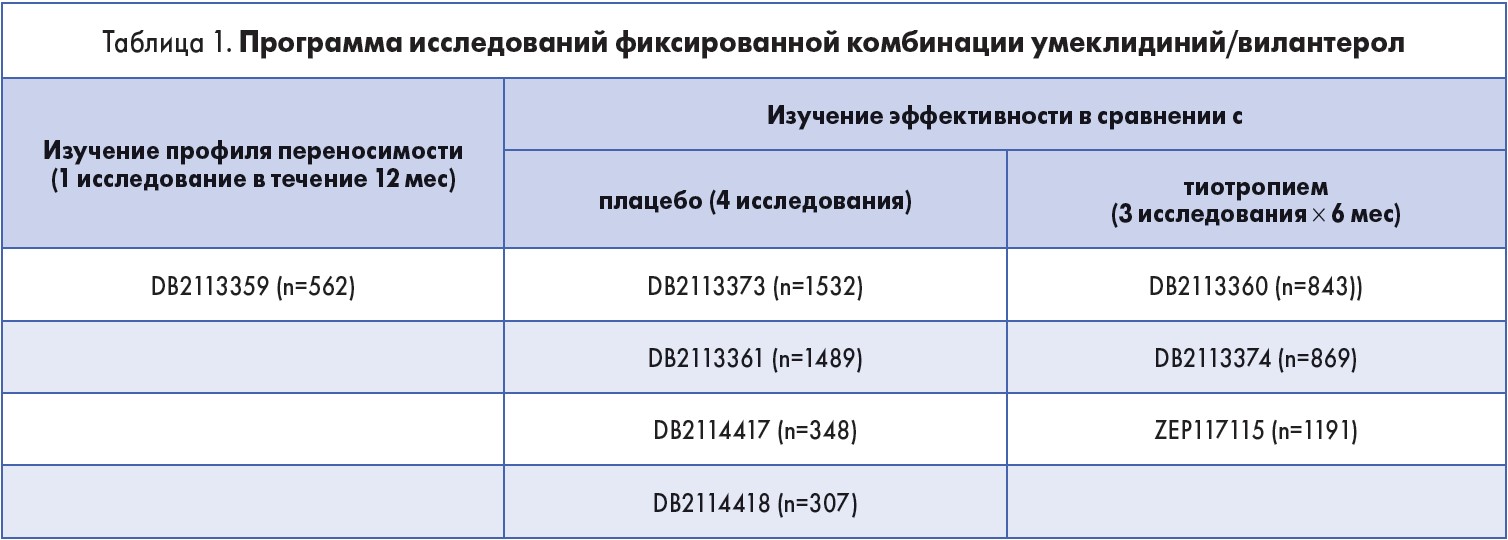
Фиксированная комбинация умеклидиний/вилантерол (Аноро Эллипта) является представителем нового класса двойных длительно действующих бронходилататоров. Программа изучения действия препарата включает целый ряд независимых исследований с участием большого количества пациентов в разных странах (табл. 1).
Для пациента самым важным показателем лечения является быстрота наступления действия и сохранение терапевтического эффекта препарата после ингаляции. Эффективность длительно действующих бронходилататоров объективно оценивается по сохранению улучшения показателей спирометрии на исходе действия дозы – конечного объема форсированного выдоха за 1-ю секунду (ОФВ1).
Стабильный бронхорасширяющий эффект комбинации умеклидиний/вилантерол был продемонстрирован в ходе 24-недельного рандомизированного двойного плацебо-контролируемого исследования. Клинически значимое увеличение ОФВ1 было выявлено уже спустя 15 мин после первой ингаляции; разница составила >100 мл по сравнению с плацебо. На 168-й день применения препарата было зафиксировано достоверное уменьшение одышки по шкале TDI и увеличение разницы количества баллов по результатам опросника SGRQ (St. George’s Respiratory Questionnaire), что свидетельствовало об улучшении самочувствия больных. Таким образом, было доказано, что применение фиксированной комбинации умеклидиний/вилантерол (Аноро Эллипта) объективно влияет на пациент-ориентированный результат (J.F. Donohue et al., 2013).
Результаты объединенного post hoc (ретроспективного) анализа 3 сравнительных исследований эффективности и безопасности комбинации умеклидиний/вилантерол показали достоверное увеличение конечного ОФВ1: к концу исследования, на 168-й день лечения, средние различия составили 86-105 мл по сравнению с тиотропием (M.R. Maleki-Yazdi, 2015).
При оценке влияния бронходилатационной терапии всегда учитываются показатели клинически значимого ухудшения: обострения, SGRQ ≥4 баллов, снижение конечного ОФВ1 более чем на 100 мл. В исследовании D. Singh и соавт. (2016) было выявлено, что на фоне применения фиксированной комбинации умеклидиний/вилантерол риск развития клинически значимых ухудшений был на 43% меньше по сравнению с монотерапией тиотропием.
В свете обновленных Рекомендаций GOLD‑2017 интерес исследователей также направлен на изучение эффективности и безопасности перехода с монотерапии на двойную бронходилатацию у пациентов с персистирующей одышкой. E.M. Kerwin и соавт. (2017) опубликовали результаты 12-недельного рандомизированного слепого исследования с участием 494 пациентов с ХОЗЛ (группы А и В по GOLD), проводившегося в 64 центрах 9 стран, в том числе Украины. Первичной конечной точкой был уровень ОФВ1 на 85-й день терапии после эскалации в группе сравнения. Установлено, что переход на двойную бронходилатацию с помощью фиксированной комбинации умеклидиний/вилантерол клинически более эффективен по сравнению с монотерапией тиотропием у пациентов с умеренными проявлениями ХОЗЛ. Разница конечного ОФВ1 на 84-й день терапии составила 73 мл (91 и 164 мл в группах тиотропия и умеклидиния/вилантерола соответственно). При этом статистически достоверное преимущество применения комбинации умеклидиний/вилантерол наблюдалось уже с первого дня эскалации.
Важным показателем безопасности усиления терапии у пациентов групп B, C и D является частота возникновения нежелательных явлений при переходе на двойную бронходилатацию. Спектр и частота побочных эффектов применения комбинации умеклидиний/вилантерол изучались в ходе 24-недельного мультицентрового рандомизированного слепого исследования с использованием параллельных групп. Было отмечено, что профиль переносимости в группе комбинированного лечения и группе приема тиотропия практически одинаков: 44 и 42% соответственно. Фатальные нежелательные эффекты составили по 2% в обеих группах. По результатам исследования было рекомендовано с осторожностью применять двойную бронходилатацию с помощью комбинации умеклидиний/вилантерол у пациентов с тяжелыми формами сердечно-сосудистых заболеваний, закрытоугольной глаукомой и задержкой мочи (M.R. Maleki-Yazdi et al., 2014).
Высокий профиль безопасности фиксированной комбинации умеклидиний/вилантерол обеспечивается наличием высокоселективного β2-агониста вилантерола. По данным исследования R.J. Slak и соавт. (2013), селективность вилантерола in vitro сопоставима с сальметеролом, но более чем в тысячу раз превышает таковую у индакатерола и формотерола.
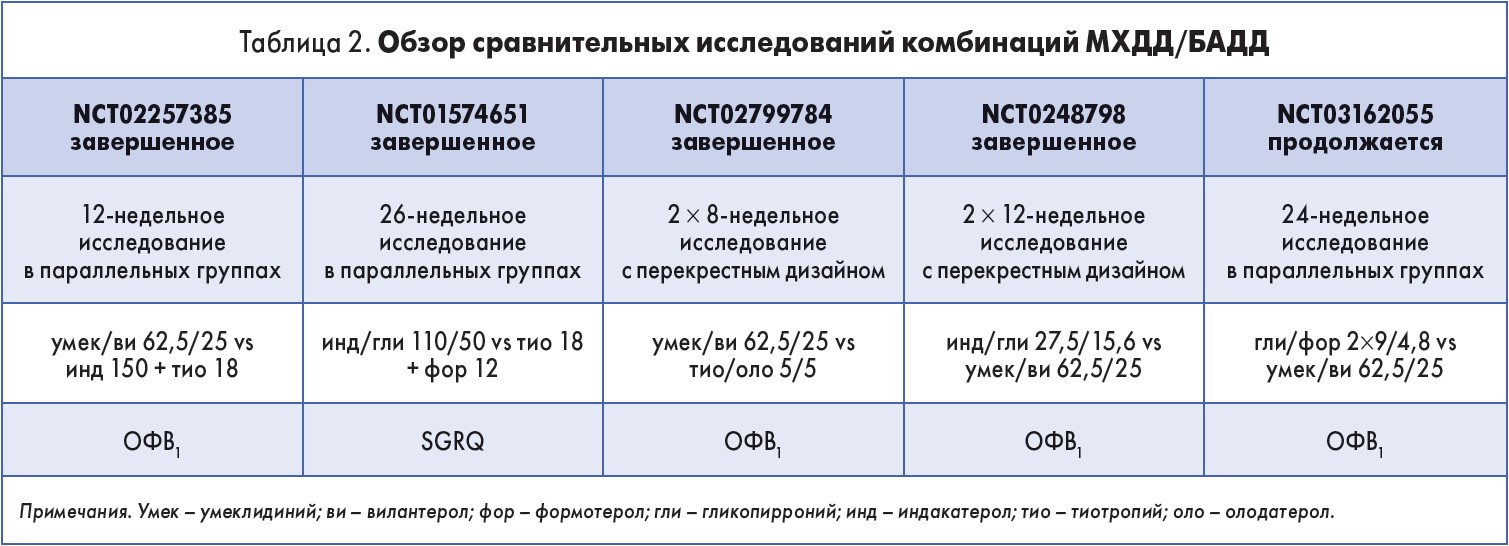
Распространенность ХОЗЛ в мировой популяции, а также социально-экономическая значимость этого заболевания объясняют тот факт, что сегодня проводится все больше сравнительных клинических исследований, в которых изучаются эффективность и безопасность применения новых фиксированных комбинаций длительно действующих бронхолитиков (табл. 2).
Данные систематического обзора и метаанализа результатов применения двойной бронходилатации в терапии ХОЗЛ свидетельствуют, что фиксированные комбинации более эффективны по сравнению с монокомпонентами. Применение каждой из комбинаций приводило к более значимому улучшению ОФВ1; достоверную разницу между различными препаратами установить не удалось (L. Calzetta et al., 2016).
Доказательства, полученные в ходе завершенных исследований, а также промежуточные результаты незавершенных научных испытаний позволяют сделать вывод, что раннее назначение фиксированных комбинаций МХДД/БАДД обеспечивает пациентам с ХОЗЛ статистически достоверный регресс симптомов, улучшение функции легких и повышение качества жизни.
Кандидат медицинских наук К.С. Малиновская (г. Киев) познакомила присутствующих с методами оценки характера воспаления при выборе варианта терапии ХОЗЛ.
– В последние годы изменившийся подход к лечению и появление новых комбинаций бронхолитиков существенно расширили возможности лечения ХОЗЛ. При этом особое внимание специалистов обоснованно направлено на пациентов с тяжелым течением ХОЗЛ, история болезни которых включает ≥2 обострений или ≥1 госпитализации за прошедший год. В то же время существуют категории больных, отвечающих на лечение ИГКС (ингаляционные глюкокортикостероиды)/БАДД.
Согласно критериям GOLD‑2017 цели терапии ХОЗЛ имеют 2 стратегических направления: уменьшение выраженности симптомов и снижение риска, что, в свою очередь, подразумевает профилактику и лечение обострений, предупреждение прогрессирования заболевания и наступления смерти. Для оценки ответа больного на терапию врачу достаточно таких показателей, как облегчение симптомов, повышение толерантности к физической нагрузке и улучшение состояния здоровья пациента. Несколько сложнее оценить такие долгосрочные цели терапии, как снижение риска, поэтому клиницисты руководствуются имеющейся доказательной базой.
Преимущества терапии ИГКС/БАДД у пациентов с тяжелыми и среднетяжелыми обострениями изучались в мультицентровом двойном слепом рандомизированном плацебо-контролируемом исследовании TORCH, длившемся 3 года. Целью исследования было изучение эффективности действия комбинации сальметерол/флютиказон (Серетид) у пациентов со среднетяжелой и тяжелой степенью ХОЗЛ по сравнению с сальметеролом, флютиказона пропионатом и плацебо. Первичной конечной точкой указанного исследования была смерть от всех причин; этот показатель в группах комбинированной терапии и плацебо оказался сопоставимым (р=0,052).
Результаты исследования продемонстрировали снижение на 17,5% риска смерти от любых причин в группе, получавшей сальметерол/флютиказон, по сравнению с группой плацебо. Комбинированная терапия ИГКС/БАДД привела к значительному снижению частоты и выраженности обострений в долгосрочной перспективе. В то же время в ходе исследования TORCH было установлено, что комбинация сальметерол/флютиказон предупреждает обострения за счет множественного влияния на механизмы бронхиальной обструкции, одним из которых является замедление высвобождения гистамина (Р.М. Calverley et al., 2007).
Следует заметить, что имеющиеся данные о влиянии эозинофилии на течение ХОЗЛ достаточно противоречивы и нуждаются в дальнейшем изучении. Тем не менее уже сегодня эозинофилию можно рассматривать в качестве предиктора ответа на терапию ингаляционными ИГКС. Кроме того, идентификация эозинофилии в качестве наиболее доступного биомаркера, позволяющего оценить ответ на применение ИГКС, может помочь в выборе варианта лечения конкретного пациента с ХОЗЛ, что полностью соответствует индивидуализированному подходу в современной медицине.
Каковы же предпосылки использования эозинофилов периферической крови в качестве биомаркера? Результаты, полученные в ходе независимых клинических исследований, подтверждают тот факт, что пациенты с эозинофилией ≥2% лучше отвечают на терапию комбинацией сальметерол/флютиказон.
Ретроспективный анализ двойного слепого плацебо-контролируемого исследования ISOLDE, в котором изучалось влияние ИГКС на прогрессирование тяжелой и среднетяжелой степени ХОЗЛ, обнаружил более выраженное снижение ОФВ1 у пациентов с эозинофилией ≥2% в группе плацебо по сравнению с группой флютиказона пропионата.
В исследовании TRISTAN было установлено, что применение комбинации сальметерол/флютиказон обеспечивает достоверное преимущество у пациентов с эозинофилией по сравнению с участниками из группы плацебо и больными из групп лечения монокомпонентами – сальметеролом и флютиказона пропионатом (Р.М. Calverley et al., 2003).
Данные, полученные в предыдущих исследованиях, оказались сопоставимы с результатами исследования INSPIRE; post hoc анализ показал, что в группе сальметерола/флютиказона (Серетид) у пациентов с эозинофилией ≥2% частота обострений ХОЗЛ была достоверно ниже таковой в группе приема тиотропия (Wedzicha et al., 2008).
В целом метаанализ рандомизированных клинических исследований по изучению применения комбинации ИГКС/БАДД продемонстрировал, что 50-70% пациентов с ХОЗЛ имели уровень эозинофилии ≥2% (или ≥150 кл/мкл). Это дало основания включить в Рекомендации GOLD‑2017 дополнения относительно применения ИГКС/БАДД:
- к терапии пациентов группы С, страдающих постоянными обострениями, следует добавить второй бронходилататор (МХДД/БАДД) или назначить ИКС/БАДД;
- у некоторых пациентов группы D препаратами выбора могут быть ИГКС/БАДД. Более высокий уровень эозинофилии может также являться фактором, свидетельствующим в поддержку использования ИГКС-содержащих препаратов, однако этот вопрос еще находится на стадии обсуждения.
Итак, можно сделать следующие выводы:
- Показатель эозинофилии можно рассматривать в качестве предиктора ответа на терапию ИГКС/БАДД.
- GOLD‑2017 рекомендует комбинацию ИГКС/БАДД некоторым пациентам в качестве терапии первой линии, в том числе пациентам с повышенным уровнем эозинофилии.
- Препарат Серетид имеет обширную доказательную базу у пациентов с ХОЗЛ и может быть рекомендован в качестве альтернативы у больных группы D с эозинофилией, а также у пациентов групп С и D с обострениями на фоне применяемой терапии.
Актуальным вопросам повышения приверженности пациентов с БА к выполнению лечебных рекомендаций было посвящено чрезвычайно интересное выступление В.В. Мороза (г. Киев).
– По результатам исследования REALISE survey неконтролируемая астма по-прежнему входит в перечень наиболее острых медицинских проблем в странах Европы. Как показал опрос 8 тыс. пациентов, проведенный в 11 европейских странах, примерно у 45% имелась неконтролируемая БА (D. Price et al., 2014). В ходе исследования также было установлено, что в дополнение к низким уровням контроля заболевания наблюдаются частые обострения:
- 44% пациентов сообщали об использовании оральных кортикостероидов в предыдущие 12 мес;
- 24% пациентов обращались за помощью в ургентном порядке;
- 12% пациентов были госпитализированы.
При этом обнаружилось, что >80% больных считают свою астму контролируемой, а из тех, у кого были обострения, требующие применения оральных кортикостероидов, 75% считают свое заболевание «не тяжелым».
По мнению Международной группы по оказанию помощи при респираторных заболеваниях в первичном звене (International Primary Care Respiratory Group), причиной отсутствия контроля БА является прежде всего низкая приверженность к лечению. Среди других причин, не позволяющих достичь контроля астмы, специалисты отмечают: неправильный диагноз; курение; коморбидность (аллергический ринит); неправильная техника ингаляции; вариабельность ответа на фармакотерапию (J. Haughney et al., 2008).
По определению Всемирной организации здравоохранения (ВОЗ) (2003), «приверженность» означает «степень изменения поведения человека, такое как прием лекарства, следование диете и изменение образа жизни в соответствии с рекомендациями, согласованными с врачом». При этом ВОЗ подчеркивает, что отношения между пациентом и врачом должны быть партнерскими.
В чем же причины низкого комплайенса пациентов с БА? Различают целый ряд факторов, часто взаимосвязанных. Так, поведение пациента обусловлено его возрастом, образованием, знаниями, восприятием заболевания, сопутствующей патологией, опасениями по поводу цены лекарств, побочных эффектов и зависимости. Неправильная техника ингаляции может быть сопряжена со сложностью устройств доставки препарата, а также нежеланием пациента демонстрировать ингалятор в общественных местах.
По данным исследования GAPP (2016), среди перечня причин, по которым пациенты меняют или прекращают применение препарата для лечения астмы, ключевое место занимает уменьшение или исчезновение симптомов (45%). Среди других причин отказа от лечения – развитие побочных эффектов (21%), беспокойство о возможном развитии таковых (18%), высокая цена препарата (13%) и неудобство его использования (9%). В исследовании приняли участие 1726 взрослых в возрасте ≥18 лет.
Следует отметить, что результаты, полученные в ходе клинических исследований, о приверженности пациентов к лечению, выше таковых в условиях реального мира. Если по данным метаанализа клинических исследований приверженность составляет 98%, то по результатам обсервационных исследований – не превышает 20%.
Низкий комплайенс пациентов к лечению ведет к неблагоприятным исходам заболевания, что увеличивает экономическую составляющую терапии и нагрузку на здравоохранение. В итоге формируется замкнутый круг, в котором стоимость лечения перекладывается на плечи пациента и его родных, что, разумеется, еще более снижает комплайенс.
Какими же должны быть меры профилактики, призванные повысить приверженность пациентов к лечению? М. Nose и соавт. (2003) и K.J. Petri и соавт. (2012) сгруппировали с этой целью разрозненные рекомендации:
- технические (упрощение режима, снижение количества доз в день, использование по возможности фиксированных комбинаций и пациент-ориентированных типов ингаляторов);
- поведенческие (использование вспомогательных средств для запоминания или напоминаний – компьютер, телефон, визиты на дом);
- образовательные (когнитивный и активный подход к обучению, предоставление информации пациенту о его болезни и лечении, беседы, аудиовизуальные материалы, работа в группе, контроль на дому, анализ обратной связи);
- социальные (практические или эмоциональные – поддержка членов семьи, информирование общественности, при этом практические подходы более эффективны);
- другие (комплексное вмешательство, сочетающее когнитивные и поведенческие аффективные компоненты, такие как доверительные отношения между пациентом и лечащим врачом или совместное принятие решений).
Мнение пациента относительно его приверженности несколько отличается от мнения по этому поводу медиков. Так, если фармпроизводители и врачи говорят о «приверженности», то сами пациенты больше заинтересованы в «вовлеченности», то есть в осознанности назначенной ему стратегии терапии. Это непосредственным образом влияет на его решения и действия, а также приводит к лучшему восприятию здоровья. Установлено, что пациенты, задействованные своими лечащими врачами в принятие решения, получали более высокую кумулятивную дозу противовоспалительных препаратов в течение года по сравнению с пациентами, не принимавшими участия в таких решениях. В итоге прямой и доверительный контакт с пациентами значимо улучшил соблюдение фармакотерапии и клинические исходы астмы (S.R. Wilson et al., 2010).
Рассмотрим факт приверженности к терапии как необходимость пациента принимать изменения в его жизни, тем более если речь идет о впервые выявленном заболевании. Наиболее частая причина сложности таких изменений – это амбивалентность или одновременное желание несовместимых вещей. Так как амбивалентность некомфортна, она часто ведет к прокрастинации, которую ошибочно принимают за резистентность. Однако прогресс возможен только при четком намерении меняться. Если такого намерения нет, происходит срыв, ведущий к отсутствию изменений.
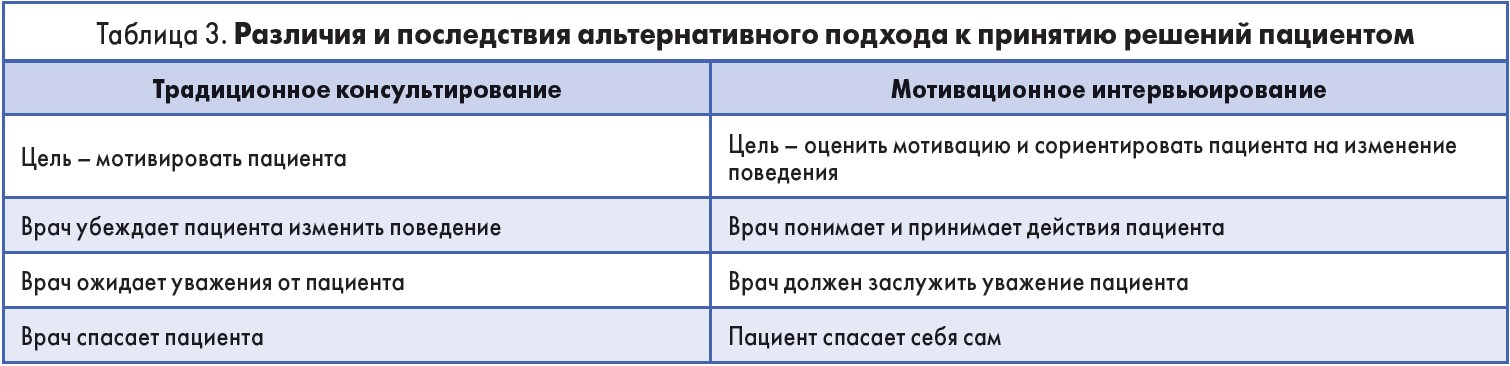
Эффективным способом, позволяющим говорить с пациентами об изменениях, является мотивационное интервьюирование. Этот метод консультирования помогает задействовать и развивать внутреннюю мотивацию пациента, с тем чтобы изменить его поведение. Между традиционным консультированием и мотивационным интервьюированием есть существенная разница. В первом случае врач предполагает, что у пациента недостаточно знаний, поэтому предоставляет информацию, рассказывает о принципах здорового образа жизни и надеется, что пациент будет следовать этим инструкциям. Применяя мотивационное интервьюирование, врач развивает партнерские отношения с пациентом и обменивается информацией для выработки информированного решения (табл. 3). Таким образом врач и пациент обсуждают и достигают договоренностей (Carl J. Possidente et al., 2006).
Следует отметить, что отношения «пациент-врач» предполагают партнерство, при котором врач избегает роли «эксперта». Принятие пациента означает уважение его автономности и потенциала. Сострадание врача выражается в том, что он стремится действовать в самых лучших интересах пациента. В свою очередь, у пациента рождаются наилучшие идеи и мотивы к изменениям.
Партнерские отношения «пациент-врач» осуществляются посредством диалога, который включает открытые вопросы, подтверждение, отражение и резюмирование. Вопросы врача помогают понять внутреннюю мотивацию пациента. Подтверждение направлено на поддержку пациента и способствует более открытому диалогу. Отражение – на глубокое понимание того, что пациент думает и чувствует, чтобы затем возвратить это пациенту. Резюмирование – это отражение врачом более чем одного утверждения пациента в виде резюме.
Процесс мотивационного интервьюирования включает в себя 4 этапа: вовлечение, фокусирование, побуждение и планирование. Вовлечением называют процесс установления доверия в отношениях на основе взаимного уважения, а также настройка, выравнивание и построение терапевтических отношений. Фокусирование – это продолжающийся процесс поиска, создания и поддержания направления, постановка целей, определение приоритетов. В процессе первых двух этапов у пациента появляется побуждение к изменениям и выявляется собственная мотивация к ним, после чего можно переходить к планированию, которое состоит в разработке детального плана действий, с которым пациент согласен и который готов воплощать в жизнь.
Результаты исследования, где изучались убеждения и поведение пациентов с астмой, показали, что 95% врачей, прошедших тренинг по развитию навыков консультирования приверженности, оценили его как чрезвычайно полезный. В конце исследования (17±4 мес) уверенность врачей в использовании навыков консультирования увеличилась, равно как и частота использования этих навыков и их удовлетворенность своими консультациями (J.M. Foster et al., 2016).
Участники мероприятия отметили высокий уровень организации ХІ Национального астма-конгресса, информационную насыщенность прозвучавших на нем докладов. Выступления авторитетных специалистов и неподдельный интерес аудитории в очередной раз подтвердили важность Конгресса не только для пульмонологов, но и для врачей других специальностей.
Подготовила Наталия Позднякова
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 4 (41), грудень 2017 р.