29 грудня, 2017
Опасность рыбной кости
 Воспалительные псевдоопухоли (ВПО) – образования, которые формируются в тканях вследствие развития реактивного воспаления хронического характера. ВПО встречаются в легких (это самая распространенная локализация), центральной нервной системе, больших слюнных железах, почках, печени, сальнике, яичниках, гортани, мочевом пузыре, молочных железах, поджелудочной железе, селезенке, лимфатических узлах, коже, мягких тканях и т.д. [1].
Воспалительные псевдоопухоли (ВПО) – образования, которые формируются в тканях вследствие развития реактивного воспаления хронического характера. ВПО встречаются в легких (это самая распространенная локализация), центральной нервной системе, больших слюнных железах, почках, печени, сальнике, яичниках, гортани, мочевом пузыре, молочных железах, поджелудочной железе, селезенке, лимфатических узлах, коже, мягких тканях и т.д. [1].
Впервые о ВПО печеночной локализации в 1953 году сообщили Pack и Baker, которые описали ее как воспалительную миофибробластическую опухоль. ВПО могут быть единичными и множественными и достигать размеров до 25 см в диаметре [2].
Этиология и патогенез ВПО до сих пор остаются неизвестными [4]. Тем не менее в современной научной литературе имеются данные, свидетельствующие о роли инфекционных агентов в возникновении ВПО.
Во многих сообщениях упоминаются такие микроорганизмы, выделенные из ВПО, как Bacteroides caccae, Actinomyces species, Klebsiella species, Escherichia coli, грамположительные кокки (в том числе β-hemolytic streptococcus) [7]. Тем не менее выделить микроорганизмы из ВПО не всегда удается, поэтому ряд авторов связывают возникновение ВПО с гепато-панкреатико-билиарными аутоиммунными заболеваниями, например IgG4-ассоциированным склерозирующим холангитом [8]. Вот почему одни врачи применяют для консервативного лечения ВПО антибиотики, а другие – кортикостероиды.
Несмотря на значительный прогресс в диагностике, отсутствие четких различий между ВПО и другими очаговыми поражениями печени все еще вызывает множество проблем. ВПО могут имитировать злокачественные опухоли (лимфому, злокачественную фиброзную гистиоцитому, гепатоцеллюлярную карциному, метастатическую опухоль и т.д.) и гранулематозные повреждения (туберкулез и саркоидоз) [4]. Дифференциальная диагностика между ВПО и злокачественными опухолями, даже при помощи спиральной компьютерной томографии (СКТ) и магнитно-резонансной томографии (МРТ), представляет огромную сложность. Между тем мировая практика показывает, что проведение чрескожной биопсии опухоли позволяет поставить правильный диагноз.
Рекомендуемой тактикой лечения ВПО является консервативная терапия (антибиотики, нестероидные противовоспалительные препараты, кортикостероиды), которая применяется до полного исчезновения опухоли [7]. В случае ее неэффективности рекомендовано прибегать к оперативной тактике лечения [1, 4].
По некоторым данным, опубликованным в научной литературе, часть ВПО после завершения полного консервативного курса лечения рецидивируют. Кроме того, еще одной проблемой, встречающейся в мировой практике, помимо рецидива ВПО, является их малигнизация. Авторы сообщают о случаях перерождения ВПО в неходжкинскую лимфому и саркому печени [11, 12]. Вместе с тем у пациентов, оперированных по поводу ВПО, рецидивов не наблюдалось [10].
Клинический случай
Пациентка М. поступила 01.04.2017 г. в клинику Института общей и неотложной хирургии (далее – Институт) с жалобами на боли в области эпигастрия и правого подреберья, слабость, повышение температуры тела до 38,0 oС. Анамнез болезни: считает себя больной на протяжении трех месяцев, когда возникли периодические ноющие боли в эпигастрии. За 2 нед до госпитализации болевой синдром усилился, возникла лихорадка. Больная М. обследована по месту жительства, при мультидетекторной КТ в SIII печени выявлено гиподенсивное образование неоднородной структуры размерами 38×40×47 мм с нечеткими контурами, прилежащее к круглой, серповидной связке. Заключение: новообразование SIII печени с признаками агрессивного роста (периваскулярная эпителиоидно-клеточная опухоль(?) (PEComa) гепатоцеллюлярный рак(?) (ГЦР) аденома(?)).
Пациентка была обследована в клинике Института. Согласно клинико-лабораторным данным, находилась в компенсированном состоянии. Несоответствие клинической картины опухолевому процессу печени потребовало пересмотра данных мультидетекторной КТ (рис. 1).
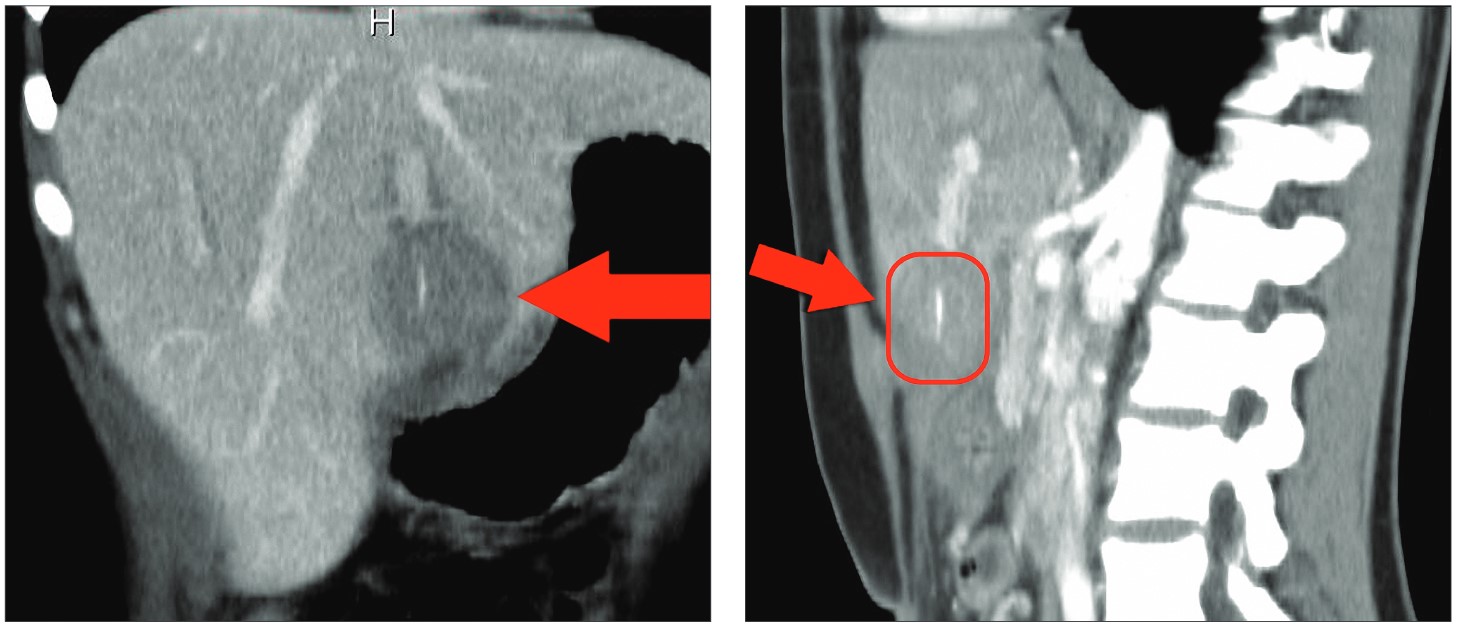
Рис. 1. КТ органов брюшной полости пациентки М.
Описание КТ органов брюшной полости: размеры печени не увеличены, в SIII-SIVb визуализируется гиподенсивное округлое образование размерами до 45×42×40 мм; в структуре образования лоцируется линейный высокоплотный фрагмент протяженностью около 20 мм и диаметром до 3 мм. От данного образования к антральному отделу желудка визуализируется свищеподобный мягкотканный тяж толщиной до 15 мм; стенка желудка на этом уровне локально утолщена. Также отмечается инфильтрация прилежащего отдела передней брюшной стенки. Заключение: КТ-картина характерна для воспалительного процесса (воспалительная псевдоопухоль) на фоне перфорации антрального отдела желудка инородным телом (возможно, костью). Наличие неопластического процесса представляется менее вероятным.
Консилиум врачей в составе хирурга-гепатолога, хирурга-онколога, радиолога установил клинический диагноз: воспалительная псевдоопухоль SIII-SIVb печени, вызванная микроперфорацией инородным телом желудка.
Накопленный опыт выполнения более 500 резекций печени позволил нам в качестве оптимального метода хирургического лечения выбрать резекционный – удаление ВПО в пределах здоровых тканей. С учетом локализации ВПО в SIII-SIVb печени, а также распространения воспалительного инфильтрата на желудок и переднюю брюшную стенку больной рекомендована анатомическая резекция SIII-SIVb печени, а при выявлении дополнительных показаний в ходе операции – клиновидная резекция малой кривизны желудка.
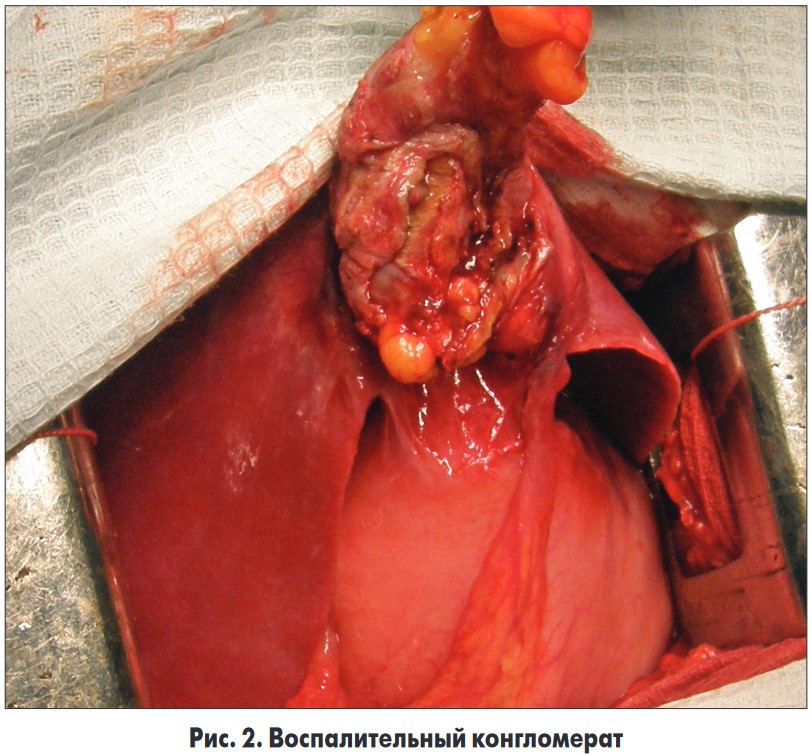 Ход операции. Выполнена верхне-срединная лапаротомия. При ревизии в брюшной полости определяется воспалительный конгломерат до 5 см в диаметре, состоящий из круглой связки печени, участка малой кривизны желудка, пряди малого сальника, SIII-SIVb печени и передней брюшной стенки (рис. 2).
Ход операции. Выполнена верхне-срединная лапаротомия. При ревизии в брюшной полости определяется воспалительный конгломерат до 5 см в диаметре, состоящий из круглой связки печени, участка малой кривизны желудка, пряди малого сальника, SIII-SIVb печени и передней брюшной стенки (рис. 2).
Острым путем мобилизирована малая кривизна желудка, свищевого отверстия не выявлено, зона инфильтрированного участка желудка ушита серо-серозными швами.
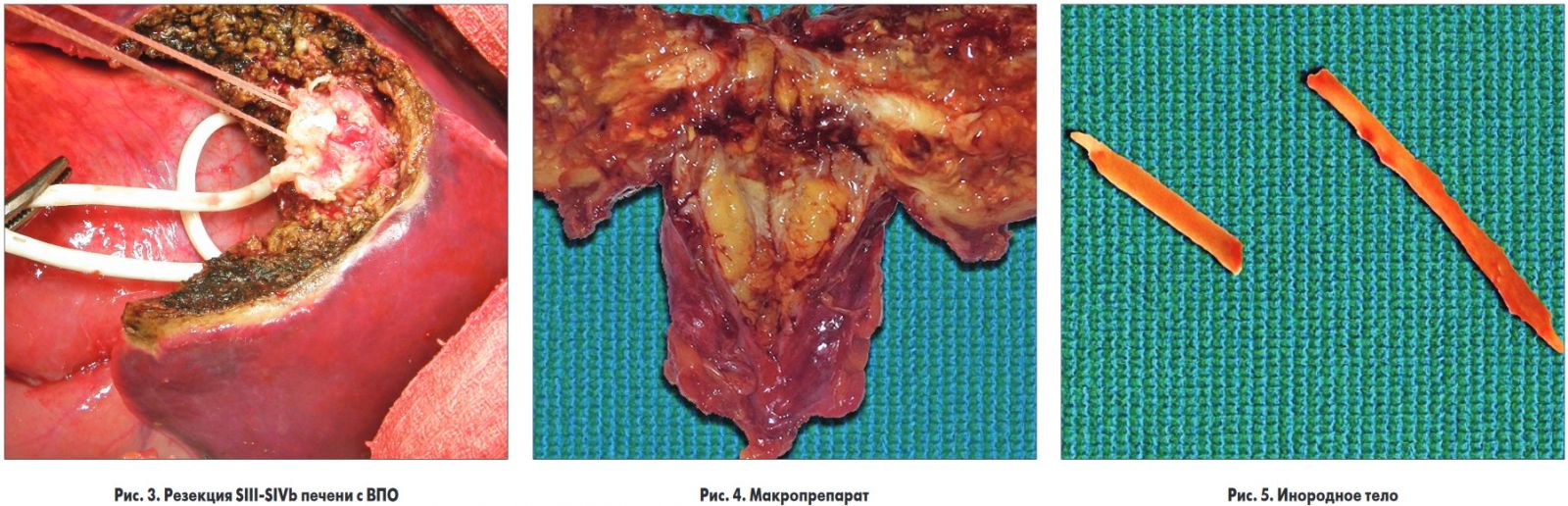
Произведена резекция SIII-SIVb печени с ВПО, при этом диссекцию паренхимы выполняли с использованием афферентной васкулярной эксклюзии печени (Pringle-маневр) в режиме 5’-10’-15’ (рис. 3).
В ходе транссекции паренхимы была применена методика «clamp crush»: в плоскости резекции мягким зажимом разрушалась паренхима печени, при этом сосуды и протоки диаметром >1 мм оставались неповрежденными. Это давало возможность их дополнительно обрабатывать – для этого сосудистые структуры «заваривали» с помощью аппарата электрохирургической сварки «Патонмед ЕКВЗ‑300», а желчные протоки клипировали или лигировали.
Все указанные вмешательства были выполнены в соответствии с принципами малообъемной инфузионной терапии при низких цифрах ЦВД (0-50 мм вод. ст.).
Удаленный макропрепарат представлял собой резецированный участок SIII-SIVb печени с ВПО размерами около 5×5×6 см. При рассечении ВПО из последнего выделились 2 фрагмента инородного тела, предположительно – рыбья кость (рис. 4, 5).
Гистологическое заключение: микроскопически в печени обнаружены участки фиброзной и грануляционной ткани с выраженной воспалительной инфильтрацией, местами – с пролиферацией желчных протоков.
Послеоперационный период протекал без особенностей на фоне проведения консервативной терапии и перевязок. Послеоперационные раны зажили первичным натяжением, швы сняты. Пациентка выписана на 10-е послеоперационные сутки.
Выводы
Резекцию печени следует рассматривать как оптимальный вариант лечения ВПО в случаях, когда диагностические методы исследования не дают точной информации о происхождении образования, а предшествующие ей консервативные мероприятия не оказывают ожидаемого эффекта. Однако необходимо акцентировать внимание на том, что оперативное вмешательство должно проводиться в специализированных центрах со специалистами, обладающими большим опытом выполнения резекций печени.
Литература
1. Rosa B. Ghost tumor: an inflammatory pseudotumor of the liver / B. Rosa, P. Moutinho-Ribeiro, J.M. Pereira [et al.] // Gastroenterol Hepatol. – 2012. – Vol. 8. – P. 630-633.
2. Goodman Z.D. Tumors and tumor-like lesions of the liver / Z.D. Goodman, L.M. Terraciano, A. Wee et al. // MacSweens Pathology of the Liver. – 2012. – Vol. 6. – P. 761-851.
3. Ferrel L. Benign and malignant tumors of the liver / L. Ferrel, R.D. Odze, J.R. Goldblum // Surgical Pathology of the GI Tract, Liver, Biliary Tract, and Pancreas. – 2008. – Vol. 2. – P. 1291-1325.
4. Gleason B.C. Inflammatory myofibroblastic tumours: where are we now? / J.L. Gleason // Journal of Clinical Pathology. – 2008. – Vol. 61. – P. 428-437.
5. Cheuk W. Inflammatory pseudotumor-like follicular dendritic cell tumor: a distinctive low-grade malignant intra-abdominal neoplasm with consistent Epstein-Barr virus association / W. Cheuk, J.K. Chan, T.W. Shek et al. // Am. J. Surg. Pathol. – 2001. – Vol. 25. –
P. 721-731.
6. Kutok J.L. Inflammatory pseudotumor of lymph node and spleen: an entity biologically distinct from inflammatory myofibroblastic tumor / J.L. Kutok, G.S. Pinkus, D.M. Dorfman et al. // Hum Pathol. – 2001. – Vol. 32. – P. 1382-1387.
7. Yamamoto H. Inflammatory myofibroblastic tumor versus IgG4-related sclerosing disease and inflammatory pseudotumor: a comparative clinicopathologic study / H. Yamamoto, H. Yamaguchi, S. Aishima et al. // Am J Surg Pathol. – 2009. – Vol. 33. – P. 1330-1340.
8. Zen Y. Pathological classification of hepatic inflammatory pseudotumor with respect to IgG4-related disease / Y. Zen, T. Fujii, Y. Sato, S. Masuda et al. // Mod Pathol. – 2007. – Vol. 20. – P. 884-894.
9. Faraj W. Inflammatory pseudo-tumor of the liver: a rare pathological entity / W. Faraj, H. Ajouz, D. Mukherji et al. // World J Surg Oncol. – 2011. – Vol. 9. – P. 5.
10. Makhlouf H. Inflammatory pseudotumor (IPT) of the liver: an entity distinct from inflammatory myofibroblastic tumors (IMFT): a clinicopathologic, immunohistochemi-cal, and molecular genetic study of 145 cases / H. Makhlouf, J. Fanburg-Smith, G. Wang et al. // Mod Pathol. – 2011. – Vol. 23. – P. 364.
11. Pfeifer L. Complete long-term remission of an inflammatory pseudotumor under corticosteroid therapy / L. Pfeifer, A. Agaimy, R. Janka, et al. // Case Rep Oncol. – 2011. – Vol. 4 – P. 304-310.
12. Zavaglia C. Inflammatory pseudotumour of the liver with malignant transformation. Report of two cases / C. Zavaglia, M. Barberis, F. Gelosa, et al. // Ital J Gastroenterol. – 1996. – Vol. 28 (3) – P. 152-159.
13. Rockey C.D. Liver Biopsy AASLD Position Paper. / C.D. Rockey, H.S. Cadwell, D.H. Goodman et al. // Hepatology. – 2009. – Vol. 49 (3). – P. 1017-1044.
14. Takamori R. Needle-tract implantation from hepatocellular cancer: is needle biopsy of the liver always necessary? / R. Takamori, L.L. Wong, C. Dang, L. Wong // Liver Transpl. – 2000. – Vol. 6 (1). – P. 67-72.
15. Imamura H. One thousand fifty-six hepatectomies without mortality in 8 years / H. Imamura, Y. Seyama, N. Kokudo et al. // Arch Surg. – 2003. – Vol. 138 (11). – P. 1198-1206.
16. Бойко В.В. Роль предварительной ишемической подготовки в возникновении ишемически реперфузионного повреждения печени в эксперименте / В.В. Бойко, М.Э. Писецкая, А.М. Тищенко и др. // Клінічна хірургія. – 2013. – № 5. – С. 72-76.