3 січня, 2018
Нові тенденції в клініці екстракорпорального запліднення, медичні переваги контрольованої стимуляції яєчників з антагоністами гонадотропін-рилізінг-гормону та корифолітропіном альфа
Безплідний шлюб становить серйозну медичну та соціальну проблему. За останні 30 років відбувся феноменальний прогрес в лікуванні безпліддя: в 1978 р. народилася перша дитина після IVF – Луїза Браун. На сьогодні більше 1 млн дітей народилося в світі завдяки допоміжним репродуктивним технологіям – ДРТ (більше 1% дітей за рік – у США). В Україні, як і в усьому світі, спостерігаються тенденції до збільшення віку вступу в шлюб та народження першої дитини. При аналізі даних національного реєстру з допоміжних репродуктивних технологій можна помітити, що кількість жінок віком до 25 років, що вступають у програми ДРТ, суттєво скоротилася на 40% (8% у 2001 р. і 4,8% у 2007 р.), кількість жінок 25-29 років також знизилася на 22,9% (29,7-22,9%). За той самий період кількість пацієнток 35-39 років збільшилася на 2,9% (24,6-25,3%), а старших за 40 років збільшилася на 26% (8,0-10,1).
Важливою проблемою при проведенні екстракорпорального запліднення (ЕКЗ) є відносно низька результативність. Середня частота настання вагітності у перерахунку на перенос 1 ембріона дуже залежить від низки чинників (віку жінки, стадії розвитку ембріона, стану ендометрія та імунної системи, протоколу підготовки) та становить у середньому 30-45%. Збільшення кількості ембріонів, що переносяться в порожнину матки за одну процедуру, може підвищувати результативність, але суттєво збільшує ризики багатопліддя.
Саме тому згідно з Наказом Міністерства охорони здоров’я (МОЗ) від 09.09.2013 № 787 рекомендовано переносити не більше 2-х ембріонів за спробу. Очікувана частота настання вагітності в такому разі становитиме залежно від віку жінки приблизно 45-55%. Таким чином, у більшості випадків досягнення вагітності пов’язане з потребою в проведенні повторних циклів ЕКЗ.
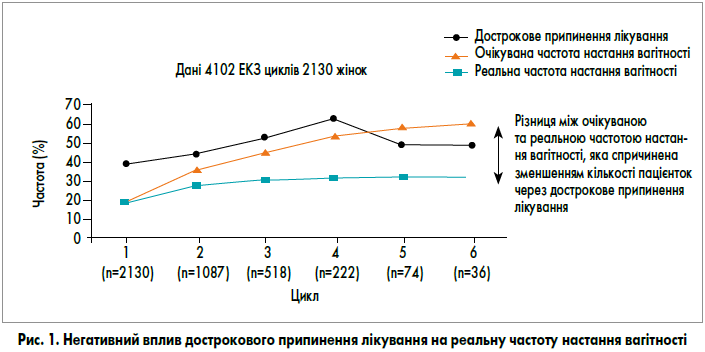
Аналізуючи кумулятивну частоту настання вагітності при проведенні ЕКЗ за декілька спроб, отримуємо суттєве збільшення у порівнянні з 1 циклом. Різниця між очікуваною частотою настання вагітності за 4-5 циклів і реальною складає 20-40%. Це переважно відбувається через великий відсоток пацієнток, що з різних причин достроково припиняють лікування (рис. 1).
Вивчення причин припинення лікування дозволить модифікувати лікувальні підходи, зробити ЕКЗ більш дружнім і прийнятним для пацієнток. Це, у свою чергу, збільшить відсоток жінок, що зможуть отримати позитивний результат.
Причини припинення лікування
Загальноприйнятою є думка, що в більшості випадків пацієнтки припиняють лікування переважно з двох причин: поганий прогноз і фінансові проблеми (Cousineau and Domar, 2007). Цікавими є в цьому сенсі дослідження, що проводяться в країнах, де вартість ЕКЗ лікування відшкодовується страховими компаніями. У таких країнах, як виявлено в дослідженнях (Olivius et al., 2004, M.F. Verberg et al., 2008), основними причинами припинення лікування є:
- фізичний та психологічний дискомфорт – 28%;
- невідома етіологія – 25%;
- поганий медичний прогноз – 14%.
Серед інших причин було вказано знижену якість ооцитів або ембріонів, етичні або психологічні проблеми подружжя, всиновлення тощо.
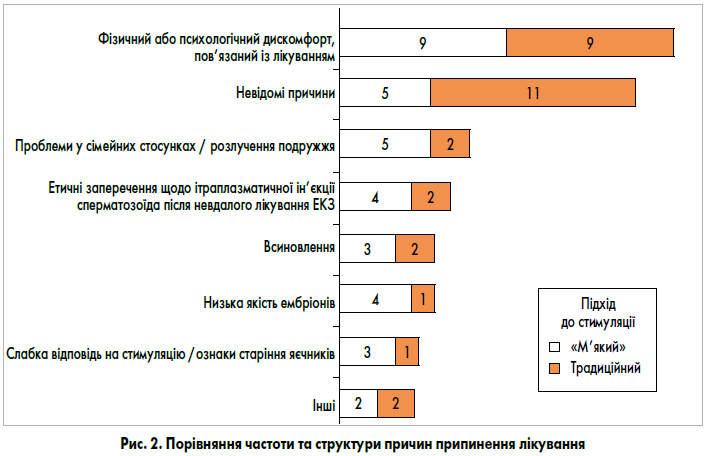
При порівнянні частоти та структури причин припинення лікування було виявлено, що більш «м’які» підходи до стимуляції значно знижують відсоток припинення циклів ЕКЗ до досягнення результату (рис. 2).
Протокол стимуляції: згідно з численними дослідженнями частота припинення лікування в так званих м’яких або мінімальних протоколах стимуляції була значно меншою у порівнянні з традиційними протоколами (рис. 3).
Проведення опитування серед пацієнток клініки «Родинне джерело», що проходять лікування за програмою ЕКЗ в 2017 році, продемонструвало, що пацієнтки віддають перевагу короткому протоколу стимуляції, з мінімальною кількістю ін’єкцій, більш простого дизайну, коротшої тривалості.
Іншою поширеною проблемою при застосуванні ДРТ є вибір лікарем оптимального протоколу стимуляції, адже існує велика кількість гонадотропінів, дозування та схем їх застосування. При виборі протоколу необхідно попередити надмірну відповідь на стимуляцію й обрати оптимальну стартову дозу у потенційно поганих відповідачів.
Антимюллерів гормон (AMГ) – ключовий біомаркер, що застосовують для прогнозування відповіді яєчників (Broer et al., 2013; Nelson et al., 2015). Традиційно у жінок зі зниженим оваріальним резервом (АМГ <1 нг/мл) застосовується збільшення стартової дози гонадотропінів. Різні автори пропонують починати стимуляцію з дози фолікулостимулюючого гормону (ФСГ) як мінімум 300 МО/день. Інші рекомендують збільшувати стартову дозу до 450 МО/день і навіть більше. З точки зору клінічної ефективності дані авторів є суперечливими.
Новий гормональний препарат для лікування безпліддя, що відноситься до нового класу рекомбінантних гонадотропінів пролонгованої дії, – корифолітропін альфа. Особливістю цієї молекули є вдвічі більший період напіввиведення у порівнянні зі стандартним рекомбінантним ФСГ (Corifollitropin alfa Dose-finding Study Group, 2008)
Ця властивість дозволяє ініціювати та підтримувати мультифолікулярний ріст протягом 7 днів після одноразової підшкірної ін’єкції (Fauser et al., 2009). Корифолітропін альфа був виведений на ринок у двох дозах: 100 мкг для жінок вагою <60 кг і 150 мкг при вазі > 60 кг. Корифолітропін альфа 150 мкг ініціює в середньому трохи сильнішу відповідь яєчників у порівнянні з добовою щоденною дозою ФСГ 200 МЕ (Devroey et al., 2009).
Отже, виникає питання, чи можемо ми в більшості випадків застосування контрольованої суперовуляції яєчникiв (КСОЯ) використовувати стандартний протокол із корифолітропіном альфа? Чи не буде такий підхід знижувати результативність лікування у порівнянні зі стандартними щоденним ін’єкціями ФСГ. У досліджені 2017 р. T. Lerman, M. Depenbusch та співавт. вивчили частоту аномальної реакції яєчників – як знижену (<6 ооцитів), так і надмірну (>18 ооцитів) – при застосуванні 150 мкг корифолітропіну альфа у жінок з різними рівнями АМГ та іншими біомаркерами оваріального резерву (n=5) в багатоцентрових, багатонаціональних проспективних, спостережних, когортних дослідженнях.
Безплідні жінки (n=212) з масою тіла >60 кг проходили лікування методом ЕКЗ, що включало КСОЯ у протоколі з множинними дозами антагоніста гонадотропін-рилізінг-гормону (аГнРГ). Демографічні, сонографічні та ендокринні показники були проспективно оцінені на 2-й або 3-й день спонтанного менструального циклу до введення корифолітропіну альфа. Сироватковий рівень АМГ показав найкращу кореляцію з кількістю ооцитів у порівнянні з іншими предикторами оваріальної відповіді. При аналiзi для прогнозування низької відповіді рівні AMГ до 0,91 нг/мл показали чутливість 82,4%, специфічність – 82,4%, позитивне прогностичне значення – 52,9%, негативне прогностичне значення – 95,1% (95% довiрчий інтервал – ДІ – 0,769-0,936; р<0,0001). Для прогнозування високої відповіді оптимальний поріг АМГ склав 2,58 нг/мл, чутливість – 80,0%, специфічність – 82,1%, позитивна прогностична величина – 42,5%, негативна прогностична величина – 96,1% (95% ДІ 0,787-0,955; р<0,0001).
Таким чином, можна зазначити, що жінки з концентрацією АМГ у сироватці між 0,9 та 2,6 нг/мл будуть мати оптимальну відповідь на стимуляцію в протоколах КСОЯ.
Стосовно пацієнток із ризиком надмірної відповіді деякі дослідження також демонструють можливість безпечного та ефективного застосування корифолітропіну альфа.
Так, у дослідженні T. Lee, H. Chen і співавт. (2015) брала участь 121 пацієнтка з рівнем АМГ >3,5 нг/мл. Усі вони проходили КСОЯ в рамках проведення ЕКЗ. 49 пацієнток отримували 100 мкг корифолітропіну альфа, 72 пацієнтки мали традиційні щоденні ін’єкції ФСГ (150 МЕ‑225 МО) протягом перших 5 днів. Оцінювалася кількість ооцитів, частота прогресуючої вагітності та частота гіперстимуляції яєчників.
Рівні естрадіолу (2396±1181 проти 3003±1864 pg/мл) та прогестерону (0,92±0,54 проти 1,22±0,84 нг/мл) у день ін’єкції хоріоничного гонадотропіну людини був значно нижчим у групі жінок корифолітропіну альфа у порівнянні з групою щоденного ФСГ. Кількість ооцитів (13,3±6,3 проти 14,3±7,5), частота запліднення (74,7±15,6 проти 74,7±19,1%) та відсоток ембріонів хорошої якості на 3-тю добу (53,5±32,6 проти 58,7±25,3%), а також частота настання вагітності (28/48 = 58,3% проти 31/70 = 44,3%) були схожими в обох групах. Частота синдрому гіперстимуляції яєчників становила 2,04% (1/49) і 2,78% (2/72) для корифолітропіну альфа та групи ФСГ відповідно. Усі випадки синдрому гіперстимуляції яєчників були помірного ступеня, і парацентез не був необхідним.
У результаті автори дійшли висновку, що корифолітропін альфа 100 мкг ефективний і безпечний у циклах IVF/ICSI для пацієнток із високим рівнем АМГ. Подальші дослідження необхідні для оцінки ефективності 100 мкг корифолітропіну альфа у пацієнток із масою понад 90 кг і жінок із потенційно зниженою реакцією на стимуляцію.
В іншому дослідженні (H. Selman, L. Rinaldi, 2016) було оцінено ефективність корифолітропіну альфа при стимуляції яєчників у пацієнток із низьким рівнем відповіді. У ньому взяли участь 85 пацієнток із потенційно поганою відповіддю згідно з Болонськими критеріями та середнім віком 40,2±3,9 років. Пацієнтки були проспективно рандомізовані у дві групи на основі режиму стимуляції яєчників: група А (досліджувана група, n=42) отримувала кломіфен цитрат і корифолітропін альфа протягом перших 7 днів стимуляції, а потім рекомбінантний ФСГ у протоколі з аГнРГ; група В (контрольна група, n=43) отримувала кломіфен цитрат та щоденну ін’єкцію ФСГ у протоколі з аГнРГ. Ми проаналізували результат стимуляції, кількість отриманих ооцитів, дроблення ембріонів, а також показники вагітності та імплантації.
Обидві групи були схожими за демографічними даними, результатом стимуляції та кількістю скасованих циклів. Відмінностей між групами А та В щодо кількості отриманих ооцитів (3,0±0,8 та 2,7±0,7 відповідно) та кількості ембріонів (1,8±0,6 та 1,7±0,7 відповідно) не виявлено. Вищими, хоч і статистично не значущими є результати на користь групи А порівняно з групою В за частотою вагітності за цикл (19 і 16,3% відповідно), частотою настання вагітності на перенос (21,6 і 17,9% відповідно) та частотою імплантації (14,7 і 13,4% відповідно). Також частота викиднів була зіставною між пацієнтками, які отримували корифолітропін альфа, та тими, хто отримував щоденну ін’єкцію рФСГ (12,5 і 14,2% відповідно).
Результати свідчать про те, що стимуляція яєчників із корифолітропіном альфа є настільки ж ефективною, як щоденна ін’єкція рекомбінантним ФСГ для лікування пацієнток із поганою реакцією на стимуляцію.
Щодо сприйняття пацієнтками протоколів із застосуванням корифолітропіну альфа дослідження демонструють кращу переносимість у порівнянні з традиційними протоколами.
Ефективність корифолітропіну альфа з рекомбінантним ФСГ у протоколі з аГнРГ було вивчено в дослідженні H.Y. Park, M.Y. Lee та співавт. (2014). Як показали результати, застосування ФСГ продовженої дії має таку саму ефективність (а в певних аспектах навіть кращу), як і традиційні протоколи КСОЯ.
Застосування корифолітропіну альфа в пацієнток із ризиком надмірної відповіді (у дозі 100 мкг) є безпечним и таким само ефективним, як і традиційні протоколи стимуляції.
Застосування корифолітропіну альфа у пацієнток зі зниженою відповіддю на стимуляцію не погіршує результативність лікування у порівнянні з традиційними схемами лікування.
Менша кількість ін’єкцій покращує переносимість лікування у більшості пацієнток і знижує ймовірність дострокового припинення лікування (рис. 4).
Інформація надана компанією «MСД»
для професійної підтримки фахівців охорони здоров'я. Інформація, що стосується будь-якого продукту(ів), може не збігатися з інструкцією
для медичного застосування препарату.
Будь ласка, ознайомтеся з повним текстом інструкції для отримання точної інформації
або даних щодо продуктів, які розглянуто
в цій публікації, до призначення.
WOMN‑1240970-0000
Тематичний номер «Гінекологія, Акушерство, Репродуктологія» № 4 (28), грудень 2017 р.