16 січня, 2018
Жирова дисплазія правого шлуночка та некомпактність міокарда лівого шлуночка в пацієнтки похилого віку з хронічною стабільною ішемічною хворобою серця
Клінічний семінар (спостереження та огляд літератури)
Клінічна інформація: пацієнтка П., 1944 р. н. 29.09.2016 р. поступила у відділення серцевої недостатності Державної установи «Національний науковий центр «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України» (далі – Інститут) зі скаргами на загальну слабкість, відчуття стискання за грудиною при фізичних навантаженнях (ході до 500 м), що минає після відпочинку. Нітрогліцерином не користувалася. Пацієнтка акцентує увагу на схильності до «рідкого пульсу».
Анамнез захворювання: вважає себе хворою з 22.09.2016 р., коли втратила свідомість (тривалість синкопального епізоду невідома). Зазначає, що артеріальний тиск (АТ) ніколи не підвищувався >130/80 мм рт. ст. До лікарів раніше не зверталася, ліків не приймала.
Анамнез життя: виразкова хвороба дванадцятипалої кишки, останнє загострення понад 30 років тому. У 1994 р. – тотальне вилучення лівої долі щитоподібної залози з приводу багатовузлового зоба ІІІ ступеня.
Клініко-інструментальне обстеження: при надходженні в стаціонар стан хворої задовільний. Будова тіла нормостенічна, зріст – 165 см, маса тіла – 65 кг, індекс маси тіла – 23,8 кг/м2. При аускультації легень дихання везикулярне, хрипи відсутні. Межі серця перкуторно не розширені, тони серця приглушені, ритмічні. Частота серцевих скорочень (ЧСС) – 60 уд/хв. АТ – 110/80 мм рт. ст. При пальпації живота печінка не виступає з-під краю реберної дуги, м’яка, безболісна, край круглий. Периферичні набряки відсутні.
За даними лабораторних досліджень, у клінічних аналізах крові, сечі та біохімічних аналізах, окрім ліпідограми, патологічних відхилень не виявлено.
 Ліпідограма: холестерин (ХС) загальний – 6,3 ммоль/л; тригліцериди – 0,59 ммоль/л; ХС ліпопротеїнів високої щільності – 1,7 ммоль/л; ХС ліпопротеїнів низької щільності – 4,33 ммоль/л; ХС ліпопротеїнів дуже низької щільності – 0,27 ммоль/л; індекс атерогенності – 2,7.
Ліпідограма: холестерин (ХС) загальний – 6,3 ммоль/л; тригліцериди – 0,59 ммоль/л; ХС ліпопротеїнів високої щільності – 1,7 ммоль/л; ХС ліпопротеїнів низької щільності – 4,33 ммоль/л; ХС ліпопротеїнів дуже низької щільності – 0,27 ммоль/л; індекс атерогенності – 2,7.
Швидкість клубочкової фільтрації, розрахована за формулою CKD-ЕРІ (Chronic Kidney Desease Epidemiology Collaboration), – 81 мл/хв/1,73 м2. Тиреотропний гормон – 2,74 мкМО/мл. Тропоніновий тест – негативний (у динаміці).
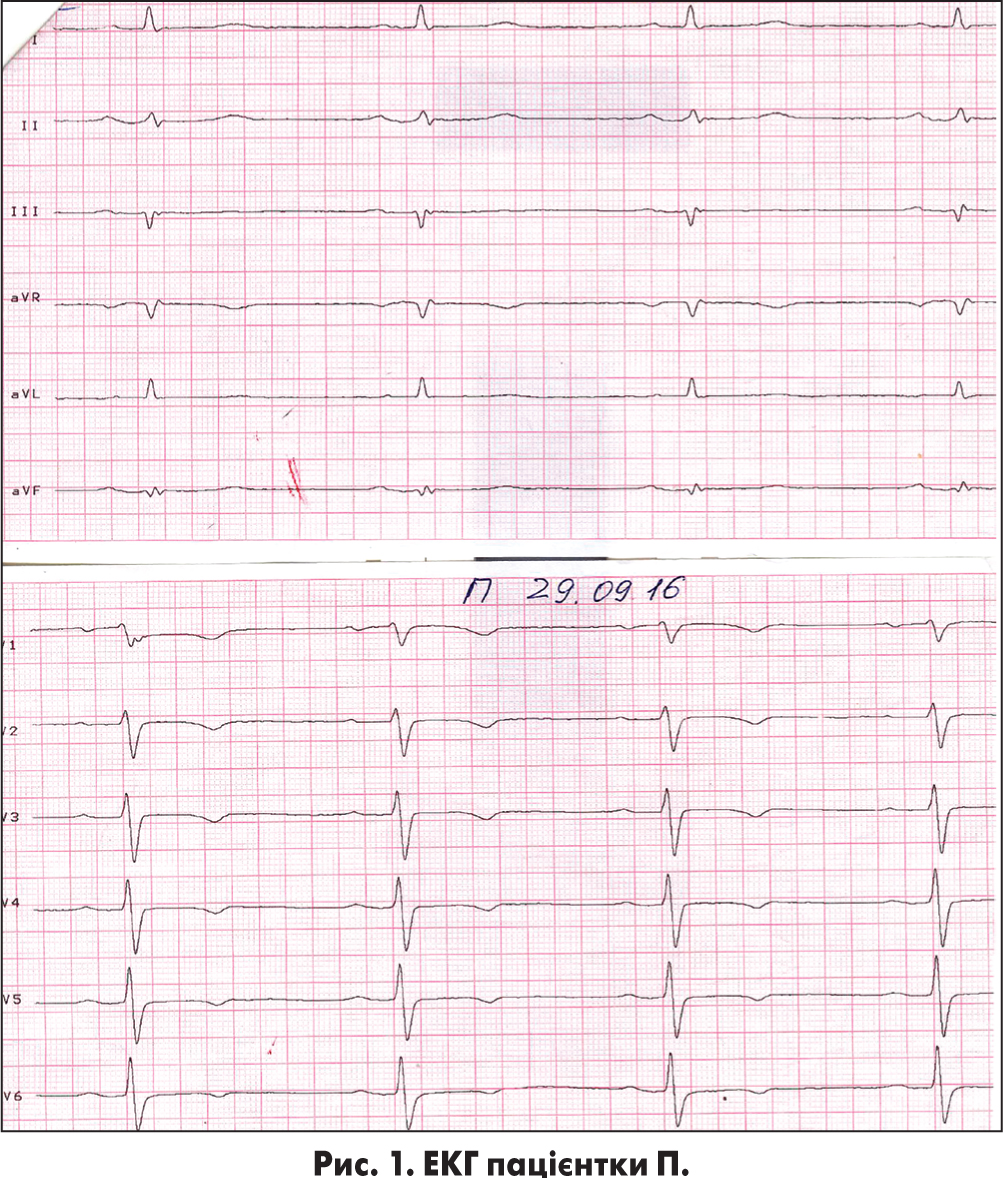
Електрокардіограма (ЕКГ): ритм синусовий, регулярний; ЧСС – 55-50 уд/хв. Інтервал PQ – 0,18 c; комплекс QRS – 0,08-0,10 c; інтервал QT – 0,40 c; кут α – 8°. Ознаки можливих дрібновогнищевих змін у передньо-перегородковій, верхівковій і передньо-боковій ділянках лівого шлуночка (ЛШ) у вигляді слабконегативних зубців Т у відведеннях V1-V6. Перевага біопотенціалів ЛШ. Попередні ЕКГ для порівняння відсутні. Графіка подальших ЕКГ, зареєстрованих у період перебування пацієнтки у стаціонарі, – без істотної динаміки (рис. 1).
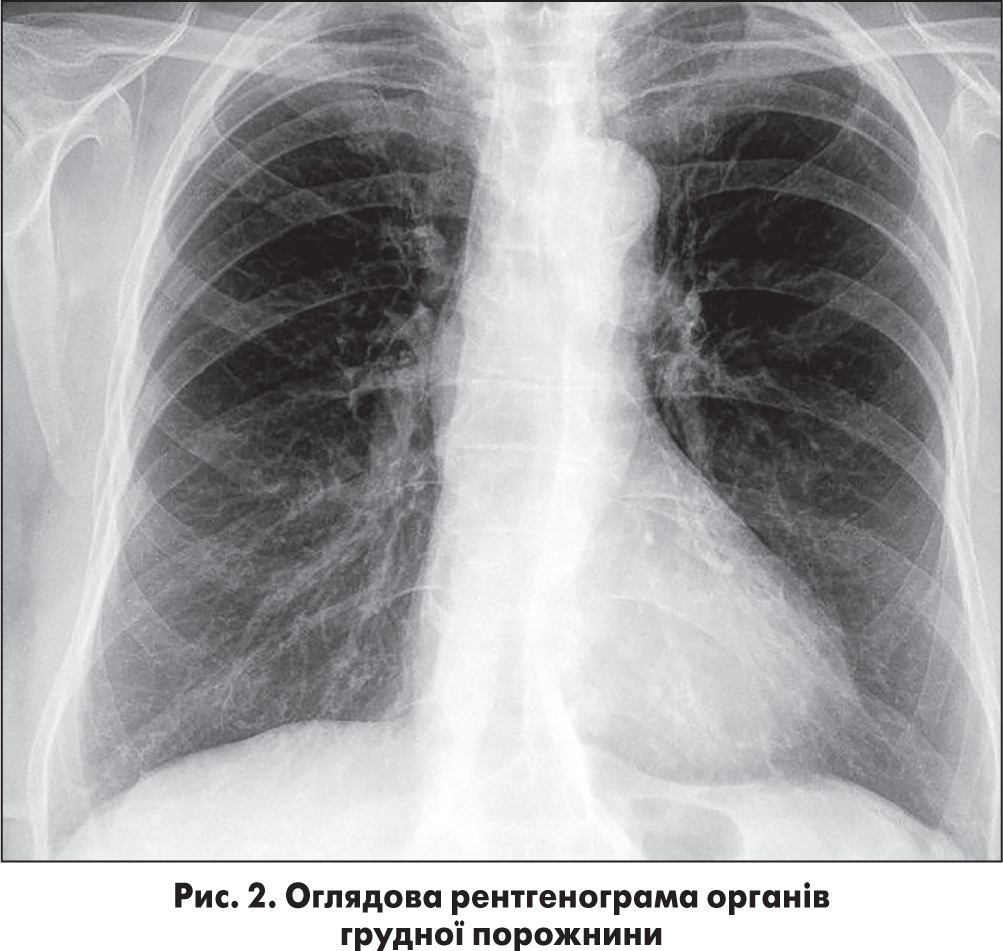 Рентгенографія органів грудної порожнини: легеневі поля прозорі. Малюнок нечіткий, у нижніх відділах збагачений і деформований. Корені легень – нечіткі, малоструктурні, деформовані, визначаються поодинокі кальцинати. Синуси вільні. Тінь серця помірно розширена вліво в нижніх відділах. Звапнення на рівні дуги аорти. Наявні базальні кардіо-діафрагмальні спайки. Кардіо-торакальний індекс – 47% (рис. 2).
Рентгенографія органів грудної порожнини: легеневі поля прозорі. Малюнок нечіткий, у нижніх відділах збагачений і деформований. Корені легень – нечіткі, малоструктурні, деформовані, визначаються поодинокі кальцинати. Синуси вільні. Тінь серця помірно розширена вліво в нижніх відділах. Звапнення на рівні дуги аорти. Наявні базальні кардіо-діафрагмальні спайки. Кардіо-торакальний індекс – 47% (рис. 2).
Консультація невролога. Дисциркуляторна енцефалопатія ІІ ступеня, атактичний синдром, лівостороння пірамідна недостатність, синдром когнітивних порушень. Рекомендовано провести магнітно-резонансну томографію (МРТ) структур головного мозку.
Консультація офтальмолога. Гіперметропія слабкого ступеня обох очей. Початкова катаракта обох очей. Ангіопатія сітківки за дистальним типом.
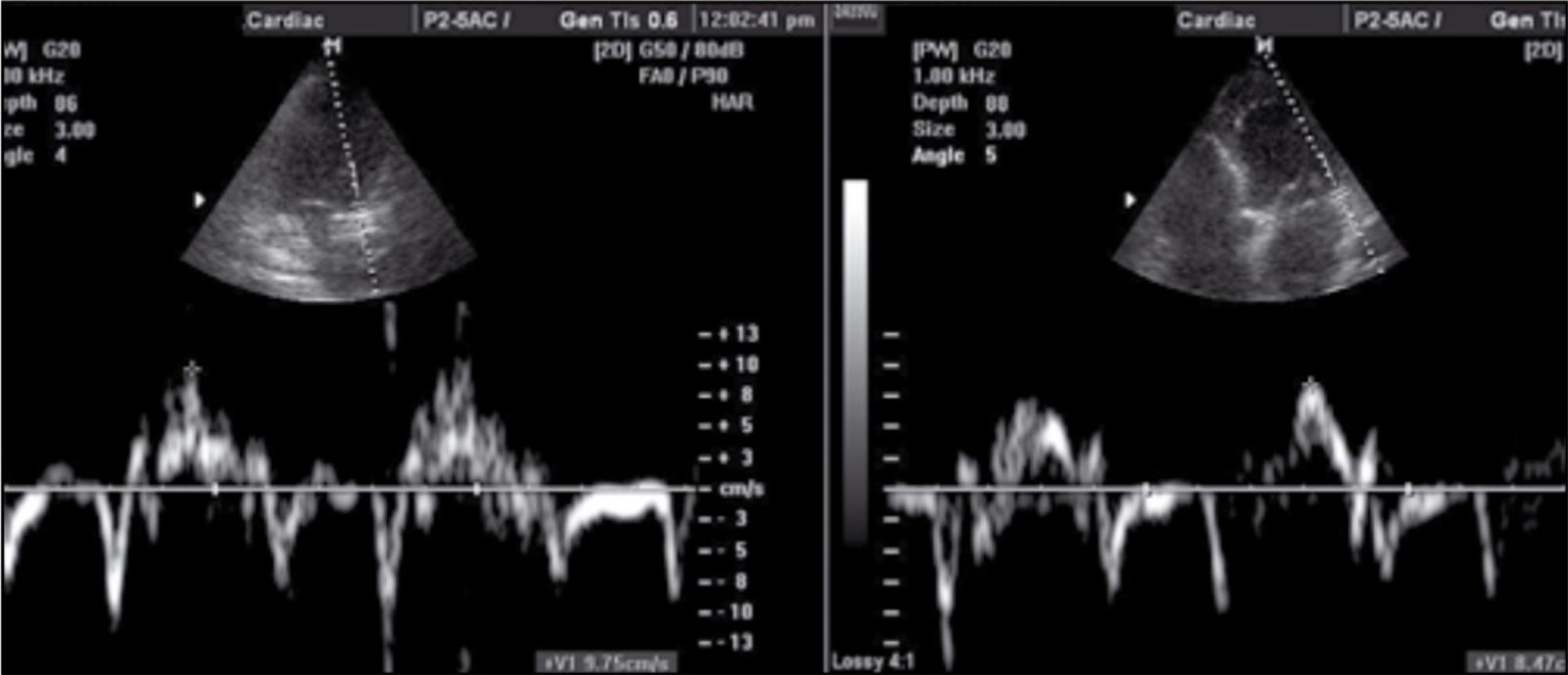
Ультразвукове дослідження (УЗД) серця: маса міокарда ЛШ – 116 г; індекс маси міокарда ЛШ – 69 г/м2. Порожнини нормальні, кінцево-діастолічний розмір (КДР) ЛШ – 4,65 см; кінцево-систолічний розмір (КСР) ЛШ – 3,0 см; кінцево-діастолічний об’єм (КДО) ЛШ – 100 мл; кінцево-систолічний об’єм (КСО) ЛШ – 35 мл; ударний об’єм ЛШ – 65 мл; передньо-задній розмір лівого передсердя – 3,45 см, корінь аорти – 3,3 см. Фракція викиду (ФВ) ЛШ – 65%, зони гіпокінезу не визначаються, швидкості систолічного руху мітрального кільця нормальні (рис. 3).
Рис. 3. Високі швидкості рухів мітрального кільця, що свідчать про збережену функцію субендокардіального шару міокарда
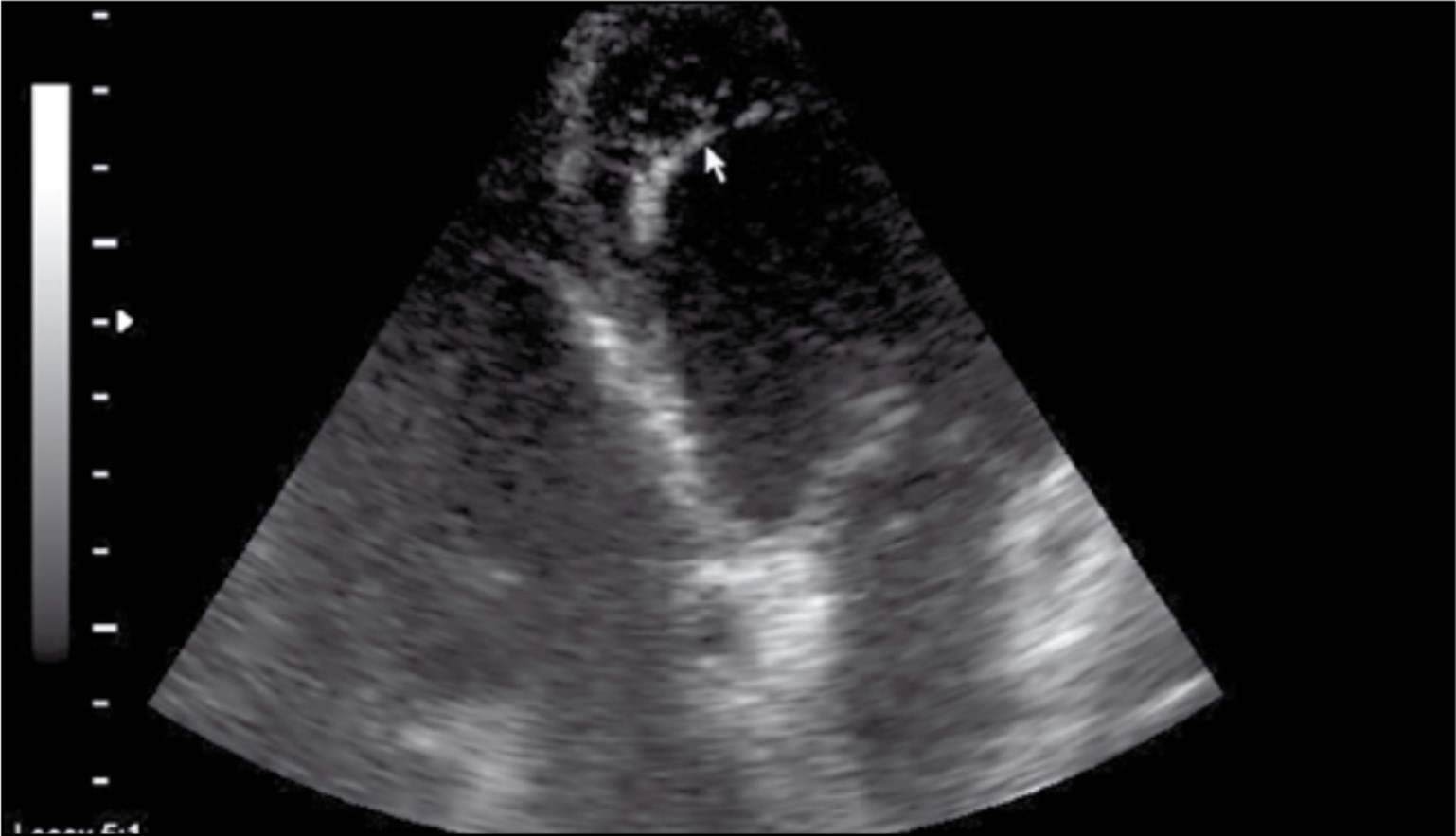
У ділянці верхівки ЛШ спостерігається прошарок некомпактного міокарда (НКМ) у вигляді множинних трабекул і хорд товщиною 4-5 мм (рис. 4).
Рис. 4. Зона НКМ у ділянці верхівки ЛШ
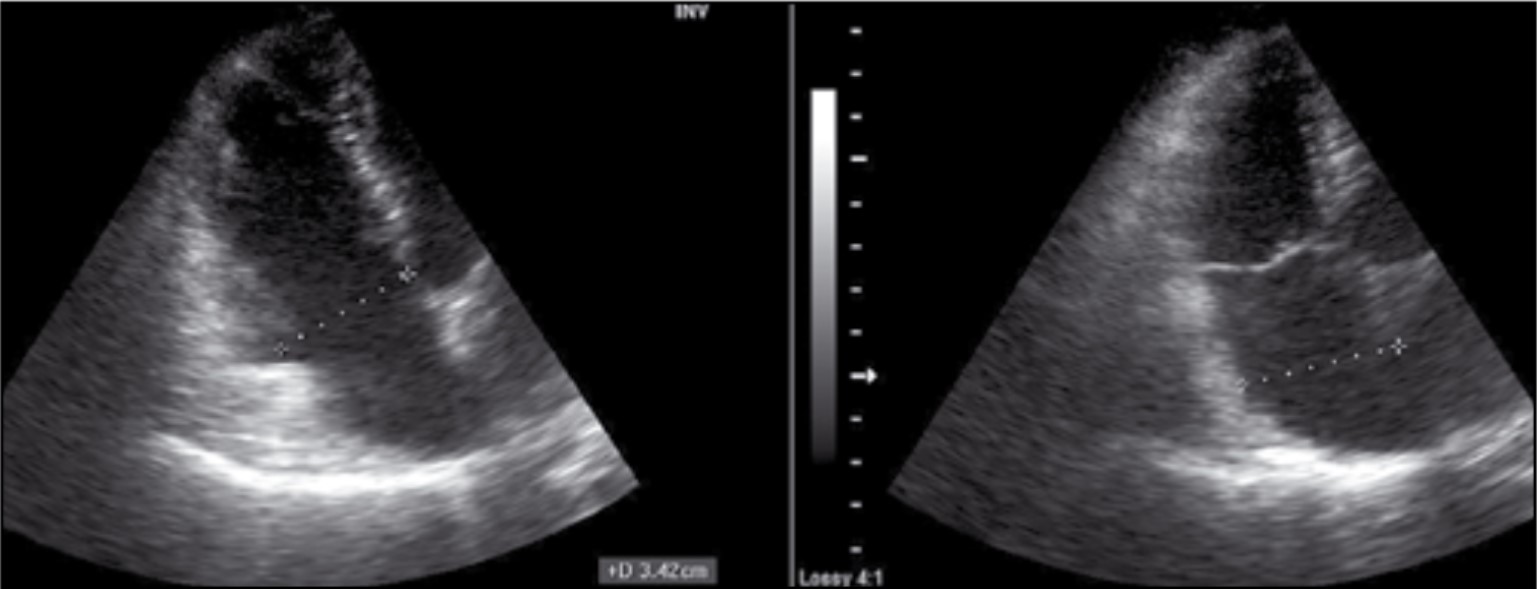
Праві відділи серця не дилатовані – поперечний розмір правого шлуночка (ПШ) у діастолу – 3,4 см; поперечний розмір правого передсердя (ПП) у систолу – 3,75 см; функції тристулкового клапана (ТК) без порушення (рис. 5).
Рис. 5. Розміри правих відділів серця в позиції А4С
При прицільному дослідженні стінки ПШ у його апікальних відділах відзначено гіпокінез стінки з нерівномірністю (узурацією) контура стінки з нерівномірним, місцями гіперехогенним сигналом і локальними потоншеннями стінки, що може відповідати локусам жирової інфільтрації (адипозного заміщення міокарда), типового для жирової дисплазії (ЖД) ПШ (рис. 6).
Рис. 6. Атипові локальні потоншення з нерівномірною ехогенністю стінки апікального відділу ПШ
Отже, в нашої пацієнтки виявлені ознаки як НКМ, так і ЖД ПШ за результатами УЗД серця.
Можливість діагностики ЖД ПШ за допомогою ехокардіографії (ЕхоКГ) в асимптомних пацієнтів досліджували R. Scognamiglio і співавт. (1989). У третини пацієнтів із сімейним анамнезом ЖД ПШ і шлуночковою екстрасистолією були виявлені її ознаки за допомогою цього методу. До ознак останньої належали: помірна дилатація ПШ, локальне вип’ячування й дискінезія нижньо-базальної стінки, виражений модераторний тяж, ізольована дилатація вихідного тракту чи дискінезія верхівки, трабекулярна дезорганізація. Патогномонічними ЕхоКГ-ознаками ЖД ПШ є: КДР і КСР ПШ, а також співвідношення КДР ПШ / КДР ЛШ >0,5 (чутливість – 86%, специфічність – 93%, позитивна діагностична значущість для виявлення ЖД ПШ – 86%). У нашої пацієнтки співвідношення КДР ПШ / КДР ЛШ становило 0,73.
Зважаючи на скарги щодо болей за грудиною стискаючого характеру під час фізичного навантаження, прийнято рішення щодо візуалізації коронарного русла за допомогою мультиспіральної комп’ютерної томографії (МСКТ) із контрастуванням за умови протипоказаного навантажувального тесту (негативні зубці Т у стані спокою в грудних відведеннях).
 МСКТ-коронарографія була проведена до контрастування та з внутрішньовенним (в/в) болюсним контрастуванням на базі Інституту.
МСКТ-коронарографія була проведена до контрастування та з внутрішньовенним (в/в) болюсним контрастуванням на базі Інституту.
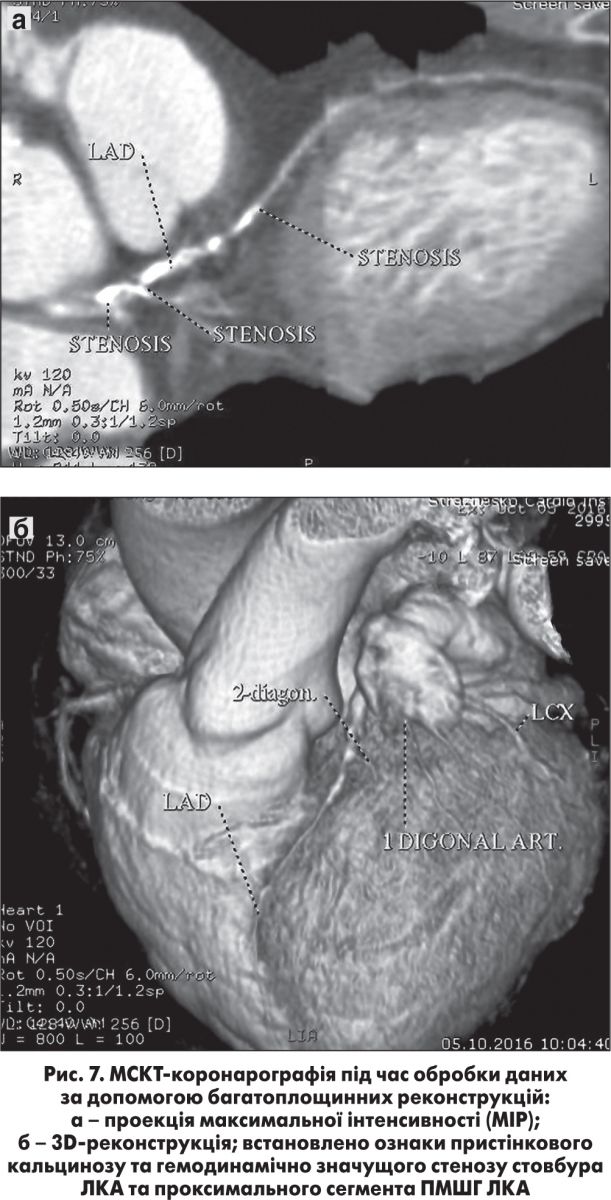
При обробці за допомогою стандартизованої програми Smart Score встановлено ознаки вираженого коронарокальцинозу, який при кількісному підрахунку за шкалою Агатстона становив 552 од. – 4-й ступінь прояву («кальцієвий індекс» (КІ) >400 од. – це виражений коронарний атеросклероз, що відповідає високій імовірності значущого коронарного стенозу та високому ризику серцево-судинних подій).
При постпроцесинговому аналізі МСКТ-результатів: кальцинати визначались у проекції стовбура лівої коронарної артерії (ЛКА), КІ – 146 од., проксимального, середнього сегментів передньої міжшлуночкової гілки (ПМШГ) ЛКА, КІ – 436 од., огинаючій гілці (ОГ) ЛКА, КІ – 27 од., правій коронарній артерії (ПКА), КІ – 89 од. (вікова норма вмісту коронарного кальцію для пацієнтів старше 70 років – 65 од.).
При в/в контрастуванні КА визначено: праводомінуючий тип кровопостачання міокарда ЛШ.
Проксимальний відділ ПКА діаметром 3 мм; на рівні кальцинозу гемодинамічно значущі стенози не виявлені; діаметр середнього відділу ПКА – 3,5-3 мм; дистальний відділ ПКА діаметром 3 мм, без ознак звуження просвіту.
Гілка гострого краю, що відходить від ПКА, діаметром 2 мм, без ознак звуження просвіту. Стовбур ЛКА в діаметрі 4 мм, протяжністю 12 мм, розгалужується на ПМШГ і ОГ ЛКА та а. intermedia. На рівні трифуркації визначається пристінкова змішана атеросклеротична бляшка (АСБ), з ознаками стенозу 50-60%.
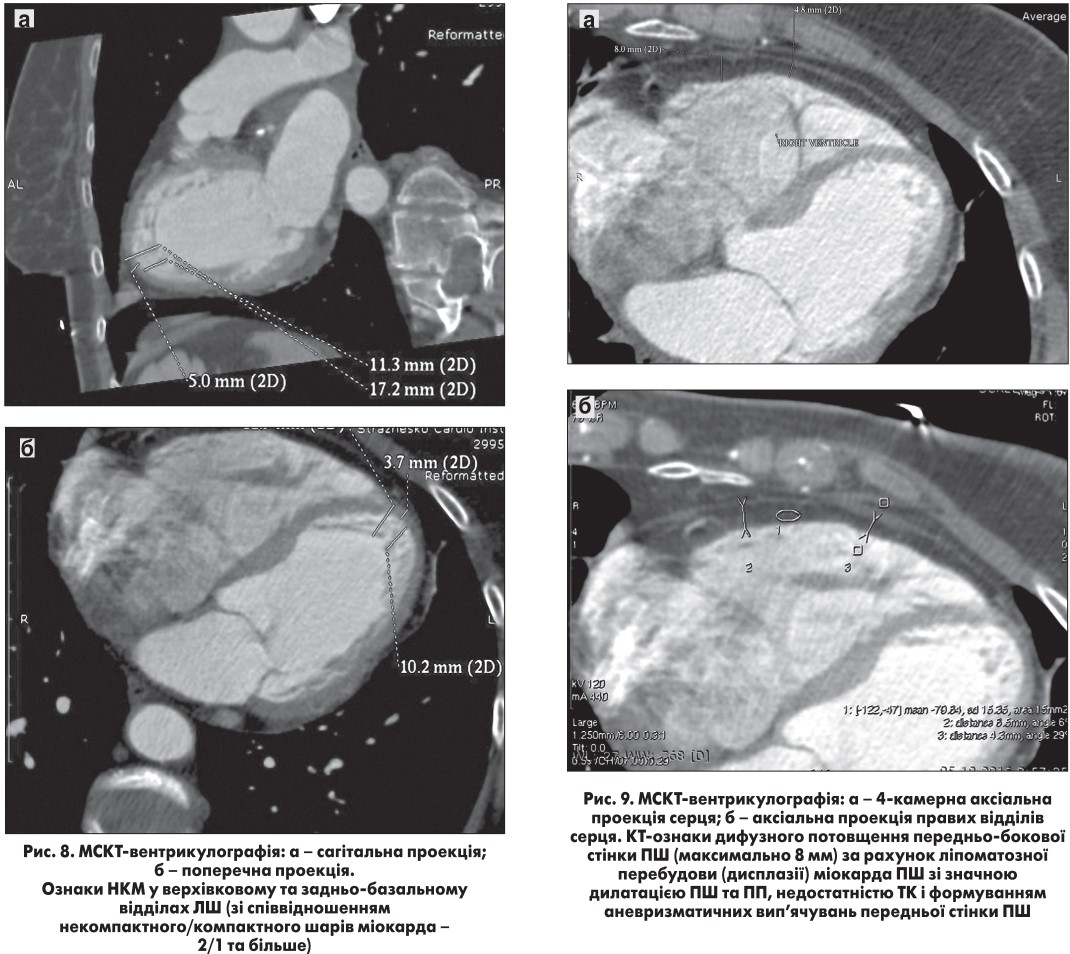
ПМШГ ЛКА контрастується до дистального відділу. У проксимальному та в середньому сегментах ПМШГ ЛКА визначається протяжний кальциноз із ознаками звуження просвіту на 30-60% (рис. 7, а, б).
У проксимальній частині проміжної артерії (a. intermedia) оклюзія за рахунок кальцинованої АСБ. Перша гілка діагональної артерії добре розвинена, діаметром до 3 мм, на рівні протяжних кальцинованих бляшок у проксимальному її відділі стеноз до 40%.
Друга гілка діагональної артерії діаметром 2 мм, без ознак стенозу. ОГ ЛКА без ознак гемодинамічно значущих звужень.
Крайова гілка (тупого краю) добре розвинена, контрастується до дистальних відділів, без ознак звуження просвіту.
Камери серця рівномірно контрастуються. Їхні розміри в діастолу: ПП – 3,9 мм, ПШ не дилатований, максимальний діаметр – 44 мм.
Міокард ЛШ має підвищену трабекулярність, товщина некомпактного шару на рівні верхівки ЛШ – 9-12 мм, на рівні задньої стінки – 5 мм; товщина компактного шару стінок ЛШ: на рівні верхівки ЛШ – 4-5 мм, задня стінка – 7 мм (рис. 8, а, б). При цьому індекс співвідношення некомпактного та компактного шарів міокарда ЛШ становить 2/1 та більше.
Міокард стінки ПШ жирової щільності: -70/-100 одиниць Хаунсфілда. Товщина стінки ПШ – 4-5 мм.
Легеневі артерії рівномірно контрастуються, нормального діаметра (стовбур – 24 мм, права легенева артерія – 19 мм, ліва легенева артерія – 18 мм).
Грудна аорта не розширена, рівномірно контрастується. Діаметр: на рівні кореня – 33 мм, висхідний відділ – 29 мм, нисхідний відділ – 20 мм (рис. 9, а, б).
Висновок: МСКТ-ознаки вираженого коронарокальцинозу (КІ за шкалою Агатстона – 552 од.).
Гемодинамічно значущі стенози: у стовбурі ЛКА – 50-60%, у проксимальному та середньому відділах ПМШГ ЛКА – до 60%.
Оклюзія (a. intermedia).
Ознаки дифузної жирової трансформації міокарда ПШ (за типом ЖД). Ознаки НКМ ЛШ.
 Для остаточної верифікації ЖД ПШ та НКМ ЛШ виконано МРТ серця з в/в посиленням (гадопентетату димеглюмін – 20 мл).
Для остаточної верифікації ЖД ПШ та НКМ ЛШ виконано МРТ серця з в/в посиленням (гадопентетату димеглюмін – 20 мл).
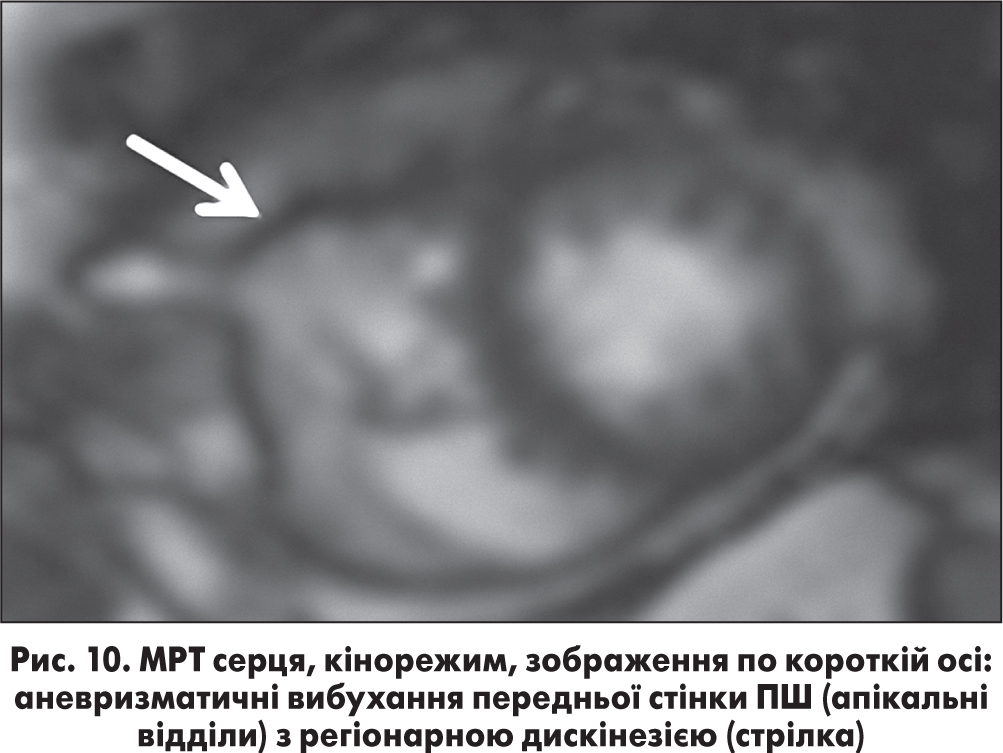
Виявлено розширення середніх і апікальних відділів ПШ із нерівним витонченням і аневризматичним вибуханням передньої стінки на рівні й нижче модератора.
Загальний об’єм порожнини ПШ не збільшений (КДО – 95,5 мл, кінцевий діастолічний індекс – 57 мл/м2), скоротливість знижена (ФВ – 37%).
Виражений шар епікардіальної жирової клітковини на рівні вільної стінки ПШ, до 10 мм, з імовірною інвазією в поверхневий шар міокарда ПШ.
Вогнищеве мезоміокардіальне посилення міокарда ПШ визначається на пізніх післяконтрастних зображеннях серця (рис. 10).
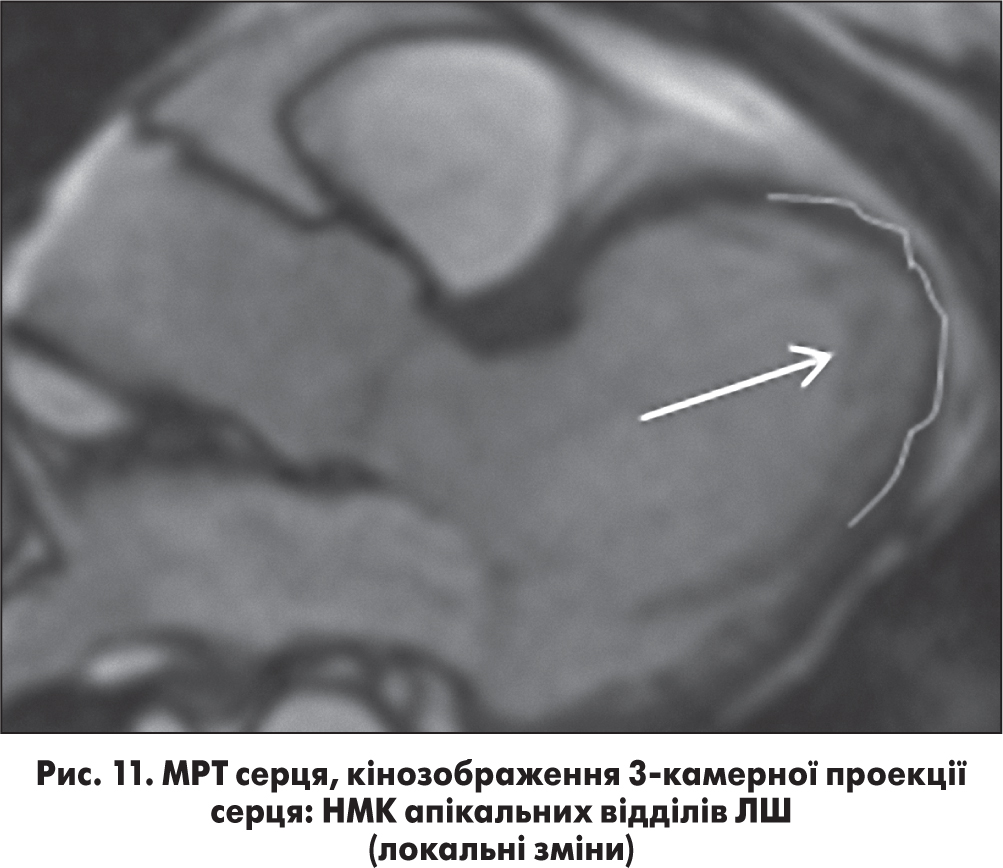 Порожнина ЛШ не розширена, маса міокарда незначно знижена; визначається посилення трабекулярності субендокардіальних відділів; діастолічне співвідношення некомпактного/компактного шарів на рівні верхівки ЛШ до 3,0 (9/3) – НКМ без порушення регіонарної скоротливості (рис. 11).
Порожнина ЛШ не розширена, маса міокарда незначно знижена; визначається посилення трабекулярності субендокардіальних відділів; діастолічне співвідношення некомпактного/компактного шарів на рівні верхівки ЛШ до 3,0 (9/3) – НКМ без порушення регіонарної скоротливості (рис. 11).
Негомогенне підвищення МР-сигналу на Т1-зважених зображеннях від мезоміокардіальних відділів міжшлуночкової перетинки (МШП), найімовірніше, за рахунок інтраміокардіальних жирових включень.
Додаткова хорда від МШП до передньої стінки ЛШ. Парієтальний листок перикарда фіброзований, потовщений.
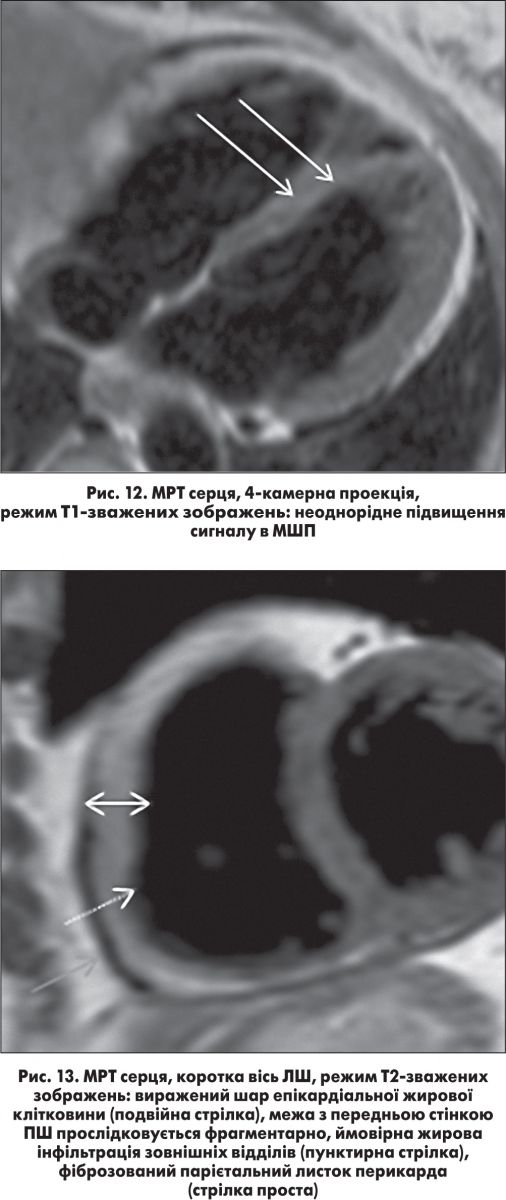 Патологічного випоту в порожнині перикарда не виявлено (рис. 12 і 13).
Патологічного випоту в порожнині перикарда не виявлено (рис. 12 і 13).
Функціональні показники ЛШ: ФВ – 64%; КДО – 100 мл; індекс КДО – 60 мл/м2; ударний об’єм – 36 мл; КСО – 64 мл; індекс КСО – 39 мл/м2; маса міокарда – 74 г. Площа поверхні тіла – 1,66 м2.
Висновок: МРТ-дані свідчать на користь фіброзно-жирової інфільтрації міокарда ПШ із регіонарною дискінезією, зниженням загальної скоротливості ПШ.
Висока ймовірність ЖД ПШ. НКМ ЛШ (локальні зміни). МРТ-ознак постішемічного фіброзу міокарда не виявлено.
Зважаючи на перенесений пацієнткою синкопальний стан і з метою виключення клінічно значущого стенозуючого ураження каротидних артерій, прийнято рішення про проведення триплексного сканування екстракраніальних судин.
Результати проведеного дослідження: виявлені гемодинамічно незначні стенози каротидних артерій.
Локалізація АСБ і стенози (ECST, European Carotid Surgery Trial) у місцях доступної локалізації: задня стінка гирла правої підключичної артерії – стеноз до 20-25% по діаметру; каротидна біфуркація правої зовнішньої сонної артерії (ЗСА) – стеноз до 20-25% по діаметру; гирло правої внутрішньої сонної артерії (ВСА) – стеноз до 20-25% по діаметру; каротидна біфуркація лівої ЗСА – стеноз до 15-20% по діаметру; гирло лівої ВСА – стеноз до 30-35% по діаметру.
Комплекс інтима-медіа ЗСА: справа – 0,6 мм, зліва – 0,6 мм. Не потовщена в стандартних точках вимірювання. Висновок: стенозуючий атеросклероз (гемодинамічно незначущий) екстракраніальних відділів магістральних артерій голови. Ознаки недостатності кровообігу у вертебро-базилярному басейні вертеброгенного генезу.
Зважаючи на те, що кожен з описаних вище патологічних станів може бути причиною порушень серцевого ритму та провідності, а також з огляду на наявність у пацієнтки синкопального епізоду в анамнезі, було проведене добове моніторування ЕКГ за Холтером (ХМ ЕКГ): за період моніторування ЕКГ зареєстрований синусовий нерегулярний ритм, синусова (дихальна) аритмія. Ритм пацієнтки включав 8 год 40 хв синусової брадикардії, середня ЧСС дорівнювала 66 уд/хв, мінімальна – 42 уд/хв, максимальна – 106 уд/хв. Суправентрикулярна (мономорфна, політопна) ектопічна активність складалася з 5 поодиноких скорочень. Шлуночкової екстрасистолії під час моніторування не виявлено. Максимальний інтервал R-R становив 1,7 с. Процент середніх корегованих інтервалів QTc тривалістю >450 мс дорівнював 84.
За період моніторування ЕКГ значних пауз (інтервал R-R >2500 мс), дислокацій сегмента ST ішемічного генезу, порушень синоатріальної, атріовентрикулярної та внутрішньошлуночкової провідності не зареєстровано.
Враховуючи відсутність життєво небезпечних аритмій за даними ХМ ЕКГ, прийнято рішення про проведення місячного моніторингу ЕКГ.
Місячний моніторинг ЕКГ за допомогою системи HEARTRAK SMART: зареєстровано синусовий ритм, не регулярний (синусова аритмія); атріовентрикулярна блокада І ступеня, поодинока суправентрикулярна та шлуночкова екстрасистолія.
МРТ головного мозку: виявлено розширення підпавутинних просторів та окремі вогнища гліозу в паренхімі, що відповідає ознакам хронічної судинно-мозкової недостатності.
На підставі клінічних даних та інструментальних і лабораторних методів дослідження встановлено клінічний діагноз: ІХС – стенокардія напруження ІІ функціонального класу. Стенозуючий атеросклероз коронарних судин (стеноз стовбура КА – 50-60%, ПМШГ – 60%, оклюзія проміжної артерії ЛКА) (за даними МСКТ). Некласифікована кардіоміопатія: НКМ ЛШ. Фіброзно-жирова дисплазія ПШ (за даними МРТ).
Поодинока суправентрикулярна та шлуночкова екстрасистолія. Атріовентрикулярна блокада І ступеня (за даними місячного моніторингу ЕКГ). СН – 0. Гіпердисліпопротеїнемія. Синкопальний епізод (22.09.2016 р.). Церебральний стенозуючий атеросклероз. Дисциркуляторна енцефалопатія ІІ ступеня, атактичний синдром, лівостороння пірамідна недостатність. Синдром когнітивних порушень. Виразкова хвороба дванадцятипалої кишки в стадії ремісії. Початкова катаракта обох очей. Багатовузловий зоб ІІІ ступеня. Стан після видалення лівої долі щитоподібної залози (1994 р.), еутиреоз.
Хворій П. підібрано лікування: варфарин, аторвастатин, триметазидин. Наявність артеріальної гіпотензії (систолічний АТ <100 мм рт. ст.) зробила неможливим призначення нітратів та антагоністів кальцію. У зв’язку зі схильністю до брадикардії не призначалися β-адреноблокатори.
У листопаді 2016 р. хворa продовжувала приймати рекомендоване лікування, її клінічний стан залишався стабільним.
Дискусія
Цей клінічний випадок становить інтерес поєднанням таких рідкісних видів патології міокарда, як НКМ ЛШ і неаритмогенна (виходячи з характеру перебігу захворювання та результатів поточних інструментальних досліджень) ЖД ПШ зі стенозуючим, клінічно значущим коронарним атеросклерозом у пацієнтки похилого віку.
Діагностика цих патологічних станів становить певні труднощі. Відсутність чітких діагностичних критеріїв, генетичних маркерів і неспецифічність клінічної картини є причиною того, що більшість випадків цих захворювань залишаються недіагностованими, виявленими запізно чи віднесеними до іншої серцевої патології. Деякі «здорові носії» не мають практично жодних симптомів захворювання, в тому числі шлуночкових аритмій, синкопальних станів.
ЖД ПШ вважається рідкісним типом кардіоміопатії, що вражає переважно підлітків і молодих людей, тому нерідко спостерігається у спортсменів під час кар’єрного розквіту. До 80% випадків ЖД ПШ виявляються у віці до 40 років, частіше в чоловіків (4 проти 1).
Гістологічні ознаки ЖД ПШ виявляються у третини пацієнтів, які померли раптово у віці до 35 років. Ця хвороба характеризується високим ризиком розвитку раптової серцевої смерті (РСС). Аритмогенну дисплазію вважають причиною РСС у 26% дітей і молодих осіб у віці до 20 років. За результатами аутопсій раптово померлих молодих спортсменів у кожного четвертого з них була діагностована ЖД ПШ. За різними даними, поширеність ЖД ПШ становить від 1 випадку на 1 тис. до 1 випадку на 5 тис. населення. В інших джерелах поширеність ЖД ПШ варіює від 6 на 10 тис. до 44 на 10 тис. населення.
Таке нездужання виникає, коли м’язова тканина в ПШ гине й заміщується рубцевою тканиною. Цей процес є потенційно аритмогенним.
У 1982 р. F.I. Marcus запропонував терміни «аритмогенна правошлуночкова кардіоміопатія» чи «аритмогенна хвороба ПШ». Симптоми можуть проявлятися відчуттям серцебиття, перебоїв у роботі серця, а також синкопальними епізодами.
Етіопатогенез ЖД ПШ досі залишається не остаточно з’ясованим. Розглядають чотири основні патогенетичні механізми: апоптоз; запалення; дистрофія міокарда; генетично зумовлені аномальні міжклітинні «прилипання» білків і втрата проміжного з’єднання. Кінцевим результатом зазначених процесів є заміщення міокарда ПШ, а потім і ЛШ жировою та/або фіброзною тканиною, яка є субстратом для шлуночкових аритмій.
Про можливий сімейний характер ЖД ПШ повідомили F.I. Marcus і співавт. Відомі такі два типи успадкування: аутосомно-домінантний і аутосомно-рецесивний (останній трапляється рідко). Проте більшість пацієнтів не мають сімейного анамнезу чи факторів ризику РСС у найближчих родичів. Подібна ситуація склалася й у родині нашої пацієнтки П. – у її сина патології не виявлено.
Отже, постає запитання: чи сам феномен жирової інфільтрації є самостійним морфологічним маркером ЖД ПШ? Деякі автори вважають, що цей феномен належить до нормальних знахідок у цілої низки хворих, особливо старших вікових груп.
Зокрема, згідно з даними D.K. Tansey (2005) при дослідженні сердець пацієнтів, раптово померлих від некардіальних причин, 85% мали невеликі зони інтраміокардіального жиру при відсутності фіброзу та запалення. З віком і в жінок ця тенденція була більш вираженою.
Масивна жирова інфільтрація ПШ без будь-яких ознак фіброзу й дегенерації міоцитів розглядається як сумнівна причина РСС і, як правило, не має сімейного анамнезу. В цих випадках міоцити є зміщеними, але не заміщеними, й не мають структурних аномалій, на відміну від ЖД ПШ, коли маємо дегенеративні зміни кардіоміоцитів і ядер.
Тому є зрозумілою необхідність використання діагностичних методик, які можуть відображати не тільки жирові нашарування, а й наявність сполучної тканини. До них належить МРТ із контрастуванням гадолінієм.
Іноді захворювання протікає безсимптомно й виявляється тільки з допомогою ЕКГ. Непритомність або пресинкопальні стани можуть виникати через короткочасну чи стійку шлуночкову тахікардію. Причиною РСС є шлуночкова тахікардія, що переходить у фібриляцію шлуночків. РСС при ЖД ПШ у близько 3-10% випадків виникає в осіб віком до 65 років. Вона може стати першим і єдиним проявом цієї недуги.
До основних методів діагностики ЖД ПШ належать ЕхоКГ, морфологічне дослідження та біопсія з подальшим дослідженням ендоміокардіальних біоптатів, МРТ серця з контрастуванням. При морфологічному дослідженні ПШ часто має плямистий вигляд: змінені ділянки можуть бути захоплені здоровим міокардом. Міокард ПШ у подальшому заміщується жировою й фіброзною тканинами. На ранніх стадіях захворювання стінки правих відділів серця потовщуються, але в подальшому внаслідок нагромадження жирової тканини можуть з’являтися ділянки дилатації, стінки серця стають більш тонкими. Жирове переродження міокарда поширюється частіше від епікардіальних шарів до ендокарда. Міокард ушкоджується переважно в ділянці вивідного тракту, верхівки й субтрикуспідальної зони, котрі розглядаються як «трикутник дисплазії». У міру прогресування фібро-жирова дистрофія здатна ушкоджувати також ліві відділи серця (передсердя та шлуночок).
Дослідження ендоміокардіальних біоптатів демонструє жирову інфільтрацію, порушення безперервності міокардіального синтицію, дилатацію цистерн саркоплазматичного ретикулуму, внутрішньоклітинні жирові вкраплення й аномалії вставних дисків – зниження кількості десмосом і збільшення їх довжини, зміни забарвлення десмосом, зміни та зменшення контактів або ж їх розширення.
Біопсія є високочутливим методом діагностики ЖД ПШ. Чутливість цієї методики становить 67%, специфічність – 92%. Основним недоліком цього методу дослідження є обмеження його доступності. Критерієм діагностики ЖД ПШ є наявність ділянки фіброзної та жирової тканини в біоптаті (частка жирової тканини становить >3%, фіброзної – 40%).
Дослідження з оцінювання ролі МРТ у пацієнтів із підтвердженою ЖД ПШ за даними біопсії показали, що ця методика здатна замінити ангіографію й навіть біопсію в діагностиці цієї патології. Отже, МРТ серця є найоптимальнішим методом верифікації ЖД ПШ. Цьому методу притаманна висока точність, і він дає змогу кількісно оцінити параметри й розміри ПШ. Відомо, що МРТ із в/в контрастуванням гадолінієм дає змогу виявити фіброзні зміни в міокарді ПШ. До МРТ-ознак ЖД ПШ зараховують: витончення й дилатацію стінок ПШ, локальні вип’ячування й дискінезію нижньо-базальної стінки, виражену трабекулярну дезорганізацію та виражений модераторний тяж, дилатацію вивідного тракту ПШ, дискінезію верхівки.
ЖД ПШ у вигляді інтраміокардіального відкладання жиру вперше описали за даними МРТ Casolo і співавт. (1987). Згідно із сучасними поглядами до морфологічних ознак ЖД ПШ належать інтракардіальні відкладення жирової тканини, фокальні витончення стінки (<2 мм), гіпертрофія ПШ (потовщення його стінок >8 мм), порушення орієнтації та характеру трабекул (у тому числі гігантські Y-подібні трабекули, мають вигляд глибоких щілин при проведенні ангіографії), розширення вивідного тракту ПШ.
Виділяють такі форми клінічного перебігу ЖД ПШ:
– безсимптомна форма, при якій першим та єдиним проявом хвороби є РСС унаслідок фібриляції шлуночків;
– аритмічна форма, що характеризується наявністю документованих шлуночкових порушень ритму серця (шлуночкової екстрасистолії та шлуночкової тахікардії з конфігурацією комплексу QRS за типом блокади лівої ніжки пучка Гіса);
– симптоматична форма – властиві такі симптоми, як напади сердцебиття, біль у ділянці серця;
– форма, що дає симптоми серцевої недостатності (СН), переважно правошлуночкової, з наявністю чи відсутністю порушень серцевого ритму.
Незважаючи на те що у вивченні ЖД ПШ досягнуті певні результати, наявність «білих плям» в етіології цього захворювання свідчить про необхідність проведення подальших досліджень.
Дані про ЖД ПШ обмежені через відсутність великих популяційних досліджень, які могли б оцінити відповідні анатомічні характеристики правих відділів серця в нормі.
Діагностика ЖД ПШ здійснюється за діагностичними критеріями, розробленими робочою групою із захворювань міокарда та перикарда Європейського товариства кардіологів. Ці критерії визначають клінічний спектр захворювання й поділені на 6 груп, із великими та малими діагностичними критеріями залежно від їх специфічності.
Діагностичні критерії ЖД ПШ:
1. Глобальна чи регіональна дисфункція та структурні порушення:
а) великі критерії ЖД ПШ: виражена дилатація та зниження систолічної функції ПШ при відсутності змін ЛШ (або при незначному їх характері); локалізовані аневризми ПШ (зони а- чи дискінезу з діастолічним вип’ячуванням); виражена сегментарна дилатація ПШ;
б) малі критерії: помірна дилатація ПШ або зниження ФВ ПШ із нормальною функцією ЛШ; помірна сегментарна дилатація ПШ; сегментарний гіпокінез ПШ.
2. Особливості будови тканини стінок шлуночків серця:
а) великий критерій: заміщення міокарда жировою й фіброзною тканиною (за даними ендоміокардіальної біопсії).
3. Аномалії реполяризації:
а) малий критерій: інверсія хвилі Т у правих прекардіальних відведеннях (V2-V3) в осіб старше 12 років за відсутності блокади правої ніжки пучка Гіса.
4. Аномалії деполяризації / порушення проведення:
а) великий критерій: епсилон-хвилі чи поширення комплексу QRS у відведеннях V2-V3 (>110 мс);
б) малий критерій: наявність пізніх потенціалів на ЕКГ високого розрішення.
5. Порушення ритму серця:
а) малий критерій: стійка чи нестійка шлуночкова тахікардія з морфологією блокади лівої ніжки пучка Гіса (документована за допомогою рутинної ЕКГ, ХМ ЕКГ або при навантажувальній пробі); часта шлуночкова екстрасистолія (>1000 за 24 год згідно з даними ХМ ЕКГ).
6. Сімейний анамнез:
а) великий критерій: сімейний характер захворювання підтверджений даними аутопсії чи під час хірургічного втручання;
б) малі критерії: сімейний анамнез ускладнений випадками РСС (у віці до 35 років), імовірно, зумовлений ЖД ПШ; діагностовано випадки ЖД ПШ (відповідно мають критерії) в сім’ї.
Діагноз ЖД ПШ можна встановити за наявності 2 великих ознак, або 1 великої ознаки та 2 малих ознак, або за наявності 4 малих критеріїв.
У нашої пацієнтки ми виявили такі критерії ЖД ПШ:
а) великі критерії: знижена систолічна функція ПШ; локалізовані аневризми ПШ;
б) малі критерії: інверсія зубця Т у відповідних відведеннях, поодинокі шлуночкові та суправентрикулярні екстрасистоли.
НКМ ЛШ, згідно з Міжнародною класифікацією хвороб 10-го перегляду (МКХ‑10) та рекомендаціями Асоціації кардіологів України (2016), належить до розділу некласифікованих кардіоміопатій (І42.8) і є генетично гетерогенним захворюванням. НКМ – рідкісна природжена кардіоміопатія, що характеризується порушенням ендоміокардіального морфогенезу, гіпертрофією міокарда, наявністю вираженої його трабекулярності та глибоких інтертрабекулярних ніш. Перша публікація про НКМ датована 1986 р.
Справжня поширеність НКМ ЛШ невідома. Згідно з результатами найбільшого ретроспективного епідеміологічного дослідження серед дорослої популяції населення поширеність НКМ ЛШ становила 0,014%. На думку інших авторів, зазначені показники істотно занижені й поширеність НКМ ЛШ варіює від 0,05 до 0,24%, оскільки більшість пацієнтів не доживає до дорослого віку. Епідеміологічне дослідження, проведене серед австралійських дітей упродовж 10 років, показало, що поширеність НКМ ЛШ становила 9,2% і посідала третє місце у структурі кардіоміопатій після гіпертрофічної та дилатаційної. Сімейні форми захворювання в дитячій популяції спостерігаються в 40-50% випадків і у 18% серед дорослих. Серед чоловіків захворювання трапляється значно частіше.
Відомі такі генетично успадковувані варіанти НМК:
- НКМ ЛШ, сімейний, ізольований, аутосомно-домінантний першого типу (ген, картований на хромосомі 18q12.1-q12.2);
- НКМ ЛШ – захворювання зумовлено мутацією α-дистробревіну, сімейний, ізольований, аутосомно-домінантний другого типу (ген, картований на хромосомі 11р15);
- НКМ ЛШ, сімейний, ізольований, Х-зчеплений (ген, картований на хромосомі Хq28), захворювання зумовлено мутацією TAZ gene (тафазин), впливає на метаболізм кардіоліпіну.
НКМ ЛШ не має специфічної гістологічної картини. Більшість патоморфологів відзначають підвищений фіброз трабекулярних структур. При гістологічному дослідженні серцевого м’яза пацієнтів із НКМ у товщі ендокардіального шару й трабекул визначають фокальні ділянки ішемічного некрозу, відсутні в епікардіальному шарі. Характерні ділянки інтерстиціального фіброзу різного ступеня вираженості. Обговорюються можливі механізми виникнення порушень ритму та прогресуючої недостатності ЛШ, характерної для НКМ ЛШ.
Міжтрабекулярні кармани отримують кров прямо з порожнини ЛШ, але епікардіальний та ендокардіальний шари міокарда та трабекули залежать від коронарного кровопостачання. Поступово развиваються мікроциркуляторні порушення в численних трабекулах, які призводять до невідповідності маси міокарда та кількості потрібних їм капілярів. Окрім того, потовщений міокард може зробити додаткову компресію інтрамурального коронарного русла. У підсумку ці два процеси зумовлюють зменшення субендокардіальної перфузії, незважаючи на відсутність обструкції вінцевих артерій. Зниження коронарного резерву реєструється в пацієнтів із НКМ ЛШ при позитронно-емісійній томографії серця. Прогресуюча ішемія та фіброз можуть призвести до зниження систолічної функції й підготувати субстрат для виникнення порушень ритму. Виражена трабекулярність спричиняє виникнення діастолічної дисфункції. Рестриктивні зміни реєструються у третини дорослих пацієнтів із НКМ ЛШ. Тромбоемболії виникають унаслідок застою крові в міжтрабекулярних карманах.
Частота їх виникнення доволі висока й становить 24%. Першою маніфестацією хвороби можуть бути цереброваскулярні ускладнення (в тому числі транзиторні ішемічні атаки), мезентеріальні інфаркти чи тромбоемболії гілок легеневої артерії.
Сучасні інструментальні методи діагностики НКМ ЛШ – ЕхоКГ, МСКТ та МРТ із контрастуванням. Ці методики є золотим стандартом виявлення НКМ ЛШ. ЕхоКГ – найважливіший метод діагностики НКМ ЛШ. У 2001 р. були запропоновані ЕхоКГ-критерії НКМ ЛШ, що ґрунтувалися на кінцево-систолічному співвідношенні некомпактного та компактного шарів ЛШ. Це співвідношення становить 2,0 при НКМ, 1,1 – при гіпертрофії міокарда гіпертензивної етіології та 0,8 – при дилатаційній кардіоміопатії. Зміни міокарда більше виражені в середній частині (нижні й бокові сегменти) та на верхівці ЛШ. При доплерографії однією з ознак є прямий тік крові з порожнини ЛШ у глибокі інтратрабекулярні ніші.
Сучасним альтернативним методом діагностики НКМ ЛШ є МРТ із контрастуванням гадолінієм.
МРТ-критерії НКМ:
- співвідношення НКМ і компактного міокарда наприкінці діастоли >2,3;
- маса трабекулярної частини становить >20% від загальної маси міокарда ЛШ (чутливість – 93,7%, специфічність – 93,7%);
- виявлення фіброзу трабекулярної частини міокарда при проведенні МРТ-дослідження з гадолінієм.
Найчастішими клінічними проявами НКМ ЛШ у дорослих пацієнтів є СН (61-70%), шлуночкові порушення ритму (20-41%) та атріовентрикулярні блокади (26-56%). Такі хворі можуть потребувати трансплантації серця в 41% випадків.
Серед порушень ритму в пацієнтів із НКМ ЛШ найхарактернішими є такі: шлуночкові, суправетрикулярні екстрасистоли (поодинокі й групові) та порушення провідності. Подібні порушення ритму виявлені й у нашої пацієнтки П.
Наявність НКМ ЛШ пов’язана з високою смертністю, при цьому ознаки СН іноді виникають уже в ранньому віці. Проте можуть виявлятися й безсимптомні випадки, що діагностуються за допомогою ЕхоКГ. За даними літератури, НКМ ЛШ рідко діагностують при першому ЕхоКГ-дослідженні.
Основні напрями лікування НКМ ЛШ та ЖД ПШ: вплив на перебіг СН; запобігання системній тромбоемболії; терапія порушень ритму серця та РСС, у тому числі імплантація кардіовертера-дефібрилятора (ІКД); трансплантація серця при несприятливому перебігу захворювання та відсутності позитивних результатів консервативної терапії.
Лікування СН здійснюється за відповідними рекомендаціями.
Усім пацієнтам зі встановленим діагнозом НКМ ЛШ показана антикоагулянтна терапія, оскільки наявність патологічної трабекулярності й глибоких міжтрабекулярних просторів сприяє внутрішньошлуночковому тромбоутворенню.
Основними сучасними методами профілактики РСС є: ІКД, а також (за показаннями) проведення постійної медикаментозної антиаритмічної терапії та виконання радіочастотної абляції (РЧА) з метою усунення шлуночкових порушень ритму. Слід обережно проводити ІКД та застосовувати лікарські препарати при ліпоматозній інфільтрації ПШ ≥6 мм без дисфункції ПШ (локальної чи поширеної).
Питання про можливість РЧА вогнищ шлуночкових аритмій при НКМ ЛШ наразі не вирішене. У літературі нами знайдено три повідомлення про випадки РЧА в пацієнтів із цією кардіоміопатією. У двох із трьох випадків РЧА була виконана епікардіальним доступом. За іншими даними, абляція проводиться тільки при ангіографічному підтверженні фокальної дисплазії.
Пацієнтам групи високого ризику показано активне динамічне спостереження в кардіолога не рідше двох разів на рік, більш агресивні підходи до лікування (в тому числі з ІКД) та, якщо можливо, раннє зарахування до листа очікування для трансплантації серця.
У пацієнтів із порушеннями ритму серця, котрі можуть бути причиною РСС та емболічних ускладнень, необхідно щорічне проведення ХМ ЕКГ, призначення антиаритмічної терапії.
Отже, незважаючи на те що НКМ ЛШ і ЖД ПШ є рідкісними й недостатньо вивченими вродженими кардіоміопатіями, кардіологи мають пам’ятати про них. Це дасть змогу своєчасно запідозрити цю патологію, враховуючи, що симптоми НКМ ЛШ і ЖД ПШ неспецифічні та іноді проявляються тільки з віком. Наразі єдиним золотим стандартом у первинній діагностиці НКМ ЛШ і ЖД ПШ є ЕхоКГ, діагностичні критерії якої допомогають встановити діагноз, а за потреби – уточнити його за допомогою КТ або МРТ із контрастуванням і призначити адекватне лікування. При прогресуючій, рефрактерній до лікування СН пацієнтам із НКМ ЛШ доцільно рекомендувати трансплантацію серця.
Список літератури знаходиться в редакції.
Стаття надрукована в журналі «Серцева недостатність та коморбідні стани», № 1, 2018.