16 січня, 2018
Препараты растительного происхождения в лечении остеоартроза: что о них известно?
По материалам VII Национального конгресса ревматологов Украины (18-20 октября, г. Киев)
До начала эры синтетической фармакологии для лечения заболеваний скелетно-мышечной системы использовали лекарственные растения. Препараты растительного происхождения в виде экстрактов, настоек для приема внутрь, а также кремов и гелей сохраняют актуальность и на сегодняшний день.
 Заведующий кафедрой внутренней медицины № 3 Национального медицинского университета им. А.А. Богомольца (г. Киев), доктор медицинских наук, профессор Олег Борисович Яременко обобщил доказательную базу и клинические перспективы растительных препаратов, которые применяются для лечения остеоартроза (ОА).
Заведующий кафедрой внутренней медицины № 3 Национального медицинского университета им. А.А. Богомольца (г. Киев), доктор медицинских наук, профессор Олег Борисович Яременко обобщил доказательную базу и клинические перспективы растительных препаратов, которые применяются для лечения остеоартроза (ОА).
Систематические обзоры и метаанализы Кокрановской библиотеки (Cochrane Library) давно стали общепризнанным золотым стандартом доказательной медицины, беспристрастным «чистилищем фактов» высшей инстанции. В 2013 и 2014 гг. были опубликованы два таких обзора, призванных оценить пользу или вред растительных препаратов при лечении ОА. Анализировались данные рандомизированных контролируемых исследований (РКИ) с группами плацебо или активным контролем, параллельным и перекрестным дизайном, в которых изучались эффекты растительных препаратов у пациентов с диагнозом ОА в соответствии с критериями
Американской коллегии ревматологов (ACR) или эквивалентными критериями Европейской противоревматической лиги.
Первый обзор посвящен растительным средствам для местного применения (Cochrane Database Syst. Rev. 2013 May 31; (5): CD010538). Авторами обсуждаются их преимущества при симптоматическом лечении суставной и мышечной боли:
• относительная простота и безопасность применения;
• слабо выраженное системное действие и, как следствие, значительно меньшая выраженность побочных эффектов, в первую очередь со стороны желудочно-кишечного тракта;
• обеспечение высокой концентрации действующих веществ в месте нанесения препарата;
• возможность сочетания в одном препарате нескольких веществ, различных по механизму и направленности лечебного воздействия;
• возможность пролонгированного действия.
В обзоре проанализированы результаты исследований масла семян льна, ментола, капсаицина, арники и окопника (живокост). По результатам анализа проведенных исследований, единственным растительным топическим средством, которое рекомендовано авторами кокрановского обзора, является гель арники, который уменьшает боль и действует так же эффективно, как гель, содержащий нестероидные противовоспалительные средства (НПВС). Гель с окопником уменьшает боль эффективнее, чем плацебо. Однако эффективность окопника в отношении функции суставов и качества жизни не доказаны. Гель на основе стручкового перца (капсаицина) уменьшает боль и улучшает функцию сопоставимо с плацебо. «Для составления клинических рекомендаций относительно использования других актуальных лекарственных растений для лечения ОА доказательств недостаточно», – заключили авторы обзора.
Отдельно в обзоре рассмотрены вопросы безопасности топических растительных средств. Распространенное мнение, что растительные продукты более безопасны, чем другие методы лечения ОА, является ошибочным. По данным Европейского научного общества фитотерапии (ESCOP), аллергические реакции могут возникать при применении любых топических лекарственных растительных продуктов. Использование препаратов, содержащих капсаицин, ограничено до нескольких недель из-за возможной нейротоксичности и канцерогенности (ESCOP, 2009). В исследованиях арники in vitro возникали проблемы цитотоксичности (Woerdenbag, 1994), в связи с чем окопник и арника рекомендуются только для наружного применения и только на неповрежденной коже (ESCOP, 2003, 2009).
Алкалоиды окопника являются гепатотоксичными и канцерогенными (Li, 2011), поэтому содержание токсичного алкалоида в суточной дозе окопника было ограничено до 100 мкг (Blumenthal, 1998).
Данные кокрановского обзора по использованию пероральных растительных лекарственных средств в лечении ОА (Cochrane Database Syst. Rev. 2014 May 22; (5): CD002947) представляют большой интерес в связи с разнообразием представленных на рынке препаратов. Хотя их механизмы действия не до конца понятны, влияние на провоспалительные медиаторы обосновывает использование некоторых из этих лекарственных средств в лечении ОА. Предполагается, что только пероральный прием препаратов оказывает какое-либо влияние на структуру суставов.
Boswellia serrata (индийский ладан). В обзор включено 5 исследований трех различных экстрактов из B. serrata. Высококачественные данные из двух исследований (85 участников) показали, что 90-дневное лечение 100 мг экстракта улучшило симптомы ОА: уменьшилась боль в суставах, улучшились их подвижность и функция.
Curcuma domestica (желтый имбирь, один из основных компонентов карри). В рандомизированное исследование с параллельными группами включили 107 пациентов. В течение 6 нед C. domestica продемонстрировала сравнимую эффективность с ибупрофеном в отношении боли и связанных с болью функциональных нарушений.
Derris scandens. В сравнительном исследовании спиртовой экстракт из ствола D. scandens сравнивали с напроксеном в 2 группах пациентов с ОА коленных суставов. По эффективности облегчения боли и улучшения функции суставов D. scandens существенно не отличался от напроксена.
Garcinia kola в плацебо-контролируемом исследовании с участием 143 пациентов с ОА коленного сустава сравнивали в течение 6 нед с напроксеном и целекоксибом. Все препараты обеспечивали сопоставимое улучшение функции и уменьшение боли по сравнению с плацебо.2
Harpagophytum procumbens (чертов коготь, мартиния душистая). В сравнительном исследовании длительностью 4 мес у пациентов с ОА коленного сустава доза 2610 мг порошка H. procumbens существенно не отличалась по противоболевому эффекту от 100 мг диацереина. В этом же исследовании участники группы H. procumbens использовали меньше НПВС (диклофенака) и аналгетиков (ацетаминофена с кофеином), чем участники группы диацереина.
Как отмечают в выводах авторы обзора: «Мы не уверены, улучшают ли другие растительные препараты боль или функцию ОА, замедляют ли прогрессирование повреждения суставов, поскольку имеющиеся данные ограничены только одним исследованием или исследованиями, предоставляющими результаты, которые нельзя объединить. Некоторые из этих исследований имеют низкое и очень низкое качество, а некоторые важные критерии оценки результатов (например, качество жизни, ширина суставной щели) были опущены».
Несмотря на большое количество проведенных клинических испытаний, достаточно убедительные данные были получены только в отношении комплекса неомыляемых соединений авокадо и сои, известного как препарат Пиаскледин 300. Компоненты Пиаскледина обладают рядом симптоматических и болезнь-модифицирующих эффектов при ОА: повышают экспрессию тканевых факторов роста ТФР-β1 и ТФР-β2 в синовиальной жидкости суставов (L. Altinel et al., 2007), стимулируют синтез протеогликанов и коллагеновых волокон хряща, ингибируют провоспалительные интерлейкины IL‑6, IL‑8, простагландина Е и металлопротеиназы, ответственные за дегенерацию суставов (Y. Henrotin et al., 1998, 2003).
Метаанализ четырех РКИ по оценке симптоматической эффективности Пиаскледина 300 при ОА (421 пациент, длительность исследований – от 3 до 24 мес) подтвердил достоверное облегчение боли и уменьшение индекса Лекена со средними размерами эффекта 0,38 и 0,45 соответственно (R. Christensen et al., 2008).
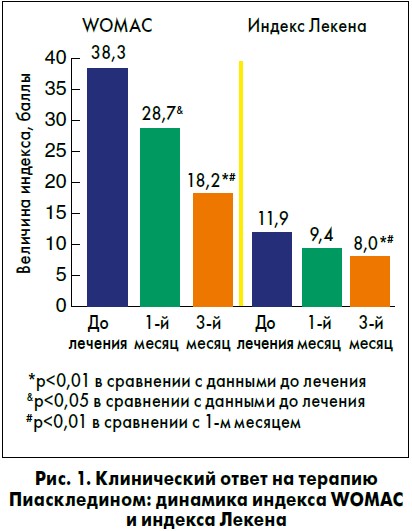
Профессор О.Б. Яременко представил результаты проведенного под его руководством исследования эффектов Пиаскледина у пациентов с ОА коленных суставов. В результате трехмесячного курса терапии наблюдалось достоверное клиническое улучшение по индексам тяжести артрита (рис. 1).
Кроме того, на фоне лечения Пиаскледином 300 отмечалась тенденция к уменьшению толщины синовиальной оболочки и количества синовиальной жидкости по данным ультразвукового исследования коленных суставов. Важным свидетельством болезнь-модифицирующего потенциала препарата стало снижение концентрации маркера деградации хряща uСTX-II – на 80,8% через 1 мес (р<0,001) и на 51% через 3 мес лечения (р<0,05) по сравнению с исходными значениями. При этом толщина суставного хряща через 3 мес достоверно увеличилась во всех компартментах коленных суставов (медиальный, центральный и латеральный). Вряд ли увеличение толщины хряща по данным ультразвукового исследования можно трактовать как следствие его регенерации, произошедшее за сравнительно короткий период лечения, хотя принципиальная возможность заживления эрозий и ямочных дефектов, увеличения толщины хряща продемонстрирована в исследованиях с использованием макроскопической, гистологической и гистоморфометрической техники, количественной МРТ для других медленно действующих препаратов для лечения ОА (J-P. Pelletier et al., 2013; J. Martel-Pelletier et al., 2015). Скорее всего в данном случае речь может идти о «набухании» – увеличении гидрофильности хряща вследствие улучшения его физико-химических характеристик, происходящих в результате ингибирования воспалительно-деструктивных и стимуляции репаративных процессов.
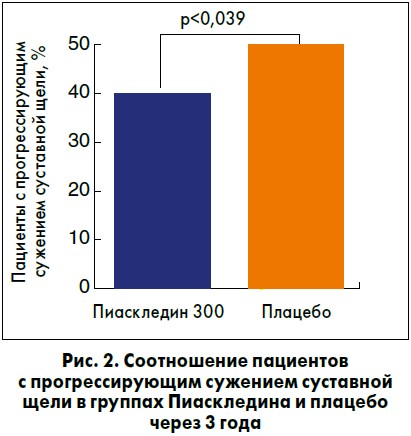
Структурно-модифицирующее действие Пиаскледина изучалось в рандомизированном двойном слепом плацебо-контролируемом исследовании ERADIAS. В него включили 399 пациентов с ОА тазобедренного сустава (не менее 4 лет согласно критериям ACR), умеренным и выраженным болевым синдромом (>40 мм по визуальной аналоговой шкале более 1 года), несмотря на прием НПВС или аналгетиков. Согласно результатам трехлетнего наблюдения в группе Пиаскледина по сравнению с группой плацебо было на 20% меньше пациентов с прогрессирующим сужением суставной щели (рис. 2).
Таким образом, преимуществами терапии Пиаскледином являются:
– доказательная база уровня 1А;
– сочетание симптоматического и структурно-модифицирующего действия;
– позволяет снизить дозу НПВС (T. Appelboom et al., 2001);
– высокая безопасность и отличная переносимость (R. Christensen, 2014; E. Maheu et al., 2014);
– удобный режим лечения – 1 капсула в сутки.
По результатам анализа доказательной базы можно сделать следующие выводы относительно роли растительных средств терапии ОА:
– согласно результатам кокрановского обзора (2013) единственным растительным топическим средством, рекомендованным для лечения ОА, является гель арники, который уменьшает боль и действует так же эффективно, как гели НПВС;
– для рекомендаций относительно использования других топических лекарственных средств растительного происхождения доказательств недостаточно;
– согласно результатам кокрановского обзора (2014) несколько пероральных препаратов растительного происхождения могут оказывать при ОА симптоматический эффект, сравнимый с НПВС (Boswellia serrata, Curcuma domestica, Derris scandens, Garcinia kola) или диацереином (Harpagophytum procumbens);
– наиболее убедительные данные в отношении механизмов действия, симптоматических эффектов (снижение индексов WOMAC и Лекена) и структурно-модифицирующего потенциала (замедление рентгенологического прогрессирования, снижение концентрации uСTX-II) получены для комплекса неомыляемых соединений авокадо и сои (Пиаскледин 300).
Подготовил Дмитрий Молчанов
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (55) грудень 2017 р.