26 березня, 2018
Сучасний алгоритм діагностики і тактика лікування неалкогольної жирової хвороби печінки
 Неалкогольна жирова хвороба печінки (НАЖХП) патогенетично пов’язана з інсулінорезистентністю (ІР) не тільки в печінці, а й у м’язах і жировій тканині, а також із метаболічним синдромом (МС). Наявність МС встановлюється за сукупністю будь-яких трьох із п’яти перелічених нижче ознак: підвищення рівня глюкози натще або цукровий діабет (ЦД) 2 типу, гіпертригліцеридемія, зниження рівня холестерину ліпопротеїдів високої щільності – ЛПВЩ (залежно від віку), збільшення окружності талії (залежно від етнічної належності) та підвищення артеріального тиску. Оскільки усі компоненти МС корелюють із вмістом жиру в печінці незалежно від індексу маси тіла (ІМТ), при виявленні МС у конкретного пацієнта необхідно оцінити ризик наявності в нього НАЖХП, і, навпаки, діагностування НАЖХП потребує оцінки всіх компонентів МС.
Неалкогольна жирова хвороба печінки (НАЖХП) патогенетично пов’язана з інсулінорезистентністю (ІР) не тільки в печінці, а й у м’язах і жировій тканині, а також із метаболічним синдромом (МС). Наявність МС встановлюється за сукупністю будь-яких трьох із п’яти перелічених нижче ознак: підвищення рівня глюкози натще або цукровий діабет (ЦД) 2 типу, гіпертригліцеридемія, зниження рівня холестерину ліпопротеїдів високої щільності – ЛПВЩ (залежно від віку), збільшення окружності талії (залежно від етнічної належності) та підвищення артеріального тиску. Оскільки усі компоненти МС корелюють із вмістом жиру в печінці незалежно від індексу маси тіла (ІМТ), при виявленні МС у конкретного пацієнта необхідно оцінити ризик наявності в нього НАЖХП, і, навпаки, діагностування НАЖХП потребує оцінки всіх компонентів МС.
Накопичення тригліцеридів у печінці супроводжується порушенням енергетичного обміну та патологічними змінами інсулін-опосередкованої супресії продукції глюкози та ліпопротеїдів низької щільності (ЛПНЩ), що призводить до розвитку гіперглікемії, гіпертригліцеридемії та гіперінсулінемії. В осіб без ЦД індекс інсулінорезистентності – HOMA-IR (розраховується за формулою: HOMA-IR = рівень глюкози крові натще (ммоль/л) х рівень інсуліну натще (мкОД/мл) / 22,5) – може бути сурогатним маркером ІР. HOMA-IR є прийнятною альтернативою більш затратному і більш тривалому динамічному тесту. Прогресування ураження печінки корелює з метаболічними порушеннями, які спостерігаються протягом значного проміжку часу або наростають, у тому числі зі зміною показника HOMA-IR.
Однак цінність цього показника залежить від здатності організму адаптовувати секрецію інсуліну при ІР, що ставить під сумнів можливість його застосування при клінічно вираженому діабеті. Більш того, методи дослідження рівня інсуліну дуже відрізняються один від одного, і єдина думка щодо порогового значення ІР на підставі HOMA-IR відсутня. HOMA-IR – сурогатний маркер ІР в осіб без ЦД, і його можна рекомендувати для застосування за умови наявності чітко визначених референтних значень. HOMA-IR має обмежене значення для діагностики НАЖХП у пацієнтів із метаболічними факторами ризику. Цей показник дає змогу підтвердити порушення ІР, що свідчить про наявність ІР-асоційованої НАЖХП у діагностично неясних випадках (наприклад, якщо під час УЗД виявлено стеатоз в особи з нормальною масою тіла).
У ході спостереження в окремих випадках HOMA-IR можна використовувати для виявлення пацієнтів із ризиком розвитку неалкогольного стеатогепатиту (НАСГ) або прогресування фіброзу. Зменшення індексу HOMA-IR на тлі зниження маси тіла може вказувати на поліпшення метаболізму, що має сприятливий ефект при НАЖХП.
Ожиріння. ІМТ і окружність талії, індекс вісцерального ожиріння асоціюються з розвитком та прогресуванням НАЖХП. У значної частки пацієнтів із криптогенним цирозом печінки відзначається збільшення кількості метаболічних факторів ризику, на підставі чого можна припустити, що більшість випадків захворювання є наслідком НАСГ. Стани, які найчастіше супроводжують ожиріння, такі як ЦД 2 типу, апное уві сні, синдром полікістозу яєчників та інші ендокринні розлади (гіпогонадизм), сприяють підвищенню частоти виникнення і тяжкості НАЖХП. Слід зазначити, що у пацієнтів із ІМТ <30 кг/м2 (або навіть <25 кг/м2), але з вісцеральним характером відкладення жиру або дисфункціональною жировою тканиною перебіг НАЖХП може характеризуватися як підвищеним, так і нормальним рівнем печінкових ферментів.
Сучасна концепція «метаболічно здорових» осіб з ожирінням потребує виваженого підходу, враховуючи можливість експресії у них тих самих генів, як і в осіб з ожирінням і порушенням метаболізму, зміни біохімічних показників функції печінки та розвитку несприятливих наслідків у майбутньому. Спостереження в динаміці при ожирінні слід здійснювати обов’язково, оскільки цей стан вважається основним проявом і фактором ризику розвитку НАЖХП, зумовленої ІР, і підвищує ризик ускладнень захворювання.
У більшості пацієнтів із НАЖХП із нормальним ІМТ спостерігаються ІР і порушення розподілу жиру, навіть незважаючи на меншу вираженість метаболічних розладів, ніж у хворих із надлишковою масою тіла і НАЖХП. Такі пацієнти потребують спостереження у зв’язку з можливим прогресуванням захворювання.
Цукровий діабет. Пацієнти з ЦД 2 типу незалежно від ІМТ мають ІР, ожиріння, дисліпопротеїдемію, підвищений рівень печінкових ферментів, а також схильність до накопичення жиру в печінці. Поширеність НАЖХП також вища серед осіб із ризиком розвитку ЦД 2 типу, який характеризується рівнем глікозильованого гемоглобіну (HbA1c) 5,7-6,4% (38,8-46,4 ммоль/л), підвищеним рівнем глюкози натще (100-125 мг/дл або 5,55-6,94 ммоль/л) і/або порушенням толерантності до глюкози (глюкоза 140-199 мг/дл або 7,77-11,04 ммоль/л через 2 год після стандартного перорального тесту на толерантність до глюкози (ПГТТ) з 75 г глюкози). Наявність і ризик ЦД 2 типу тісно пов’язані з тяжкістю НАЖХП, її прогресуванням до НАСГ, розвитком тяжкої форми фіброзу та гепатоцелюлярної карциноми (ГЦК) незалежно від рівня печінкових ферментів. І навпаки, встановлення НАЖХП під час УЗД корелює з підвищенням у 2-5 разів ризику ЦД 2 типу.
У зв’язку з цим в осіб із підвищеним ризиком розвитку ЦД слід проводити стандартизований ПГТТ з 75 г глюкози. На тлі інсулінотерапії підвищується вміст жиру в організмі, але вона, напевне, не призводить до збільшення або зменшення тяжкості НАЖХП при ЦД.
На відміну від одноразового введення інсуліну, яке зумовлює дозозалежне збільшення вмісту жиру в печінці при ЦД 2 типу [6, 7], тривале його застосування сприяє зниженню ІР жирової тканини і, як наслідок, зменшенню рівня неетерифікованих жирних кислот і вмісту жиру в печінці.
У пацієнтів із НАЖХП, які належать до груп високого ризику, обов’язковим є скринінг на ЦД 2 типу з визначенням рівня глюкози натще, HbA1c та за можливості за допомогою стандартизованого ПГТТ з 75 г глюкози.
Хворих на ЦД 2 типу необхідно обстежити для виявлення НАЖХП незалежно від рівня печінкових ферментів, оскільки вони мають високий ризик прогресування захворювання.
Алгоритм діагностики та спостереження
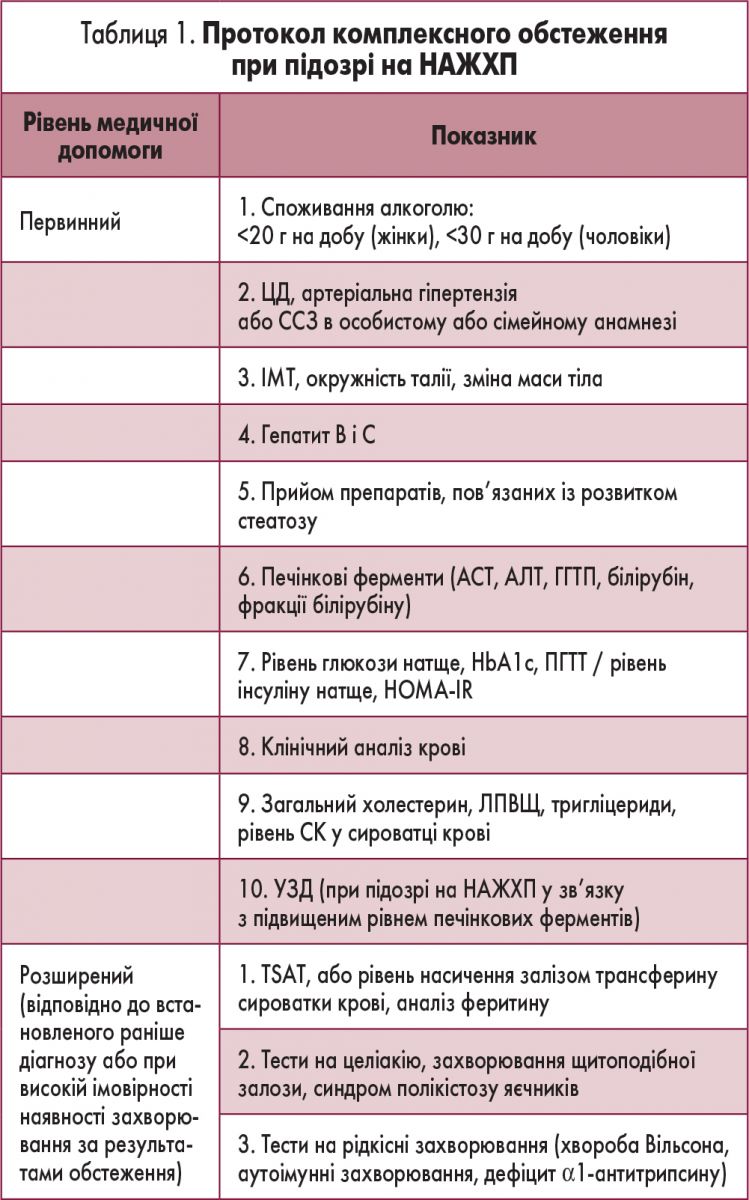
Випадкове виявлення стеатозу є підставою для всебічного вивчення анамнезу пацієнта та спадкового анамнезу для встановлення НАЖХП-асоційованих захворювань і виключення вторинних причин стеатозу (табл. 1).
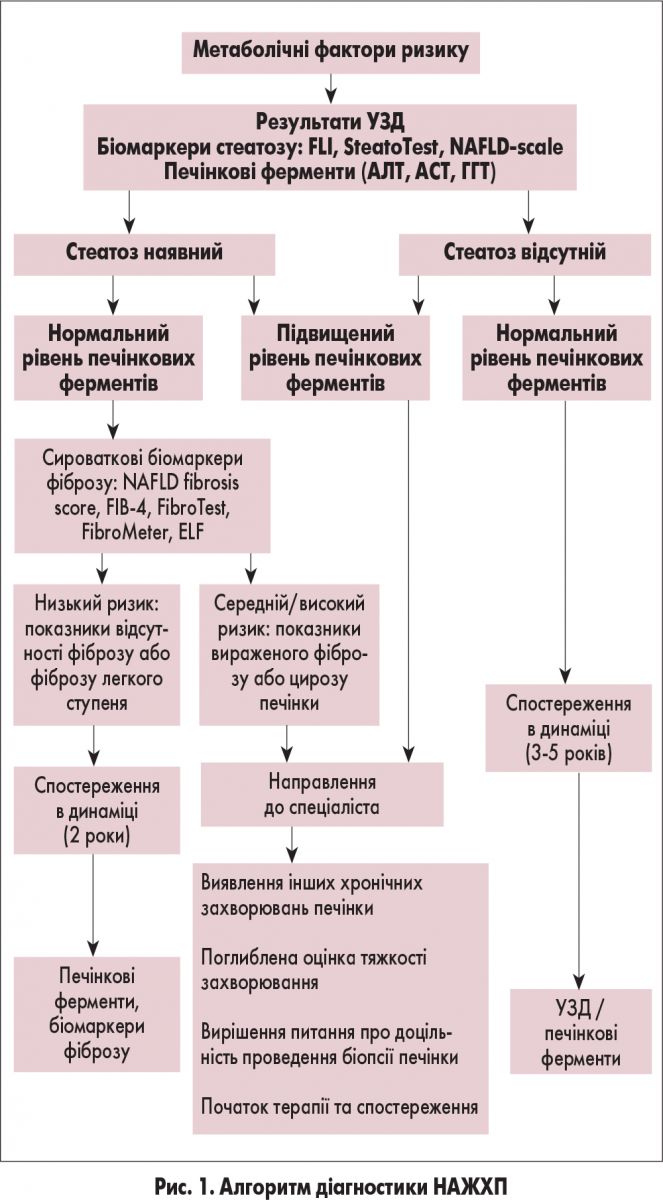
Аналіз метаболічних факторів ризику має включати ретельне дослідження всіх компонентів МС. Так само, як при ожирінні і ЦД 2 типу або випадковому визначенні підвищеного рівня печінкових ферментів, у пацієнтів із метаболічними факторами ризику необхідно проводити неінвазивний скринінг на стеатоз, НАСГ та фіброз (рис. 1).
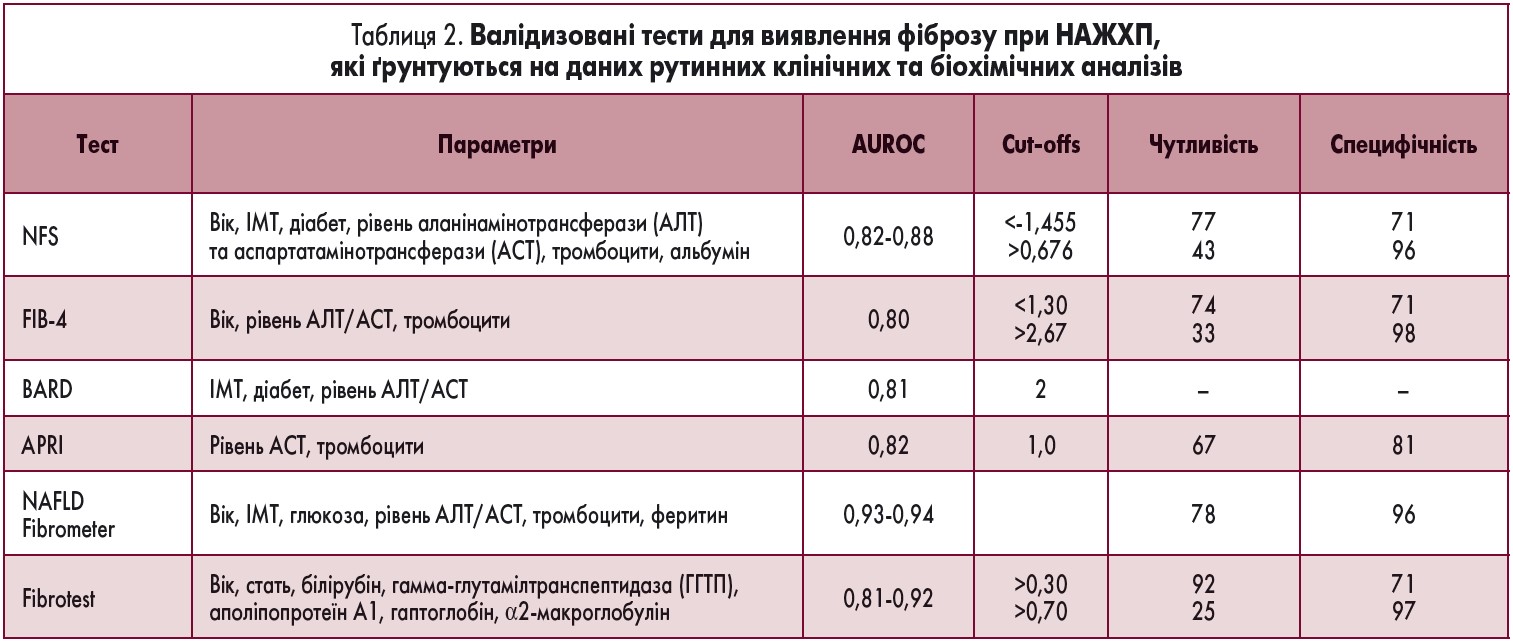
Неінвазивні біомаркери фіброзу. Ступінь активності НАЖХП з використанням тест-систем для діагностики прогресування фіброзу NAFLD fibrosis score, Fibrosis‑4 (FIB‑4), European Liver Fibrosis panel (ELF) або FibroTest має розраховуватися для кожного пацієнта для виключення вираженого фіброзу (≥F2) (табл. 2 і 3).
Якщо виражений фіброз виключити не можна, рекомендовано проведення ультразвукової еластографії. У разі підтвердження вираженого фіброзу остаточний діагноз встановлюється за результатами біопсії печінки.
Усіх хворих на ЦД або із ризиком його розвитку необхідно направляти до ендокринолога для призначення оптимального лікування.
 Пацієнти з підвищеним ризиком діабету мають бути включені у структуровану програму модифікації способу життя. Наявність ожиріння – це критерій включення таких пацієнтів у структуровану програму зниження маси тіла та направлення до фахівця, який займається проблемами ожиріння. Крім цього, необхідно провести комплексне обстеження для виявлення серцево-судинних захворювань (ССЗ).
Пацієнти з підвищеним ризиком діабету мають бути включені у структуровану програму модифікації способу життя. Наявність ожиріння – це критерій включення таких пацієнтів у структуровану програму зниження маси тіла та направлення до фахівця, який займається проблемами ожиріння. Крім цього, необхідно провести комплексне обстеження для виявлення серцево-судинних захворювань (ССЗ).
Оптимальний порядок спостереження за пацієнтами з НАЖХП досі не визначений. Моніторинг має включати біохімічний аналіз крові, оцінку супутніх захворювань та неінвазивний моніторинг фіброзу. Пацієнти з НАЖХП без обтяження метаболічними факторами ризику повинні проходити регулярне обстеження з інтервалом 2-3 роки. Хворі з НАСГ і/або фіброзом печінки мають робити це щороку, а пацієнти з НАСГ і цирозом печінки – кожні 6 міс. За показаннями повторну біопсію слід виконати через 5 років.
Перебіг та ускладнення НАЖХП
Прогресування захворювання
НАЖХП здебільшого повільно прогресує як у дорослих, так і у дітей, проте у 20% випадків спостерігається швидке прогресування фіброзу печінки. Швидкість прогресування фіброзу відповідає 1 стадії: кожні 14 років – при стеатозі печінки, кожні 7 років – при НАСГ, і подвоюється за наявності артеріальної гіпертензії. НАСГ пов’язаний з підвищенням стандартизованого коефіцієнта смертності порівняно з загальною популяцією. Загалом хвороби печінки є третьою за частотою причиною смерті після серцево-судинних та онкологічних захворювань.
Ізольована НАЖХП, виявлена лише за допомогою УЗД, не пов’язана з підвищенням смертності, ймовірно, через те, що ізольований стеатоз рідко прогресує до НАСГ або фіброзу. НАЖХП у дитячому віці викликає особливе занепокоєння у зв’язку з можливим розвитком тяжких ускладнень з боку печінки у майбутньому. НАСГ-асоційований цироз печінки був описаний у дитини 8-річного віку.
Серцево-судинні захворювання
Серед пацієнтів із НАЖХП поширеність ССЗ є вищою, що зумовлено компонентами МС. Хворі на НАЖХП помирають від ССЗ частіше, ніж від захворювань печінки. За результатами більшості досліджень встановлено, що при НАЖХП біохімічні маркери атеросклерозу (низький рівень холестерину ЛПВЩ, високий рівень тригліцеридів) або запалення (підвищений рівень С-реактивного білка) і підвищені рівні прокоагулянтних і протромботичних факторів зустрічаються частіше, ніж в осіб без стеатозу. Передатерогенні порушення, такі як збільшення товщини комплексу інтима-медіа сонної артерії, кальцифікація коронарних артерій, черевної аорти та аортального клапана, дисфункція ендотелію і функціональна резистентність стінки артерій, зустрічаються частіше при НАЖХП і, як встановлено в деяких дослідженнях, корелюють із гістологічною тяжкістю захворювання.
Виявлено також інші порушення, такі як негативні результати ехокардіографії (ЕхоКГ) і електрокардіографії (ЕКГ) і зміна енергетичного обміну серця. Ці порушення, як правило, не залежать від традиційних факторів ризику, тривалості ЦД, контролю глікемії, призначеної терапії та компонентів МС. У загальній популяції стеатоз, виявлений за допомогою УЗД, та його сурогатні маркери (наприклад, FLI) корелюють із підвищеним ризиком смерті від ССЗ при тривалому спостереженні, і цей ризик підвищується при НАСГ або тяжкому фіброзі.
Дослідники одностайні у необхідності обстеження на ССЗ пацієнтів із НАЖХП незалежно від наявності традиційних факторів ризику.
І навпаки, скринінг НАЖХП слід проводити у пацієнтів із високим ризиком розвитку ССЗ. Проспективно встановлено зв’язок між рівнем гамма-глутамілтрансферази (ГГТ) і ССЗ, хоча цей показник не є достатнім для внесення відповідних змін до протоколу спостереження в динаміці. Слід зазначити, що ССЗ та метаболічні фактори ризику також описані у підлітків і дітей з НАЖХП.
Лікування НАЖХП
Успішне лікування НАСГ має поліпшити результати захворювання: знизити НАСГ-асоційовану смертність та уповільнити його прогресування та розвиток цирозу або ГЦК. Гістологічна відповідь за наявності НАСГ є загальноприйнятим сурогатним показником ефективності лікування, зокрема, у клінічних дослідженнях. На сьогодні тільки в кількох ретельно розроблених рандомізованих контрольованих дослідженнях (РКД) встановлено, що основними результатами лікування НАЖХП є зменшення/регресія некрозу та запалення і/або фіброзу печінки.
Дієта і зміна способу життя
Епідеміологічні дані свідчать про тісний взаємозв’язок між НАЖХП та нездоровим способом життя, що робить його модифікацію обов’язковою для всіх пацієнтів. Утім, щоденного вживання <30 г алкоголю на добу для чоловіків і <20 г для жінок недостатньо для розвитку алкогольного стеатозу. Більш того, вживання алкоголю в таких кількостях може чинити навіть захисну дію порівняно з повною відмовою від нього.
Відносно незначне зниження маси тіла призводить до зменшення вмісту жиру в печінці та зниження ІР. У пілотному РКД, у ході якого проводили когнітивно-поведінкову терапію, у результаті втручань, спрямованих на зміну способу життя, більш істотно знизилась маса тіла, збільшилась частота розрішення НАСГ (p=0,05) та зменшилась оцінка за шкалою NAS (p=0,05) [6]. Зниження маси тіла на 7% пов’язане з гістологічною відповіддю. У неконтрольованому 12-місячному дослідженні, в якому було виконано 261 парну біопсію, помірне зниження маси тіла на тлі зміни способу життя корелювало з регресією НАСГ (25% усіх випадків) без збільшення вираженості фіброзу [4].
Кращого результату можна досягнути завдяки використанню комплексного підходу, який передбачає дотримання дієти та збільшення аеробного навантаження у поєднанні з силовими вправами [3, 4].
При НАЖХП рекомендовані структуровані програми, спрямовані на модифікацію способу життя шляхом корекції харчування та посилення фізичної активності (С2) (рис. 2). Пацієнтам без НАСГ або фіброзу печінки проводиться тільки консультування щодо здорового харчування та фізичної активності та не рекомендується застосування фармакотерапії. У пацієнтів з НАЖХП із надмірною масою тіла або ожирінням метою більшості втручань, спрямованих на зміну способу життя, є зменшення маси тіла на 7-10%, внаслідок чого знижується рівень печінкових ферментів та поліпшується гістологічна картина (B1).
Рекомендації з корекції харчування мають включати обмеження калорійності раціону та виключення тих продуктів, які стимулюють розвиток НАЖХП (зазнали технологічної обробки, продуктів і напоїв із високим вмістом фруктози). Склад макрокомпонентів харчування має бути скоригований відповідно до середземноморської дієти (B1).
Як аеробні, так і силові вправи сприяють зменшенню вмісту жиру в печінці. Вибір фізичного навантаження має ґрунтуватися на бажаннях пацієнта і бути розрахованим на тривалий час (B2).
Дієтичні рекомендації
Сучасне лікування НАЖХП має на меті насамперед поступове зниження маси тіла за допомогою дієти з або без збільшення фізичної активності. Внаслідок цього нормалізується рівень печінкових ферментів у сироватці крові, зменшується жирова інфільтрація печінки, знижується вираженість запалення печінки та меншою мірою – фіброзу.
В одному з РКД 32 пацієнти з НАСГ були рандомізовані на дві групи з метою порівняти ефективність інтенсивної 48-тижневої модифікації способу життя та базового навчання здоровому способу життя. Активність НАЖХП, оцінена за допомогою NAFLD Activity Score (NAS), істотно зменшилась у 1-й групі з інтенсивною 48-тижневою модифікацією способу життя. У пацієнтів, маса тіла яких знизилась на ≥7%, спостерігалося значне зменшення стеатозу, глобулярного запалення, балонування порівняно з тими, маса тіла яких зменшилась на <7%.
У дослідженні ефективності застосування орлістату в лікуванні таких пацієнтів встановлено, що зниження маси тіла на 9% є необхідною передумовою для значного покращення NAS, тоді як зниження маси тіла на 5% є достатнім для зменшення стеатозу (Harrison et al., 2009).
В іншому дослідженні оцінювали ефективність 12-місячного інтенсивного втручання зі зміни способу життя для зменшення стеатозу печінки у хворих на ЦД 2 типу. Втручання включало помірне обмеження калорійності раціону, збільшення фізичної активності та щотижневі консультації, тоді як контрольна група отримувала лише загальну інформацію щодо корекції харчування та фізичної активності. Після 12 міс в учасників досліджуваної групи досягнуто більш істотного зниження маси тіла (-8,5% проти -0,05%; p<0,01) і прямо пропорційного зменшення стеатозу (-50,8% проти -22,8%; p=0,04) порівняно з пацієнтами групи контролю (Lazo et al., 2010).
Масштабне РКД, проведене у 2013 році, за участю 154 дорослих із НАЖХП продемонструвало, що 12-місячна програма модифікації способу життя (створена дієтологом) дозволила досягти ремісії НАЖХП у 64% пацієнтів основної групи порівняно з 20% у контрольній групі (с<0,001) і зменшення жорсткості печінки лише у досліджуваній групі (Wong et al., 2013).
Позитивні результати у досягненні регресії фіброзу печінки внаслідок зниження маси тіла за допомогою дієти були отримані у кубинському дослідженні та опубліковані у 2015 р. До участі у цьому дослідженні був залучений 261 пацієнт із НАСГ, усім проводили біопсію до та після 52 тижнів спостереження. У всіх пацієнтів, маса тіла яких знизилась на ≥10%, спостерігалося зменшення активності НАЖХП за NAS, у 90% – розрішення НАСГ, у 45% – регресія фіброзу (Vilar-Gomez et al., 2015).
Дієту з низьким вмістом вуглеводів можна вважати більш ефективною щодо зменшення вмісту жиру в печінці. Пацієнти з ІР та ожирінням, які мали дотримуватися низькокалорійної дієти протягом 16 тижнів, були рандомізовані на 2 групи: дієта для 1-ї групи передбачала склад раціону у співвідношенні 60% вуглеводів / 25% жирів, для 2-ї групи – 40% вуглеводів / 45% жирів. При цьому, попри однакове зниження маси тіла, значне зниження рівня АЛТ спостерігалося при дотриманні 2-ї дієти (із низьким вмістом вуглеводів).
В іншому, менш тривалому, дослідженні рівень тригліцеридів значно зменшився в учасників, які протягом 2 тижнів дотримувалися дієти з низьким вмістом вуглеводів, порівняно з тими, хто був на низькокалорійній дієті.
Окрім того, після 48 год дієти з низьким вмістом вуглеводів рівень ліпідів у печінці зменшувався порівняно з дієтою з низьким вмістом жирів, проте ставав однаковим в обох групах при зниженні маси тіла їх учасників понад 7% (Kirk et al., 2009).
У масштабному тривалому РКД 102 пацієнти з надмірною масою тіла та ожирінням були рандомізовані на дві групи, які дотримувалися дієти зі зниженою енергетичною цінністю: 6-місячної з низьким вмістом вуглеводів (<90 г вуглеводів та мінімум 30% жирів від загальної енергетичної цінності раціону) або з низьким вмістом жирів (<20% жирів відповідно). За допомогою цих двох дієт було досягнуто зниження енергетичної цінності – 70% від звичайної. До того ж у результаті дотримання вказаних дієт істотно знизились рівні ліпідів та АЛТ у печінці (Haufe et al., 2011). Слід зазначити, що обидві дієти були створені відповідно до концепції здорового харчування, оскільки передбачали зниження кількості насичених жирів.
У 2012 р. метааналіз РКД продемонстрував ідентичну ефективність дієти з низьким вмістом вуглеводів та дієти з низьким вмістом жирів у зниженні рівня АЛТ та вмісту жиру в печінці (Musso et al., 2012).
Роль складу макронутрієнтів (білків, жирів, вуглеводів) та інших нутрієнтів
З огляду на те що знизити масу тіла і зберегти отримані результати в довгостроковій перспективі досить складно (Katan, 2009), зміна дієти без зменшення калорійності раціону може бути більш реалістичною альтернативою у лікуванні пацієнтів із НАЖХП. Зауважимо, що збільшилась кількість таких пацієнтів з ІМТ у межах норми (Lee et al., 2002). В епідеміологічних дослідженнях показано, що пацієнти з нормальною масою тіла мають звички нездорового харчування, що свідчить про важливість дієтичних рекомендацій (Musso et al., 2003; Assy et al., 2008).
Види вуглеводів. Природний цукор є невід’ємною складовою фруктів, овочів та молочних продуктів, тоді як додатковий цукор належить до рафінованих цукрів (сахарози та ін.) і міститься у солодких напоях, фруктових соках та харчових продуктах (Howard, Wylie-Rosett, 2002). Безалкогольні солодкі напої за вмістом додаткового цукру посідають провідну позицію у світі. Доведено, що у щурів, так само як і в людей, які споживають їжу, збагачену сахарозою та фруктозою, згодом розвивається жирова хвороба печінки. Крім того, безалкогольні солодкі газовані напої містять карамельні барвники, багаті кінцевими продуктами глікації (AGEs), які можуть посилювати ІР та запалення (Gaby, 2005).
Споживання фруктози також призводить до порушення кишкової мікробіоти. Зростає доказовість ролі інтестинальної проникності та ендотоксинів у розвитку НАЖХП у людей та гризунів (Federico et al., 2016). У дослідженнях на тваринах встановлено, що дієта з високим вмістом фруктози індукує зміни, подібні до тих, які спостерігаються при хронічному споживанні алкоголю та харчуванні з високим вмістом жирів, що проявляється у посиленні проникності кишечнику, ендотоксемії, збільшенні рівня фактору некрозу пухлини (ФНП) та підвищенні стеатозу печінки (Federico et al., 2016). У мишей, які споживали більше фруктози, значно посилювались акумуляція ліпідів у печінці, перекисне окислення ліпідів та експресія ФНП, збільшувався рівень ендотоксинів у портальній крові порівняно з тими, які отримували глюкозу, сахарозу, або з контрольною групою. Супутнє лікування антибіотиками групи, раціон якої був багатий фруктозою, призвело до помітного зниження накопичення ліпідів у печінці (Bergheim et al., 2008).
У ще одному РКД 47 учасників з надмірною масою тіла було рандомізовано з метою оцінки ефекту вживання 4 різних тестових напоїв (1 л на добу протягом 6 міс): звичайного газованого напою, ізокалорійного напівзнежиреного молока, аспартам-підсолодженого дієтичного газованого напою та води. Істотна зміна вмісту жиру в печінці порівняно з нормою наприкінці 6 міс була значно вищою у групі, яка вживала звичайний газований напій, ніж у 3 інших групах (Maersk et al., 2012).
Масштабне дослідження за участю 427 пацієнтів із НАЖХП розширило розуміння механізмів ураження печінки, яке, зокрема, може бути пов’язане з надмірним споживанням напоїв, які містять фруктозу. Порівняльний аналіз за віком, статтю, ІМТ та загальною калорійністю раціону встановив, що надмірне щоденне споживання таких напоїв асоційоване з вищою стадією фіброзу печінки (відносний ризик – ВР – 3,2; 95% довірчий інтервал – ДІ – 1,4-7,4 при ≥7 проти <7 порцій на тиждень) (Abdelmalek et al., 2010).
Одна з патогенетичних ланок, через яку солодкі напої призводять до посилення фіброзу печінки, є збільшення рівня сечової кислоти (СК) у дозозалежному зв’язку, що пояснюється саме вмістом фруктози у вказаних напоях, оскільки це єдиний вуглевод, роль якого у підвищенні рівня СК доведена (Choi et al., 2008). Проспективне спостереження показало, що рівень сироваткової СК є незалежним предиктором розвитку НАЖХП (Xu et al., 2010). Поперечний аналіз даних 82 608 осіб встановив наявність сильного позитивного зв’язку між рівнем СК та підвищеним рівнем АЛТ як у чоловіків, так і у жінок, причому незалежно від ІМТ (Zelber-Sagi et al., 2015). Підвищений рівень СК може спричинити оксидативний стрес, ІР та розвиток метаболічного синдрому, що обґрунтовує сильний зв’язок між рівнем СК та підвищеним рівнем печінкових ферментів, розвитком цирозу печінки після виключення усіх інших причин та факторів ризику розвитку хронічних захворювань печінки.
Медикаментозна терапія
Медикаментозну терапію слід призначати при прогресуванні НАСГ (мостовидному фіброзі або цирозі), а також пацієнтам із НАСГ на ранніх стадіях із підвищеним ризиком прогресування фіброзу (вік понад 50 років, ЦД, МС, підвищений рівень АЛТ) або при активному НАСГ з високим ступенем запалення і некрозу. Дослідження III фази ефективності будь-яких препаратів для лікування НАСГ останніми роками не проводилися, тому вони не схвалені для клінічного застосування. У зв’язку з цим рекомендації щодо специфічної терапії відсутні, тому будь-яке медикаментозне лікування можна вважати лікуванням за незареєстрованими показаннями. Необхідними критеріями для проведення медикаментозної терапії є її безпека та хороша переносимість через наявність НАСГ-асоційованих супутніх захворювань і можливий розвиток лікарських взаємодій.
Препарати, які підвищують ІР. На сьогодні накопичено недостатньо даних щодо гістологічної ефективності метформіну при НАСГ.
Метформін чинить слабкий вплив на вміст жиру в печінці через його нездатність швидко відновити рівень адипонектину в сироватці крові.
Деякі доклінічні дані вказують на антионкогенну активність метформіну відносно розвитку раку печінки, хоча дані щодо зменшення частоти розвитку ГЦК обмежені результатами рандомізованих досліджень, а цього недостатньо для формулювання науково обґрунтованих рекомендацій з його застосування.
Тіазолідиндіони. У дослідженні PIVENS порівняли ефективність низьких доз піоглітазону, вітаміну E і плацебо, які протягом 2 років приймали пацієнти без ЦД. На тлі застосування піоглітазону поліпшувались усі гістологічні ознаки (за винятком фіброзу) порівняно з плацебо [5]. Гістологічний ефект супроводжувався зниженням рівня АЛТ і частковою корекцією ІР. Терапія розиглітазоном тривалістю до 2 років не призвела до додаткового гістологічного поліпшення [8]. Викликають занепокоєння побічні ефекти глітазонів: збільшення маси тіла, переломи кісток у жінок та іноді розвиток хронічної серцевої недостатності. Незважаючи на недоліки, пов’язані з безпекою та переносимістю, піоглітазон можна застосовувати в окремих пацієнтів із НАСГ, особливо за наявності ЦД 2 типу, при якому цей препарат був схвалений для застосування.
Інкретиноміметики, що впливають на взаємодію глюкози та інсуліну, показали сприятливі результати стосовно рівня печінкових ферментів у передмаркетингових дослідженнях [4]. У невеликому пілотному дослідженні у пацієнтів із НАСГ, яким щоденно вводили ліраглутід, досягнуто ремісії захворювання без посилення фіброзу [3, 4].
Антиоксиданти, цитопротекторні та гіполіпідемічні засоби. У дослідженні PIVENS застосування вітаміну E (800 МО на добу) призвело до зменшення вираженості стеатозу, запалення і балонної дистрофії при НАСГ у 36% пацієнтів (21% у групі плацебо). Зниження рівня АЛТ корелювало з гістологічним поліпшенням, а у пацієнтів, які не досягли гістологічної відповіді, рівень АЛТ не змінився.
У дослідженні TONIC за участю дітей у результаті застосування вітаміну E не знизився рівень амінотрансфераз, а також не зменшилася вираженість стеатозу і запалення, проте зменшилась балонна дистрофія. Ефективність лікування НАСГ на тлі застосування вітаміну E вдвічі перевищувала таку порівняно з плацебо. Ці дані суперечать результатам попередніх досліджень, які переважно були негативними як у дітей, так і у дорослих. Існують побоювання з приводу тривалого застосування вітаміну E, головним чином, у зв’язку з підвищеним рівнем загальної смертності, збільшенням частоти геморагічних інсультів, а також раку простати у чоловіків старше 50 років. Вітамін E можна призначати пацієнтам із НАСГ без ЦД і цирозу печінки, проте необхідні подальші дослідження для того, щоб сформулювати чіткі рекомендації з його застосування.
У кількох РКД предметом вивчення було застосування урсодезоксихолевої кислоти в різних дозах тривалістю аж до 2 років, проте спостерігалося поліпшення тільки деяких біохімічних показників без гістологічної відповіді [1]. При різкому схудненні УДХК рекомендовано застосовувати для профілактики розвитку жовчнокам’яної хвороби.
Застосування синтетичного агоніста фарнезоїдного X-рецептора – обетихолевої кислоти – супроводжувалося зменшенням ІР у хворих на ЦД 2 типу. У дослідженні IIb фази FLINT застосування обетихолевої кислоти протягом 72 тижнів у пацієнтів із НАСГ без цирозу печінки призвело до зменшення вираженості всіх гістологічних проявів НАСГ та фіброзу. Основні проблеми, пов’язані з безпекою і переносимістю такого лікування, стосувалися підвищення рівня холестерину ЛПНЩ і появи свербежу.
Попередні дані, отримані в невеликих неконтрольованих дослідженнях, свідчать про те, що омега-3 поліненасичені жирні кислоти (ПНЖК) сприяють зниженню вмісту жиру в печінці, проте результати двох досліджень, предметом вивчення яких був вплив ПНЖК на гістологічні результати НАЖХП, були негативними [3, 4]. Відповідно до рекомендацій Американського коледжу гастроентерології (ACG, 2017) омега-3 ПНЖК не слід застосовувати для лікування НАЖХП, проте їх рекомендовано призначати при супутній гіпертригліцеридемії.
Наявні дані щодо ефектів пентоксифіліну та орлістату – обмежені та суперечливі. Недостатніми є також дані щодо ефективності гіполіпідемічних засобів; у проведених нещодавно дослідженнях ефективності застосування езетімібу отримано негативні результати [4].
Зараз у пізніх фазах РКД триває вивчення ефективності застосування при НАСГ нових перспективних препаратів, які мають протизапальні, антифібротичні властивості та здатність підвищувати ІР (подвійних агоністів рецепторів активаторів проліферації пероксисом – PPAR α/δ, подвійних антагоністів хемокінових рецепторів CCR2/CCR5 і кон’югатів жирних кислот / жовчних кислот).
Нижче подано спільні клінічні рекомендації з лікування НАЖБП Європейської асоціації з вивчення печінки (EASL), Європейської асоціації з вивчення діабету (EASD) та Європейської асоціації з вивчення ожиріння (EASL/ EASD/EASO, 2016).
Рекомендації EASL/EASD/EASO (2016)
• Фармакотерапія показана пацієнтам із НАСГ, особливо за наявності вираженого фіброзу (у стадії F2 або вище). Пацієнти з менш тяжкою формою захворювання, але з високим ризиком прогресування (у поєднанні з ЦД, МС, тривалим підвищенням рівня АЛТ, вираженим запаленням) також можуть вважатися кандидатами для проведення фармакотерапії з метою профілактики прогресування захворювання (B1).
• При НАСГ можна призначати піоглітазон (найбільш переконливі дані щодо ефективності, але офіційно препарат схвалений тільки для застосування при ЦД 2 типу), вітамін E (більш сприятливий профіль безпеки і переносимості при нетривалому застосуванні) або їх комбінацію (B2).
• Оптимальна тривалість терапії – невідома. У пацієнтів із початковим підвищеним рівнем АЛТ лікування необхідно припинити, якщо через 6 міс не досягнуто зниження рівня амінотрансфераз. Для пацієнтів із нормальним початковим рівнем АЛТ чіткі рекомендації сформулювати неможливо (C2).
• Статини можна застосовувати для зниження рівня холестерину ЛПНЩ і профілактики ССЗ без будь-якого позитивного або негативного впливу на стан печінки.
• ПНЖК знижують рівень ліпідів як у плазмі крові, так і в печінці, однак дані щодо доцільності їх призначення при НАСГ відсутні (B1).
Зниження рівня заліза
Накопичення заліза у печінці пов’язано з посиленням ІР, а виведення заліза призводить до її зниження. Для НАЖХП характерний високий рівень феритину при різних рівнях насичення трансферином незалежно від наявності генетичних поліморфізмів, пов’язаних із сімейним гемохроматозом. У таких хворих флеботомія, спрямована на зниження рівня заліза аж до розвитку його дефіциту, призводить до зниження індексу NAS без посилення вираженості фіброзу [3]. Однак для підтвердження вказаних ефектів необхідно проводити подальші дослідження.
Баріатрична хірургія
У лікуванні тих пацієнтів із НАЖХП, у яких зміна способу життя та фармакотерапія не дали позитивних результатів, баріатрична хірургія може бути методом вибору для зниження маси тіла та запобігання метаболічним ускладненням [4]. Позитивні результати встановлено стосовно впливу баріатричної хірургії на зменшення запалення та фіброзу печінки при НАЖХП. Результати проведеного нещодавно когортного дослідження зі спостереженням протягом одного року показали, що зниження маси тіла після баріатричних операцій призвело до зменшення запалення у 85% пацієнтів та вираженості фіброзу у 34% пацієнтів, хоча при цьому слід враховувати ймовірність розвитку пери- та післяопераційних ускладнень. Порівняльні дані щодо впливу різних баріатричних процедур на вміст жиру в печінці поки що відсутні.
Відповідно до рекомендацій EASL/EASD/EASO (2016) баріатричні операції за рахунок зменшення проявів ожиріння та ЦД призводять до зменшення вмісту жиру у печінці та уповільнення прогресування НАСГ. Проспективні дані свідчать про зменшення всіх гістологічних змін при НАСГ, включаючи фіброз (B1).
НАЖХП-асоційований цироз є одним із трьох основних показань до трансплантації печінки. Виживаність протягом 3 і 5 років у пацієнтів із НАЖХП після трансплантації печінки приблизно така сама, як і у пацієнтів з іншими захворюваннями. Такі пацієнти мають високий ризик летальності від серцево-судинних ускладнень та сепсису, натомість низький ризик відторгнення трансплантата [3, 4]. Загальна смертність корелює з показником ІМТ і наявністю ЦД. При цьому 50% пацієнтів з ІМТ >35 кг/м2 помирають протягом 1-го року після трансплантації.
Відторгнення трансплантата (10 і 45% через 10 і 20 років відповідно) в осіб з ожирінням рідко пов’язане з рецидивом цирозу при НАСГ (приблизно 2%) [3, 4].
Відповідно до рекомендацій EASL/EASD/EASO (2016) трансплантація печінки є прийнятним методом лікування пацієнтів із НАСГ у термінальній стадії. Виживаність після трансплантації порівнянна з показниками при інших показаннях, незважаючи на вищу смертність від серцево-судинних ускладнень. Пацієнти з НАСГ із печінковою недостатністю і/або ГЦК є кандидатами на проведення трансплантації печінки (А1).
Література
1. Asrih M., Jornayvaz F.R. Inflammation as a potential link between non-alcoholic fatty liver disease and insulin resistance // J of Endocrinology. 2013. – Vol. 218. – P. 25-36.
2. Bhat G., Baba C.S., Pandey A. et al. Lifestyle modification improves insulin resistance and liver histology in patients with non-alcoholic fatty liver disease // World J Hepatol. – 2012. – Vol. 4 (7). – P. 209-217.
3. Chalasani N., Younossi Z., Lavine J.E. et al. The Diagnosis and Management of Non-Alcoholic Fatty Liver Disease: Practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association // Hepatology. – 2012; 2017.
4. European Association for the Study of the Liver et al. EASL-EASD-EASO Clinical Practice Guidelines for the Management of Non-Alcoholic Fatty Liver Disease // Obesity Facts. – 2016. – Vol. 9 (2). – Р. 65-90.
5. Hurjui D.M., Nita O., Graur L.I. et al. Non-alcoholic fatty liver disease is associated with cardiovascular risk factors of metabolic syndrome // Rev. Med. Chir. Soc. Med. Nat. Lasi. – 2012. – Vol. 116 (3). – P. 692-699.
6. Kistler K.D., Brunt E.M., Clark J.M. et al. Physical activity recommendations, exercise intensity, and histological severity of non-alcoholic fatty liver disease // The Am J of Gastroenterol. – 2011. – Vol. 106 (3). – P. 460-468.
7. Nseir W., Hellou E., Assy N. Role of diet and lifestyle changes in non-alcoholic fatty liver disease // World J Gastroenterol. – 2014. – Vol. 28 (20). – P. 9338-9344.
8. Rodriguez B., Torres D.M., Harrison S.A. Physical activity: an essential component of lifestyle modification in NAFLD // Nature Reviews Gastroenterol. and Hepatol. – 2012. – Vol. 9 (12). – P. 726-731.
9. St George A., Bauman A., Johnston A. et al. Independent effects of physical activity in patients with non-alcoholic fatty liver disease // Hepatology. – 2009. – Vol. 50 (1). – Р. 68-76.
10. Van der Heijden G.J., Wang Z.J., Chu Z.D. et al. A 12-week aerobic exercise program reduces hepatic fat accumulation and insulin resistance in obese, Hispanic adolescents // Obesity. – 2010. – Vol. 18. – P. 384-390.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 1 (47), березень 2018 р.