11 травня, 2018
Рациональная фармакотерапия урологических инфекций: что нового?
8-9 февраля состоялась научно-практическая конференция с международным участием «Рациональная фармакотерапия в урологии‑2018». Данное мероприятие уже более 10 лет является одной из самых популярных площадок для общения урологов, андрологов, клинических фармакологов, терапевтов, гинекологов. В этом году высокий профессиональный уровень конференции обеспечили свыше тысячи специалистов и ведущих ученых из разных стран мира.

Новый метод комбинированной терапии послеоперационной дизурии, возникающей после трансуретральной резекции предстательной железы (ТУРПЖ) представил заведующий кафедрой урологии и андрологии ФГБУ ГНЦ ФМБЦ им. А. И. Бурназяна, доктор медицинских наук, профессор Алексей Георгиевич Мартов.
– Эндохирургическое лечение доброкачественной гиперплазии предстательной железы (ДГПЖ), независимо от способа проведенного оперативного вмешательства, является успешным только в 70% случаев. К сожалению, у 30% пациентов после операции остаются симптомы нижних мочевых путей (СНМП).
При этом, помимо частого мочеиспускания и ночной поллакиурии, которые встречаются у трети из этих пациентов, у 10-40% наблюдаются вялая струя мочи, ночные позывы к мочеиспусканию, а также болезненное мочеиспускание и ургентное недержание мочи.
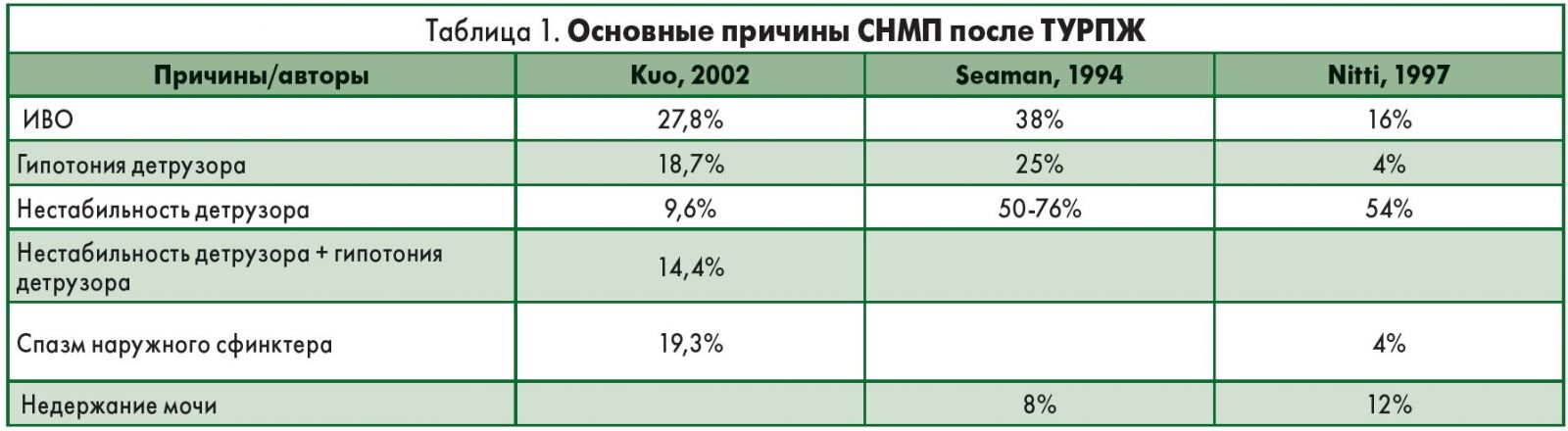
Основные причины СНМП после эндоскопической операции по поводу аденомы ПЖ представлены в таблице 1 (данные разных авторов).
Очевидно, что чаще всего встречаются инфравезикальная обструкция (ИВО) и нестабильность детрузора.
На втором месте по значимости – СНМП-гипотония детрузора, сочетание нестабильности детрузора с его гипотонией. Несколько реже наблюдаются спазм наружного сфинктера и недержание мочи.
Механизм развития дизурии у больных после оперативного эндоскопического лечения ДГПЖ, помимо хронического инфицированного простатита, подлежащего стандартной противовоспалительной терапии, включает и другие факторы, вызванные собственно операционной травмой: изменения в шейке мочевого пузыря, обусловленные предшествующей аденомой ПЖ; неполная регенерация уротелия; повышенная активность и нестабильность детрузора. Также отметим, что при больших объемах ПЖ наиболее часто выполняемыми операциями в мире являются паллиативная ТУРПЖ или псевдо-ТУРПЖ, при которых ткань ПЖ не полностью удаляется, а выполняется так называемая «бороздка» определенной величины.
Такая ситуация со временем способствует «ложному» рецидиву ДГПЖ с возвращением ирритативных симптомов. Помимо этого дизурии способствуют и неудаленные апикальные ткани. В отличие от гипотонии детрузора основными признаками в данном случае будут слабая струя мочи после операции, обструктивный тип кривой либо малый объем микции, рецидивирующие острые задержки мочи в послеоперационном периоде.
Другими причинами ИВО в указанном периоде считаются вентральная средняя доля, слишком длинный простатический отдел уретры, при котором край ПЖ недостижим, и неудаленные во время операции крупные фрагменты ткани и сгустки крови.
Ранее стандартным способом лечения СНМП, которыми страдали пациенты после эндоскопического вмешательства, была противовоспалительная терапия. Мы решили найти нестандартные способы медикаментозной коррекции этих нарушений и выявили, что применение в послеоперационном периоде α1-адреноблокаторов существенно улучшает результаты оперативного лечения больных ДГПЖ. Этот факт подтвержден результатами проведенного нами в 2016-2017 гг. рандомизированного клинического исследования, целью которого было сравнение эффективности монотерапии и комбинированной терапии для ликвидации послеоперационной дизурии у пациентов после ТУРПЖ по поводу ДГПЖ больших размеров.
В исследовании приняли участие 94 пациента с объемом ПЖ ≥100 см3: 22 участника выбыли из исследования по критериям исключения, остальные (n=72) были поровну разделены на 2 группы. Участники 1-й группы (n=36) в течение 1 мес после операции получали тамсулозин с модифицированным высвобождением в стандартной дозе 0,4 мг*, пациенты 2-й (n=36) – фиксированную комбинацию тамсулозина (0,4 мг) и солифенацина (6 мг)**.
Спустя 1 мес после приема препаратов в обеих группах осуществили контроль состояния пациентов с применением Международной шкалы оценки простатических симптомов I-PSS, визуальной аналоговой шкалы (ВАШ), урофлоуметрии, ультразвукового исследования и стандартных анализов.
При сравнении интра- и послеоперационных показателей в обеих группах (вес удаленной ткани, время операции, время нахождения уретрального катетера в полости мочевого пузыря, количество койко-дней) значимых различий не было. Пациенты 1-й группы получали стандартную противовоспалительную терапию: фторхинолон перорально в течение 7 дней, нестероидные противовоспалительные свечи ректально и уросептики в течение 30 дней, гемостатики до визуального эффекта, а также, в течение 1 мес, тамсулозин с модифицированной системой высвобождения препарата. 2-я группа в течение 1 мес после операции получала фиксированную комбинацию солифенацин + тамсулозин, каждая двухслойная таблетка которого содержит один слой солифенацина сукцината в дозе 6 мг, что соответствует 4,5 мг солифенацина, и один слой тамсулозина гидрохлорида в дозе 0,4 мг (соответствует 0,37 мг тамсулозина) с модифицированной системой высвобождения препарата.
Результаты исследования показали статистически значимое улучшение симптоматики по шкале I-PSS (p≤0,05) и достоверное уменьшение ирритативных симптомов до и после ТУРПЖ (p≤0,05) через 1 мес после лечения фиксированной комбинацией Везомни во 2-й группе. Наглядной была и оценка пациентами 2-й и 1-й групп своего состояния по ВАШ (0 – плохо, 10 – отлично): 9,2 против 6,5 соответственно.
Следует отметить, что хотя статистически достоверной разницы по отдельным показателям (количество остаточной мочи, максимальная объемная скорость мочеиспускания) ожидаемо не наблюдалось, средний объем микции до и после операции оказался достоверно выше во 2-й группе, получавшей фиксированную комбинацию солифенацин + тамсулозин, что объясняется благоприятным влиянием м-холинолитика солифенацина в комплексной терапии послеоперационной дизурии.
Что касается нежелательных явлений (НЯ), наблюдавшихся во 2-й группе, то они в основном были связаны с известными эффектами м-холинолитиков (сухость во рту, запоры), проявлялись в легкой степени и не требовали отмены препарата.
Результаты проведенного нами исследования позволили сделать целый ряд практических выводов:
- использование новой фиксированной комбинации солифенацин + тамсулозин в послеоперационном периоде показано пациентам с преобладанием ирритативной симптоматики в предоперационном периоде или имеющих факторы, вызывающие ирритативную симптоматику (камни мочевого пузыря, рецидивирующая инфекция мочевых путей – ИМП, сахарный диабет – СД);
- срок терапии составляет не менее 1 мес после операции;
- преимущества фиксированной комбинации солифенацин + тамсулозин по сравнению с тамсулозином состоит в лучшем устранении ирритативных симптомов, увеличении объема микции, устранении позывов к мочеиспусканию, уменьшении ночной поллакиурии;
- использование фиксированной комбинации солифенацин+тамсулозин нежелательно у пациентов с подозрением на возможную гипотонию детрузора (дивертикулы мочевого пузыря, неврологические заболевания, пациенты с колостомой).
 О пациент-ориентированном подходе в современной терапии инфекций нижних мочевыводящих путей детально рассказала профессор кафедры урологии Первого МГМУ им. И.М. Сеченова доктор медицинских наук Заида Камалудиновна Гаджиева.
О пациент-ориентированном подходе в современной терапии инфекций нижних мочевыводящих путей детально рассказала профессор кафедры урологии Первого МГМУ им. И.М. Сеченова доктор медицинских наук Заида Камалудиновна Гаджиева.
– Установлено, что ИМП наиболее часто подвержены женщины, беременные, а также пациенты с неврологической патологией и СД – у этой группы больных урологические инфекции протекают особенно тяжело и могут стать причиной летального исхода.
Поэтому с пациентом, страдающим ИМП, одновременно работают не только урологи, но и врачи других специальностей: нефрологи, акушеры-гинекологи, эндокринологи, неврологи и нейрохирурги, психиатры, хирурги, педиатры. При таком междисциплинарном подходе к конкретному пациенту правильная формулировка клинического диагноза способствует правильному подбору патогенетической терапии ИМП и предполагает точное определение основного и фонового заболеваний, их осложнений, а также сопутствующей патологии.
Несмотря на то что Европейская ассоциация урологов (EAU) давно предложила рабочую классификацию ИМП, учитывающую клинические проявления, степень тяжести, факторы риска и тип возбудителя, на практике урологи, к сожалению, обращаются к ней недостаточно часто. Что касается пациент-ориентированного подхода, в первую очередь необходимо выделять больных, для которых ИМП является осложненной.
В этом случае, в соответствии с прогнозом, ИМП дифференцируют на инфекцию, осложняющие факторы которой могут быть полностью устранены в процессе лечения, и инфекцию, чьи осложняющие факторы в процессе лечения устранить либо невозможно, либо можно только частично.
Следует отметить, что для установления диагноза ИМП недостаточно выявления только лейкоцитурии/пиурии. Так, лейкоцитурия может иметь место при неинфекционных почечных заболеваниях (гломерулопатия, интерстициальный нефрит, врожденные аномалии развития почек) и гельминтозах.
У женщин лейкоцитурия и повышенный риск развития ИМП связаны с целым рядом факторов: анатомические особенности мочеполовых органов; вагинальная контаминация при воспалительных гинекологических заболеваниях, цистоцеле; сексуально активный образ жизни, использование контрацептивов со спермицидами; период менопаузы и длительной постменопаузы, сопровождающиеся атрофией слизистой оболочки мочеполовых органов. Особую группу составляют пациенты с рецидивирующими инфекциями верхних и нижних мочевыводящих путей и нарушениями мочеиспускания.
Так, по нашим исследованиям, проведенным в 2009 году, среди женщин, страдающих рецидивирующим циститом и необструктивным пиелонефритом, у 45,68% выявлялась нестабильность уретры (НУ), у 8,62% – гиперактивность мочевого пузыря (ГМП) и у 22,4% – сочетание НУ с ГМП.
Что касается ИМП во время беременности, то одним из факторов риска их развития является бессимптомная бактериурия (ББ), которую выявляют по наличию двух последовательных (с промежутком ≥24 ч) бактериологических исследований мочи (>105 КОЕ/ мл) с выявлением одного и того же возбудителя и отсутствием клинических проявлений.
При отсутствии лечения ББ у беременных могут развиться такие осложнения:
- острый пиелонефрит;
- анемизация, преэклампсия, преждевременные роды;
- внутриутробная смерть плода, гипотрофия новорожденного.
Следует особо отметить, что во время беременности существенно возрастает риск развития пиелонефрита вследствие действия целого ряда факторов, которые в совокупности ведут к нарушению почечного кровотока и уродинамики (крупный плод, узкий таз, многоводие, многоплодие, латентно протекающие болезни почек, интеркуррентные воспалительные заболевания и т.п.).
Если говорить о пациентах с нейрогенными дисфункциями нижних мочевыводящих путей, то к развитию и рецидивам ИМП может приводить неадекватное лечение основного заболевания. В этом случае повышенное внутрипузырное давление в фазу накопления, а также камни мочевого пузыря способствуют неполному его опорожнению с развитием и поддержанием инфекционно-воспалительных процессов.
Особенно высок риск развития ИМП у пациентов с инсультом во время пребывания в стационаре, независимо от того, проводилась катетеризация мочевого пузыря или нет. В целом у пациентов с неврологическими заболеваниями развитие ИМП ассоциировано с неблагоприятными неврологическими исходами, увеличением продолжительности пребывания в стационаре. Пациентов с нейропатией мочевого пузыря необходимо обучать профилактическим мерам, направленным на прекращение застоя мочи:
- соблюдение режима мочеиспускания каждые 3-4 ч (за исключением ночи) в условиях отсутствия позывов;
- массаж надлобковой части живота после мочеиспускания;
- при необходимости – назначение нейрогенных препаратов, восстанавливающих моторику мочевого пузыря.
Что касается больных СД, то ИМП – это наиболее частое урологическое осложнение основного заболевания. Основными патогенетическими факторами при этом являются:
- токсическое и дизметаболическое воздействие гипергликемии;
- микро- и макроангипатии с ишемией тканей мочеполовой системы;
- специфическая полинейропатия, приводящая к нейрогенной дисфункции мышечного слоя мочевого пузыря с последующим развитием задержки мочи;
- сниженная фагоцитарная активность лейкоцитов и бактерицидность мочи, а также повышение адгезии уропатогенов на фоне глюкозурии.
Принимая во внимание все вышесказанное, профилактику и лечение ИМП у пациентов с СД следует проводить одновременно со стабилизацией гликемии. При выборе антибактериальной терапии (АБТ) необходимо учитывать возраст, осложнения СД, факторы, влияющие на иммунную систему, состояние почек и печени, реакцию мочи.
Курс АБТ должен быть более длительным, чем у пациентов без СД, по причине большего риска развития тяжелых осложнений со стороны почек, частоты случаев реинфекции, а также трудностей достижения полного излечения.
Следует отдельно напомнить и о специфических ИМП, в частности о туберкулезе мочевой системы, который развивается вторично, через 10-15 лет после легочного или костно-суставного туберкулеза. При этом сочетание стерильной пиурии с симптомами мочевой инфекции (пиелонефрита) требует исключения атипических уропатогенов: микобактерий туберкулеза, хламидий, микоплазм.
Туберкулез мочевой системы можно заподозрить при обнаружении следующих признаков в нескольких анализах мочи:
- кислая реакция;
- асептическая пиурия;
- микрогематурия;
- бесцилиндровая протеинурия.
После обнаружения данных признаков необходимо произвести 3-кратный бакпосев мочи с целью выявления микобактерий туберкулеза.
При работе с пациентами, страдающими ИМП, возникает ряд проблем, снижающих эффективность назначаемой терапии. К таковым относятся:
- самолечение;
- позднее обращение к врачу;
- неадекватная длительность, несоблюдение режима АБТ.
В соответствии с национальными рекомендациями 2017 года препаратами выбора при остром неосложненном цистите (ОНЦ) считаются фосфомицина трометамол 3 г однократно или фуразидина калиевая соль по 100 мг 3 р/сут в течение 5-7 дней. Альтернативные препараты – пероральные фторхинолоны в течение 3 дней (офлоксацин по 200 мг 2 р/сут, ципрофлоксацин или левофлоксацин по 500 мг 2 р/сут) или цефалоспорины в течение 5-7 дней (цефиксим или цефтибутен 400 мг 1 р/сут, цефуроксим 250 мг 2 р/сут).
В свою очередь, недавно обновленные рекомендации IDSA (Infections Diseases Society of America) акцентируют внимание на том, что при лечении неосложненных ИМП к препарату, выбранному в качестве эмпирической АБТ, резистентность уропатогенов должна быть <20% (инфекции нижних мочевыводящих путей) и 10% (верхние мочевыводящие пути).
При этом в рекомендациях EAU (2017) фторхинолоны исключены из перечня препаратов для лечения ОНЦ, а в Евразийских клинических рекомендациях (2016) препаратом первой линии является цефиксим. Почему именно этот препарат?
По результатам, полученным в ходе различных исследований, цефиксим обладает более высокой клинической и бактериологической эффективностью и безопасностью в сравнении с чаще назначаемым в предыдущие годы ципрофлоксацином. Что касается пациент-ориентированного подхода, то цефиксим доступен в форме Солютаб****, отличие которой от традиционных пероральных антибиотиков основано на 7 иновационных технологиях:
- высокое качество субстанции;
- запатентованная технология гранулирования;
- полное и предсказуемое всасывание антибиотика в тонкой кишке;
- технология контролируемого высвобождения активного вещества;
- минимальное количество наполнителя (нет глютена, сахара);
- технология контролируемого распада;
- гипоаллергенные ароматизаторы.
В парадигме пациент-ориентированного подхода необходимо также отметить преимущества оригинального цефиксима перед его генериками. Так, результаты сравнительного исследования кинетики растворения оригинального цефиксима (в форме Солютаб) и генерика показали, что количество растворенного цефиксима через 1 ч было на 20-30% меньше у генерика.
Это позволило исследователям сделать вывод о том, что несоответствие кинетики растворения может быть прогностическим признаком недостаточной биодоступности и, как следствие, недостаточной клинической эффективности генерического препарата (Зырянов С.К., 2016).
Что касается актуальной проблемы рецидивирующих ИМП (РИМП), при выборе препарата EAU (2017) рекомендует следующий подход, основанный на принципах доказательной медицины (уровень доказательств, степень рекомендаций):
- антибиотикопрофилактика короткими курсами (2b, А);
- использование низких доз антибиотиков после полового акта (2b, В);
- местная заместительная гормональная терапия в климактерии (1b, А);
- иммуноактивная профилактика (1a, А).
При РИМП используется лизат бактерий E. coli (наиболее частые уропатогены). Для терапевтической иммунизации препарат назначают по 1 капсуле в день перорально в течение 3 месяцев.
Таким образом, учитывая ряд проблем, возникающих при выборе препарата для АБТ (отсутствие новых классов антибиотиков, рост полирезистентности уропатогенов ко всем уже имеющимся препаратам, а также вызванные ими побочные эффекты), очевидно, что на сегодняшний день необходимы альтернативные стратегии в рамках пациент-ориентированного подхода. В этой парадигме иммунопрофилактика рецидивов ИМП имеет самые высокие качество и уровень доказательств.
 Собственный опыт применения альтернативной терапии РИМП представила доктор медицинских наук, профессор Тамара Сергеевна Перепанова.
Собственный опыт применения альтернативной терапии РИМП представила доктор медицинских наук, профессор Тамара Сергеевна Перепанова.
– РИМП считаются наиболее сложной темой в инфектологии в силу их распространенности, трудностей в диагностике и выборе метода терапии. Основными факторами развития РИМП являются биологические и генетические особенности макроорганизма, увеличивающие чувствительность к уропатогенам, а также вирулентность микроорганизмов.
Дополнительными предрасполагающими факторам РИМП служат сама слизистая оболочка мочеполового тракта, ее дефекты (фистулы, абсцессы, опухоли), различные образования (камни, инородные тела), которые в совокупности создают благоприятные условия для пролиферации и персистенции уропатогенов.
На практике РИМП подразделяют на осложненные и неосложненные, в развитии которых принимают участие разные патофизиологические механизмы (табл. 2).
Установлено, что наиболее частым (до 80% случаев) возбудителем обоих типов РИМП являются UPEC (уропатогенные штаммы E. coli), которые обладают уникальными факторами вирулентности, обеспечивающими успешную пролиферацию и длительную персистенцию в макроорганизме:
- высокие адгезивные свойства (фимбрии, сидерофоры, адгезин);
- возможность преодолевать электростатические силы между клеточной мембраной и поверхностью материала (функциональные флагеллы);
- инвазия, репродукция, репликация в клетках уротелия;
- при воспалительном ответе слизистой – инвазия в глубокие слои уротелия и создание покоящихся внутриклеточных резервуаров бактерий (QIR);
- персистенция покоящихся клеток в поверхностном слое уротелия (IBS).
Такие свойства UPEC значительно снижают эффективность антимикробных средств. При этом следует заметить, что при острой ИМП целью терапии является эрадикация возбудителя, в то время как при РИМП – увеличение безрецидивного периода и улучшение качества жизни пациента.
Поэтому лечебная тактика для РИМП предусматривает как АБТ, так и препараты, влияющие на врожденный иммунный ответ слизистых оболочек мочевыводящих путей. Вместе с тем традиционную терапию РИМП осложняет ряд факторов:
- отсутствие консенсуса в лечении;
- частые курсы АБТ, приводящие к развитию дисбиоза кишечника и мочеполового тракта, селекции микроорганизмов со множественной лекарственной резистентностью;
- возврат симптомов РИМП после отмены длительной антибиотикопрофилактики;
- часто присутствует симптоматика ИМП без бактериурии или асимптоматическая бактериурия на фоне РИМП;
- смена возбудителей в моче или комменсальная колонизация энтеробактериями (E. coli, E. faecalis).
Поэтому специалисты все больше обращаются к нетрадиционным методам лечения и профилактики РИМП, влияющим не только на уропатогены, но и на формирование адекватного местного и системного иммунного ответа макроорганизма:
- бактериальный антагонизм (пробиотики, содержащие лактобациллы);
- бактериофаги;
- инстилляции препаратов гиалуроновой кислоты (гиалуронат цинка, натрия);
- фитотерапия;
- иммунотерапия.
Выше было отмечено, что иммунотерапия ИМП основана на доказательствах высокого качества. В рутинной клинической практике для лечения РИМП успешно используется препарат Уро-Ваксом***, который содержит лиофилизированные E. coli и специфически воздействует на факторы иммунной защиты урогенитального тракта, а именно:
- стимулирует активность макрофагов, Т- и В-лимфоцитов, NK-клеток;
- усиливает фагоцитоз, синтез противовоспалительных цитокинов, протекторных антител, интерферонов.
Эти эффекты в совокупности приводят к ускорению элиминации уропатогенов, нейтрализации их токсинов и формированию иммунологической памяти, что способствует длительному безрецидивному периоду и повышению качества жизни пациентов с РИМП.
В 2016 г. мы закончили 5-летнее исследование, дизайн которого включал изучение иммунного статуса у пациенток с рецидивирующим циститом (РЦ) и оценку влияния препарата Уро-Ваксом на показатели иммунитета.
Пациентки были разделены на 2 группы: 1-я группа получала лиофилизат из 18 штаммов E. coli по 1 капсуле утром натощак в течение 3 мес; 2-й группе традиционно проводилась АБТ в соответствии с действующими рекомендациями. В обеих группах через 3 мес терапии и 6 мес наблюдений проводился контроль иммунологической панели по множеству показателей.
В конце периода наблюдения было выявлено, что общая эффективность терапии с использованием бактериального лизата E. coli в 1-й группе пациенток составила 73,3%, в то время как в группе стандартной АБТ – 50% (р≤0,05). Результаты исследования позволили нам сделать ряд выводов:
- у женщин с РЦ имеются выраженные нарушения системного и местного (мукозального) иммунитета, обусловливающие высокую частоту РИМП;
- терапия бактериальными лизатами, содержащими, приводит к нормализации или значимому улучшению показателей иммунитета у женщин с РЦ, при этом по большинству параметров улучшение сохраняется в течение не менее 3 мес после иммунотерапии;
- традиционная АБТ у пациенток с РЦ не оказывает существенного влияния на состояние иммунитета;
- иммунотерапия способствует более эффективной эрадикации возбудителя из мочевыводящих путей и уменьшает частоту рецидивирования цистита по сравнению с традиционной АБТ.
 Председатель правления Европейской секции инфекций в урологии Европейской урологической ассоциации, заведующий клиникой урологии, педиатрической урологии и андрологии Университета им. Юстуса Либиха (г. Гессен, Германия), профессор Флориан Вагенленер познакомил присутствующих с современными данными о перспективных направлениях терапии и превенции РИМП.
Председатель правления Европейской секции инфекций в урологии Европейской урологической ассоциации, заведующий клиникой урологии, педиатрической урологии и андрологии Университета им. Юстуса Либиха (г. Гессен, Германия), профессор Флориан Вагенленер познакомил присутствующих с современными данными о перспективных направлениях терапии и превенции РИМП.
– Как известно, РИМП дифференцируют на осложненные и неосложненные. При этом последние встречаются гораздо чаще, и в основном у женщин. Почти 50% мировой женской популяции хотя бы один раз в жизни перенесла ИМП, 20% из них испытывают рецидив заболевания, 30% – приобретают РИМП, а остальные страдают от очень частых ИМП.
Данные исследования GESPRIT, проведенного в 5 крупнейших странах Европейского континента, свидетельствуют о значительном социально-экономическом бремени РИМП, об увеличении затрат для национальных систем здравоохранения, о росте издержек и ухудшении качества жизни пациентов (Wagenlenher F. et al., 2017).
Патофизиология осложненных и неосложненных РИМП хотя и различается, но практически всегда характеризуется восходящим путем инфицирования. При этом всегда присутствуют факторы, в совокупности способствующие рефлюксу и развитию ИМП: камни, инородные тела, анатомические нарушения, медицинские вмешательства на мочеполовых органах в прошлом и т. п.
Каким образом уропатогены проникают в мочевыводящие пути? Анатомическая группа Университета Гессена установила, что только в эпителии уретры есть специфические клетки (мы их называем «хранители врат»), строение которых схоже с таковым клеток вкусовых рецепторов слизистой оболочки языка.
Специфические клетки уретры контактируют с нервными рецепторами, секретирующими ацетилхолин. Почему эти рецепторы находятся в уретре? В уродинамических исследованиях было установлено, что ацетилхолиновые рецепторы призваны распознавать горький вкус, которым обладают некоторые бактерии; это помогает иммунной системе идентифицировать такие патогены в качестве мишеней и предотвратить восходящее инфицирование.
Формированию РИМП у некоторых людей, по-видимому, способствует генетически детерминированное отсутствие или функциональная недостаточность «хранителей врат» в уротелии. Кроме того, уропатогены могут проникать и в более глубокие слои слизистой оболочки мочевыводящих путей; относительно способа такой «миграции» существует множество гипотез и основанных на них терапевтических стратегий.
Например, поверхностный эпителий мочевого пузыря не только является мощным барьером для мочи, но также служит регулятором его объема посредством апикального экзоцитоза специализированных веретенообразных везикул при растяжении мочевого пузыря.
Во время смены циклов его наполнения и опорожнения бактерии могут попадать внутрь «зонтичных клеток» путем эндоцитоза, что впоследствии делает их недосягаемыми для любых антимикробных препаратов. В 2007 г. эксперименты на мышах показали, что воздействовать на внутриклеточные UPEC можно при помощи форсколина, который способствует экзоцитозу веретенообразных везикул и возвращению бактерий во внеклеточную среду (Bishop B.L. et al., 2007).
Другая стратегия предлагает использование пероральной D-маннозы. Результаты рандомизированного открытого исследования продемонстрировали, что порошок D-маннозы значительно снизил риск РИМП, при этом клинический эффект был сопоставим с таковым нитрофурантоина (Kranjcec В. et al., 2014). Указанные стратегии представляют собой перспективные направления, находящиеся в стадии дальнейшего изучения.
Сегодня европейские руководства по лечению и профилактие РИМП рекомендуют в первую очередь использовать иммуностимуляторы при всех возможных ситуациях и во всех возрастных группах пациентов. В арсенале практикующих специалистов имеется пероральный иммуностимулятор ОМ‑89, который представляет собой экстракт из 18 штаммов UPEC.
Эффективность ОМ‑89 продемонстрирована в 6 рандомизированных клинических исследованиях и 3 метаанализах. У женщин в период постменопаузы для предотвращения РИМП используют вагинальные эстрогены, способствующие восстановлению естественной микрофлоры мочеполовых путей, а также препараты для внутримышечной и вагинальной иммуностимуляции.
В целом сегодня пока не существует единственной специфической превентивной стратегии предотвращения РИМП; исключением могут стать вакцины, появление которых ожидается в будущем.
Очевидно, что камертоном научно-практической конференции стал персонифицированный подход в лечении урологических инфекций, который предполагает разработку и применение инновационных методов фармакотерапии, не только оказывающих влияние на уропатогены, но и стимулирующих иммунную систему самого пациента.
Подготовила Наталия Позднякова
Справка ЗУ
*В Украине препарат тамсулозина пролонгированного действия с пероральной системой контролируемой абсорбции представлен препаратом Омник Окас, каждая таблетка содержит 0,4 мг тамсулозина.
**Каждая таблетка препарата Везомни, являющегося фиксированной лекарственной комбинацией для лечения СНМП, а также ДГПЖ, содержит солифенацина сукцинат 6 мг, что соответствует 4,5 мг солифенацина, и тамсулозина гидрохлорида 0,4 мг, что соответствует 0,37 мг тамсулозина.
***Препарат Уро-ваксом (каждая капсула содержит лиофилизат бактерий E. Coli 6 мг) является иммуностимулирующим агентом, который оказывает следующее действие: стимулирует Т-лимфоциты, индуцирует производство эндогенного интерферона и увеличивает содержание иммуноглобулина А (IgA), в том числе в моче.
****Солютаб является диспергируемой формой таблеток, использующейся компанией «Астеллас» для выпуска антибиотиков и позволяющей повысить биодоступность до уровня, сопоставимого с инъекционным, а также обеспечить прогнозируемость фармакокинетических процессов. В форме Солютаб, например, выпускаются такие антибиотики, как Вильпрафен Солютаб, Супракс Солютаб, Юнидокс Солютаб и др.
Тематичний номер «Урологія. Нефрологія. Андрологія» № 1 (12), березень 2018 р.